固相萃取-高效液相色谱法同时测定牛组织中三氮脒和氯化氮氨菲啶残留
2017-09-14周雨卉曾振灵余静贤潘丽花钟秋玉
周雨卉, 曾振灵, 余静贤, 刘 戎, 潘丽花, 钟秋玉, 陈 红
(华南农业大学兽医学院, 国家兽药残留基准实验室, 广东 广州 510642)
研究论文
固相萃取-高效液相色谱法同时测定牛组织中三氮脒和氯化氮氨菲啶残留
周雨卉, 曾振灵, 余静贤, 刘 戎, 潘丽花, 钟秋玉, 陈 红*
(华南农业大学兽医学院, 国家兽药残留基准实验室, 广东 广州 510642)
建立了固相萃取-高效液相色谱同时检测牛组织中三氮脒(DIM)和氯化氮氨菲啶(ISM)残留的分析方法。针对不同的组织样品采用不同比例的水-乙腈溶液提取药物,结合Oasis WCX固相萃取小柱净化富集。采用Spherisorb CN柱(250 mm×4.6 mm, 5 μm)对药物进行分离,以乙腈和0.05 mol/L甲酸铵溶液(pH 2.4)为流动相,梯度洗脱,紫外检测波长为380 nm。牛组织中DIM和ISM的检出限(S/N≥3)为0.01 mg/kg,定量限(S/N≥10)为0.025 mg/kg。牛组织中DIM和ISM在各自的线性范围内线性关系良好(r≥0.999 3)。DIM和ISM在低、中、高添加水平下的回收率为82.2%~97.6%,日内精密度和日间精密度分别为0.3%~5.2%(n=5)和1.3%~5.2%(n=15)。结果表明,建立的方法重复性好,灵敏度高,操作简便,适用于牛组织中DIM和ISM的残留检测。
高效液相色谱;固相萃取;多残留检测;三氮脒;氯化氮氨菲啶;牛组织

图 1 三氮脒和氯化氮氨菲啶的化学结构式Fig. 1 Chemical structural formulas of diminazene aceturate (DIM) and isometamidium chloride (ISM)
三氮脒(diminazene aceturate, DIM,又名贝尼尔(Berenil®))和氯化氮氨菲啶(isometamidium chloride, ISM,又名沙漠林(Samorin®)),是国内外应用最多的治疗锥虫感染的药物之一[1,2]。在非洲、南美洲地区布氏锥虫广泛传播,其可引起家畜感染布氏锥虫病和人类非洲锥虫病[3]。在我国,尤其在南方各省和西北地区,主要流行伊氏锥虫病,牛、羊、猪等家畜均可受其感染[4],可对我国畜牧业造成重大的经济损失。DIM主要用来治疗锥虫病,ISM可以治疗和预防锥虫病[5,6]。DIM和ISM的联合用药对治疗和控制锥虫病有更好的疗效[7],但二者的毒副作用较强,养殖过程中的不合理使用容易引起残留,污染下游产品,危害公众健康。DIM和ISM进入体内后吸收、分布迅速,消除缓慢,在肝脏和肾脏中的残留量较高,而在肌肉和脂肪中的残留量较少[8,9]。我国农业部和国际食品法典委员会(CAC)均规定了DIM和ISM在牛的各组织中的最高残留限量(MRL),但国内关于动物组织中DIM和ISM的检测方法还未建立完善,不利于养殖生产过程中的监控和动物源食品的质量控制。由于抗锥虫药物的种类不多,长时间反复使用同一种药物容易产生耐药性,目前大多数养殖场会采用联合用药和交叉用药的方式来减少耐药的产生,同时提高治疗效果[10,11],因此相关药物的多残留检测具有重要意义。从药物理化性质来看,DIM和ISM均含有苯甲脒基团,化学结构相似(见图1),建立相关的检测方法有助于对其他含有苯甲脒基团化合物的检测及研究。
目前用于检测DIM或ISM的方法主要有高效液相色谱法(HPLC)[12-15]和液相色谱-串联质谱法(LC-MS/MS)[16]等。LC-MS/MS的灵敏度高,选择性好,利于定性定量分析,但基质效应明显,且流动相和提取液中必须避免使用离子对试剂;HPLC为比较常用的检测方法,其具有分离效果多样性、分析速度快、分离效能高的优点,并可连接紫外检测器,最小检测量可达ng级。关于DIM与ISM的研究基质多为牛奶和牛肉,尚无同时检测DIM和ISM的相关报道。检测动物组织中DIM的方法目前尚未见报道,但已有检测动物组织中ISM的相关报道,其前处理方法多采用液-液萃取法,但过程繁琐,易造成分析物的损失。SPE技术与传统的液-液萃取技术相比具有简便、低耗、高效等优点,除了能够去除样品中的杂质、富集药物、提高分析灵敏度外,还能够变换试样溶剂,使上样溶液与分析方法相匹配。
本研究从DIM和ISM的理化性质出发,结合SPE技术,建立了检测牛组织中DIM和ISM的分析方法。该法操作简便,灵敏度高,特异性好,可为我国加强用药监控、提高动物源食品质量提供技术支持。
1 实验部分
1.1仪器与试剂
2695型高效液相色谱仪(配2489型紫外检测器)、Oasis WCX固相萃取小柱(60 mg/3 mL)(美国Waters公司); Legend March 1.6R冷冻型高速离心机(美国Thermo Fisher公司); UV-2550型紫外可见分光光度计(日本岛津公司); Milli-Q Advantage超纯水仪(美国Millipore公司); N-EVAPTM111型氮吹仪(美国Organomation公司)。
标准品:DIM(C14H15N752C4H7NO3,纯度90%, CAS No. 908-54-3,美国Sigma公司)、ISM(C28H26ClN7,纯度97.0%, CAS No. 34301-55-8,日本和光公司)。色谱纯甲醇、乙腈(瑞典Oceanpak公司);分析纯甲酸铵、甲酸、冰乙酸、氨水(广州化学试剂厂)。
1.2标准溶液的配制
标准储备液:称取(40.77±0.05) mg DIM标准品,用超纯水配制质量浓度为2 000 mg/L的标准储备液,于4 ℃保存;称取(10.53±0.05) mg ISM标准品,用甲醇配制质量浓度为200 mg/L的标准储备液,于4 ℃保存。混合标准工作液:移取DIM和ISM标准储备液,用15%(v/v)乙腈水溶液稀释成所需浓度,现用现配。
0.05 mol/L甲酸铵溶液:准确称量3.153 g的甲酸铵,置于1 000 mL容量瓶中,用水溶解并定容至1 000 mL,之后用甲酸调节pH至2.4;牛肌肉提取液:40%(v/v)水乙腈溶液,60 mL乙腈中加入40 mL水,混匀。牛肝脏提取液:40%(v/v)水乙腈溶液(含0.2%(v/v)的乙酸-水(50∶50, v/v)溶液), 60 mL乙腈中加入40 mL水,再加入200 μL乙酸-水(50∶50, v/v)溶液,混匀;牛肾脏提取液:40%(v/v)水乙腈溶液(含0.4%(v/v)的乙酸-水(50∶50, v/v)溶液), 60 mL乙腈中加入40 mL水,再加入400 μL乙酸-水(50∶50, v/v)溶液,混匀。
1.3样品前处理
牛肌肉、牛肝脏、牛肾脏均购自屠宰场,属黄牛。将空白牛肌肉、牛肝脏、牛肾脏样品分别剔除筋膜、脂肪、血管和其他结缔组织,切成小块,用组织匀浆机匀浆1 min,待其成糊状后,分别装入封口样品袋中,标记,置于-20 ℃冰箱中备用,使用前于室温下融解。
准确称量(2.00±0.05) g融解后的组织样品,置于50 mL离心管中,加入10 mL各组织的提取液,涡旋1 min,于25 ℃水浴中超声10 min,于4 ℃以10 000 r/min离心5 min,取上清液于新的50 mL离心管中。重复上述步骤,合并两次上清液。取Oasis WCX固相萃取小柱,依次用3 mL甲醇和3 mL超纯水活化后,将上清液上样,然后用3 mL 5%(v/v)氨水和3 mL甲醇淋洗,弃去淋洗液,用1 mL 含20%(v/v)乙酸的甲醇溶液洗脱,收集洗脱液,负压抽干,于50 ℃水浴中氮气吹干,用1 mL 15%(v/v)乙腈水溶液复溶,于25 ℃水浴中超声5 min,涡旋30 s,过0.22 μm针筒滤膜,待上机检测。
1.4分析条件
色谱柱:Spherisorb CN柱(250 mm×4.6 mm, 5 μm,美国Waters公司);柱温:25 ℃;流动相:A为乙腈,B为0.05 mol/L甲酸铵溶液(pH 2.4)。梯度洗脱程序:0~4.0 min, 5%A~10%A; 4.0~4.1 min, 10%A~65%A; 4.1~11.0 min, 65%A; 11.0~11.1 min, 65%A~5%A; 11.1~20.0 min, 5%A。流速:1.00 mL/min;进样量:50 μL;检测波长:380 nm。
2 结果与讨论
2.1色谱条件的优化
2.1.1检测波长的选择
DIM的检测波长多为254 nm[17]和372 nm[14,15]; ISM的检测波长多为254 nm[18]、320 nm[19]和380 nm[12,13]。本实验用紫外分光光度计分别对10.0 mg/L的DIM水溶液和10.0 mg/L的ISM甲醇溶液进行测定,显示DIM和ISM的最大吸收波长分别为372 nm和383 nm,这与Gummow等[20]和Schad[21]的结果基本一致。实验比较了在372~383 nm波长下DIM和ISM的紫外光谱图,结果表明,以380 nm作为检测波长时,DIM和ISM的色谱峰吸收值相对较大,杂质少。故选择380 nm作为本实验的紫外检测波长。
2.1.2色谱柱的选择
DIM含有两个强碱性的脒基,ISM含有一个强碱性的脒基及一个位于菲啶基团上的显碱性的四价氮原子,这些基团使得这两种药物在分离过程中易与色谱柱填料中未键合的酸性硅羟基结合,导致产生严重的拖尾现象[17,22]。DIM为极性较强的碱性化合物,ISM为亲水亲脂两性阳离子化合物,因此考虑在反相色谱中采用含弱极性填料的色谱柱分离DIM和ISM。有文献[14,15]报道使用氰基柱可以有效保留DIM,其色谱峰形也有所改善。实验发现使用Spherisorb CN柱(250 mm×4.6 mm, 5 μm)时,DIM和ISM的保留效果较好,色谱峰形的对称性好,因此选为实验所用。
2.1.3流动相的选择和优化
实验考察了不同浓度(0.02、0.05、0.1 mol/L)的甲酸铵溶液(pH 2.4)作为流动相中的水相时对药物分离效果和峰形的影响。结果表明,随着甲酸铵溶液浓度的升高,ISM的色谱峰更尖锐,响应值更高,保留时间随之提前,且当浓度为0.1 mol/L时,ISM的洗脱效果最佳;但DIM以0.1 mol/L甲酸铵溶液为流动相时色谱峰明显变宽,响应值降低。考虑到ISM和DIM同时洗脱时的分离效果,实验选用0.05 mol/L作为甲酸铵溶液的浓度。
实验还比较了不同pH值(4.0、3.5、3.0、2.4)的甲酸铵溶液(0.05 mol/L)对药物分离效果和峰形的影响。结果发现,随着pH值的减小,硅羟基的离子化现象被抑制,降低了药物中强碱性脒基和四价氮原子与其发生离子交换作用的几率,进而改善了DIM和ISM的色谱峰峰形,减少了拖尾现象的产生;且当pH值为2.4时,DIM和ISM的分离度好,峰形尖锐。因此实验最终将甲酸铵溶液的pH值设为2.4。
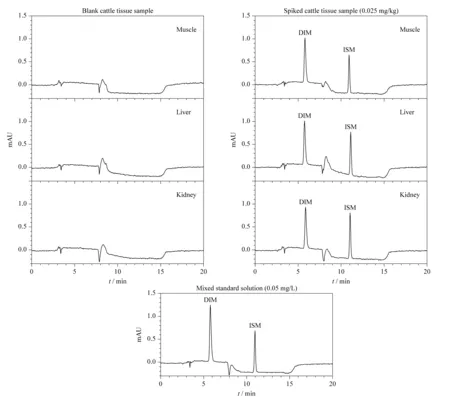
图 2 空白牛组织样品、牛组织加标样品和混合标准溶液中DIM、ISM的色谱图Fig. 2 Chromatograms of DIM and ISM in blank cattle tissue samples, spiked cattle tissue samples and a mixed standard solution
实验进一步考察了不同的洗脱方式对药物分离效果的影响。比较了等度洗脱时,采用乙腈-甲酸铵溶液(pH 2.4)为流动相,不同体积分数(10%~50%)的乙腈对DIM和ISM保留时间和分离效果的影响。发现随着乙腈含量的升高,DIM和ISM的出峰时间提前,峰形更尖锐,当乙腈的含量达到50%(v/v)时分离效果最好,但此时DIM出峰时间约4 min,易受到样品基质峰的干扰,因此考虑使用梯度洗脱的方法。
实验对比了不同起始比例的乙腈和甲酸铵溶液(0.05 mol/L, pH 2.4)对DIM出峰时间和峰形的影响,以及4.1 min时不同比例的乙腈和甲酸铵溶液对ISM出峰时间和峰形的影响。当乙腈-甲酸溶液的起始比例为10∶90(v/v)并持续至4 min时,DIM的出峰时间较早,在4 min左右,易受组织或溶剂峰的干扰;当采用起始比例5∶95(v/v),并在4 min内线性过渡到10∶90(v/v)时,DIM的出峰时间为5.8 min,周围无干扰峰,峰形尖锐,响应值高。实验尝试在4.1 min时调节乙腈-甲酸溶液的比例至50∶50(v/v),并持续至11.0 min,发现ISM的色谱峰有拖尾现象,于是考虑增加乙腈的比例。当在4.1 min调节乙腈-甲酸溶液至65∶35(v/v)时,ISM得到了较好地分离,保留时间约11.0 min。图2显示了空白组织样品、空白加标样品和混合标准溶液中DIM和ISM的色谱图。
2.1.4进样量的优化
实验分别考察了不同进样量(10、20、50、100 μL)对DIM和ISM色谱分离效果和峰形的影响。结果发现,随着进样量的增加,DIM和ISM的峰面积成比例增加,响应值变高,但DIM的色谱峰变宽,综合考虑响应值大小和色谱峰形,最终将进样量设为50 μL。
2.2前处理条件的优化
2.2.1提取液的优化
不同组织所含杂质的性质不同,牛肌肉组织蛋白质含量高,牛肝脏组织脂肪含量高,牛肾脏组织水分含量高,牛肌肉组织呈弱酸性而牛肝脏和肾脏组织呈弱碱性,这些因素都会影响药物在提取液中的分布,因而不同样品基质对药物的提取效率也会产生很大影响。
肌肉提取液的优化 实验比较了亲水性有机溶剂甲醇、乙腈以及不同比例的水甲醇溶液和水乙腈溶液对牛肌肉样品沉淀蛋白质的效果及对DIM和ISM提取效果的影响(见图3)。当乙腈或甲醇作提取液时,二者沉淀蛋白质的效果均很好,但其提取回收率均低于50%;当水的体积分数达到40%左右时,提取液沉淀蛋白质和提取药物效果最佳,且水-乙腈比水-甲醇对药物的提取回收率更高,能达到90%左右,于是实验采用40%(v/v)水乙腈溶液作为牛肌肉提取液。
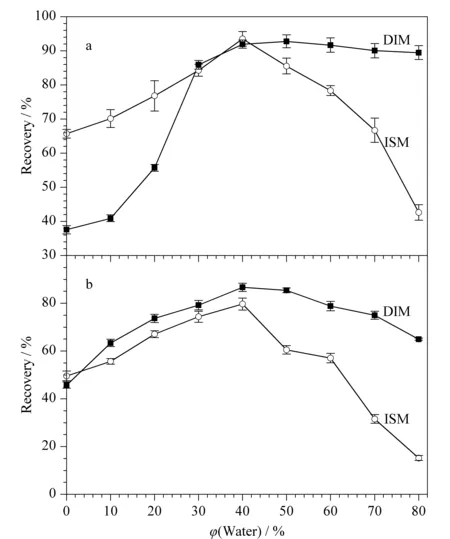
图 3 不同体积分数的(a)水-乙腈和(b)水-甲醇提取液对DIM和ISM回收率的影响(n=5)Fig. 3 Effect of different volume percentages of (a) water-acetonitrile and (b) water-methanol on recoveries of DIM and ISM (n=5)
肝脏和肾脏提取液的优化 实验发现40%(v/v)水乙腈提取液对牛肝脏和肾脏中DIM和ISM的提取效率较差(回收率<50%)。牛肾脏和肝脏的水溶液呈碱性,加入弱酸性的水-乙腈提取液后呈弱碱性,而DIM和ISM为偏碱性药物,在碱性环境下较难从组织中提取出来。因此实验在40%(v/v)水乙腈提取液中加入不同体积分数的50%(v/v)乙酸水溶液,通过降低提取液的pH值,破坏药物与生物大分子的结合,提高对目标分析物的提取效率,实验结果见图4。可以看出,当添加50%(v/v)乙酸水溶液的体积分数分别为0.2%(v/v)和0.4%(v/v)时,牛肝脏和牛肾脏样品中药物的回收率均能达到80%以上。
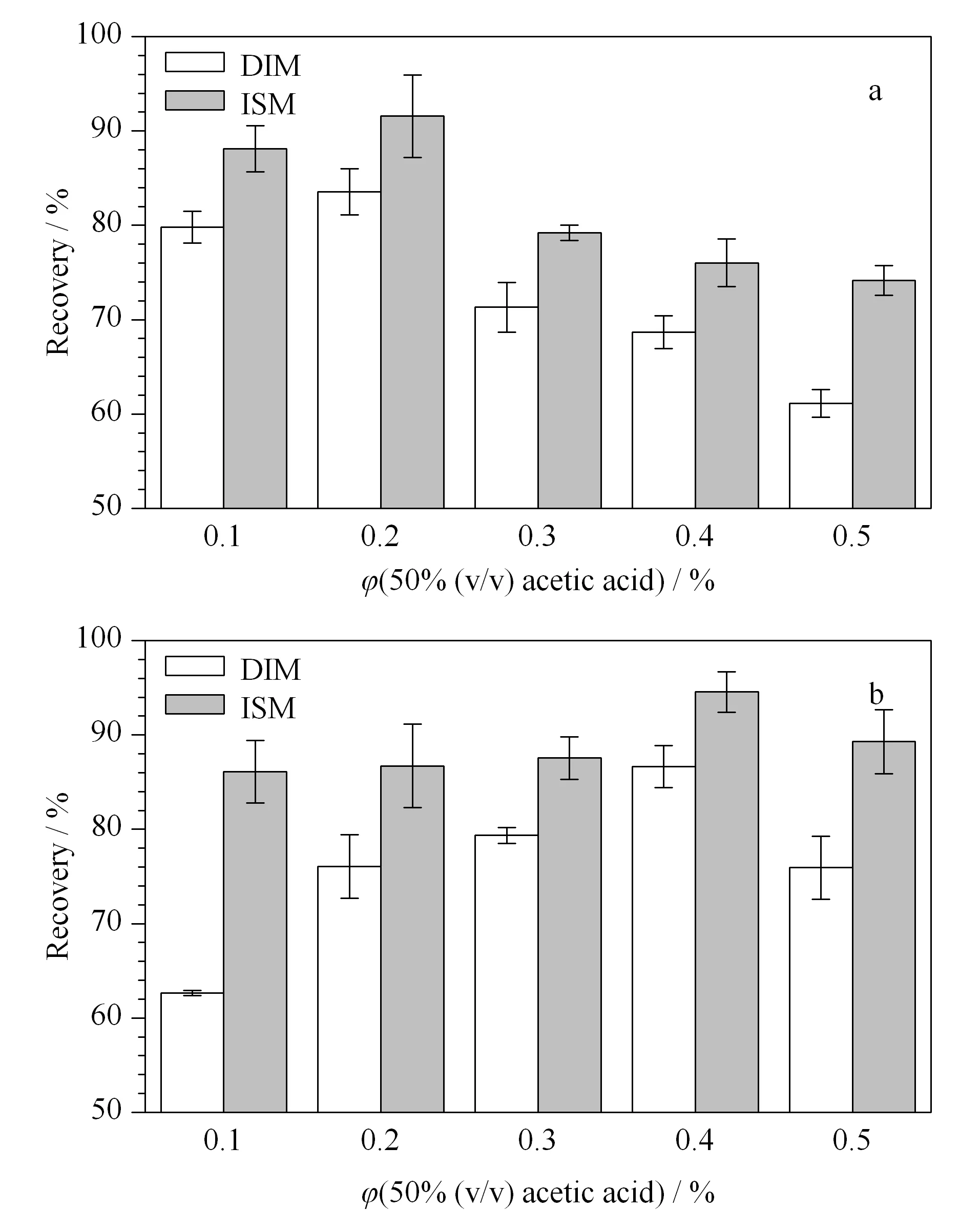
图 4 不同体积分数的50%(v/v)乙酸水溶液对(a)牛肝脏和 (b)牛肾脏样品中DIM和ISM回收率的影响(n=5) Fig. 4 Effect of different volume percentages of 50% (v/v) acetic acid aqueous solution on the recoveries of DIM and ISM in (a) cattle liver and (b) cattle kidney samples (n=5)
2.2.2固相萃取小柱的选择
样品经提取液提取后上清液的体积较大,若采用液-液萃取法会消耗大量的试剂和时间,故采用固相萃取的方式进行净化和富集。文献多采用CN柱[14]、C18柱[20]、HLB柱[24]、WCX柱[16]和C8柱[25]对DIM和ISM进行萃取。根据药物的性质,实验考察了亲水亲脂小柱Poly-Sery HLB、中等极性小柱Sep-Pak CN、混合型强阳离子小柱Poly-Sery MCX和混合型弱阳离子小柱Oasis WCX对DIM和ISM回收率的影响(见图5)。采用Poly-Sery HLB小柱时,淋洗液和洗脱液分别为4 mL 5%(v/v)甲醇水溶液和4 mL甲醇;采用Sep-Pak CN小柱时,淋洗液为2 mL水和2 mL乙醇,洗脱液为2 mL 0.4%(v/v)五氟丙酸酐甲醇溶液;采用Poly-Sery MCX小柱时,淋洗液为3 mL 0.1 mol/L的盐酸溶液和3 ml甲醇,洗脱液为5%(v/v)氨水甲醇;采用Oasis WCX柱时,按1.3节进行前处理。结果表明,采用HLB柱和CN柱时,组织提取液中的DIM和ISM不能有效保留;采用MCX柱时,洗脱液无法有效洗脱DIM;采用WCX柱时,淋洗和洗脱效果均较好,回收率为80%以上,因此选为实验所用。

图 5 不同固相萃取柱对DIM和ISM回收率的影响(n=5)Fig. 5 Effect of different SPE cartridges on the recoveries of DIM and ISM (n=5) HLB SPE cartridge: washing solution, 4 mL 5% (v/v) methanol aqueous solution; eluent, 4 mL methanol. CN SPE cartridge: washing solution, 2 mL water and 2 mL methanol; eluent, methanol containing 0.4% (v/v) pentafluoroproprionic acid (PFPA). MCX SPE cartridge: washing solution, 3 mL 0.1 mol/L HCL and 3 mL methanol; eluent, methanol containing 5% (v/v) ammonia water. WCX SPE cartridge: washing solution, 3 mL 5% (v/v) ammonia water and 3 mL methanol; eluent, methanol containing 20 (v/v) acetic acid.
2.2.3离子交换通量的考察
实验选择Oasis WCX小柱(60 mg/3 mL)作为固相萃取柱,当固相离子吸附剂表面的离子超载时,部分药物会穿透填料,无法有效保留,造成回收率下降。因此本实验对Oasis WCX小柱的吸附容量进行了考察。实验将1 mL 100 mg/L的混合标准工作液过柱,收集上样液,过0.22 μm针筒滤膜,上机检测,结果未检测到药物,说明样品未穿透固相萃取柱的填料,所有药物均被全部保留,满足目标分析物的吸附净化要求。
2.2.4洗脱液的选择和优化
实验比较了氨水甲醇、甲酸甲醇、乙酸甲醇对DIM和ISM的洗脱效率。结果发现,5%~20%(v/v)氨水甲醇和5%~20%(v/v)甲酸甲醇都无法有效洗脱目标药物,只有乙酸甲醇能够将药物从WCX小柱上洗脱下来。实验考察了6%~20%(v/v)乙酸甲醇溶液、6%(v/v)乙酸甲醇(氨水调pH至7.0)[15]对药物洗脱效率的影响(见图6)。实验发现20%(v/v)乙酸甲醇溶液能够洗脱90%以上的药物,且氮吹速率较快,因此选为实验所用。本实验建立的固相萃取法与液-液萃取法[12,13,16]相比,操作更简便,更快速,试剂损耗更少。
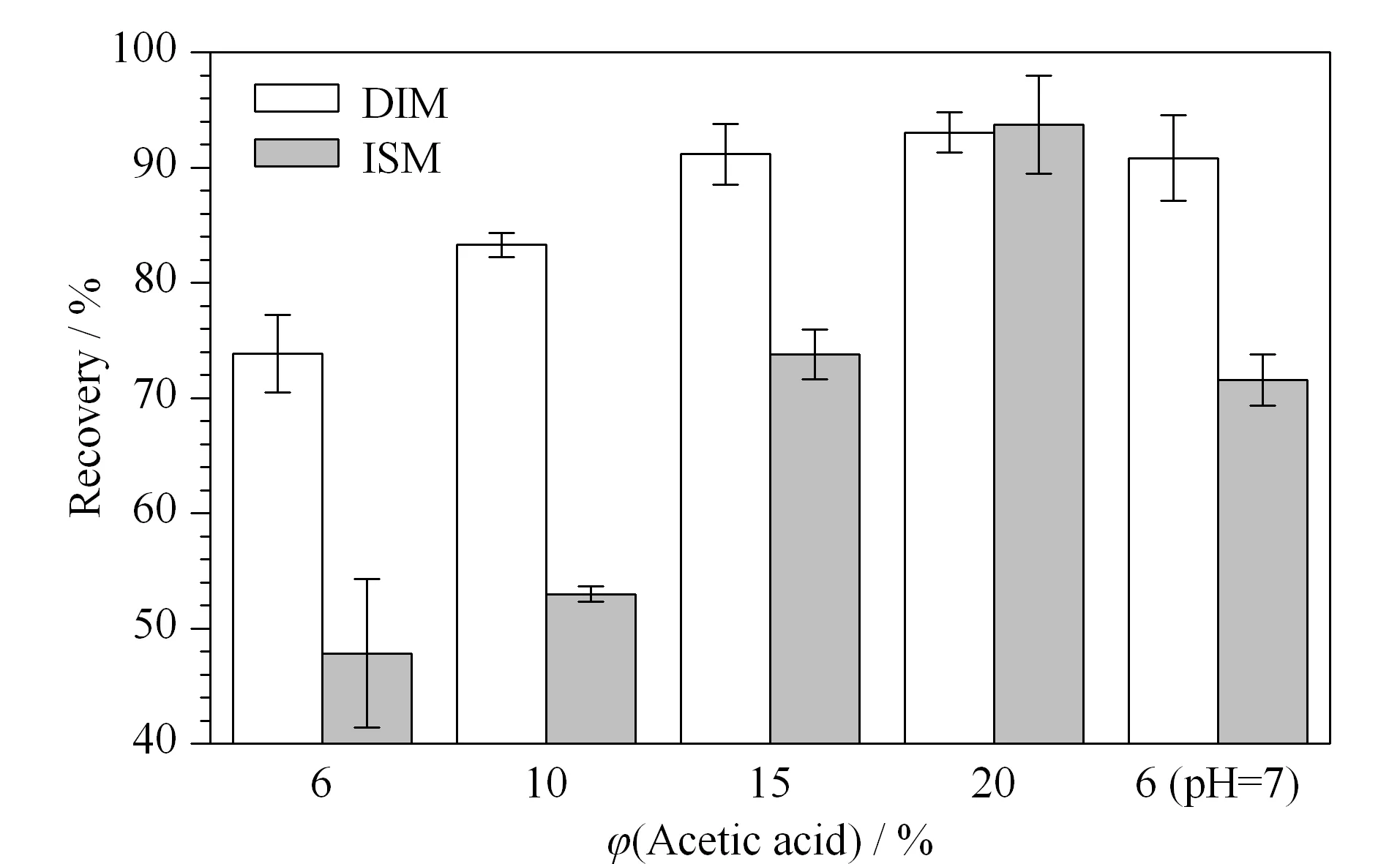
图 6 不同体积分数的乙酸甲醇洗脱液对DIM和ISM回收率的影响(n=5)Fig. 6 Effect of different volume percentages of acetic acid-methanol eluent on the recoveries of DIM and ISM (n=5)
2.2.5复溶液的选择和优化
实验发现,将洗脱液直接上机检测,药物的峰形较差不利于定性定量分析,于是通过氮吹仪吹干洗脱液后复溶,置换上机溶液。DIM为极性较大的化合物,水溶性好;ISM为亲水亲脂两性化合物,20 ℃时水中的溶解度为6 g/100 g。实验考察了不同体积分数(5%~80%)的乙腈水溶液、甲醇水溶液和甲酸铵水溶液(0.05 mol/L, pH 2.4)的复溶效果。实验发现,DIM和ISM在15%(v/v)乙腈水溶液中的溶解度较好,回收率高,直接上机检测,两种药物均能得到良好的峰形,因此选为实验所用。
2.3方法学评价
2.3.1检出限和定量限
计算各组织空白样品噪声值与对应组织添加样品中DIM和ISM峰高的比值,按S/N≥3和≥10计算方法的检出限和定量限。结果表明,DIM和ISM在牛各组织样品中的检出限和定量限分别为0.01 mg/kg和0.025 mg/kg,均小于DIM和ISM各自的最高残留限量[26](见表1)。与文献[12,13,16,25]报道的相关组织中ISM的检测结果相比,在同时检测两种药物的条件下具有相对较低的检出限和定量限,方法的灵敏度高,能够满足残留检测的要求。
2.3.2标准曲线和线性范围
在空白牛组织样品中添加混合标准溶液,DIM和ISM的质量浓度范围分别为0.025~25.0 mg/kg和0.025~2.0 mg/kg,按1.3节的方法前处理后进行检测,记录峰面积。对DIM和ISM的色谱峰面积(y)和对应添加药物的含量(x, mg/kg)进行线性回归分析,每个水平重复3次,共3个批次,不同批次间隔1 d或数天。线性回归方程、线性范围及相关系数(r)见表1。结果表明,在各自的线性范围内牛组织中DIM和ISM的线性关系良好,r均大于0.999 0,能够满足残留分析要求。

表 1 牛组织中DIM和ISM的线性范围、线性方程、相关系数和最高残留限量Table 1 Linear ranges, linear equations, correlation coefficients (r) and maximum residue limits (MRLs) of DIM and ISM in cattle tissue samples
y: average peak area;x: content, mg/kg. Slope and intercept of linear equation represented mean and standard deviation (S.D.,n=9), respectively.
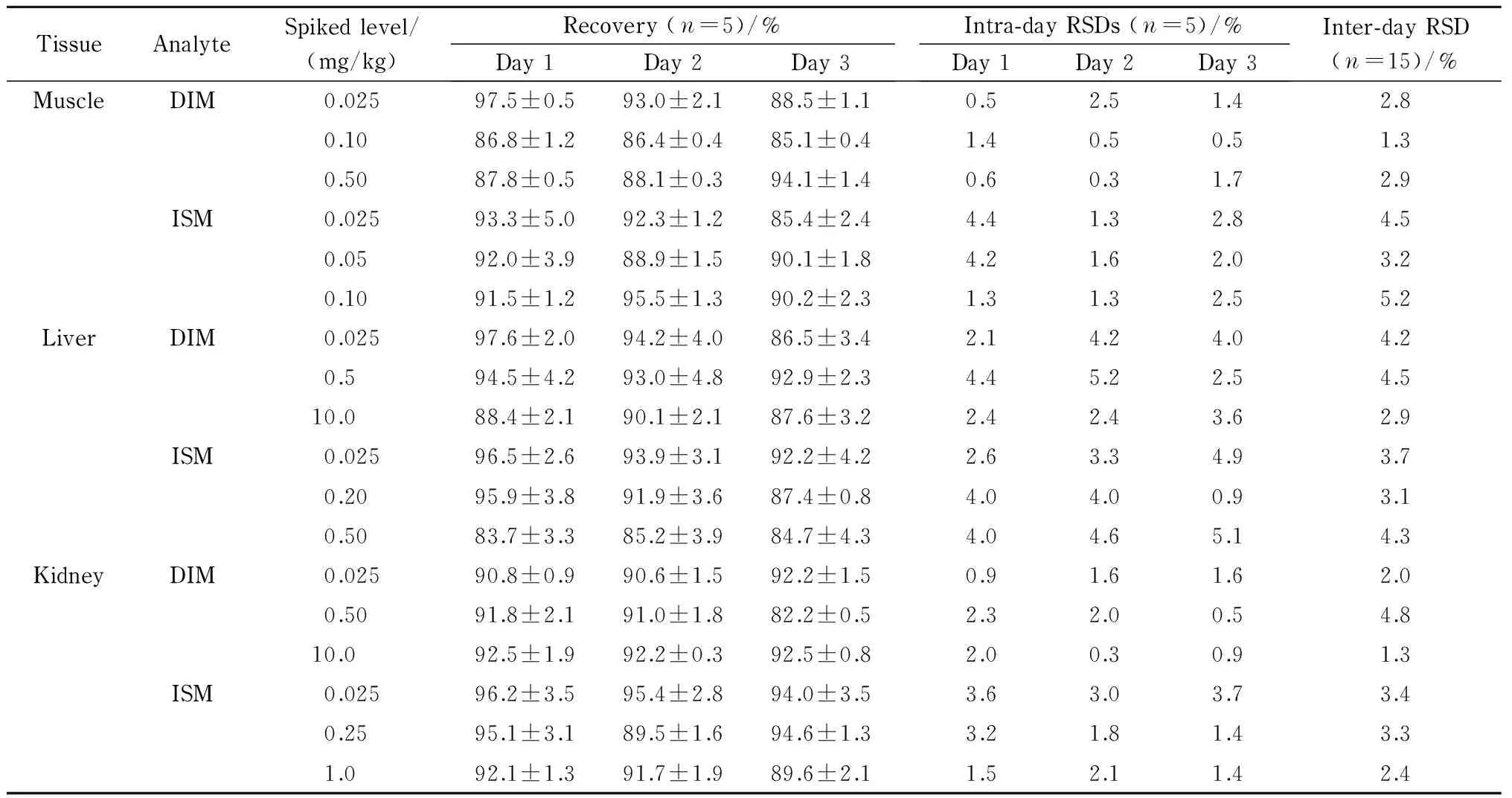
表 2 牛组织中DIM和ISM的平均加标回收率、日内精密度和日间精密度Table 2 Recoveries, intra-day RSDs and inter-day RSDs of DIM and ISM spiked in tissue samples
Recovery: mean±S.D.
2.3.3回收率和精密度
分别向空白牛组织样品中添加低、中、高3个水平的混合标准溶液,每个水平重复5次,并分别在3个工作日内重复3个批次。将测得的空白牛组织加标样品的峰面积与相应混合标准溶液的峰面积进行比较,从而计算提取回收率和精密度,具体结果见表2。DIM和ISM的平均回收率为82.2%~97.6%,日内精密度为0.3%~5.2%(n=5),日间精密度为1.3%~5.2% (n=15)。结果表明,经本实验的前处理方法处理后目标物的提取效率高、药物损失小、实验重复性好,结果均符合食品中兽药残留法典委员会(CCRVDF)[27]和欧盟[28]规定的残留分析要求。
2.4实际样品检测
采用本文建立的固相萃取-高效液相色谱法分别检测了从菜市场购买的牛肌肉、肝脏、肾脏样品(每种组织各5个样品),结果均未测出DIM和ISM。实际样品的色谱图见图7。
图 7 实际(a)牛肌肉、(b)牛肝脏和(c)牛肾脏样品的色谱图Fig. 7 Chromatograms of (a) cattle muscle, (b)cattle liver and (c) cattle kidney practical samples
3 结论
本实验建立的高效液相色谱检测牛组织中DIM和ISM的方法的灵敏度、回收率及重复性均符合残留分析的要求。该法前处理过程迅速,操作简便,试剂损耗少,适用于牛组织中DIM和ISM的残留检测,同时对于含有苯甲脒基团的其他化合物的提取和检测也具有重要的参考价值。
[1] Zhang J L, Li B, Zhang J Y. Heilongjiang Animal Science and Veterinary Medicine, 2016(5): 74
张吉丽, 李冰, 张继瑜. 黑龙江畜牧兽医, 2016(5): 74
[2] Tchamdja E, Kulo A E, Akoda K, et al. Prev Vet Med, 2016, 126: 151
[3] Du J, Zhu M Y. Progress in Modern Biomedicine, 2015, 15(6): 1154
杜金, 朱明彦. 现代生物医学进展, 2015, 15(6): 1154
[4] Bai Z M. Friend of Farmer Richness, 2015(4): 284
白忠明. 农民致富之友, 2015(4): 284
[5] Yan X J, Zhou Q G. Chinese Journal of Animal Husbandry and Veterinary Medicine, 2014, 34(12): 134
颜喜俊, 周庆国. 中国畜牧兽医文摘, 2014, 34(12): 134
[6] Sahin A, Asencio C, Izotte J, et al. Vet Parasitol, 2014, 203(3/4): 270
[7] Jamal S, Sigauque I, Macuamule C, et al. Onderstepoort J Vet Res, 2005, 72(4): 333
[8] Miller D M, Swan G E, Lobetti R G, et al. J S Afr Vet Assoc, 2005, 76(3): 146
[9] Murilla G A, Mdachi R E, Karanja W M. Acta Trop, 1996, 61(4): 277
[10] Singh S, Chopra M, Dilbaghi N, et al. Int J Biol Macromo, 2016, 92: 788
[11] Do Carmo G M, Baldissera M D, Vaucher R A, et al. Exp Parasitol, 2015, 149: 39
[12] Kondo K, Horie M, Murayama M, et al. Shokuhin Eiseigaku Zasshi, 1999, 40(3): 211
[13] Liu K L, Zhao Y, Zhang S X, et al. Journal of China Agriculture University, 2011, 16(5): 116
刘凯丽, 赵岳, 张素霞, 等. 中国农业大学学报, 2011, 16(5): 116
[14] Roybal J E, Pfenning A P, Storey J M, et al. J AOAC Int, 2003, 86(5): 930
[15] Liu J, Zeng Z L, Yu J X, et al. Chinese Veterinary Science, 2012, 42(5): 533
刘瑾, 曾振灵, 余静贤, 等. 中国兽医科学, 2012, 42(5): 533
[16] Li Y G, Zou Y, Zhang L, et al. J Chromatogr B, 2011, 879(13/14): 1008
[17] Atsriku C, Watson D G, Tettey J N A, et al. J Pharm Biomed Anal, 2002, 30(4): 979
[18] Igoli J O, Blackburn G, Gray A I, et al. Anal Bioanal Chem, 2015, 407(4): 1171
[19] Schad G J, Allanson A, Mackay S P, et al. J Pharm Biomed Anal, 2008, 46(1): 45
[20] Gummow B, Du Preez J L, Swan G E. Onderstepoort J Vet Res, 1995, 62(1): 1
[21] Schad G J. [PhD Dissertation]. Glasgow: University of Strathclyde, 2010
[22] Tettey J N A, Skellern G G, Midgley J M, et al. J Pharm Biomed Anal, 1998, 17(4/5): 713
[23] Schad G J, Euerby M R, Skellern G G, et al. Anal Bioanal Chem, 2012, 404(1): 239
[24] Turnipseed S B, Clark S B, Andersen W C, et al. J Chromatogr B, 2006, 844(1): 127
[25] Kinabo L D, Bogan J A. Acta Trop, 1988, 45(2): 165
[26] Ministry of Agriculture. No. 235 Bulletin of the Ministry of Agriculture of the People’s Republic of China. (2002-12-24) [2017-04-01]. http://yz.hz-agri.gov.cn/uploadFiles/2005-10/1130221564406.doc
农业部. 中华人民共和国农业部公告第235号. (2002-12-24) [2017-04-01]. http://yz.hz-agri.gov.cn/uploadFiles/2005-10/1130221564406.doc
[27] Wu Y N, Shao B, Shen J Z. Veterinary Medicine Residue Detection and Monitoring Technology. Beijing: Chemical Industry Press, 2007
吴永宁, 邵兵, 沈建忠. 兽药残留检测与监控技术. 北京: 化学工业出版社, 2007
[28] 96/23/EC
Simultaneous determination of diminazene aceturate and isometamidium chloride residues in cattle tissues by high performance liquid chromatography with solid-phase extraction
ZHOU Yuhui, ZENG Zhenling, YU Jingxian, LIU Rong, PAN Lihua,ZHONG Qiuyu, CHEN Hong*
(College of Veterinary Medicine, South China Agricultural University, National Reference Laboratory of Veterinary Drug Residues, Guangzhou 510642, China)
A method for the simultaneous determination of trypanocidal diminazene aceturate (DIM) and isometamidium chloride (ISM) that containing benzamidine groups in cattle tissues was developed by high performance liquid chromatography (HPLC) with solid-phase extraction (SPE). The tissue samples were extracted with different proportions of water-acetonitrile, then were cleaned up by Oasis WCX cartridges. DIM and ISM were separated by HPLC with a Spherisorb CN column (250 mm×4.6 mm, 5 μm). Acetonitrile-0.05 mol/L ammonium formate solution (pH 2.4) was used as mobile phases with gradient elution. The detection wavelength of UV was set at 380 nm. The limits of detection (LODs) and the limits of quantification (LOQs) of DIM and ISM in cattle tissues were 0.01 mg/kg and 0.025 mg/kg, respectively. The correlation coefficients (r) of DIM and ISM in cattle tissues were not less than 0.999 3. The average recoveries of DIM and ISM at three spiked levels were 82.2%-97.6% with the intra-day relative standard derivations (RSDs) of 0.3%-5.2% (n=5) and inter-day RSDs of 1.3%-5.2% (n=15). The method was successfully applied to the analysis of DIM and ISM in cattle tissues. The method is rapid, sensitive and repeatable for the determination of diminazene aceturate and isometamidium chloride in cattle tissues.
high performance liquid chromatography (HPLC); solid-phase extraction (SPE); multi-residue determination; diminazene aceturate (DIM); isometamidium chloride (ISM); cattle tissues
10.3724/SP.J.1123.2017.04033
2017-04-27
.Tel:(020)85283034,E-mail:shuyi@scau.edu.cn.
农业行业标准制定项目(农财发[2009]105号).
O658
A
1000-8713(2017)09-0995-08
Foundation item: Agricultural Industry Criteria Formulate Project (Agricultural Finance [2009] No. 105).
*
猜你喜欢
杂志排行
色谱的其它文章
- 超高效液相色谱-四极杆-飞行时间质谱法快速筛查姜和葱中44种农药残留
- Separation and purification of acteoside from Rehmanniaglutinosa by combining macroporous resin with high-speed countercurrent chromatography
- Preparation of filter paper with chiral separation function by oxidation and Schiff-base reaction
- 气相色谱法测定及预测有机磷阻燃剂的蒸气压
- 固相萃取-超高效液相色谱-高分辨质谱法快速测定食用油中4种酚类环境雌激素残留
- 《色谱》论文中可直接使用的缩略词