桃儿七茎叶组织内生真菌多样性
2017-09-12李艳玲周国英杨路存徐文华
宁 祎,李艳玲,李 媛,周国英,杨路存,徐文华,*
1 中国科学院西北高原生物研究所,西宁 810001 2 中国科学院大学,北京 100049 3 中国科学院藏药研究重点实验室,西宁 810001 4 中国科学院生态环境研究中心,北京 100085
桃儿七茎叶组织内生真菌多样性
宁 祎1,2,李艳玲1,4,李 媛1,2,周国英1,3,杨路存1,3,徐文华1,3,*
1 中国科学院西北高原生物研究所,西宁 810001 2 中国科学院大学,北京 100049 3 中国科学院藏药研究重点实验室,西宁 810001 4 中国科学院生态环境研究中心,北京 100085
通过用两种传统培养基(PDA、SDA)分离方法对5个自然野生分布的桃儿七群落(分布于青海省、甘肃省和四川省)茎叶组织内的内生真菌多样性进行研究,并用形态学与分子生物学的方法鉴定菌株。实验结果显示,720个茎叶组织块中共分离到141株内生真菌。依据真菌在培养基上的形态初步划分为52个分类单元,经鉴定归属于19属,其中茎组织中16属>叶组织中6属,桃儿七茎叶组织中的真菌优势属为拟青霉属,相对分离频率为26.34%。5个采样点间内生真菌的香浓维纳多样性指数为0.71—1.41,Sorenson相似性系数为0.13—0.50,定殖率为14.58%—28.47%。通过对PDA、SDA两种培养基以及茎、叶组织的定殖率进行统计,结果显示: PDA(17.50%)
桃儿七;内生真菌;多样性;定殖率;真菌群落结构
植物内生真菌是指其生活史的一定阶段或全部阶段定殖在宿主植物体内,而不引起植物发生明显病变的一类真菌总称[1]。早在19世纪中期,科学界就已经发现某些健康的植物组织中有微生物的存在,但对于这些微小生物体在植物中所发挥的作用却不得而知。现代研究表明,内生真菌定殖在植物体内是自然界长期进化选择的结果,两者形成一种共生或互生关系。其相互作用受到内部因子(宿主植物种类)和外部因子(气候条件、地理位置、温度、湿度、海拔高度等)因素的影响[2]。许多植物内生真菌具有重要的生物学和生态学功能,如产生生物活性物质、抗逆促生、抗病抗虫、降解凋落物等[3- 6],有的研究还表明植物内生真菌能够影响中药药材的道地性,能够提高药用植物对某些次级代谢产物的累积[7- 8]。
桃儿七(Sinopodophyllumhexandrum(Royle) Ying)又名鬼臼、小叶莲等,属小檗科(Berberidaceae)桃儿七属(Sinopodophyllum)多年生草本植物,是我国重要的传统中药材。桃儿七生长于海拔2700—4300 m的林下或灌丛中,在我国主产于青海、甘肃、四川西部、西藏、云南西北部、陕西等地[9]。桃儿七用药部位主要为果实、根及根状茎,藏医体系以果实入药,可调经活血、保胎、消肿、止痛等治疗妇科疾病,中医体系以根及根状茎入药,具有祛痰止咳、抗肿瘤、抗免疫等作用[10],现代医学以提取根及根茎中的鬼臼毒素为原料用于抗病毒(治疗尖锐湿疣)及抗肿瘤药物的合成(VP- 16、VM- 26、NK61等)[11]。由于近年来市场对鬼臼毒素化合物需求急剧增长,导致老百姓大规模无序采挖桃儿七地下部位,造成桃儿七野生资源急剧锐减,加之藏医以其果实入药,更加削弱了桃儿七群体的天然繁殖能力。早在1992年桃儿七植物已被列入《中国珍稀濒危保护植物名录》,为国家三级保护植物,因此转移依靠桃儿七植物资源获取天然药物来源方式势在必行。目前,利用植物内生真菌代谢产物筛选生物活性物质的研究非常引人关注。
研究认为,从植物产天然化合物的组织部位提取分离的内生真菌,其次生代谢产物与宿主植物产的天然药物相同或化学结构式相近的概率较大[12]。目前,有关桃儿七植物内生真菌的研究均集中于根部内生真菌的分离研究,分离到能产鬼臼毒素的内生真菌[13- 18],但这些真菌中没有一株产量能够达到工业生产水平的要求。究其原因,一是可供开发利用的菌种种类太少,为诱变育种和基因工程育种增加了难度。二是分离内生真菌的部位局限于根部,导致菌种中DSE(深色有隔内生真菌类群)内生真菌较多[19],不利于菌种的扩大筛选。研究表明鬼臼毒素在桃儿七中的分布具有一定的规律性,在根及根茎中含量最高,茎叶次之[20]。另有研究表明,桃儿七植物不同产地、不同营养器官中鬼臼毒素的含量差异较大,某些地区茎中鬼臼毒素含量高于根中[21]。由此可见,对于桃儿七植物除了研究根部还应研究茎叶组织等不同器官,扩大菌株筛选部位,为进一步扩大筛选有价值菌种奠定基础。
鉴于此,本研究对桃儿七茎叶组织中的内生真菌多样性展开研究。采集青藏高原东缘桃儿七生长最适宜区的青海、甘肃和四川境内5个自然野生分布点的桃儿七茎叶组织,研究茎叶组织内生真菌群落结构的多态性,探讨不同产地桃儿七茎叶组织中的菌群结构差异,以期掌握桃儿七茎叶组织内生真菌资源状况,为后续研究内生真菌对桃儿七道地性的影响提供理论依据;同时,分离、保存获得的内生真菌菌株,为进一步扩大筛选产鬼臼毒素活性物质的菌种研究奠定基础。
1 材料与方法
1.1 样品采集
于2014年9月初,样品分别采自青海省、甘肃省和四川省境内的5个桃儿七自然分布点。其中,青海省3个采样点,甘肃省和四川省各一个采样点(表1)。采样时每个采样点选取成年健康植株3株,根据随机取样原则,取样的株距在30—50 m之间,所有样品共15株。样品采集后装入干净塑料袋,置入便携式保温箱中,编号、标记后带回实验室备用。实验室内所有样品的处理时间不超过48 h。
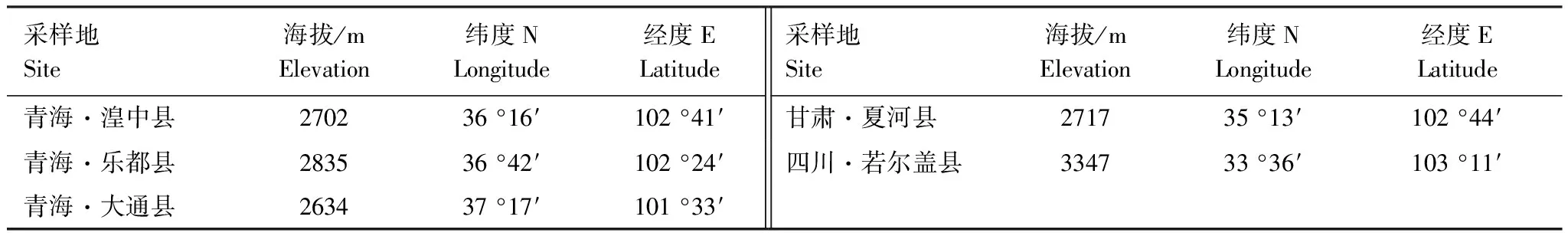
表1 桃儿七采样地点
1.2 分离纯化内生真菌
新鲜样品采回后,洗净桃儿七茎叶表面泥土,自来水冲洗30 min,取出样品置于无菌烧杯中用无菌水漂洗3次,置于无菌操作台中。无菌操作台中的样品表面灭菌过程具体方法如下[16]:将样品浸入70%酒精1 min,再浸入5%的次氯酸钠5 min,最后无菌水漂洗3次。在超净工作台中用无菌吸水纸吸取表面多余水分后,将材料剪切成约1 cm×1 cm小圆片,置于直径为90 mm的马铃薯葡萄糖琼脂培养基(PDA)和沙氏葡萄糖琼脂培养基(SDA)的平板中(茎和叶共720个组织块),于25℃恒温培养箱中暗培养4周。每隔1d检查培养基内有无真菌长出,若有真菌长出及时将真菌转接至新的PDA培养基中,纯化两次,直至获得单菌落。为保证外植体表面灭菌彻底,将第3次漂洗过组织的无菌水抽取1 mL平板涂布在PDA培养基上,此外,将漂洗干燥后的外植体轻压在PDA培养基上20 min后取出。两组无菌对照在相同的培养条件下培养,培养4周后培养基内无真菌长出,说明材料外植体表面灭菌彻底。
1.3 内生真菌的鉴定
分离出的单菌落真菌通过分子生物学和形态学相结合的方法予以鉴定。
分子生物学鉴定:表面刮取纯化后的单菌落真菌菌丝体至无菌的1.5 mL离心管中,编号。用液氮研磨收集的各菌株菌丝体,采用OMEGA公司生产的真菌提取试剂盒提取真菌的总基因组DNA。用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG- 3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC- 3′) 扩增真菌的ITS序列。PCR反应体系为25 μl,反应条件如下:95℃预变性3 min,95℃变性30 s,56℃退火30 s,72℃延伸45 s,共35个循环,72℃延伸7 min。将PCR反应得到的产物经1%琼脂糖凝胶电泳检测后,扩增出的ITS序列送至生工生物工程(上海)股份有限公司进行测序。测序后获得的序列,拷贝校正后,采用Blast程序在NCBI数据库进行同源性对比,使用Clustal X 1.83软件进行多序列比较, 然后用MEGA 5.0软件构建Neighbor-Joining 系统发育树,将内生真菌鉴定到属[22]。
形态学观察鉴定:根据菌落的在PDA培养基上不同阶段生长的菌落形态、颜色、菌体延伸及生长状况等特征,依据《真菌鉴定手册》[23]和《中国真菌志》[24]并结合分子生物学鉴定结果最终确定真菌类群。
1.4 数据统计处理
为了评价青藏高原东缘桃儿七茎叶组织内优势类内生真菌组成、组织块中内生真菌的丰富程度和每个组织块受多重侵染的发生频率。分别统计内生真菌的相对分离频率(IF)和定殖率。
相对分离频率(%) =(样本中分到的某种内生真菌的菌株数/分到的总菌株数)×100%
定殖率= (有内生真菌侵染的组织块数/实验供试的总组织块数)
不同地域内生真菌群落的多样性分析根据Shannon-Wiener指数(H′)来计算。
H′=-∑(Pi)(lnPi)
式中,Pi为分离到的某种内生真菌的菌株数占分离到的全部内生真菌菌株数的百分数。为了比较不同采样地之间内生真菌群落组成的相似程度,采用Sorenson(Cs)相似性系数进行比较。
CS=2j/(a+b)
式中,j为两个采样地间共有的内生真菌种类数,a表示为一个采样地中分离到的内生真菌种类数,b表示为另一个采样地中分离到的内生真菌种类数。
2 结果
2.1 桃儿七茎叶组织内生真菌的组成
从青藏高原东缘3个省份的5个采样点采集的桃儿七茎叶720个组织块中,共分离到141株内生真菌,依据生长形态初步分为52个分类单元,经分子生物学结合形态学鉴定最终可归为19属(表2,图1)。5个采样点中除若尔盖县采样点分离的10个属真菌之外,其余4个采样点间分离的内生真菌属数较为接近。具体为大通6属、乐都6属、湟中5属和夏河5属。综合5个采样点的结果来看,桃儿七茎叶组织内生真菌群落中的优势类真菌为拟青霉属和小球腔菌属,相对分离频率分别为26.24%和14.89%(表2)。

表2 桃儿七茎叶内生真菌的群落组成及分离频率

图1 桃儿七茎叶内生真菌18S rDNA序列系统发育树状图Fig.1 Phylogenetic tree of 18S rDNA ITS sequences of the endophytic fungi isolated from S. hexandrum
在门水平上,子囊菌门占绝对优势,有18个属为子囊菌门,1个属为担子菌门。而在纲的分类水平上,优势类真菌分别为座囊菌纲和散囊菌纲,各占9个属和6个属;在目的分类水平上,优势类真菌为丛梗孢目Moniliales(31.58%);在科的水平上,丛梗孢科Moniliaceae(26.32%)为优势类真菌;属的水平上以拟青霉属Paecilomyces和小球腔菌属Leptosphaeria为优势属内生真菌,分别占到分离内生真菌总数的26.24%和14.89%。分离结果还显示,内生真菌在桃儿七茎叶组织中的分布是不同的,茎和叶组织中共有的内生真菌有3属,分别为拟青霉属、小球腔菌属和曲霉属,而壳针孢属、葡萄孢属和枝霉属真菌只存在于叶中,其余的真菌如短梗霉属等13个属真菌只存在于茎组织中。
2.2 不同采样地内生真菌定殖率的比较
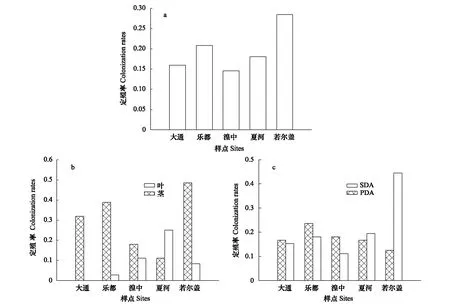
图2 内生真菌的定殖率Fig.2 Colonization rates of endophytic fungi(a)表示为不同采样点间内生真菌的定殖率;(b)表示为桃儿七地上部分茎和叶内生真菌定殖率的差异;(c)表示为不同采样点间内生真菌定殖率对不同培养基类型的响应
由实验结果可得,桃儿七茎叶组织内生真菌定殖率相对较低(19.58%)。5个采样点间内生真菌的定殖率存在差异,其中四川省若尔盖县采样点的定殖率最大(28.47%),青海省湟中县境内的定殖率最小14.58%(图2a)。定殖率在茎叶组织间的分布为茎(29.72%)>叶(9.44%),不同采样点间茎的定殖率表现为:四川若尔盖(48.61%)>青海乐都(38.89%)>青海大通(31.94%)>青海湟中(18.06%)>甘肃夏河(11.11%),叶的定殖率表现为:甘肃夏河(25.00%)>青海湟中(11.11%)>四川若尔盖(8.33%)>青海乐都(2.78%)>青海大通(0)。从采样点间来看,除甘肃夏河之外,其余四个采样点均为茎组织内生真菌的定殖率高于叶组织,而青海大通采样点叶组织中没有分离到内生真菌(图2b)。研究结果显示,不同的培养基类型对于内生真菌定殖率的影响不同。总的来说,SDA培养基上内生真菌的定殖率(21.67%)要高于PDA培养基(17.50%),但是不同的采样点对不同的培养基类型偏好性不同,位于青海省境内的3个采样点均偏好于PDA培养基,而位于甘肃省境内和四川省境内的采样点却偏好于SDA培养基(图2c)。
2.3 不同采样地内生真菌的多样性和相似性
Shannon-Wiener多样性指数分析结果如表3所示,5个采样点内生真菌多样性指数较低,分布在0.71—1.41之间。多样性最高的采样点为若尔盖,而多样性最低的为夏河。不同采样点间的相似性指数分布在0.13—0.50之间,其中青海省境内的乐都和大通两个采样点间的相似性最高,为0.50,而青海省境内的湟中与四川省境内的若尔盖相似性最低,为0.13。总的来说,不同采样地之间桃儿七茎叶内生真菌的相似性较低,说明不同采样地间菌群组成具有较大的差异。

表3 采样点间内生真菌的相似性和多样性
2.4 不同采样地内生真菌的组成
对不同采样地分离出的内生真菌种群进行分析可得,夏河、大通和乐都以拟青霉属为优势属,所占频率分别为42.31%,56.52%和33.33%,若尔盖以小球腔菌属为优势属,占该地内生真菌总数的26.83%,而湟中的优势属则为壳针孢属,占该地内生真菌总数的38.10%(表4)。

表4 不同采样地分离的内生真菌菌株数
此外,本研究中没有发现某一类内生真菌能够同时出现在5个采样点中,分离频率最高的内生真菌拟青霉属只存在于除四川若尔盖采样点之外的其余4个采样点中(表4)。某些类群的内生真菌只存在于一个采样点中,如若尔盖桃儿七茎组织中的核座孢属、木霉属、小鬼伞属、根球虫属及叶组织中的葡萄孢属,湟中采样点中的锥毛壳属和背芽突霉属,大通采样点中的茎点霉属和座囊菌属,乐都采样点中的球囊菌属,夏河采样点中的枝孢属。这表明内生真菌群落结构与宿主植物桃儿七所处的生境有关,外部环境条件决定了一些特有的真菌类群的定殖。
3 讨论
3.1 内生真菌的群落结构与生境相关性
本研究对青藏高原东缘3个省份,5个采样点的桃儿七茎叶组织内生真菌进行分离研究。结果显示,优势属真菌为拟青霉属,但各采样点间优势属真菌不完全相同,夏河、大通和乐都以拟青霉属为优势属,而若尔盖和湟中则分别以小球腔菌属和壳针孢属为优势属。对比前人对桃儿七根茎组织内生真菌研究:如李海燕等[25]对云南中甸县桃儿七地下茎内生真菌进行分离,结果分离内生真菌28株,可归属为5目、6科、9属,优势属真菌为丛梗孢属;张琨等[17]对陕西太白山桃儿七地下茎内生真菌进行研究,分离内生真菌菌株20株,归属于2目、3属,优势属为毛霉属;毕江涛等[26]从宁夏泾源县桃儿七根、茎、叶中分别分离到内生真菌 22株、18株和9株,归属于2目、3科、9属,其中梭孢霉属为优势属真菌;祝英等[27]从甘肃兴隆山桃儿七地下茎中分离内生真菌20株,优势属真菌为曲霉属、Eucasphaeria、白僵菌属和镰刀菌属。可见,不同采样地桃儿七内生真菌优势属真菌差别明显,内生真菌的群落组成也存在着较大差异。本研究中,除不同采样地优势属真菌不完全相同外,内生真菌的群落相似性同样较低。这些结果表明,内生真菌的群落结构与宿主植物所处的生境密切相关,局部微环境是影响桃儿七内生真菌种群形成的主要原因。有研究认为影响植物内生真菌群落结构的主因在于根系周围的土壤微生物,认为土壤中的真菌入侵植物组织内部造成群落结构各有不同[28]。也有研究认为区域的植被类型和气候特征是造成内生真菌群落结构差异的主要因素[29]。总之,宿主植物生境的不同决定着定殖在植物体内内生真菌的群落结构,至于何种生境因子起关键作用还需要系统、全面的深入研究。
此外,本研究中内生真菌定殖率为14.58%—28.47%,多样性指数为0.71—1.41。研究结果与同处于相近纬度或热带地区维管植物内生真菌的定殖率和多样性指数相比较低。前人研究表明,陆生植物地上部分定殖率在11%—100%之间[6,30],如Huang等[31]对中国不同地域29种传统药用植物内生真菌进行研究,结果显示内生真菌的定殖率在36.7%—100%之间。Sun等[30]对北京植物园内的6种药用植物茎叶组织内生真菌进行研究,结果显示内生真菌的定殖率在6种植物间为47.9%—63.1%之间。定殖率和多样性代表着植物中内生真菌的丰富程度,本研究中内生真菌的多样性和定殖率较低可能和所处的青藏高原特殊地理气候有关,青藏高原是世界上海拔最高、面积最大的高原,高海拔、强辐射、昼夜温差大和寒冷是这一地区的普遍特征[32]。内生真菌的定殖率和多样性会随着宿主植物所处环境的海拔、湿度、降雨量和温度的不同呈现明显的变化[2]。
3.2 桃儿七茎叶内生真菌的应用潜力
5个采样地中的15株桃儿七植株茎叶组织采用两种培养基共分离出19属内生真菌。其中,交链孢属[13]、青霉属[14]均是已被证明过的能够产生鬼臼毒素的自桃儿七中分离到的内生真菌。本研究中,这些真菌均不是优势属真菌,它们在真菌群落所占频率较低,但鉴于它们有产生鬼臼毒素的研究历史,这两类真菌将是我们此后筛选产生鬼臼毒素内生真菌的首要研究对象。此外,研究还发现,某些内生真菌首次作为桃儿七内生真菌被报道,如优势属真菌拟青霉属和小球腔菌属等13属真菌,这些真菌均可以作为新的筛选资源,为从中发现新的菌株和有活性的代谢产物提供了广泛的研究空间。
此外,优势属的真菌拟青霉属和次优势属真菌小球腔菌属,它们在桃儿七植株的茎叶组织中均有分布。这两种内生真菌是常见的内生真菌,在许多植物和环境地域均被分离报道,其次生代谢产物表现出药用价值和应用价值,如产抗癌活性物质、拮抗病原性真菌、产新型化合物等[33- 36]。并且,研究还显示拟青霉属真菌是自然界中一类重要的昆虫病原性真菌,可以有效的控制害虫的种群数量和繁殖[37],本研究中拟青霉属在桃儿七茎叶中广泛定殖,可能对桃儿七种群抵御自然环境中的虫害具有一定的生态学作用。此外,青霉属、木霉属、曲霉属、茎点霉属和交链孢属是自然界常见的植物内生真菌类群,它们在宿主植物中广泛分布,这些真菌具有重要的生物学和生态学功能[38],对于这些真菌的开发利用,亦是我们今后工作的研究重点。目前,对于桃儿七茎叶内生真菌的研究较少,大量的内生真菌资源还有待挖掘和开发,本研究对扩大桃儿七植株内生真菌种源筛选提供了新的思路。此外,选取桃儿七茎叶组织为研究对象,这样在得到内生真菌的同时也不破坏野生桃儿七种群,可以更加充分的保护桃儿七自然资源。
[1] Stone J K, Bacon C W, White J F Jr. An overview of endophytic microbes: Endophytism defined //Bacon C W, White J, eds. Microbial Endophytes. New York: Marcel Dekker, 2000: 3- 29.
[2] Hoffman M T, Arnold A E. Geographic locality and host identity shape fungal endophyte communities in cupressaceous trees. Mycological Research, 2008, 112(3): 331- 344.
[3] Li H Y, Qing C, Zhang Y L, Zhao Z W. Screening for endophytic fungi with antitumour and antifungal activities from Chinese medicinal plants. World Journal of Microbiology and Biotechnology, 2005, 21: 1515- 1519.
[4] Redman R S, Sheehan K B, Stout R G, Rodriguez R J, Henson J M. Thermotolerance conferred to plant host and fungal endophyte during mutualistic symbiosis. Science, 2002, 298: 1581.
[5] Arnold A E, Mejía L C, Kyllo D, Rojas E I, Maynard Z, Robbins N, Herre E A. Fungal endophytes limit pathogen damage in a tropical tree. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(26): 15649- 15654.
[6] Sun X, Guo L D, Hyde K D. Community composition of endophytic fungi inAcertruncatumand their role in decomposition. Fungal Diversity, 2011, 47(1): 85- 95.
[7] 贾敏, 游飞, 秦路平. 内生菌药用新资源与道地药材的关系探讨. 药学服务与研究, 2009, 9(5): 321- 324.
[8] 马昭, 唐承晨, 张纯, 胡之璧, 王莉莉, 黎万奎. 内生菌与宿主植物关系对中药材道地性研究的启示. 上海中医药大学学报, 2015, 29(6): 4- 11.
[9] 杨永昌. 藏药志. 青海: 青海人民出版社, 1991: 319- 320.
[10] 李艳玲, 宁祎, 徐文华, 周国英. 桃儿七不同部位2种木脂素含量的动态研究. 中国中药杂志, 2015, 40(9): 1837- 1841.
[11] Yousefzadi M, Sharifi M, Behmanesh M, Moyano E, Bonfill M, Cusido R M, Palazon J. Podophyllotoxin: Current approaches to its biotechnological production and future challenges. Engineering in Life Sciences, 2010, 10(4): 281- 292.
[12] Aly A H, Debbab A, Proksch P. Fungal endophytes: unique plant inhabitants with great promises. Applied Microbiology and Biotechnology, 2011, 90(6): 1829- 1845.
[13] 李海燕, 王志军, 张玲琪, 张无敌. 一种桃儿七内生真菌的分离初报. 云南大学学报: 自然科学版, 1999, 21(3): 243- 243.
[14] 杨显志, 郭仕平, 张玲琪, 邵华. 鬼臼类植物产鬼臼毒素内生真菌的筛选. 天然产物研究与开发, 2003, 15(5): 419- 422.
[15] 王兴红. 鬼臼类植物内生真菌的分离及其抗癌活性研究. 天然产物研究与开发, 2006, 18(5): 723- 727.
[16] Puri S C, Nazir A, Chawla R, Arora R, Riyaz-ul-Hasan S, Amna T, Ahmed B, Verma V, Singh S, Sagar R, Sharma A, Kumar R, Sharma R K, Qazi G N. The endophytic fungusTrameteshirsutaas a novel alternative source of podophyllotoxin and related aryl tetralin lignans. Journal of Biotechnology, 2006, 122(4): 494- 510.
[17] 张琨, 黄建新, 曹莉, 袁文常. 桃儿七内生菌及产鬼臼类物质菌株的筛选. 西北大学学报: 自然科学版, 2008, 38(3): 431- 434.
[18] Nadeem M, Mauji R, Pravej A, Ahmad M M, Mohammad A, Qurainy F A, Khan S, Abdin M Z.Fusariumsolani, P1, a new endophytic podophyllotoxin-producing fungus from roots ofPodophyllumhexandrum. African Journal of Microbiology Research, 2012, 6(10): 2493- 2499.
[19] 刘茂军, 张兴涛, 赵之伟. 深色有隔内生真菌(DSE)研究进展. 菌物学报, 2009, 28(6): 888- 894.
[20] 区智, 屈燕. 桃儿七国内外研究进展. 北方园艺, 2013, 37(18): 183- 185.
[21] 熊文勇, 魏朔南, 岳明. HPLC分析桃儿七中鬼臼毒素的含量. 中成药, 2010, 32(5): 875- 878.
[22] 臧威, 孙翔, 孙剑秋, 于文喜, 王雪松, 尹军霞, 宋瑞清. 南方红豆杉内生真菌的多样性与群落结构. 应用生态学报, 2014, 25(7): 2071- 2078.
[23] 魏景超. 真菌鉴定手册. 上海: 上海科学技术出版社, 1979.
[24] 齐祖同, 孔华忠. 中国真菌志—曲霉属及其相关有性型. 北京: 科学出版社, 1997.
[25] 李海燕, 曾松荣, 张玲琪. 云南桃儿七植株地下茎内生真菌多样性及有价值菌株的筛选. 西南农业学报, 1999, 12(4): 123- 125.
[26] 毕江涛, 何萍, 吕雯, 关晓庆, 贺达汉. 桃儿七内生真菌分离及其抑菌活性初步研究. 中草药, 2013, 44(12): 1667- 1672.
[27] 祝英, 王治业, 杨晖, 周剑平. 桃儿七地下茎内生真菌的分离和鉴定. 中国现代中药, 2015, 17(6): 572- 576.
[28] Bertollo P. Assessing landscape health: a case study from northeastern Italy. Environmental Management, 2001, 27(1): 349- 365.
[29] 梁雪娟, 张水寒, 张平, 彭菲, 柯健, 糜亚男. 不同产地杜仲皮内生真菌种群结构的比较分析. 中国中药杂志, 2014, 39(2): 204- 208.
[30] Sun J Q, Guo L D, Zang W, Ping W X, Chi D F. Diversity and ecological distribution of endophytic fungi associated with medicinal plants. Science in China Series C: Life Sciences, 2008, 51(8): 751- 759.
[31] Huang W Y, Cai Y Z, Hyde K D, Corke H, Sun M. Biodiversity of endophytic fungi associated with 29 traditional Chinese medicinal plants. Fungal Divers, 2008, 33: 61- 75.
[32] Gai J P, Christie P, Cai X B, Fan J Q, Zhang J L, Feng G, Li X L. Occurrence and distribution of arbuscular mycorrhizal fungal species in three types of grassland community of the Tibetan plateau. Ecological Research, 2009, 24: 1345- 1350.
[33] Huang Y J, Wang J F, Li G, Zheng Z H, Su W J. Antitumor and antifungal activities in endophytic fungi isolated from pharmaceutical plantsTaxusmairei,CephalataxusfortuneiandTorreyagrandis. FEMS Immunology and Medical Microbiology, 2001, 31(2): 163- 167.
[34] Liu J Y, Liu C H, Zou W X, Tian X, Tan R X. Leptosphaerone, a Metabolite with a Novel Skeleton fromLeptosphaeriasp. IV403, an Endophytic Fungus inArtemisiaannua. Helvetica Chimica Acta, 2002, 85(9): 2664- 2667.
[35] Xu L L, Han T, Wu J Z, Zhang Q Y, Zhang H, Huang B K, Rahman K, Qin L P. Comparative research of chemical constituents, antifungal and antitumor properties of ether extracts ofPanaxginsengand its endophytic fungus. Phytomedicine, 2009, 16(6/7): 609- 616.
[36] 杨明琰, 田稼, 马瑜, 孙超, 黄继红. 杜仲内生真菌的分离鉴定及抗菌活性研究. 西北植物学报, 2012, 32(1): 193- 198.
[37] 罗科, 张青文, 杨奇华. 拟青霉属真菌在植物保护中的研究利用. 世界农业, 1990, 32- 33.
[38] Li H Y, Shen M, Zhou Z P, Li T, Wei Y L, Lin L B. Diversity and cold adaptation of endophytic fungi from five dominant plant species collected from the Baima Snow Mountain, Southwest China. Fungal Diversity, 2012, 54(1): 79- 86.
DiversityofendophyticfungifromthestemandleafofSinopodophyllumhexandrum(Royle)Ying
NING Yi1,2, LI Yanling1,4, LI Yuan1,2, ZHOU Guoying1,3, YANG Lucun1,3, XU Wenhua1,3,*
1NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences,Xining810001,China2UniversityofChineseAcademyofSciences,Beijing100049,China3KeyLaboratoryofTibetanMedicineResearch,ChineseAcademyofSciences,Xining810001,China4ResearchCenterforEco-EnvironmentalSciences,ChineseAcademyofSciences,Beijing100085,China
In this study, endophytic fungal diversity of the host plantSinopodophyllumhexandrum(Royle) Ying was investigated at five locations in Qinghai, Gansu, and Sichuan Provinces. The endophytic fungi on the stems and leaves of the host plants were isolated on two culture media, potato dextrose agar (PDA) and Sabouraud dextrose agar (SDA), and the strains were identified using morphological and molecular analyses. A total of 141 endophytic fungi were isolated from 720 tissue samples. These fungi were divided into 52 endophytic taxa on the basis of their morphology in the culture media. Phylogenetic analysis based on the internal transcribed spacer region indicated 19 genera, 18 of which belonged to Ascomycetes and 1 to Basidiomycetes. The number of genera varied among the five locations: 10 were detected in Ruoergai County, 6 in Datong County, 6 in Ledu County, 5 in Huangzhong County, and 5 in Xiahe County. With respect to tissue type, 16 genera were isolated from the stems, 6 from the leaves, and only 3 were found in both tissues. Further analysis showed thatPaecilomyceswas the most dominant genus, with an isolation frequency of 26.34%, followed byLeptosphaeria, with an isolation frequency of 14.89%. The community structure clearly differed among the locations. At the sites in Xiahe County, Datong County, and Ledu County, the dominant genus wasPaecilomycesand the isolation frequencies were 42.31%, 56.52%, and 33.33%, respectively. The dominant genus wasLeptosphaeriain Ruoergai County andSeptoriain Huangzhong County, with isolation frequencies of 26.83% and 38.10%, respectively. Shannon′s diversity index ranged from 0.71 to 1.41 and was the highest in Ruoergai County and the lowest in Huangzhong County. Sorenson similarity index ranged from 0.13 to 0.50; it was the highest between Datong County and Ledu County and the lowest between Ruoergai County and Huangzhong County. The colonization rate of the endophytic fungi at the five locations ranged from 14.58% to 28.47%; the mean colonization rate was 19.58%, and the highest colonization rate was observed in Ruoergai County and the lowest colonization rate in Huangzhong County. In addition, the colonization rate was higher in SDA (21.67%) than in PDA (17.50%) and higher in the stem (29.72%) than in the leaf (9.44%). These findings revealed that the species diversity of the endophytic fungi in the stem and leaf tissues ofS.hexandrumwas low, but the community structure ofS.hexandrumdiffered substantially among the sampling sites. Endophytic fungi that colonize stem and leaf tissues are targets for the production of podophyllotoxin and other natural compounds and, accordingly, have potential practical applications. This study offers a novel strategy for identifying valuable microbial strains fromS.hexandrum.
Sinopodophyllumhexandrum(Royle) Ying; endophytic fungi; diversity; colonization rate; community structure
2015年国家级星火计划重点资助项目(2015GA870007);中国科学院“西部之光”人才培养计划重点项目后续择优支持资助项目(2013年)
2016- 05- 05; < class="emphasis_bold">网络出版日期
日期:2017- 03- 22
10.5846/stxb201605050851
*通讯作者Corresponding author.E-mail: whxu@nwipb.cas.cn
宁祎,李艳玲,李媛,周国英,杨路存,徐文华.桃儿七茎叶组织内生真菌多样性.生态学报,2017,37(15):5157- 5166.
Ning Y, Li Y L, Li Y, Zhou G Y, Yang L C, Xu W H.Diversity of endophytic fungi from the stem and leaf ofSinopodophyllumhexandrum(Royle) Ying.Acta Ecologica Sinica,2017,37(15):5157- 5166.
