淡水鱼类功能多样性及其研究方法
2017-09-12帅方敏李新辉陈方灿李跃飞杨计平
帅方敏,李新辉,陈方灿,李跃飞,杨计平,李 捷,武 智
1 中国水产科学研究院珠江水产研究所,广州 510380 2 农业部珠江中下游渔业资源环境重点野外科学观测试验站,肇庆 526100 3 中国水产科学研究院珠江流域渔业资源养护与生态修复重点实验室,广州 510380
淡水鱼类功能多样性及其研究方法
帅方敏,李新辉*,陈方灿,李跃飞,杨计平,李 捷,武 智
1 中国水产科学研究院珠江水产研究所,广州 510380 2 农业部珠江中下游渔业资源环境重点野外科学观测试验站,肇庆 526100 3 中国水产科学研究院珠江流域渔业资源养护与生态修复重点实验室,广州 510380
目前, 群落功能多样性备受生态学界关注,被认为是能解决生态问题的一种重要途径。我国对于群落功能多样性主要集中在植物群落和微生物群落,而在鱼类群落方面的研究几乎是空白。我国鱼类资源正面临着严重威胁,包括水坝建设导致的鱼类通道受阻、水库形成造成鱼类产卵场功能消失、过度捕捞、水质恶化和富营养化加重、外来种入侵等因素,导致渔业资源急剧衰退,水生生态系统功能下降。以淡水鱼类群落为例,对鱼类功能多样性的数据获取及处理分析与评价、测定指标及计算方法与研究难点等进行综述,以期为鱼类资源保护提供新的理论依据和切入点。
功能多样性; 群落结构;数量分析方法;淡水鱼类;功能性状
近十几年间,生物多样性如何影响生态系统功能过程得到了越来越多科学家的重视。目前普遍认为,生物多样性包括基因型、物种、功能型和景观单位的数量和组成。然而,在大多数生物多样性——生态系统功能关系的研究中,生物多样性往往被认为等同于物种多样性,而忽视了其他组成部分[1]。但是不同的物种在生理、生态、形态特征等方面存在极大的差别,因而简单的物种多样性难以真实地体现每个物种性状对生态系统过程所起的作用。生态系统功能不仅仅依赖于物种的数目,而且依赖于物种所具有的功能性状[2-3]。两个具有相同物种数的群落,由于物种拥有不同的性状和特征,很可能在功能多样性方面表现出较大差异[4]。因此,越来越多的学者提出用功能性状的多样性代替物种多样性对群落进行研究[5-6]。功能多样性作为生物多样性的一个成分对于维持生态系统的功能具有重要意义,并且对生态系统功能有更大的决定作用。作为衡量生物多样性的另一种方法,功能多样性所关注的是与生态系统功能密切相关的物种功能特征,该指标能更加明确地反映群落中物种间资源互补的程度[1,7]。换言之,功能多样性是指群落内物种间功能特征的总体差别或多样性[8]。
功能多样性高的生态系统,其生态位更趋分化,资源能够得到最大利用,生态系统更稳定,具有较高的生产力[9]、较强的恢复力[10]和较强的入侵抵抗力[11-12]。目前群落功能生态学已经成为解决生态问题的一种重要途径[13-14],这种方法已经广泛应用于微生物群落和初级生产者群落,尤其是植物群落,但是在动物群落,特别是脊椎动物(如鱼类)的研究远远滞后于植物群落。
尽管淡水生态系统只占整个地球表面的1%左右[15],但是淡水生态系统却向人类提供了极其丰富的生物多样性[16]和无以替代的生态服务功能,如饮用水,水产品等。然而由于人口的增长、社会经济的迅速发展和对生物资源不合理的开发利用,严重破坏了生态环境,已导致全球范围生物多样性的极大丧失以及生态系统功能的退化[17]。水坝建设导致的鱼类通道受阻、水库形成造成鱼类产卵场功能消失、过度捕捞、水质恶化和富营养化加重,外来物种入侵等因素,导致淡水生态系统功能急剧衰退。
近年来由于国际社会上对水生生态系统的广泛关注,关于淡水鱼类的功能多样性研究也日趋深入,国外学者在这方面做了大量工作,例如植食性鱼类相对肠长较长,而肉食性鱼类相对肠长较短[18];口裂的相对或绝对大小与食物大小呈正相关,也与鱼食性呈正相关[19-20];眼位、眼径、口位和口须与食物在水体中的垂直位置相关[19]。鱼类的营养级位置与其特化的功能性形态相对应,如鳜(Sinipercachuatsi)有较大的头面积、头高、背鳍靠前、眼睛较大且靠上、纺锤形体型,这些形态特征都适合其伏击其他鱼类;如翘嘴鲌(Culteralburnus)、鳤(Ochetobiuselongatus)等,身体呈梭形,背鳍和尾鳍靠后,有较深的叉尾,较长且较窄的尾柄,头部面积较小,这些形态特征都有利于该类鱼在追击小型鱼虾时能够持续加速[21-22]。已有研究表明外来水生生物在资源需求上的功能差异对水生生态系统过程产生巨大影响[23-24],入侵种通过改变系统水平的资源有效性、营养级结构及干扰频率与强度,从而改变生态系统的功能甚至生态系统的稳定性[25-26]。如外来种的介入,使得全球范围内淡水鱼类的体型发生不同程度的改变[27],进而影响淡水鱼类的功能多样性[28]。针对淡水生态系统,国外学者提出了一系列研究方法与计算指标[29-31]。相比,国内的研究较少,但也取得了一定的成绩[32-33]。因此加强淡水鱼类功能多样性研究迫在眉睫,有必要充分了解淡水鱼类功能多样性及其研究方法,尤其是针对淡水鱼类的功能多样性数据的获取与处理,分析与评价及存在的研究难点。
1 淡水鱼类功能性状的选择
功能多样性是指特定生态系统中物种功能特征的数值,范围和分布[34],也叫功能特征多样性(Functional trait diversity,FTD), 强调群落中物种功能的差异[35-36]。据此定义,功能多样性的测定实质就是功能特征多样的测定[8];而功能特征是指那些可影响生态系统功能过程的生物特征[35]。对淡水鱼类而言,功能特征主要指如口裂大小、眼位、眼径、胸鳍形状、尾鳍形状、体型等在觅食、运动和栖息地利用三方面的特征[21,37-38]。鱼类性状的选择主要与游泳能力和食物获取能力等相关,且遵从易于定量化计算的原则。根据近年来发表的文献,常用的功能特征指标见表1。

表1 常用的淡水鱼类功能特征(参考Villéger et al. 2010[39])
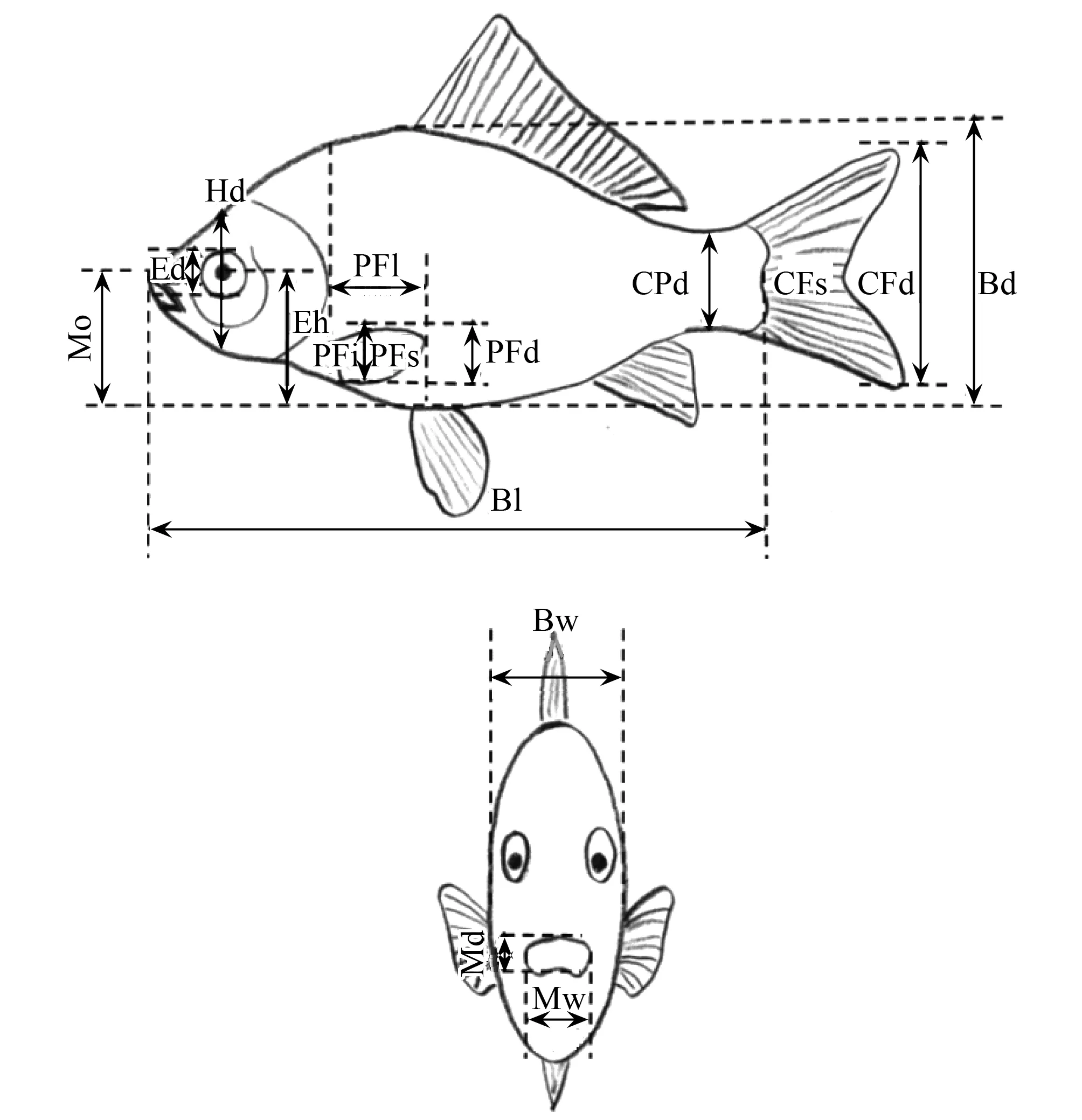
图1 功能形态特征测量图Fig.1 Morphological traits measured on digital pictures Bl:体长,Bd:体高,CPd:最小尾柄宽,CFd:尾鳍宽,CFs:尾鳍面积,PFi:胸鳍顶端到身体底部的距离,PFd:胸鳍宽,PFl:胸鳍长,PFs:胸鳍面积,Hd:通过眼中心的体高,Ed:眼直径,Eh:眼中心到身体底部的距离,Mo:嘴上沿到身体底部的距离,Bw:体宽,Md:嘴上下宽度,Mw:嘴左右宽度,Te:卵粒数,M:体重
2 鱼类功能多样性计算指数
关于淡水鱼类功能多样性的定量计算方法,国内在此领域还未曾展开,目前现有的算法均来自于国外研究者的成果。鱼类功能多样性指数的计算,很多也是借鉴植物学领域的计算方法。Mason等提出3个独立的功能多样性指数,即功能体积指数(FRic)、功能均匀度指数(FEve)和功能趋异指数(FDvar),分别表征物种占据了多少生态位空间、物种性状在所占据性状空间的分布规律、以及群落内物种间的生态位互补程度[47]。Villéger等结合物种在功能空间的分布和多度,将以上3个指数的计算方法进行了优化,并进一步提出功能离散指数(FDiv)[29]。最近,Mouillot等提出应该增加几个更能反映鱼类群落生态过程的指数,即功能专一化指数(FSpe)、功能占有指数(FOri)、功能离散指数(FDis)和功能熵指数 (FEnt)[48]。
将以上指数总体归结起来可分为三大类,即功能丰富度、功能均匀度和功能离散度。其中功能丰富度测量了现有物种所占据了多少生态位空间;功能均一度衡量物种性状平均值在己占据的性状空间中是否分布均匀;功能离散度描述物种功能和性状空间中物种群落所处位置的差异程度,即各物种在性状空间内的距离。
2.1 功能丰富度指数
功能丰富度指数衡量一个群落中鱼类占据了多少生态位空间[47,49],但不权衡物种的多度,可作为评价群落生产力、对环境波动的缓冲能力,或者对生态入侵的承受能力等的指标。功能丰富度指数对鱼类丰富度的改变非常敏感,而两个具有相同物种丰富度的鱼类群落在功能丰富度上不一定会相同,因为鱼类如果拥有不同的性状,那在性状空间中的分布会存在差异。如果两个群落功能性状间的距离较接近,则功能丰富度低,表示部分生态位未被占据,说明资源利用率低。当选择与抗胁迫能力相关的性状计算功能丰富度时,如果所得值较低,意味着该群落中缺少能够利用改变后环境条件的鱼类,群落对环境波动的缓冲能力下降[9],因此群落抗入侵能力也随之下降。
功能丰富度指数一般用功能体积指数表示(FRic)。功能体积指数是用最小凸多边形(Convex hull)体积计算性状空间体积,描绘包含所有性状的最小凸多边形,即性状空间内必存在一个最小凸多边形,使所有物种的点在其范围内或边上。首先,确定具有性状极值的物种,将其作为最小凸边形的端点;然后将其连接生成最小凸多边形;最后计算其面积或体积[50]。其计算公式为:

式中,SFic指群落中物种所占据的生态位,Rc指特征值的绝对值。
2.2 功能均一度指数
功能均匀度指数测量鱼类性状在所占据性状空间的分布规律[47]。用多维功能均匀度指数(FEve)表示。FEve指数计算所有物种对间的距离,并按相对多度权重,聚类并计算得到多维性状空间的最小生成树,即将性状空间中的所有点相连得到树状图,且保证总分枝长度最小,最后测量最小生成树分支长度的均匀性[29]。其值处于(0,1)之间,高的功能均匀度指数意味着非常有规律的分布,低的功能均匀度指数预示存在物种分布间隙。
该指数一般用于预测资源的利用,也用于生产力、恢复力、入侵脆弱性等[47,49]。其计算公式为:

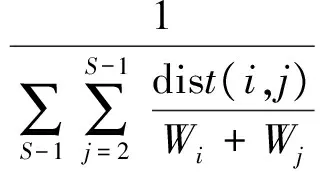
2.3 功能离散度指数
功能离散度指数测量鱼类群落功能性状的多度分布在性状空间中的最大离散程度[47]。高的功能离散度主要是由于位于性状空间边缘的物种多度较多导致。功能离散度指数用于测量资源分异度,如竞争,功能离散度小,说明物种间竞争激烈,生态位空间相对紧张。如功能均匀度指数一样,功能离散度包含物种的多度。
2.3.1 Rao的二次熵指数
Rao的二次方程整合了物种丰富度和物种对之间的功能特征差异的信息[51],它主要计算了鱼类间距离的变异。Rao 指数的计算分以下两个步骤:第一步,获得鱼类特征值的矩阵;第二步,不同采样地中鱼类的相对丰富度计算。Rao 指数的计算关键在于鱼类间的趋异性的测定(以鱼类的功能特征为基础)及鱼类在群落中的比例[4]。Rao指数兼具功能多样性的两个方面——功能丰富度和功能离散度,即Rao的意义介于功能丰富度和功能离散度之间[52]。计算公式为:
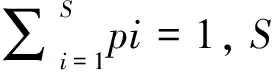
2.3.2功能趋异指数 (FDvar)
该指数用以定量表示鱼类群落内特征值的异质性,反应群落中随机抽取的两个鱼类特征值相同的概率有多少,同时也体现出物种间的生态位互补程度[47]。功能分异指数越高,表明种间生态位互补性越强,竞争作用则较弱。因此,功能分异性较高的鱼类群落,由于其对资源充分有效的利用,使得生态系统的功能增强。某一鱼类群落的功能分异指数可用体现每一物种的个体所占据的有效生态位的多维特征值及其丰富度求得,群落的功能分异指数由群落内各物种的功能分异指数的平均数表示。

2.3.3功能离散指数(FDiv)
FDiv指数也是利用鱼类凸多边形体积来计算。首先确定凸多边形的重心,再计算每个鱼类的性状与重心的平均距离,最后根据多度权重计算离散度。当优势种靠近重心时,FDiv低,而位于凸多边形顶点时,FDiv高。然而,这个方法有一定局限性,当某个性状数值缺少时,该指数无法计算,当测定对象的物种数少于性状数时也无法应用[53]。该指数的使用限定条件是需要物种数大于性状数。具体计算公式如下:



3 淡水鱼类功能多样性数据的获取及处理分析
虽然形态特征并不能完全反映鱼类在生态系统中的所有作用(如营养循环[54- 55])等,但是鱼类的外部形态是其与环境之间以及与其他生物之间的相互作用的综合反映[56],并且形态特征有效的描述了与食物获取和运动等功能相关的特征。对于鱼类来说,形态特征仍然是唯一可合理量化的功能性状[19,39,57]。因此鱼类的功能多样性通过测量鱼类形态多样性获得。
首先根据研究对象和实际情况选取能够充分反映鱼类摄食和运动的功能性状特征。可以通过野外采样获得鱼类样本,用数显游标卡尺现场测量形态特征值(图1),或通过查阅相关文献,获取鱼类图片,通过ImageJ软件(http://rsb.info.nih.gov/ij/index.html)测量各形态特征的相对值。将形态特征值按照表1进行组合后获得功能特征值。功能研究以群落为单元,因此对于群落中的每一个体,都应计算其功能特征值;同时获取群落中每个种的多度数据。获取每一个体的功能特征值和多度数据后就可利用R软件中的“ape”包 和“geometry”包计算功能多样性指数。根据不同的研究目的,可选择不同的指数,如FRic,FEve,FDiv,FSpe等[29]。如某一种鱼在功能空间所占的比例代表着该种鱼在生态系统里的功能大小。由于鱼类个体适应不同的环境,不同发育时期的种内形态变化也很大,因此在进行群落功能多样性研究时,最准确的方法是从个体的水平进行研究。
4 全球淡水鱼类群落功能多样性评价
Stuart-Smith等和 Toussaint等分别将物种多度数据和形态功能性状特征结合,在大尺度上分析了囊括全球6个地理区系(即新热带区Neotropics,东洋区Oriental,非洲区Afrotropical,古北区Palearctic,新北区Nearctic和澳洲区Australian),超过9000种鱼类后发现全球淡水鱼类功能多样性最高的地区集中在新热带地区[58-59]。新热带地区(面积约占整个地球表面的15%)拥有超过全球75%的淡水鱼类功能多样性,而其他地区的功能多样性合起来也不到25%。这种差异主要是由于新热带地区的某些鱼类具有较高的功能唯一性所产生。同时他们还定量分析了由物种消失而产生的功能多样性损失,即计算在IUCN里列出的濒危物种所占的功能多样性比例,发现在新热带地区,濒危物种的消失只导致功能多样性的有限损失(<10%),而在新北区和古北区,濒危物种的消失会导致功能多样性分别下降43%和33%,因而新北区和古北地区属于功能脆弱地区。这说明新热带鱼类多样性保护至关重要,但并不表明不需要保护世界上其他地区的濒危鱼类,因为濒危鱼类在生态系统中也发挥一定的功能。Toussaint 教授还分析了物种多样性与功能多样性之间的关系,发现他们之间呈弱相关性,这表明在同一地区,物种多样性丰富的河流,并不一定功能多样性高。该研究结果分别发表在ScientificReports杂志上。
5 鱼类功能多样性研究的难点
运用功能性状能更加清楚的描述群落功能结构中物种的生态位,然而鱼类群落功能性状的研究远远滞后于植物群落,原因可能是由于鱼类功能复杂,且均为异养生物,还能通过运动迁移来适应环境变化。目前关于鱼类在生态系统中的功能研究主要集中在通过食性[60]或者氮磷的排泄率[61]来推断鱼类对河流或湖泊生态系统功能的影响。然而由于鱼类食物来源不同,获取食物的方式也不尽相同,关键是到目前为止,还没有研究表明鱼类的功能特征是如何影响生态系统的[32]。以珠江水系里两种典型的顶级肉食性鱼类鳡(Elopichthysbambusa)和大眼鳜(Sinipercakneri)为例。它们都是鱼食性鱼类,然而它们的捕食策略完全不同,鳡是在水体中上层快速追击捕食鱼类,而大眼鳜是在水体中下层伏击捕食鱼类,因此生活在水体表层的小型鱼类(如Hemiculterleucisculus)不易被鳜捕食而容易被鳡取食。因此只考虑食物的组成,是很难评估运用不同摄食模式之间鱼类功能性状的差异,进而无法了解鱼类在水生生态系统中的生态位。另一方面,因为鱼类的功能相当复杂,不是简单依靠一个或者一对性状就能直接描述一个功能。比如摄食和游泳,明显是由一组性状集合来执行的[19],因此往往需要使用功能性状组合来描述其功能生态位。
还有一个重要的难题就是鱼类群落调查取样的限制。淡水鱼类群落研究中经常使用的采样方法包括:蹦网、罩网、刺网、电捕、拖网、围网、定置张网等。拖网采样面积较大,是鱼类群落多样性研究中较好的采样方法,但由于该方法采样时要求水体底质平坦,水生植物稀少,在淡水鱼类群落研究中应用具有一定的局限性。其他采样方法都因网具面积有限,网目大小有别等因素,单次取样获取的信息较少,因此一定程度上影响了研究的准确性,只有通过加大采样频率来解决,但这又在一定程度上增加了工作量。
6 结语
由于物种特性及个体特征会对个体在群落中的功能角色产生重要影响[62],因此基于功能特征的研究方法被认为是目前研究生物多样性最适宜的方式[48]。功能性状为在个体层面衡量影响生物体性能和适合度的生物属性[63],利用功能性状的多样性研究,可以更加清楚的理解物种多样性、多度和生态系统功能,以及多样性对环境干扰和压力下的响应,因此基于性状的功能多样性研究能够深入了解生态系统功能变化机制。
测量鱼类功能多样性通常可以通过测量任何影响鱼类生物学特性的功能性状(比如捕食效率、摄食、觅食策略、大小、运动方式、繁殖和栖息地)或者测量一组具有生态学意义和功能的形态学指标[31,64]。虽然鱼类功能多样性指数只涉及鱼类的功能特征和相对丰富度两个方面,但由于计算方法的多样化,且受多种因素的影响,其选择与测定存在较大的灵活性与难度。目前还没有一个非常完善的鱼类功能多样性的测定指标,每一种指数所反应的生态系统过程侧重点不同,各种鱼类功能多样性指数间存在一定的互补作用。
鱼类通常是水域生态系统中最敏感和最可靠的指示物种,其捕食作用可以通过上行效应和下行效应影响整个水域生态系统,包括浮游生物、水质健康等。目前,鱼类功能多样性对生态系统功能影响的实验证据尚不多见,国外的研究主要集中在对功能多样性指数的验证和改进[29,47- 48]及外来种对水生生态系统功能的影响等方面[23- 31]。对于鱼类功能多样性与水生生态系统功能过程的关系、功能多样性揭示鱼类共存机制和组配法则等则知之甚少。
中国是世界上河流最多的国家之一,分布鱼类1384种,但是对鱼类功能多样性的相关研究较少。张春光等[65]对中国内陆鱼类物种多样性的分布进行了详细研究,但是关于内陆各河流鱼类功能多样性的分区还处于空白,探讨中国淡水鱼类功能多样性的热点地区及功能多样性和物种多样性对干扰的响应等具有重要意义,这也是下一步研究的重点。随着水生生态系统在国际上的广泛关注,淡水鱼类功能多样性研究是未来研究的重要课题。
[1] Díaz S, Cabido M. Vive la différence: plant functional diversity matters to ecosystem processes. Trends in Ecology & Evolution, 2001, 16(11): 646- 655.
[2] Hooper D U, Vitousek P M. Effects of plant composition and diversity on nutrient cycling. Ecological Monographs, 1998, 68(1): 121- 149.
[3] Lepš J, Brown V K, Diaz Len T A, Gormsen D, Hedlund K, Kailová J, Korthals G W, Mortimer S R, Rodriguez-Barrueco C, Roy J, Santa Regina I, van Dijk C, van der Putten W H. Separating the chance effect from other diversity effects in the functioning of plant communities. Oikos, 2001, 92(1): 123- 134.
[4] Leps J, de Bello F, Lavorel S, Berman S. Quantifying and interpreting functional diversity of natural communities: practical considerations matter. Preslia, 2006, 78(4): 481- 501.
[5] 江小雷, 张卫国. 功能多样性及其研究方法. 生态学报, 2010, 30(10): 2766- 2773.
[6] 张金屯, 范丽宏. 物种功能多样性及其研究方法. 山地学报, 2011, 29(5): 513- 519.
[7] Hooper D U, Solan M, Symstad A, Díaz S, Gessner M O, Buchmann N, Degrange V, Grime P, Hulot F, Mermillod-Blondin F, Roy J, Spehn E, van Peer L. Species diversity, functional diversity, and ecosystem functioning // Loreau M, Naeem S, Inchausti P, eds. Biodiversity and Ecosystem Functioning: Synthesis and Perspectives. Oxford: Oxford University Press, 2002: 195- 208.
[8] Petchey O L, Gaston K J. Functional diversity: back to basics and looking forward. Ecology Letters, 2006, 9(6): 741- 758.
[9] Tilman D, Knops J, Wedin D, Reich P, Ritchie M, Siemann E. The influence of functional diversity and composition on ecosystem processes. Science, 1997, 277(5330): 1300- 1302.
[10] Nyström M, Folke C. Spatial resilience of coral reefs. Ecosystems, 2001, 4(5): 406- 417.
[11] Prieur-Richard A H, Lavorel S. Invasions: The perspective of diverse plant communities. Austral Ecology, 2000, 25(1): 1- 7.
[12] Dukes J S. Biodiversity and invasibility in grassland microcosms. Oecologia, 2001, 126(4): 563- 568.
[13] Loreau M, Naeem S, Inchausti P, Bengtsson J, Grime J P, Hector A, Hooper D U, Huston M A, Raffaelli D, Schmid B, Tilman D, Wardle D A. Biodiversity and ecosystem functioning: current knowledge and future challenges. Science, 2001, 294(5543): 804- 808.
[14] Cameron T. 2002: the year of the ‘diversity-ecosystem function′ debate. Trends in Ecology & Evolution, 2002, 17(11): 495- 496.
[15] Lévêque C, Oberdorff T, Paugy D, Stiassny M L J, Tedesco P A. Global diversity of fish (Pisces) in freshwater. Hydrobiologia, 2008, 595(1): 545- 567.
[16] Lundberg J G, Kottelat M, Smith G R, Stiassny M L J, Gill A C. So Many fishes, so little time: an overview of recent ichthyological discovery in continental waters. Annals of the Missouri Botanical Garden, 2000, 87(1): 26- 62.
[17] Chapin F S Ⅲ, Zavaleta E S, Eviner V T, Naylor R L, Vitousek P M, Reynolds H L, Hooper D U, Lavorel S, Sala O E, Hobbie S E, Mack M C, Díaz S. Consequences of changing biodiversity. Nature, 2000, 405(6783): 234- 242.
[18] Fryer G, Iles T D. The Cichlid Fishes of the Great Lakes of Africa: Their Biology and Evolution. Neptune City: TFH Publications, 1972.
[19] Winemiller K O. Ecomorphological diversification in lowland freshwater fish assemblages from five biotic regions. Ecological Monographs, 1991, 61(4): 343- 365.
[20] Piet G J. Ecomorphology of a size-structured tropical freshwater fish community. Environmental Biology of Fishes, 1998, 51(1): 67- 86.
[21] Hjelm J, Svanbäck R, Byström P, Persson L, Wahlström E. Diet-dependent body morphology and ontogenetic reaction norms in Eurasian perch. Oikos, 2001, 95(2): 311- 323.
[22] Pouilly M, Lino F, Bretenoux J G, Rosales C. Dietary-morphological relationships in a fish assemblage of the Bolivian Amazonian floodplain. Journal of Fish Biology, 2003, 62(5): 1137- 1158.
[23] Zhao T, Villéger S, Lek S, Cucherousset J. High intraspecific variability in the functional niche of a predator is associated with ontogenetic shift and individual specialization. Ecology and Evolution, 2014, 4(24): 4649- 4657.
[24] Azzurro E, Tuset V M, Lombarte A, Maynou F, Simberloff D, Rodríguez-Pérez A, Solé R V. External morphology explains the success of biological invasions. Ecology Letters, 2014, 17(11): 1455- 1463.
[25] Britton J R, Davies G D, Harrod C. Trophic interactions and consequent impacts of the invasive fishPseudorasboraparvain a native aquatic foodweb: a field investigation in the UK. Biological Invasions, 2010, 12(6): 1533- 1542.
[26] Cucherousset J, Blanchet S, Olden J D. Non-native species promote trophic dispersion of food webs. Frontiers in Ecology and the Environment, 2012, 10(8): 406- 408.
[27] Blanchet S, Grenouillet G, Beauchard O, Tedesco P A, Leprieur F, Dürr H H, Busson F, Oberdorff T, Brosse S. Non-native species disrupt the worldwide patterns of freshwater fish body size: implications for Bergmann′s rule. Ecology Letters, 2010, 13(4): 421- 431.
[28] Matsuzaki S S, Sasaki T, Akasaka M. Consequences of the introduction of exotic and translocated species and future extirpations on the functional diversity of freshwater fish assemblages. Global Ecology and Biogeography, 2013, 22(9): 1071- 1082.
[29] Villéger S, Mason N W H, Mouillot D. New multidimensional functional diversity indices for a multifaceted framework in functional ecology. Ecology, 2008, 89(8): 2290- 2301.
[30] Casanoves F, Pla L, Di Rienzo J A, Díaz S. FDiversity: a software package for the integrated analysis of functional diversity. Methods in Ecology and Evolution, 2011, 2(3): 233- 237.
[31] Farré M, Tuset V M, Maynou F, Recasens L, Lombarte A. Geometric morphology as an alternative for measuring the diversity of fish assemblages. Ecological Indicators, 2013, 29: 159- 166.
[32] 熊鹰. 中国淡水鱼类功能多样性方法与格局的研究[D]. 武汉: 华中农业大学, 2015.
[33] 张潋波. 城镇化对溪流底栖动物物种多样性和功能多样性影响的研究[D]. 南京: 南京农业大学, 2013.
[34] Pla L, Casanoves F, Di Rienzo J. Quantifying Functional Biodiversity. Dordrecht, New York: Springer, 2012.
[35] Tilman D, Reich P B, Knops J, Wedin D, Mielke T, Lehman C L. Diversity and productivity in a long-term grassland experiment. Science, 2001, 294(5543): 843- 845.
[36] Petchey O L, Gaston K J. Functional diversity (FD), species richness and community composition. Ecology Letters, 2002, 5(3): 402- 411.
[37] Xie S, Cui Y, Li Z. Dietary-morphological relationships of fishes in Liangzi Lake, China. Journal of Fish Biology, 2001, 58(6): 1714- 1729.
[38] Langerhans R B, Layman C A, Langerhans A K, Dewitt T J. Habitat-associated morphological divergence in two Neotropical fish species. Biological Journal of the Linnean Society, 2003, 80(4): 689- 698.
[39] Villéger S, Miranda J R, Hernández D F, Mouillot D. Contrasting changes in taxonomic vs. functional diversity of tropical fish communities after habitat degradation. Ecological Applications, 2010, 20(6): 1512- 1522.
[40] Karpouzi V S, Stergiou K I. The relationships between mouth size and shape and body length for 18 species of marine fishes and their trophic implications. Journal of Fish Biology, 2003, 62(6): 1353- 1365.
[41] Sibbing F A, Nagelkerke L A J. Resource partitioning by Lake Tana barbs predicted from fish morphometrics and prey characteristics. Reviews in Fish Biology and Fisheries, 2000, 10(4): 393- 437.
[42] Kramer D L, Bryant M J. Intestine length in the fishes of a tropical stream: 2. Relationships to diet——the long and short of a convoluted issue. Environmental Biology of Fishes, 1995, 42(2): 129- 141.
[43] Boyle K S, Horn M H. Comparison of feeding guild structure and ecomorphology of intertidal fish assemblages from central California and central Chile. Marine Ecology Progress Series, 2006, 319: 65- 84.
[44] Dumay O, Tari P S, Tomasini J A, Mouillot D. Functional groups of lagoon fish species in Languedoc Roussillon, southern France. Journal of Fish Biology, 2004, 64(4): 970- 983.
[45] Fulton C, Bellwood D, Wainwright P. The relationship between swimming ability and habitat use in wrasses (Labridae). Marine Biology, 2001, 139(1): 25- 33.
[46] Webb P W. Form and function in fish swimming. Scientific American, 1984, 251(1): 72- 82.
[47] Mason N W H, Mouillot D, Lee W G, Wilson J B. Functional richness, functional evenness and functional divergence: the primary components of functional diversity. Oikos, 2005, 111(1): 112- 118.
[48] Mouillot D, Graham N A J, Villéger S, Mason N W H, Bellwood D R. A functional approach reveals community responses to disturbances. Trends in Ecology & Evolution, 2013, 28(3): 167- 177.
[49] Schleuter D, Daufresne M, Massol F, Argillier C. A user′s guide to functional diversity indices. Ecological Monographs, 2010, 80(3): 469- 484.
[50] Cornwell W K, Schwilk D W, Ackerly D D. A trait-based test for habitat filtering: convex hull volume. Ecology, 2006, 87(6): 1465- 1471.
[51] Rao C R. Diversity and dissimilarity coefficients: a unified approach. Theoretical Population Biology, 1982, 21(1): 24- 43.
[52] Mouchet M A, Villéger S, Mason N W H, Mouillot D. Functional diversity measures: an overview of their redundancy and their ability to discriminate community assembly rules. Functional Ecology, 2010, 24(4): 867- 876.
[53] Laliberté E, Legendre P. A distance-based framework for measuring functional diversity from multiple traits. Ecology, 2010, 91(1): 299- 305.
[54] McIntyre P B, Flecker A S, Vanni M J, Hood J M, Taylor B W, Thomas S A. Fish distributions and nutrient cycling in streams: Can fish create biogeochemical hotspots. Ecology, 2008, 89(8): 2335- 2346.
[55] Brandl S J, Bellwood D R. Individual-based analyses reveal limited functional overlap in a coral reef fish community. Journal of Animal Ecology, 2014, 83(3): 661- 670.
[56] Langerhans R B, Chapman L J, Dewitt T J. Complex phenotype——environment associations revealed in an East African cyprinid. Journal of Evolutionary Biology, 2007, 20(3): 1171- 1181.
[57] Bellwood D R, Goatley C H R, Brandl S J, Bellwood O. Fifty million years of herbivory on coral reefs: fossils, fish and functional innovations. Proceedings of the Royal Society B: Biological Sciences, 2014, 281(1781): 20133046.
[58] Stuart-Smith R D, Bates A E, Lefcheck J S, Duffy J E, Baker S C, Thomson R J, Stuart-Smith J F, Hill N A, Kininmonth S J, Airoldi L, Becerro M A, Campbell S J, Dawson T P, Navarrete S A, Soler G A, Strain E M A, Willis T J, Edgar G J. Integrating abundance and functional traits reveals new global hotspots of fish diversity. Nature, 2013, 501(7468): 539- 542.
[59] Toussaint A, Charpin N, Brosse S, Villéger S. Global functional diversity of freshwater fish is concentrated in the Neotropics while functional vulnerability is widespread. Scientific Reports, 2016, 6: 22125.
[60] Hoey A S, Bellwood D R. Cross-shelf variation in browsing intensity on the Great Barrier Reef. Coral Reefs, 2010, 29(2): 499- 508.
[61] McIntyre P B, Jones L E, Flecker A S, Vanni M J. Fish extinctions alter nutrient recycling in tropical freshwaters. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(11): 4461- 4466.
[62] Rudolf V H W, Rasmussen N L. Population structure determines functional differences among species and ecosystem processes. Nature Communications, 2013, 4: 2318.
[63] Violle C, Navas M L, Vile D, Kazakou E, Fortunel C, Hummel I, Garnier E. Let the concept of trait be functional! Oikos, 2007, 116(5): 882- 892.
[64] Albouy C, Guilhaumon F, Villéger S, Mouchet M, Mercier L, Culioli J M, Tomasini J A, Le Loc′h F, Mouillot D. Predicting trophic guild and diet overlap from functional traits: statistics, opportunities and limitations for marine ecology. Marine Ecology Progress Series, 2011, 436: 17- 28.
[65] 张春光, 赵亚辉. 中国内陆鱼类物种与分布. 北京: 科学出版社, 2016.
Functionaldiversityoffreshwaterfishesandmethodsofmeasurement
SHUAI Fangmin, LI Xinhui*, CHEN Fangcan, LI Yuefei, YANG Jiping, LI Jie, WU Zhi
1PearlRiverFisheriesResearchInstitute,ChineseAcademyofFisherySciences,Guangzhou510380,China2ExperimentalStationforScientificObservationonFisheryResourcesandEnvironmentintheMiddleandLowerReachesofPearlRiver,MinistryofAgriculture,Zhaoqing526100,China3KeyLaboratoryoftheConservationandEcologicalRestorationofFisheryResourceinthePearlRiver,Guangzhou510380,China
A key question in ecology is how biological diversity affects ecosystem functioning. This is of particular importance in the general context of human activities that have impacts on biodiversity, ecosystems, and their complex relationship. Currently, community functional diversity is receiving considerable academic attention, and is considered important in solving ecological problems. However, research has mostly focused on plant or microbial communities, and there has been almost no related research into fish communities. Although freshwater ecosystems represent only a very small part of the planet (<1% of Earth′s surface), they support a disproportionally rich diversity of biological life and provide countless ecological services to humans (most notably to urban populations), including water purification, drinking water, food production, and leisure activities. For assemblages like reef fish communities, human disturbances such as fishing (i.e. the removal of target specimens) could reduce functional diversity and potentially have significant effects on ecosystem functioning. Fishery resources in China are declining because of many human-induced stressors such as overfishing, dam construction, and biological invasions, and aquatic ecosystem function has therefore undergone a serious decline. It has been suggested that the most appropriate way to fully understand and quantify the effects of natural- and human-induced perturbations on biodiversity is to apply functional approaches, as these incorporate the interactions between organisms and their surrounding environment. Functional diversity can be defined as the value, range, distribution, and ecological importance of organisms′ functional attributes in a community. However, empirical assessments of the potential responses of freshwater functional diversity patterns to human-induced perturbations are still lacking. We reviewed the functional diversity of freshwater fish and methods of its calculation, including data acquisition and analysis, to provide a new theoretical basis for the protection of fish resources. Three independent indices have been proposed to quantify functional diversity of freshwater fishes: functional richness (FRic), functional evenness (FEve), and functional divergence (FDiv). These are based on the distribution of species and their abundance in a multidimensional Euclidean space (i.e. the so-called functional space) created using many functional traits of species. No clear criteria exist that define the most suitable index to investigate functional diversity. Increasing number of ecologists have been using a combination of several multi-trait indices to quantify functional diversity, since the use of complementary functional diversity indices can provide a better understanding of the role of biodiversity in ecosystem functioning.
functional diversity; community structure; quantitative methodology; freshwater fishes; functional trait
中国水产科学研究院基本科研业务费项目(2015B01PT01);国家自然科学基金青年项目(31400354);广西省基金重大项目(2013GXNSFEA053003)
2016- 05- 03; < class="emphasis_bold">网络出版日期
日期:2017- 03- 22
10.5846/stxb201605030836
*通讯作者Corresponding author.E-mail: lxhui01@aliyun.com
帅方敏,李新辉,陈方灿,李跃飞,杨计平,李捷,武智.淡水鱼类功能多样性及其研究方法.生态学报,2017,37(15):5228- 5237.
Shuai F M, Li X H, Chen F C, Li Y F, Yang J P, Li J, Wu Z.Functional diversity of freshwater fishes and methods of measurement.Acta Ecologica Sinica,2017,37(15):5228- 5237.
