深松对乌拉尔甘草根际土壤养分以及微生物群落功能多样性的影响
2017-09-12张志政张旭龙
张志政,马 淼,张旭龙
石河子大学生命科学学院,石河子 832003
深松对乌拉尔甘草根际土壤养分以及微生物群落功能多样性的影响
张志政,马 淼*,张旭龙
石河子大学生命科学学院,石河子 832003
通过大田试验和室内分析相结合,研究了深松对乌拉尔甘草根际土壤养分和微生物群落功能多样性的影响,以期为乌拉尔甘草人工种植地土壤耕作措施优化和土壤环境改良提供依据。结果表明,与未深松(常规耕作)处理相比,深松处理对乌拉尔甘草根际土壤0—20 cm耕层土壤养分含量无显著性影响,可显著提高乌拉尔甘草根际土壤20—40 cm耕层有机质、全氮、全磷和全钾的含量,分别提高了60.8%、65.3%、48.9%和86.8%;明显增加了0—20 cm和20—40 cm耕层细菌、真菌和放线菌的数量(P<0.05),3种类型的微生物数量均呈现出上层大于下层,深松大于未深松的变化趋势。在156 h的微生物温育期内,深松处理下不同土层的平均颜色变化率(AWCD)均显著高于未深松处理,并显著提高了AWCD的利用率(72 h,P<0.05),较未深松分别提高了35.5%和130.8%。与未深松处理相比,深松处理显著提高了土壤微生物的多样性指数(H、S、D)。主成分分析(PCA)表明,深松优化了乌拉尔甘草根际土壤微生物的群落组成;聚合物、羧酸类化合物、氨基酸和碳水化合物是深松处理下根际土壤微生物利用的主要碳源。总而言之,深松处理显著提高乌拉尔甘草根际土壤养分含量、微生物数量和微生物多样性指数,改变了微生物群落功能多样性,造成这种差异的主要原因可能是深松改变了土壤耕层结构,改善了微生物的生存环境。因此,深松对乌拉尔甘草人工种植地土壤质量的改良有积极作用。
深松;乌拉尔甘草;土壤理化性质;土壤微生物;Biolog
乌拉尔甘草(Glycyrrhizauralensis)为豆科(Leguminosae)甘草属(Glycyrrhiza)多年生草本植物[1],素有“药中国老”和“十方九草”的美称[2],是新疆道地性药材之一。由于常年掠夺性的采挖致使野生甘草资源濒临枯竭,大力发展甘草的人工种植,提高栽培甘草的产量和品质是解决目前国际市场甘草供不应求的唯一方案。
土壤微生物是土壤生态系统中极其重要和最为活跃的部分[3- 4],它能够灵敏、及时、准确地反映土壤质量的变化状况,揭示土壤肥力及土壤改良状况,是土壤质量最重要的衡量指标之一[5- 6]。土壤耕作在改变土壤结构的同时,常会对土壤微生物群落产生影响,因此通过研究土壤微生物来探讨耕作方式对土壤生态系统的影响已成为国内外学者研究的热点问题[7- 8]。
土壤深松技术被视为土壤保护性耕作技术之一,是现代农业增产的一项根本性技术[9]。有研究表明,深松可以降低土壤容重[10- 11],增强土壤通透性[12- 13],增加土壤微生物数量和土壤酶活性[14- 16]。土壤深松由于改变了土壤物理结构,引起土壤水、肥、气、热等变化,进而影响土壤微生物学特性[17- 19]。因此,利用土壤深松技术改善土壤质量对植物生长和农业生产具有重要意义。
目前,关于深松对植物根际土壤理化性质和微生物多样性的影响方面的研究仅限于小麦与玉米等常规作物[20- 21],而关于深松对甘草根际土壤理化性质和微生物多样性影响的研究尚未见报道。本文探讨了深松对乌拉尔甘草根际土壤养分,微生物数量和微生物群落多样性的影响,旨在为改善乌拉尔甘草人工种植环境土壤耕层结构和提高土壤肥力提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于新疆奎屯前山镇,地处准噶尔盆地西南缘的奎屯河冲积平原。属于典型的大陆性北温带干旱气候,夏热冬寒,日照时间长,降水稀少,蒸发量大。全年日照总时数2620 h,多年平均降水量160 mm,多年平均蒸发量1657 mm。土壤类型为灰漠土,主要发育在黄土状母质上。土壤质地为砂质壤土,土壤容重为1.25 g/cm3,pH为7.4。
选土壤条件一致的地块作为试验区,试验区面积200 m2,长20 m,宽10 m。采用随机区组设计,在试验区内随机选4 m×4 m的样地10个,按600 kg/hm2和150 kg/hm2的剂量各施磷酸氢二铵和硫酸钾,均匀施撒作为底肥。随机选其中5个样地作为对照(常规耕作),标记为W,撒施化肥后浅松(浅松犁型号:1L-225),耕深20 cm,余下的5个样地为深松处理,标记为S,撒施化肥后深松(深松犁型号:ISQ-320),耕深40—50cm。对照未深松处理与深松处理均由大马力配套不同耕作犁完成,于播种前进行耕犁。于2015年4月10日膜下播种,膜宽125 cm,膜距55 cm,一膜6行播种,行距20 cm,穴距10 cm,每穴3—5粒种子,出苗后每穴留两苗,膜下滴灌,每月给水1次,每次给水6—8 h,除底肥外不再施肥。除松土深度不同外,其余管理措施均相同。
1.2 样品采集
2015年9月采用5点取样法采集深松区与对照组乌拉尔甘草根际土样,以乌拉尔甘草主根0—5 cm范围内取土,每样点取距地表0—20 cm和20—40 cm土壤样品。深松区土样标记为S0—20和S20—40;未经过深松处理的对照区标记为W0—20和W20—40。每个样品采土3次作为重复,取土500 g组成混合样品。将土样去除细根和杂物,碾碎,过1 mm筛并混匀,部分土样风干后测定土样理化性质,另一部分土壤样品立即进行相关的微生物测定。
1.3 测定方法
1.3.1 土壤理化性质测定
土壤理化指标测定方法参照鲍士旦的《土壤农化分析》[22],其中有机质的含量测定采用重铬酸钾容量法;全氮含量测定采用H2SO4消煮-凯氏定氮法[凯氏自动定氮仪:美国海能(Hanon)仪器有限公司(K9840)];全磷含量测定采用浓H2SO4-HClO4消煮-钼锑抗比色法测定;全钾含量测定采用NaOH熔融-火焰光度计法测定。
1.3.2 土壤微生物数量测定方法
土壤微生物数量采用平板计数法测定,细菌采用牛肉膏蛋白胨琼脂(BPA)培养基,37℃培养;真菌采用马铃薯葡萄糖琼脂(PDA)培养基(加入30 mg/L链霉素抑制细菌生长),28℃培养;放线菌采用高氏1号琼脂(GA)培养基(加入50 μg /L 重铬酸钾抑制杂菌),28℃培养。每个土样(微生物类群)预设3个浓度梯度,每个浓度梯度3次重复,选取最适计数浓度取其平均数进行计算作为该土样的微生物数量。
1.3.3 土壤微生物功能多样性分析
微生物群落功能多样性采用 Biolog(Biolog-Eco PlateTM)方法进行分析。称取相当于10 g烘干土的鲜土加入到已装有100 mL灭菌的0.85%生理盐水三角瓶中,室温震荡60 min,然后用0.85%生理盐水稀释至1000倍液,再震荡30 min,吸取稀释液接种到生态板(ECO板)中,每孔加150 μL。将接种好的微平板置于25℃的恒温培养箱中避光培养,每隔12 h在Biolog EmaxTM读数器上读取波长590 nm下的光密度值,持续156 h。用31个孔的平均颜色变化率(AWCD)表示微生物代谢的整体活性。计算Shannon物种丰富度指数(H),Shannon均匀度指数(E),Shannon优势度指数(D),碳源利用丰富度指数(S),具体计算公式如下[22- 24]:
AWCD =∑(Ci-Ri) /n
式中,Ci为每个孔的光密度值,Ri为对照孔的光密度值,n=31,为ECO板的孔数。
H=-∑Pi(lnPi)
式中,Pi= (Ci-Ri) / ∑(Ci-Ri)。

D=1-∑(Pi)2
式中,S=被利用碳源的总数
1.4 数据处理
对深松处理组和对照组不同土层数据进行单因素方差分析,用培养72 h的光密度值进行主成分分析(PCA)。数据处理采用软件Excel 2003和SPSS 18.0完成。
2 结果与分析
2.1 深松处理对乌拉尔甘草根际土壤养分的影响
土壤有机质及土壤全氮、全磷、全钾的含量作为土壤肥力的主要指标,能够表征土壤的肥力状况。由表1可知,深松与未深松不同土层单位土壤体积中有机质、全氮、全磷和全钾的含量存在着不同程度的差异。S0—20与W0—20相比,有机质、全氮和全磷含量无显著性差异,但深松处理组土样中全钾含量显著提高了82.5%;与W20—40相比,S20—40土样中的有机质、全氮、全磷和全钾的含量均有显著提高(P<0.05),分别提高了60.8%、65.3%、48.9%和86.8%。
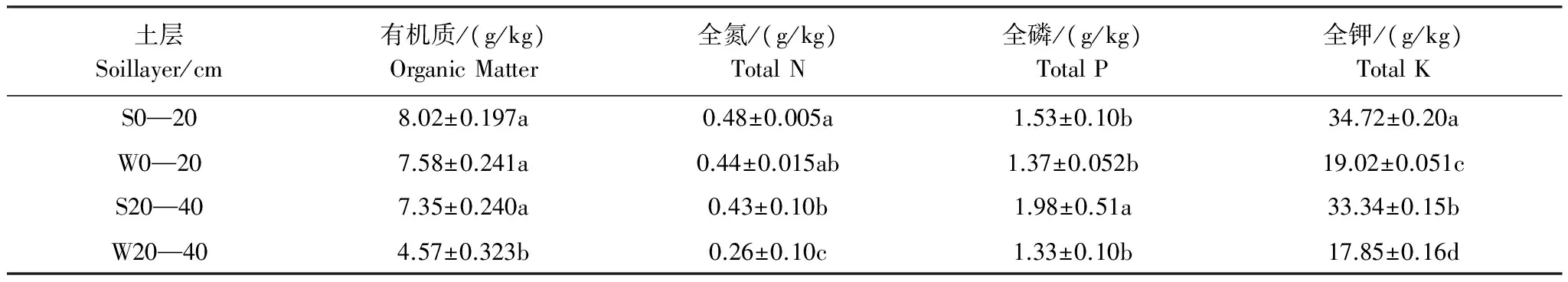
表1 深松处理对土壤养分的影响
S:深松区 subsoiling block;W:未深松区 non-subsoiling block;S0—20:深松区0—20 cm土层 0—20 cm soil layer of subsoiling block;W0—20:未深松区0—20 cm土层 0—20 cm soil layer of non-subsoiling block;S20—40:深松区20—40 cm土层 20—40 cm soil layer of subsoiling block;W20—40:未深松区20—40 cm土层 0—20 cm soil layer of non-subsoiling block;同列不同字母表示处理间差异显著(P<0.05)
2.2 深松处理对乌拉尔甘草根际土壤微生物数量的影响
土壤微生物数量直接影响土壤的生物化学活性及土壤养分的组成与转化,是评价土壤肥力的重要指标之一。土壤微生物的三大类群(细菌、放线菌和真菌)是构成土壤微生物的主要生物类群,其数量变化通常能反映出土壤生物活性水平,显示土壤中物质代谢的旺盛程度[23]。由表2可见,深松处理显著提高了土壤中细菌、真菌和放线菌的数量,较未深松具有显著性差异(P<0.05)。S0—20样品中的细菌、真菌和放线菌的数量较W0—20分别提高了25.1%、33.3%和38.6%;S20—40样品中的细菌、真菌和放线菌的数量较W20—40分别提高了177.1%、98.4%和48.0%。3种类型的微生物数量均呈现出上层大于下层,深松大于未深松的变化趋势。

表2 深松处理对土壤微生物数量的影响
同列不同字母表示处理间差异显著(P<0.05)
2.3 深松处理对乌拉尔甘草根际土壤微生物AWCD的影响

图1 AWCD 随温育时间的变化Fig.1 AWCD changes with incubation time S:深松区 subsoiling block;W:未深松区 non-subsoiling block;S0—20:深松区0—20 cm土层 0—20 cm soil layer of subsoiling block;W0—20:未深松区0—20 cm土层 0—20 cm soil layer of non-subsoiling block;S20—40:深松区20—40 cm土层 20—40 cm soil layer of subsoiling block;W20—40:未深松区20—40 cm土层 0—20 cm soil layer of non-subsoiling block;同列不同字母表示处理间差异显著(P<0.05)
AWCD是表征土壤微生物对总体碳源的利用能力,反映其生物活性的一个重要指标[24- 25]。31种碳源的AWCD变化如图1所示,随着温育时间的延长,AWCD逐渐升高,在0—12 h时,S0—20、W0—20、S20—40、W20—40 cm的AWCD值均为零,在12 h均开始利用单一碳源进行代谢。S0—20、W0—20和S20—40在36 h进入对数增长期;而W20—40在48 h进入对数增长期。各处理在144 h时均趋于稳定。不同土壤样品微生物平均光密度值随时间变化均呈近“S”形曲线,符合微生物利用基质的一般生长曲线规律。与W0—20和W20—40相比,S0—20和S20—40的温育72 h微生物代谢活性显著提高了35.5%和130.8%(P<0.05)。
2.4深松处理对乌拉尔甘草根际土壤微生物多样性指数的影响
Shannon多样性指数可以从不同侧面反映土壤微生物群落功能多样性,是目前应用最广泛的群落多样性指数之一[26]。通常把颜色变化孔数作为根际微生物群落功能多样性的丰富度[27- 28]。由图2可见,土壤微生物对碳源利用的Shannon多样性指数(H、D)和碳源利用丰富度指数(S)的变化表现出类似的规律:S0—20最高而W20—40最低,S0—20与W0—20无显著性差异,而S20—40的H、D、S值显著地高于W20—40,分别提高了15.0%、4.6%和95.6%;Shannon均匀度指数(E)以W20—40最大,且与其他土样间均具有显著性差异(P<0.05)。
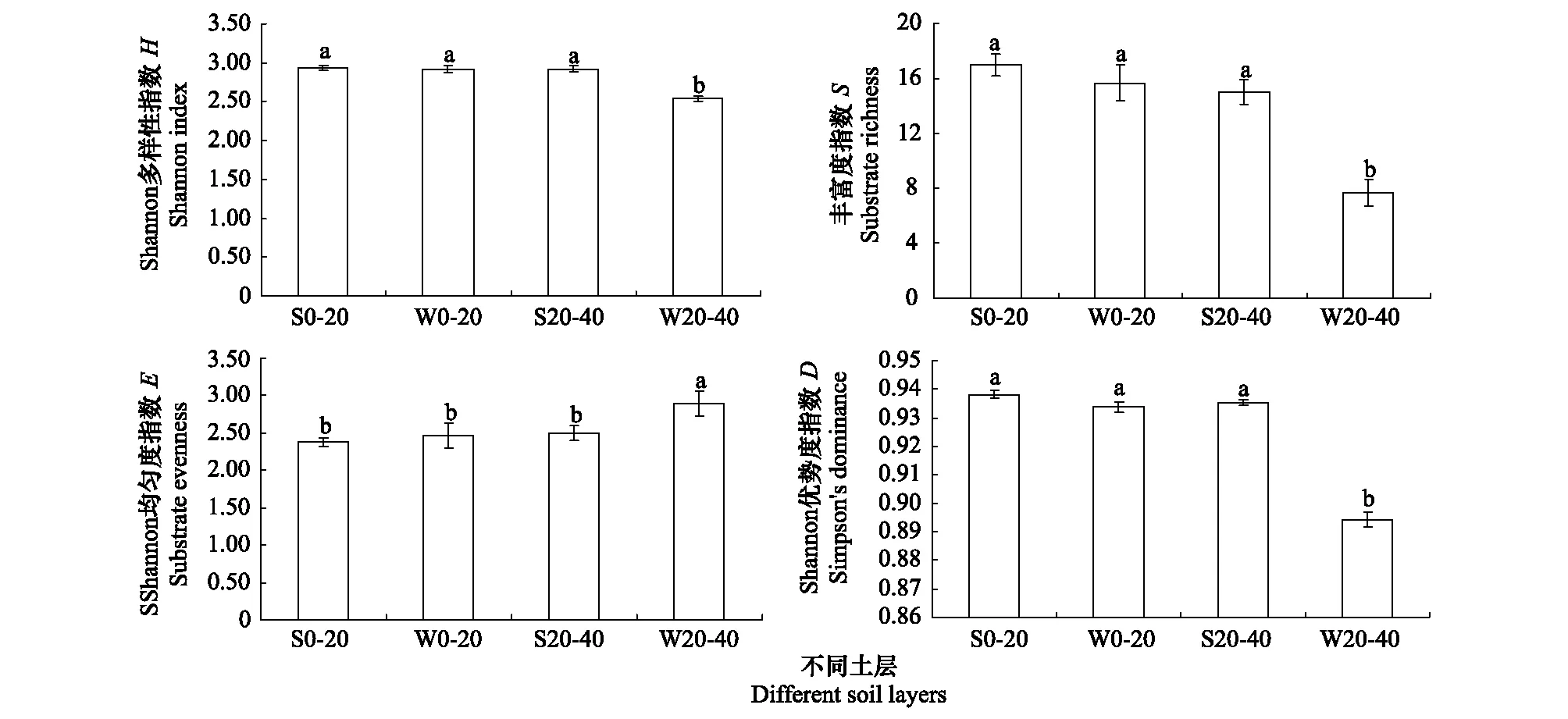
图2 深松处理对土壤微生物群落多样性指数的影响Fig.2 Effects of subsoiling on soil microbial diversity index
2.5 微生物碳源利用的主成分分析
对培养72 h的31种碳源利用情况进行主成分分析,共提取3个主成分:第一主成分(PC1)、第二主成分(PC2)和第三主成分(PC3),分别可以解释所有变量的54.666%、23.972%和21.362%。3个主成分累积方差贡献率达到100%,可以全面地反映31个变量的特征,并据其得分来表征微生物群落碳源代谢特征。从表3可看出,深松与未深松的4个不同土层中,S0—20在PC1得分最高,W0—20在PC2上得分最高,S20—40在PC3上得分最高。
因子载荷反映了主成分与碳源利用的相关程度,因子载荷绝对值越接近于1,表示该碳源对主成分的影响越大。与第一主成分相关性较高的碳源有23个(表4),主要包括酚酸类化合物:4-羟基苯甲酸;胺类化合物:腐胺;聚合物:吐温40、吐温80和α-环式糊精;氨基酸:L-精氨酸、L-天冬酰胺酸、L-丝氨酸、L-苏氨酸和甘氨酰-L-谷氨酸;羧酸类化合物:丙酮酸甲脂、D-半乳糖醛酸、γ-羟基丁酸、D-葡萄胺酸、衣康酸和α-丁酮酸;碳水化合物:β-甲基-D-葡萄糖苷、D-半乳糖内酯、I-赤藻糖醇、D-甘露醇、N-乙酰基-D-葡萄胺、葡萄糖- 1-磷酸盐和D,L-α-甘油。与第二主成分相关性较高的碳源有8个,主要包括酚酸类化合物:2-羟基苯甲酸;胺类化合物:苯乙基胺;氨基酸:L-苯基丙氨酸;羧酸类化合物:衣康酸和α-丁酮酸;碳水化合物:D-甘露醇、N-乙酰基-D-葡萄胺和D-纤维二糖。与第三主成分相关性较高的碳源有6个,主要包括聚合物:肝糖;羧酸类化合物:D-苹果酸;碳水化合物:β-甲基D-葡萄糖苷、D-木糖、I-赤藻糖醇和α-D-乳糖。综合表3和表4可知,聚合物、羧酸类化合物、氨基酸和碳水化合物是深松处理下根际土壤微生物利用的主要碳源。

表3 主成分得分及贡献率

表4 31种碳源的因子载荷(|r|>0.6)
3 讨论
土壤有机质是评价土壤质量的一个重要指标,它不仅能增强土壤的保肥和供肥能力,提高土壤养分的有效性,而且可促进土壤团粒结构的形成,改善土壤的透水性、蓄水能力及通气性,增强土壤的缓冲性等[29]。有研究报道,深松处理有助于有机质向下层分布[30];谢迎新[31]等研究指出,深松处理对表层有机碳含量影响较小,可明显增加下层土壤有机碳含量。本研究表明,深松处理对0—20 cm土层土壤有机质含量影响不显著,但能够显著增加20—40 cm土层有机质的积累,这与谢迎新等人的研究结果是一致的。其原因可能是深松打破了犁底层,降低了土壤容重,同时也为下耕层土壤微生物营造了良好的生长环境,从而促进了下耕层有机质的积累。
土壤全氮、全磷和全钾的含量是反映土壤长期肥力水平的重要指标。本研究表明,深松处理可显著增加20—40 cm土层中的全氮、全磷和全钾含量,但对0—20 cm土层影响较小;除全磷外,全氮和全钾含量都是上层高于下层,表现出上肥下瘦的特点。这与何腾兵[32]等人的研究结果相一致。其原因可能是深松加深了土壤耕层,改变了土壤结构,使富集在表层的养分部分下移,增加了下层土壤养分的积累,但是由于乌拉尔甘草侧根多分布于20—40 cm,可充分吸收下层养分,从而造成上肥下瘦的特点。另一方面可能是由于深松主要改变了20—40 cm耕层结构,使得深松处理与未深松处理乌拉尔甘草20—40 cm根系生长分布格局不同,其固氮能力也有所差异,这可能也是造成耕层全氮含量差异显著的原因之一。有研究表明,乌拉尔甘草具有吸收富集矿质元素的习性[33],这可能是造成对不同营养元素吸收利用有所差异的主要原因。
微生物作为土壤和植物两者之间极其重要的纽带,推动着土壤有机质和土壤养分的转化与循环,是评价土壤肥力的重要指标之一,其数量受土壤环境和土壤耕作措施影响[34]。本研究结果表明,土壤微生物数量随土壤深度的增加而显著减少;深松处理能够显著增加土壤微生物数量,且对20—40 cm土层影响尤为显著,其主要原因可能是深松改善了耕层下部土壤的物理结构,影响耕层下部土壤养分的积累,营造了一个较适宜微生物繁殖的土壤环境,进而影响20 cm以下耕层的土壤微生物数量[13]。梁金凤等[35]研究证明,深松可以降低土壤容重,增加土壤孔隙度,有利于土壤气体交换,提高细菌、放线菌和微生物的总体数量,改善深层土壤的微生态环境,进而有利于培肥地力。
光密度平均颜色变化率AWCD反应土壤微生物利用总碳源的能力和代谢活性的大小,AWCD越大,其代谢活性越强。本研究中,在0—24 h时微生物处于适应期阶段,在24 h之后,微生物逐渐进入对数增长期,并在144 h后基本进入稳定期,不同土壤样品微生物平均光密度值随时间变化均呈近“S”形曲线,符合微生物利用基质生长的一般规律[36]。在整个温育期内,深松处理不同土层的AWCD都高于未深松的土壤样品,即S0—20>W0—20,S20—40>W20—40。
碳源代谢的多样性指数分析可以准确地反映微生物群落功能多样性的变化,Shannon指数能客观地反映物种的丰富度和均匀度,微孔中能被利用的碳源越多,利用强度越大,则Shannon指数也越大[26]。Shannon多样性指数(H、D、E)和碳源利用丰富度指数(S)是表示群落多样性的最常用指标。本研究表明,深松处理0—20 cm和20—40 cm土层的土壤微生物Shannon 多样性指数(H、D)和碳源利用丰富度指数(S)分别显著高于未深松处理0—20 cm和20—40 cm土层,表明深松使土壤微生物群落多样性增加,其原因可能是因为深松改变了耕层土壤结构,从而改善了土壤微生物的生存环境。Lupwayi等[37]研究发现,保护性耕作有利于提高土壤微生物多样性,这与本研究的结果是一致的。W20—40的Shannon均匀度指数(E)均大于其他3个土层,且S0—20的均匀度指数最小,与其余3种指数变化趋势不一致,这可能是某些微生物倾向于利用乌拉尔甘草根系分泌物和其植物残体而引起的,这与罗希茜[38]等人的研究结果相似。
主成分分析表明深松处理对乌拉尔甘草根际土壤微生物的碳源利用能力影响显著,使乌拉尔甘草根际土壤微生物群落代谢特征发生改变。S0—20在PC1得分最高,W0—20在PC2上得分最高,S20—40在PC3上得分最高,其中S0—20和W0—20在PC2上有较大分异,S20—40与W20—40在PC3上有较大分异,表明深松改变了其根际微生物群落功能多样性,而这种改变是由根际微生物对PC2和PC3上相关系数较高的碳源的差异利用所引起的,这与孟庆杰[39]等的研究结果相一致。
土壤深松被视为土壤保护性耕作技术之一,是农业生产过程中的重要技术措施。深松可以改善耕层土壤的物理结构,从而改善土壤微生物的生存微环境,对土壤养分的积累和土壤微生物多样性的提高有着极为重要的影响[40- 44]。深松处理可以显著提高乌拉尔甘草20—40 cm耕层土壤养分的积累,显著增加其土壤中的微生物数量,对其AWCD和土壤微生物多样性指数(H、D、E)都有显著提高,改善了土壤微生物功能,优化了微生物群落结构。因此,对乌拉尔甘草地进行深松耕作可有效改善土壤质量,提高土壤肥力,值得大力推广。
[1] 中国科学院中国植物志编辑委员会. 中国植物志. 北京: 科学出版社, 1998.
[2] Dong Y Y, Gao W Y, Zhang J Z, Zuo B M, Huang L Q. Quantification of four active ingredients and fingerprint analysis of Licorice (GlycyrrhizauralensisFisch.) after spaceflight by HPLC-DAD. Research on Chemical Intermediates, 2012, 38(8): 1719- 1731.
[3] Abbott L K, Murphy D V. Soil Biological Fertility: A Key to Sustainable Land Use in Agriculture. Netherlands: Kluwer Academic Publishers, 2003.
[4] 朱丹, 张磊, 韦泽秀, 刘晓燕, 周志峰, 代先祝, 王晓锋, 夏志强, 吴先勤, 蔚建军, 付莉. 菌肥对青稞根际土壤理化性质以及微生物群落的影响. 土壤学报, 2014, 51(3): 627- 637.
[5] 刘占锋, 傅伯杰, 刘国华, 朱永官. 土壤质量与土壤质量指标及其评价. 生态学报, 2006, 26(3): 901- 913.
[6] 张心昱, 陈利顶, 傅伯杰, 李琪, 齐鑫, 马岩. 农田生态系统不同土地利用方式与管理措施对土壤质量的影响. 应用生态学报, 2007, 18(2): 303- 309.
[7] Carpenter-Boggs L, Stahl P D, Lindstrom M J, Schumacher T E. Soil microbial properties under permanent grass, conventional tillage, and no-till management in South Dakota. Soil and Tillage Research, 2003, 71(1): 15- 23.
[8] 姬艳艳, 张贵龙, 张瑞, 刘玉升, 杨殿林, 王彩灵. 耕作方式对农田土壤微生物功能多样性的影响. 中国农学通报, 2013, 29(6): 117- 123.
[9] 张丽, 张中东, 郭正宇, 宫帅, 王若男, 陶洪斌, 王璞. 深松耕作和秸秆还田对农田土壤物理特性的影响. 水土保持通报, 2015, 35(1): 102- 106, 117- 117.
[10] Laddha K C, Totawat K L. Effects of deep tillage under rainfed agriculture on production of sorghum (SorghumbiocolorL. Moench) intercropped with green gram (VignaradiataL. Wilczek) in western India. Soil and Tillage Research, 1997, 43(3/4): 241- 250.
[11] 何润兵, 李传友, 王明武. 深松对土壤理化性质和冬小麦生长特性的影响. 中国农机化学报, 2014, 35(2): 119- 122.
[12] Heuer H, Tomanová O, Koch H J, Märländer B. Subsoil properties and cereal growth as affected by a single pass of heavy machinery and two tillage systems on a Luvisol. Journal of Plant Nutrition and Soil Science, 2008, 171(4): 580- 590.
[13] Lampurlanés J, Cantero-Martínez C. Soil bulk density and penetration resistance under different tillage and crop management systems and their relationship with barley root growth. Agronomy Journal, 2003, 95(3): 526- 536.
[14] 杨江山, 张恩和, 黄高宝, 张仁陟. 保护性耕作对麦药轮作土壤酶活性和微生物数量的影响. 生态学报, 2010, 30(3): 824- 829.
[15] Piovanelli C, Gamba C, Brandi G, Simoncini S, Batistoni E. Tillage choices affect biochemical properties in the soil profile. Soil and Tillage Research, 2006, 90(1/2): 84- 92.
[16] Ji B Y, Hu H, Zhao Y L, Mu X Y, Liu K, Li C H. Effects of deep tillage and straw returning on soil microorganism and enzyme activities. The Scientific World Journal, 2014, 2014: 451493.
[17] 王群, 尹飞, 郝四平, 李潮海. 下层土壤容重对玉米根际土壤微生物数量及微生物量碳、氮的影响. 生态学报, 2009, 29(6): 3096- 3104.
[18] 张彬, 何红波, 白震, 刘宁, 丁雪丽, 解宏图, 张旭东. 保护性耕作对土壤微生物特性和酶活性的影响. 土壤通报, 2010, 41(1): 230- 236.
[19] 黄国勤, 杨滨娟, 王淑彬, 黄小洋, 张兆飞, 姚珍, 黄禄星, 赵其国. 稻田实行保护性耕作对水稻产量、土壤理化及生物学性状的影响. 生态学报, 2015, 35(4): 1225- 1234.
[20] 王芸, 李增嘉, 韩宾, 史忠强, 宁堂原, 江晓东, 郑延海, 白美, 赵建波. 保护性耕作对土壤微生物量及活性的影响. 生态学报, 2007, 27(8): 3384- 3390.
[21] Wingeyer A B, Walters D T, Drijber R A, Olk D C, Arkebauer T J, Verma S B, Wedin D A, Francis C A. Fall conservation deep tillage stabilizes maize residues into soil organic matter. Soil Science Society of America Journal, 2012, 76(6): 2154- 2163.
[22] 鲍士旦. 土壤农化分析. 北京: 中国农业出版社, 2000.
[23] 赵亚丽, 郭海斌, 薛志伟, 穆心愿, 李潮海. 耕作方式与秸秆还田对土壤微生物数量、酶活性及作物产量的影响. 应用生态学报, 2015, 26(6): 1785- 1792.
[24] Weber K P, Grove J A, Gehder M, Anderson W A, Legge R L. Data transformations in the analysis of community-level substrate utilization data from microplates. Journal of Microbiological Methods, 2007, 69(3): 461- 469.
[25] 周德平, 褚长彬, 范洁群, 姜震方, 吴淑杭. 不同种植年限设施芦笋土壤微生物群落结构与功能研究. 土壤, 2014, 46(6): 1076- 1082.
[26] Larkin R P. Characterization of soil microbial communities under different potato cropping systems by microbial population dynamics, substrate utilization, and fatty acid profiles. Soil Biology and Biochemistry, 2003, 35(11): 1451- 1466.
[27] Choi K H, Dobbs F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities. Journal of Microbiological Methods, 1999, 36(3): 203- 213.
[28] 闵伟, 侯振安, 冶军, 马丽娟, 曹志, 罗慧兰. 长期咸水滴灌棉田土壤微生物活性及群落功能多样性. 生态学杂志, 2014, 33(11): 2950- 2958.
[29] 王芸. 保护性耕作对麦田土壤微生物特性及理化性状的影响[D]. 泰安: 山东农业大学, 2007.
[30] 冀保毅. 深耕与秸秆还田的土壤改良效果及其作物增产效应研究[D]. 郑州: 河南农业大学, 2013.
[31] 谢迎新, 靳海洋, 孟庆阳, 王永华, 王晨阳, 贺德先, 郭天财. 深耕改善砂姜黑土理化性状提高小麦产量. 农业工程学报, 2015, 31(10): 167- 173.
[32] 何腾兵, 樊博, 李博, 张丽敏, 邓冬冬, 杨柳, 张佩, 李官平. 保护性耕作对喀斯特山区旱地土壤理化性质的影响. 水土保持学报, 2014, 28(4): 163- 167.
[33] 陆嘉惠. 三种药用甘草耐盐性及耐盐机制研究[D]. 石河子: 石河子大学, 2014.
[34] 郭晓霞, 刘景辉, 张星杰, 李立军, 赵宝平, Acharya S N. 免耕对旱作燕麦田耕层土壤微生物生物量碳、氮、磷的影响. 土壤学报, 2012, 49(3): 575- 582.
[35] 梁金凤, 齐庆振, 贾小红, 宫少俊, 黄元仿. 不同耕作方式对土壤性质与玉米生长的影响研究. 生态环境学报, 2010, 19(4): 945- 950.
[36] 沈萍. 微生物学. 北京: 高等教育出版社, 2000.
[37] Lupwayi N Z, Monreal M A, Clayton G W, Grant C A, Johnston A M, Rice W A. Soil microbial biomass and diversity respond to tillage and sulphur fertilizers. Canadian Journal of Soil Science, 2001, 81(5): 577- 589.
[38] 罗希茜, 郝晓晖, 陈涛, 邓婵娟, 吴金水, 胡荣桂. 长期不同施肥对稻田土壤微生物群落功能多样性的影响. 生态学报, 2009, 29(2): 740- 748.
[39] 孟庆杰, 许艳丽, 李春杰, 韩晓增, 裴希超. 不同植被覆盖对黑土微生物功能多样性的影响. 生态学杂志, 2008, 27(7): 1134- 1140.
[40] 何进, 李洪文, 高焕文. 中国北方保护性耕作条件下深松效应与经济效益研究. 农业工程学报, 2006, 22(10): 62- 67.
[41] 路怡青, 朱安宁, 张佳宝, 陈效民, 舒馨. 免耕和秸秆还田对小麦生长期内土壤酶活性的影响. 生态与农村环境学报, 2013, 29(3): 329- 334.
[42] Govaerts B, Mezzalama M, Unno Y, Sayre K D, Luna-Guido M, Vanherck K, Dendooven L, Deckers J. Influence of tillage, residue management, and crop rotation on soil microbial biomass and catabolic diversity. Applied Soil Ecology, 2007, 37(1/2): 18- 30.
[43] Helgason B L, Walley F L, Germida J J. Fungal and bacterial abundance in long-term no-till and intensive-till soils of the Northern Great Plains. Soil Science Society of America Journal, 2009, 73(1): 120- 127.
[44] Spedding T A, Hamel C, Mehuys G R, Madramootoo C A. Soil microbial dynamics in maize-growing soil under different tillage and residue management systems. Soil Biology and Biochemistry, 2004, 36(3): 499- 512.
EffectofsubsoilingonsoilnutrientandmicrobefunctionaldiversityofGlycyrrhizauralensisrhizospheres
ZHANG Zhizheng, MA Miao*, ZHANG Xulong
CollegeofLifeScience,ShiheziUniversity,Xinjiang832003,China
As a fundamental soil component, soil microorganisms can sensitively, timeously, and accurately reflect the status of the change of soil quality and reveal the condition of soil fertility and improvement, which are important indicators of soil quality. At present, subsoiling technology is considered a soil conservation-tillage technology, which can change the soil structure and influence the soil microbial community. Therefore, the effect of tillage methods on microbes in soil ecosystems is being well studied globally. However, little is known about effect of subsoiling on soil nutrients and the functional diversity of microbial communities in rhizosphere soil ofGlycyrrhizauralensis. The purpose of this study was to provide the basis for improving tillage practices and soil environmental condition of licorice. Compared to conventional methods, Biolog technology can effectively provide useful information on soil microbial community functional diversity. Therefore, in this study, two treatments, including rotary tillage (CK) and subsoiling, were conducted in licorice planting land. Using field experiments and laboratory analysis, the effect of subsoiling on soil nutrients and the functional diversity of microbial communities in rhizosphere soil ofG.uralensiswas determined. The results showed that the effect of subsoiling on soil nutrients in the 0—20 cm depth of rhizosphere soil ofG.uralensiswas not significant, but greatly improved the total nitrogen (TN), phosphorus (TP), and potassium (TK) contents in the 20—40 cm depth of rhizosphere soil ofG.uralensis(which increased by 60.8, 65.3, 48.9, and 86.8%, respectively). Meanwhile, the number and abundance of bacteria, fungi, and actinomycetes within the 0—20 and 20—40 cm depths of rhizosphere soil ofG.uralensiswas significantly increased (P< 0.05). The quantity of three types of microorganisms present in the upper layer was greater than in the lower layer, and was greater in the subsoiling than non-subsoiling. After 156 h of microbial incubation, Average Well Color Development (AWCD) of different soil layers of subsoiling treatments were obviously higher than those of non-subsoiling treatments, and subsoiling treatment significantly improved the utilization of AWCD (72 h,P< 0.05), by 35.5 and 130.8% in the upper and lower soil layers, respectively. Compared with the non-subsoiling treatment, subsoiling significantly increased the microbial diversity index (such as the Shannon Index (H), Substrate Richness Index (S), and Simpson′s Dominance Index (D)). A principal component analysis (PCA) showed that subsoiling treatment could optimize microbial community composition in licorice rhizosphere soil; polymers, carboxylic acids, amino acids, and carbohydrates were primary carbon sources of rhizosphere soil microbes in subsoiling areas. Overall, the nutrient content of soil, the number of microbes, and the microbial community diversity index were obviously improved by subsoiling in licorice rhizosphere soil, and the microbial community functional diversity was changed. The arable layer soil structure was enhanced, and therefore the survival of microorganisms was improved by subsoiling. Therefore, subsoiling treatment could effectively improve the quality of rhizosphere soil ofG.uralensis.
subsoiling;Glycyrrhizauralensis; soil physical and chemical property; soil microorganism; Biolog
国家自然科学基金资助项目(31360047);石河子大学重大科技攻关资助项目(gxjs2012-zdgg06-04)
2016- 05- 09; < class="emphasis_bold">网络出版日期
日期:2017- 03- 22
10.5846/stxb201605090893
*通讯作者Corresponding author.E-mail: mamiaogg@126.com
张志政,马淼,张旭龙.深松对乌拉尔甘草根际土壤养分以及微生物群落功能多样性的影响.生态学报,2017,37(15):5137- 5145.
Zhang Z Z, Ma M, Zhang X L.Effect of subsoiling on soil nutrient and microbe functional diversity ofGlycyrrhizauralensisrhizospheres.Acta Ecologica Sinica,2017,37(15):5137- 5145.
