HPLC-MS/MS法在骨髓移植患者全血CSA及AM1浓度测定中的应用
2017-09-12刘红星孙文利
王 磊,刘红星,孙文利
(河北燕达陆道培医院临床药理室,河北廊坊 065201)
·技术与方法·
HPLC-MS/MS法在骨髓移植患者全血CSA及AM1浓度测定中的应用
王 磊,刘红星△,孙文利
(河北燕达陆道培医院临床药理室,河北廊坊 065201)
目的 建立同时测定骨髓移植患者全血环孢素A(CSA)及AM1浓度的HPLC-MS/MS法,探索CSA及其主要代谢产物AM1在个体内及个体间的关系,为临床合理选用CSA血药浓度监测方法提供可靠依据。方法 采用环孢素D(CSD)作内标,全血样品经含内标甲醇沉淀蛋白处理。色谱柱为Ultimate XB-C18,柱温65 ℃,流动相为含0.1%甲酸和2 mmol/L乙酸铵的水和含0.1%甲酸的甲醇,梯度洗脱。质谱检测方式为电喷雾离子阱正离子模式,质谱多反应监测(MRM)扫描,监测CSA 1 219.9~1 203.1 m/z,AM1 1 236.1~1 219.1 m/z,CSD 1 234.0~1 217.0 m/z。结果 CSA浓度在16~1 600 ng/mL范围内线性关系良好,Y=0.014 3X+0.021 3(r=0.997 6);AM1浓度在10~1 000 ng/mL范围内线性关系良好,Y=0.003 63X-0.005 28(r=0.997 3)。CSA与AM1个体间比率(AM1/CSA)范围为32%~356%;CSA与AM1个体内比率(AM1/CSA)范围为27%~147%。结论 建立了同时检测CSA及AM1的HPLC-MS/MS法;CSA在骨髓移植患者个体间及个体内代谢存在变异;HPLC-MS/MS法可用于临床骨髓移植患者全血CSA浓度的监测。
环孢素A;AM1;液质联用;药物监测
环孢素A(cyclosporine,CSA)是由11个氨基酸组成的环状多肽,其相对分子质量为1 203.63×103,主要与体内的钙调磷酸酶(多基因亲环蛋白)结合,发挥免疫抑制活性,广泛应用于骨髓移植患者。在体内通过氧化和结合反应产生至少30种代谢产物[1-3],其代谢产物总体活性小于CSA活性的14%;AM1为CSA在体内代谢的第一代代谢产物,也是其主要的代谢产物,其活性至少比CSA活性低30倍;AM1C及AM1A为其次生代谢产物及半合成产物;AM1在个体间的变异较大,在个体内的变异目前尚无详细数据可查,对其研究就显得尤为必要[4-7]。使用CSA治疗需要监测血药浓度,其剂量调整取决于血药浓度水平及移植后间隔时间。由于CSA治疗窗窄,其口服制剂具有很高的变异率,临床主要通过监测其血药浓度谷值来调整患者给药剂量,达到较好的免疫抑制效果[8-9]。
目前CSA血药浓度监测方法较多,主要有EMIT、RIA、FPIA、HPLC、Elecsys、CMIA及HPLC-MS/MS。EMIT、RIA、FPIA、Elecsys及CMIA为免疫法,均存在免疫交叉反应,只是免疫交叉反应强弱不同[10-12];而HPLC和HPLC-MS/MS法不存在免疫交叉反应,其只检测CSA母体药物本身[10-15]。由于HPLC法检测CSA血药浓度需要分离CSA的各种代谢产物,耗时较长,同时其检测灵敏度较低,不利于临床快速、准确地检测CSA血药浓度;而HPLC-MS/MS法是根据待测物分子量的不同而实行检测,不需分离CSA各种代谢产物,其检测耗时较短,灵敏度较高,可满足临床快速、准确检测CSA血药浓度的需要[13-15]。本文建立同时测定CSA和AM1在全血中浓度的HPLC-MS/MS法,同时对CSA在骨髓移植患者体内代谢进行研究,进而为临床选用CSA血药浓度检测方法提供依据。
1 资料与方法
1.1 一般资料 (1) CSA与AM1个体间代谢研究:选择前来本科室监测CSA血药浓度的骨髓移植患者20例,其中男12例,女8例,患者年龄3~45岁,平均22.5岁,骨髓移植后时间未知。每位患者于清晨8:00服药前,抽取静脉血2 mL,应用专用乙二胺四乙酸(EDTA)抗凝管进行抗凝,应用HPLC-MS/MS法进行全血CSA及AM1浓度检测。(2)CSA与AM1个体内代谢研究:选择前来本科室监测CSA血药浓度的骨髓移植患者潘某,女,年龄5岁,诊断为急性淋巴细胞白血病(ALL),共收集其用于监测CSA血药浓度全血标本16份,同时用HPLC-MS/MS方法进行全血CSA及AM1浓度检测。
1.2 仪器设备 岛津20A高效液相色谱系统(日本岛津公司),配有AB Sciex 4000Qtrap质谱仪,Analyst V1.5.2工作站(美国AB公司);其林贝尔涡旋混合器(上海坤肯生物化工有限公司),全自动高速冷冻离心机(Thermo Fisher公司)。
1.3 试剂 甲醇(HPLC级,美国Fisher公司),屈臣氏蒸馏水(广州屈臣氏有限公司);甲酸、乙酸铵(HPLC 级,MREDA Technology有限公司);CSA(HPLC 级,美国Sigma公司);AM1、环孢素D(Cyclosporin D,HPLC级,加拿大Toronto Research公司)。
1.4 方法
1.4.1 液相色谱及质谱条件 色谱条件:采用Ultimate XB-C18色谱柱(4.6 mm×150.0 mm,5 μm),柱温65 ℃;流速:0.8 mL/min;流动相:2 mmol/L乙酸铵-0.1%甲酸水溶液(B)-0.1%甲酸甲醇溶液(A),进样量5 μL;洗脱方式:梯度洗脱,其中0.01~0.50 min,A相浓度从50%~100%,保持3.5~4.4 min,A相浓度从100%~50%,保持3.6 min。
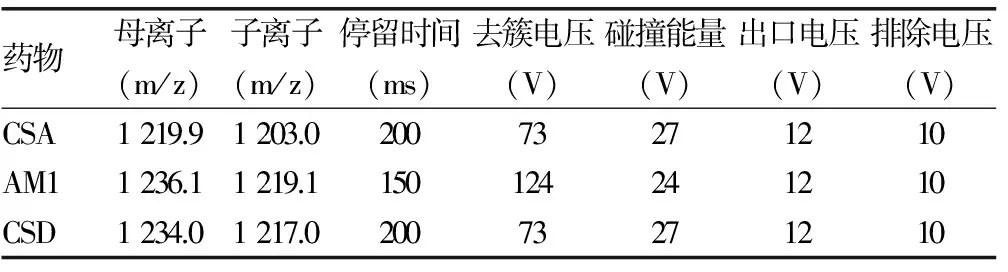
表1 质谱条件
质谱条件:电喷雾电离源(ESI);离子极性:正离子模式;监测模式为MRM;离子喷射电压:5 000 V;温度:325 ℃;GS1:60;GS2:55;Curtain gas:20;碰撞气压力:Medium;用于定量分析的离子反应:CSA 1 219.9~1 203.1 m/z,AM1 1 236.1~1 219.1 m/z,CSD 1 234.0~1 217.0 m/z;各种质谱条件参数如表1
1.4.2 样品处理方法 精密量取样本全血100 μL置于1.5 mL EP管中,然后加入100 mol/L硫酸锌溶液100 μL,涡旋振荡0.5 min,再加入25 ng/mL CSD 300 μL,涡旋振荡0.5 min,13 000 r/min离心10 min,取上清液150 μL置于自动进样器。
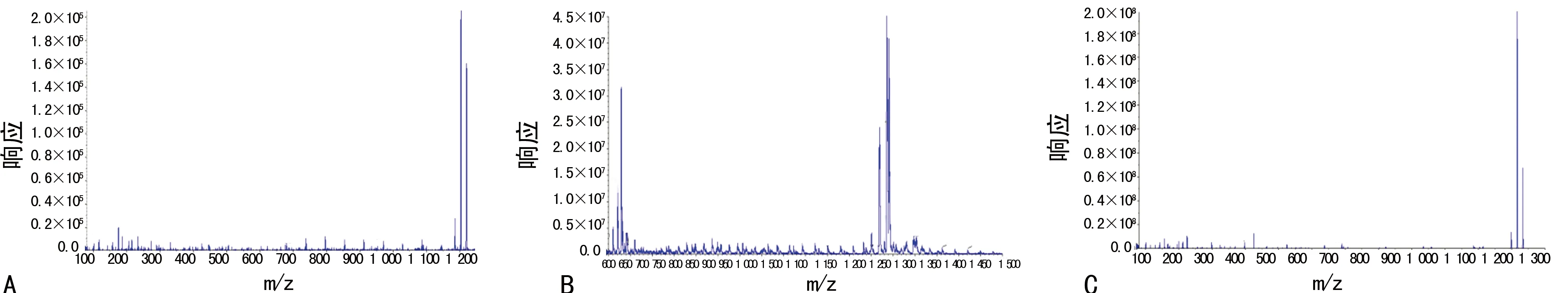
1.4.3 专属性 在上述色谱质谱条件下,CSA、CSD及AM1的保留时间分别为3.70、3.82和3.82 min。血样中的内源性物质对CSA、CSD及AM1的测定无干扰。考察了6份不同的空白全血,结果表明,流动相和空白全血中的杂质均不干扰样品峰和内标峰,且峰形良好。见图2。
1.4.4 标准曲线的制备 分别在7个1.5 mL EP管中加入空白全血90 μL,并加入10 μL CSA和AM1各系列混合标准工作液,得到CSA为16、40、80、160、400、800、1 600 ng/mL和AM1为10、25、50、100、250、500、1 000 ng/mL系列质量浓度。按“1.4.2”项下样品处理方法处理后进样测定,以CSA峰面积与CSD峰面积比值为(Y)对CSA浓度(X)进行线性回归,拟合方式为加权最小二乘法,得CSA标准曲线;以AM1峰面积与CSD峰面积比值为(Y)对AM1浓度(X)进行线性回归,拟合方式为加权最小二乘法,得AM1标准曲线。
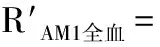
1.4.6 稳定性试验 分别在18个1.5 mL EP管中加入空白全血90 μL,并加入含有CSA和AM1 2、3、5号系列混合标准工作液各10 μL,得CSA对照品各浓度为40、80、400 ng/mL;AM1对照品各浓度为25、50、250 ng/mL,每个系列浓度6份样品。每个浓度样品各取3份按“1.4.2”项下血样处理方法处理后置于4 ℃冰箱中,于放置时间72 h测定各样品的浓度;其余样品于4 ℃冰箱中放置72 h后取出放至室温,按“1.4.2”项下样品处理方法处理后进样测定,考察其稳定性。
2 结 果
2.1 色谱质谱行为 在“1.4.1”项下的色谱质谱条件下,测得CSA、AM1、CSD二级碎片离子质谱图,见图1;CSA、AM1、CSD质谱色谱图见图2。由图2可见,CSA、AM1、CSD各个峰型良好,无杂质峰干扰,专属性较好。
2.2 标准曲线回归方程 分别以CSD为内标,CSA峰面积与CSD峰面积比值为(Y)对CSA浓度(X)进行线性回归,得CSA的回归方程:Y=0.014 3X+0.021 3(r=0.997 6),表明CSA在16~1 600 ng/mL范围内线性关系较好,可用于定量,其最低检测限为0.4 ng/mL;AM1峰面积与CSD峰面积比值为(Y)对AM1浓度(X)进行线性回归,得AM1的回归方程:Y=0.003 63X-0.005 28(r=0.997 3),表明AM1在10~1 000 ng/mL范围内线性关系较好,可用于定量,其最低检测限为0.1 ng/mL。
A:CSA;B:AM1;C:CSD质谱图
图1 CSA、AMI、CSD质谱图
A:空白全血;B:空白全血+AM1+CSA+CSD;C:患者血样+CSD
图2 CSA,AM1和CSD色谱图
2.3 回收率和精密度试验结果 CSA和AM1的回收率和日内、日间精密度测定结果如表2。CSA和AM1相对回收率为95.26%~106.35%,绝对回收率79.84%~90.35%,绝对回收率比相对回收率低,存在基质效应,但回收率都大于70%,均符合药典分析定量要求,该方法可用于定量分析。同时,日内及日间精密度均小于5%,说明该方法重现及重复性好,较稳定。
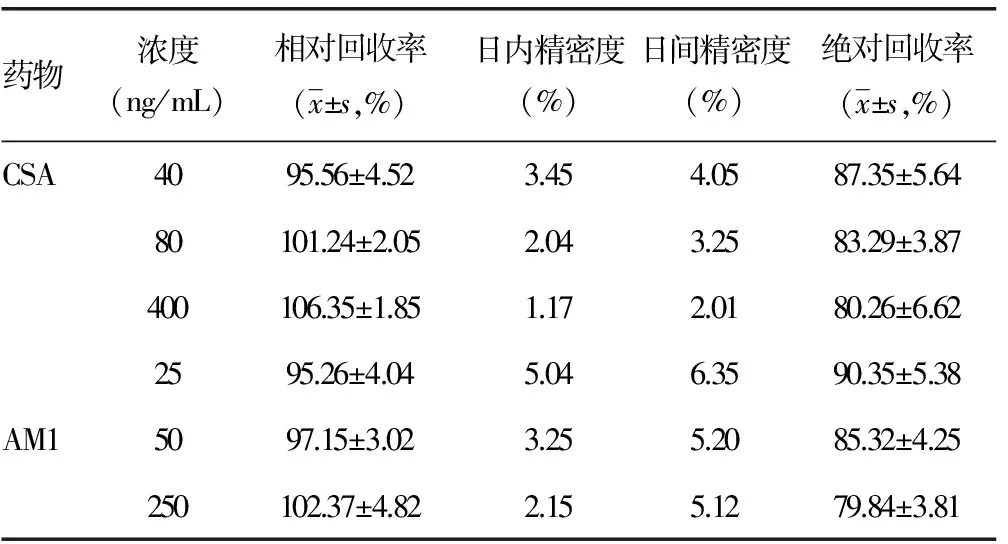
表2 CSA和AM1精密度和回收率结果(n=3)
2.4 稳定性考察结果 由表3可知,在4 ℃条件下,血中CSA和AM1放置72 h浓度稍微下降,但差异无统计学意义(P>0.05);血样经过处理后,在4 ℃条件下,放置72 h CSA和AM1浓度基本保持不变。由此可以得出,在此条件下测定血中CSA和AM1浓度的稳定性良好,能保证测定结果的准确性和重现性。由于CSA为多肽类药物,本身性质较稳定,不易降解,又由于临床血药浓度监测的及时性,故本实验只研究了4 ℃条件下的72 h稳定性,可满足临床标本的检测。
表3 稳定性结果
2.5 CSA与AM1个体间代谢检测结果 20例患者全血标本进行HPLC-MS/MS检测,对数据进行散点分析,结果如图3;以个体内AM1/CSA为研究对象进行比率分析,结果如图4、5。由图3、4可知,AM1与CSA在个体间的代谢无相关性;由图5可见AM1/CSA的比率范围为32%~356%,平均值为147%。表明CSA在骨髓移植患者个体间代谢存在差异,代谢产物的量和比例不定,造成用免疫法检测CSA浓度时,不同患者的免疫交叉反应程度不同,质谱法检测结果与免疫法检测结果差别较大,二者无固定的换算系数。
2.6 CSA与AM1个体内代谢检测结果 对2016年3月11日至2016年4月10日潘某的CSA全血标本进行回顾性检测分析,对其检测结果进行比率分析和散点分析,结果如图6、7。由图6、7可见,AM1/CSA比率范围为27%~147%,波动较大,表明CSA在骨髓移植患者个体内代谢存在差异,代谢产物的量和比例不确定,造成用免疫法检测CSA浓度时,同一患者的免疫交叉反应程度不同,质谱法检测结果与免疫法检测结果存在较大差别,二者无固定的换算系数。
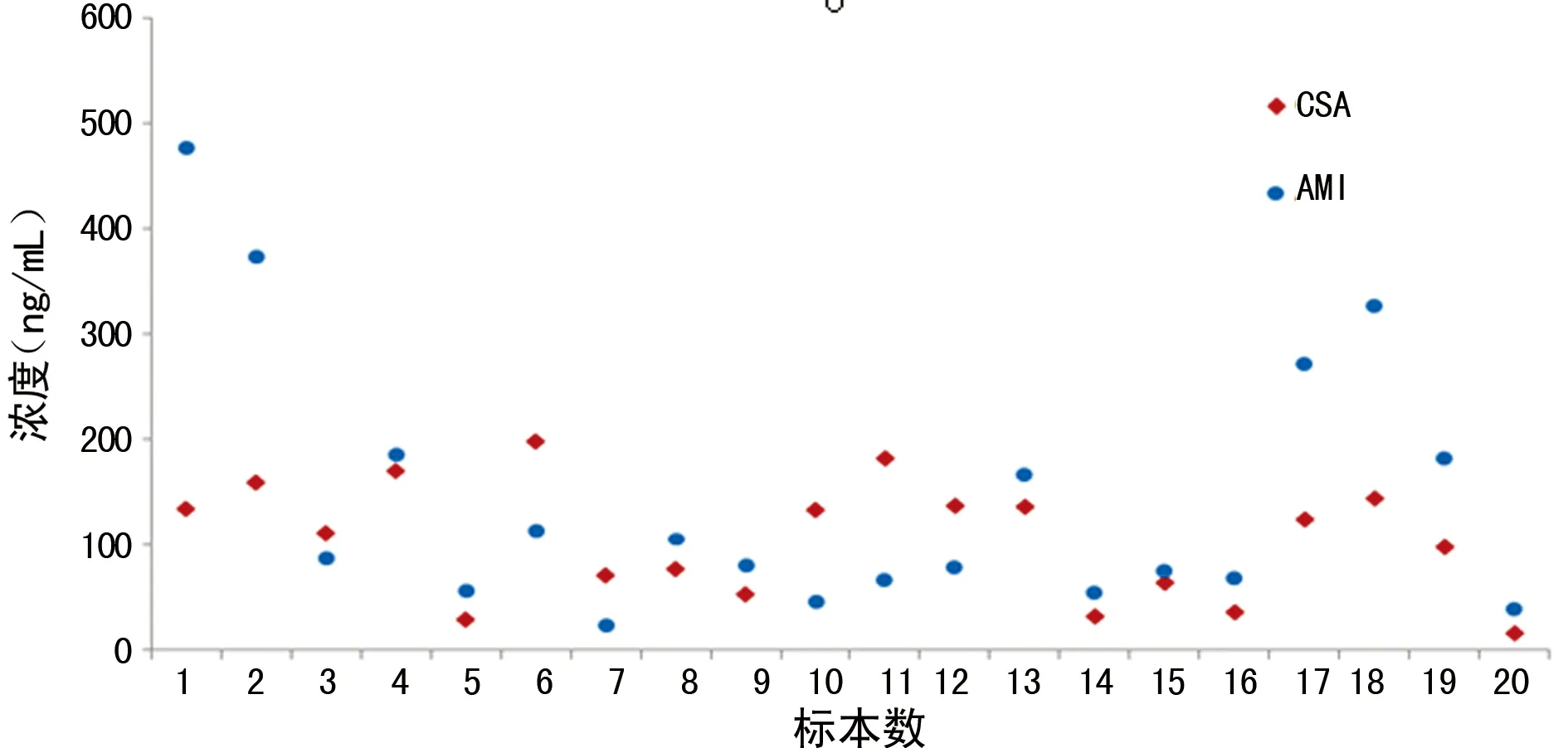
图3 AM1和CSA离散分析(n=20)
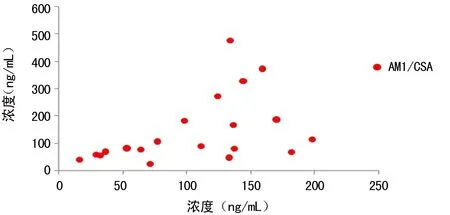
图4 AM1/CSA相关性分析
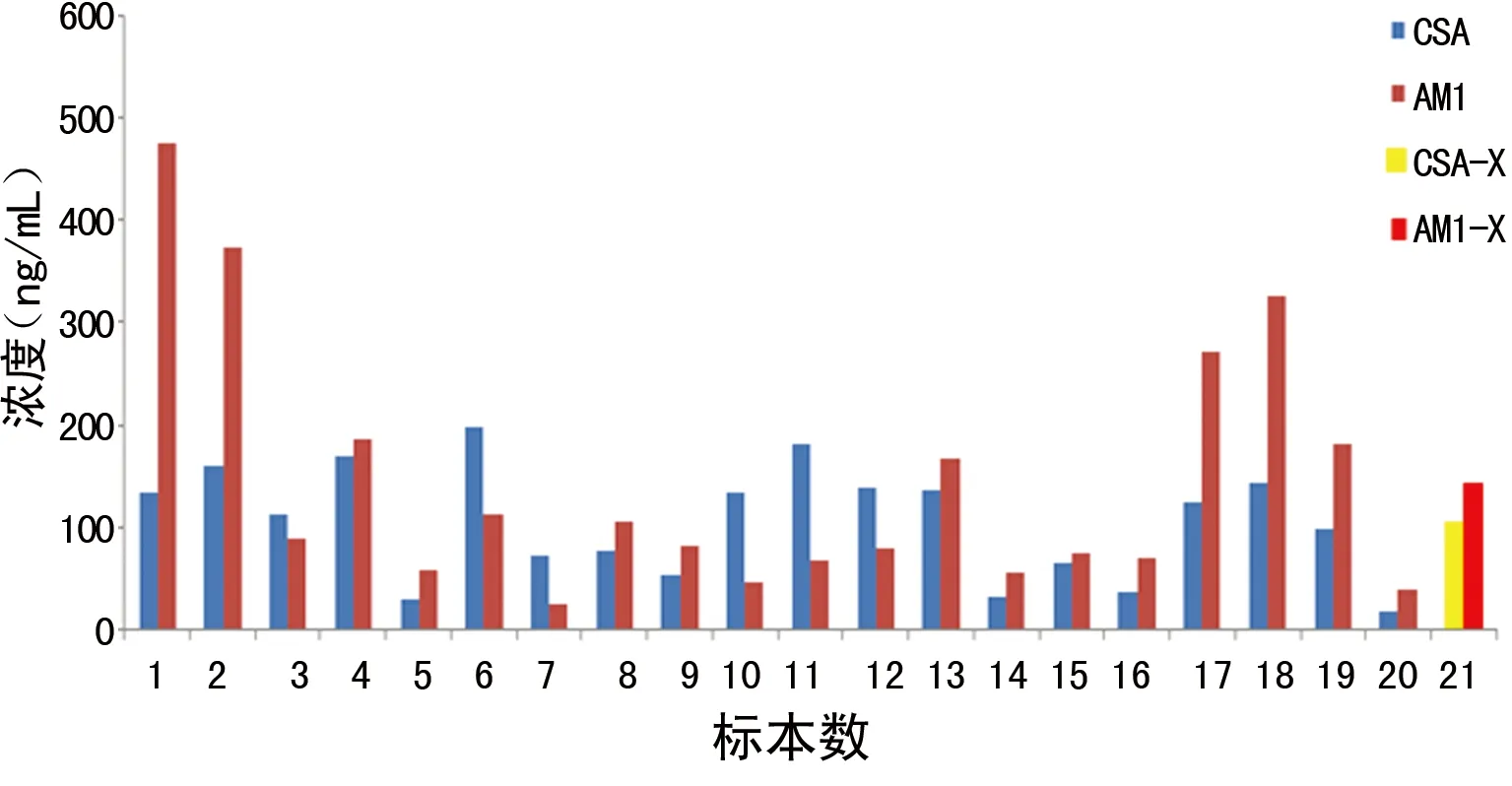
图5 AM1/CSA比率分析
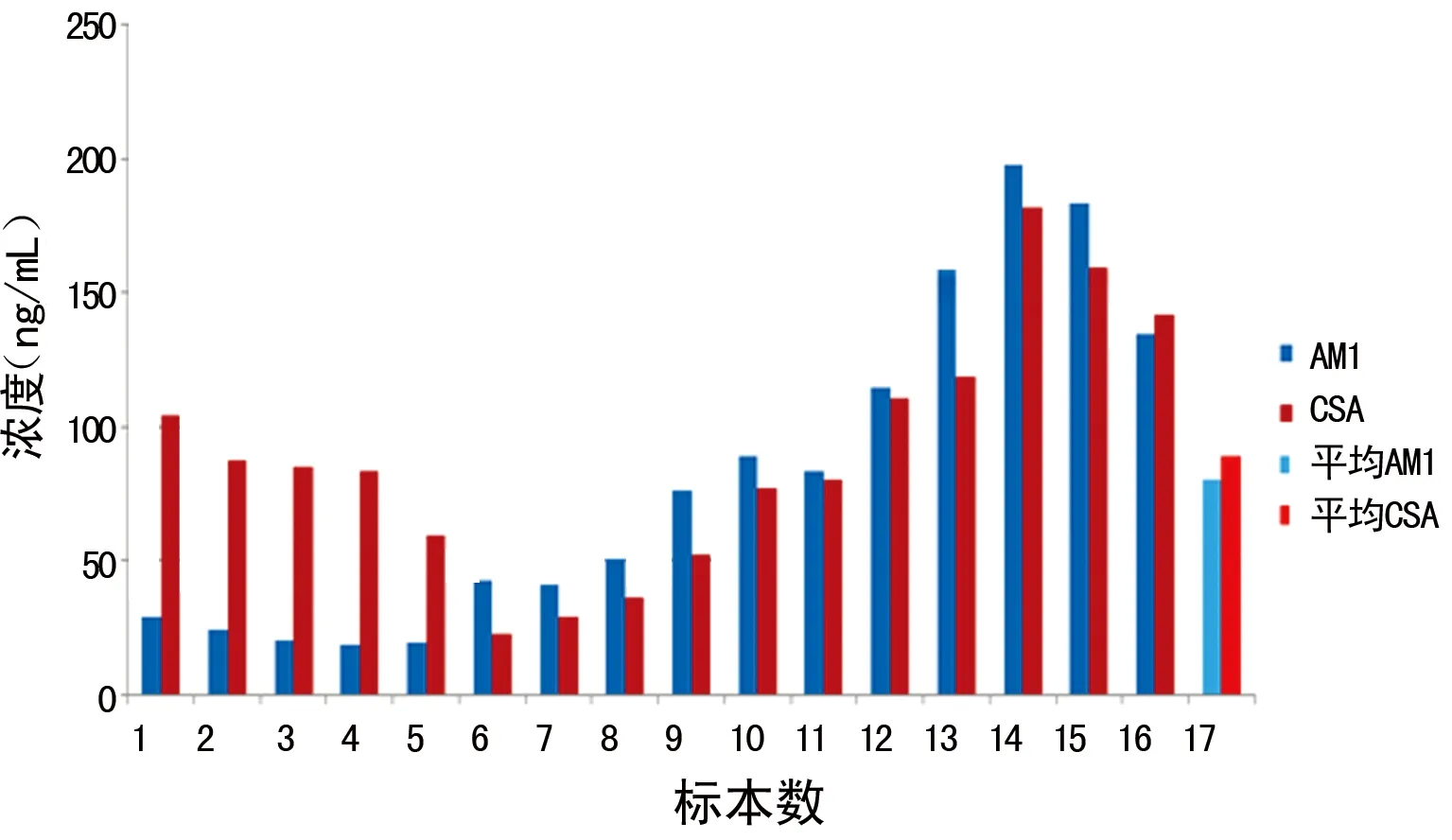
图6 AM1和CSA比率分析
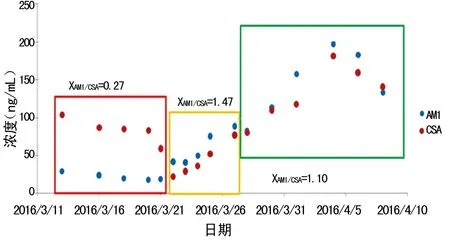
图7 AM1和CSA离散分析
3 讨 论
CSA广泛应用于骨髓移植患者,由于CSA治疗窗窄,其浓度受移植后时间和其他药物代谢的影响显著,并且患者需长期服药,CSA血药浓度监测就显得尤为重要。同时,CSA口服生物利用度约为30%,主要经肝脏代谢,代谢产物种类众多、比例各异,决定了临床医师对CSA血药浓度检测方法的选择。CSA浓度检测方法较多,有HPLC、RIA、FPIA、CMIA和HPLC-MS/MS法等,不同的CSA血药浓度检测方法所测得的CSA血药浓度水平不同,影响临床医师和临床药师对CSA结果的解读,进而影响患者的治疗,因此临床医师和临床药师在分析CSA结果时应该注意检测方法,各实验室在发放检测结果时也应注明检测方法,利于临床对结果进行分析,准确调整患者药物剂量,使骨髓移植患者应用CSA剂量更为合理,降低毒性反应和排斥反应的发生,提高患者的生存率。
本实验建立同时测定骨髓移植患者CSA及AM1血药浓度的HPLC-MS/MS法,能快速、准确及高灵敏地检测全血中CSA及AM1浓度。采用CSD作内标,通过七水硫酸锌裂解红细胞,用甲醇沉淀蛋白处理样品,线性良好,适于临床应用血药浓度监测。同时,该处理方法简单,易操作和重复,用于CSA和AM1母体药物测定准确度高,特异性强。
AM1为CSA众多代谢产物中含量较多的一种代谢产物,通过检测AM1与CSA在个体间及个体内的变化,可为CSA血药浓度监测方法的选择提供依据。由本文可知,AM1与CSA在骨髓移植患者个体间及个体内比例各异,进一步推测可知CSA代谢产物的比例在个体间及个体内代谢存在偏倚,并且CSA代谢产物的活性各异,免疫法如RIA、FPIA、CMIA均存在不同程度的免疫交叉反应,使CSA测量结果偏高,偏高的程度与CSA代谢产物的种类和量有关。因此,CSA母体药物的准确检测就显得非常必要,而HPLC-MS/MS不仅能准确检测CSA母体药物含量而且耗时较短,能满足临床快速检测的需求。
[1]Duncan N,Craddock C.Optimizing the use of cyclosporin in allogeneic stem cell transplantation[J].Bone Marrow Transplant,2006,38(3):169-174.
[2]Willemze AJ,Cremers SC,Schoemaker RC,et al.Ciclosporin kinetics in children after stem cell transplantation[J].Br J Clin Pharmacol,2008,66(4):539-545.
[3]Vollenbroeker B,Koch JH,Fobker M,et al.Determination of cyclosporine and its metabolites in blood via HPLC-MS and correlation to clinically important parameters[J].Transplant Proc,2005,37(4):1741-1744.
[4]Maza A,Montaudié H,Sbidian E,et al.Oral cyclosporin in psoriasis:a systematic review on treatment modalities,risk of kidney toxicity and evidence for use in non-plaque psoriasis[J].J Eur Acad Dermatol Venereol,2011,25 Suppl 2:19-27.
[5]Poquette MA,Lensmeyer GL,Doran TC.Effective use of liquid chromatography-mass spectrometry(LC/MS)in the routine clinical laboratory for monitoring sirolimus,tacrolimus,and cyclosporine[J].Ther Drug Monit,2005,27(20):144-150.
[6]Hinen DJ,ten Berge O,Timmer-de Mik L,et al.Efficacy and safety of long-term treatment with cyclosporin A for atopic dermatitis[J].J Eur Acad Dermatol Venereol.2007;21(1):85-89.
[7]Schultz KR,Nevill TJ,Balshaw RF,et al.Effect of gastrointestinal inflammation and age on the pharmacokinetics of oral microemulsion cyclosporin A in the first month after bone marrow transplantation[J].Bone Marrow Transplant,2000,26(5):545-551.
[8]Barkholt L,Remberger M,Bodegard H,et al.Cyclosporine A (CSA) 2-h concentrations vary between patients without correlation to graft-versus-host disease after allogeneic haematopoietic stem cell transplantation[J].Bone Marrow Transplant,2007,40(7):683-689.
[9]Furukawa T,Kurasaki-Ida T,Masuko M,et al.Pharmacokinetic and pharmacodynamic analysis of cyclosporine A (CSA) to find the best single time point for the monitoring and adjusting of CSA dose using twice-daily 3-h intravenous infusions in allogeneic hematopoietic stem cell transplantation[J].Int J Hematol,2010,92(1):144-151.
[10]Lechuga-Ballesteros D,Abdul-Fattach A,Stevenson CL,et al.Properties and stability of a liquid crystal form of cyclosporine-the first reported naturally occurring peptide that exists as a thermotropic liquid crystal[J].J Pharm Sci,2003,92(9):1821-1831.
[11]Jebabli N,Klouz A,Bahlous A,et al.Comparison of three methods for cyclosporine therapeutic monitoring[J].Transplant Proc,2007,39(8):2557-2559.
[12]Kahan BD.Therapeutic drug monitoring of cyclosporine:20 years of progress[J].Transplant Proc,2004,36(2 Suppl):378-391.
[13]Streit F,Armstrong VW,Oellerich M.Rapid liquid chromatography-tandem mass spectrometry routine method for simultaneous determination of sirolimus,everolimus,tacrolimus,and cyclosporin a in whole blood[J].Clin Chem,2002,48(6 Pt 1):955-958.
[14]Kacmaz RO,Kempen JH,Newcomb C,et al.Cyclosporine for ocular inflammatory diseases[J].Ophthalmology,2010,117(3):576-584.
[15]Salm P,Taylor PJ,Lynch SV,et al.A rapid HPLC-mass spectrometry cyclosporin method suitable for current monitoring practices[J].Clin Biochem,2005,38(7):667-673.
The application of HPLC-MS/MS method in the determination of whole blood concentration of Cyclosporine A and AM1 in bone marrow transplant patient
WangLei,LiuHongxing△,SunWenli
(ClinicalPharmacologyLaboratory,HebeiYandaLuDaopeiHospital,Langfang,Hebei065201,China)
Objective To develop a HPLC-MS/MS method for determination of cyclosporin A(CSA)and AM1 in bone marrow transplant patient,and explore the relationship of CSA and its main metabolite AM1 within individual and between individuals,and provide reliable basis for clinical rational use of monitoring in CSA blood drug concentration.Methods CSD was used as internal standard,and whole blood samples were treated with internal standard methanol precipitated protein.The column was Ultimate XB-C18 with a column temperature of 65 ℃ and the mobile phase was eluted with 0.1% of formic acid and 2 mmol/L ammonium acetate in water and methanol containing 0.1% formic acid.The mass spectrometry was detected by electrospray ion trap positive ion mode,MRM scanning,monitoring CSA 1 219.9 to 1 203.1 m/z,AM1 1 236.1 to 1 219.1 m/z,CSD 1 234.0 to 1 217.0 m/z.Results The concentration of CSA was linear in the range of 16 to 1 600 ng/mL,Y=0.014 3X+0.021 3(r=0.997 6).The concentration of AM1 was linear in the range of 10~1 000 ng/mL,Y=0.003 63X-0.005 28(r=0.997 3).The ratio of CSA to AM1 (AM1/CSA) between individual ranged from 32% to 356%.The ratio of CSA to AM1 within indiviolual(AM1/CSA) ranged from 27% to 147%.Conclusion HPLC-MS/MS method for the simultaneous detection of CSA and AM1 was established.The variation of CSA exists in the bone marrow transplant patient between individuals and within individual;the HPLC-MS/MS method can be used for monitoring of whole blood concentration of CSA in bone marrow transplant patients.
cyclosporin A;AM1;HPLC-MS/MS;drug monitoring
王磊(1984-),执业药师,硕士,主要从事医院药学研究工作。
△通信作者,E-mail:lhongxing@outlook.com。
10.3969/j.issn.1671-8348.2017.23.021
R699.2
A
1671-8348(2017)23-3234-04
2016-04-09
2017-05-09)
