siRNA干扰膜联蛋白AI表达对甲状腺乳头状癌TPC-1细胞凋亡的影响
2017-09-12钟雪梅林一民邓世山
钟雪梅,林一民,周 源,邓世山,丁 浩
(1.重庆医药高等专科学校临床医学院 401331;2.重庆市肿瘤研究所检验科 400030;3.川北医学院基础医学院,四川南充 637000)
siRNA干扰膜联蛋白AI表达对甲状腺乳头状癌TPC-1细胞凋亡的影响
钟雪梅1,林一民2△,周 源1,邓世山3,丁 浩1
(1.重庆医药高等专科学校临床医学院 401331;2.重庆市肿瘤研究所检验科 400030;3.川北医学院基础医学院,四川南充 637000)
目的 通过小干扰RNAs(siRNA)干扰膜联蛋白A1(ANX A1)在甲状腺乳头状癌(PTC)细胞中的表达,探讨ANX A1对PTC细胞的生物学特性的影响。方法 设计并筛选使用高效的siRNA在PTC TPC-1细胞株特异性干扰ANX A1的表达,然后用流式细胞术观察ANX A1干扰后对PTC细胞TPC-1凋亡的影响。结果 筛选的siRNA可高效沉默ANX A1在PTC细胞中的表达,促进PTC细胞的凋亡。结论 siRNA干扰ANX A1表达,可促进PTC细胞的凋亡,提示ANX A1可能是PTC治疗的一个重要的生物学靶标。
甲状腺肿瘤;乳头状瘤;膜联蛋白A1;TPC-1细胞;RNA,小分子干扰;凋亡
甲状腺癌(thyroid cancer,TC) 是内分泌系统常见肿瘤,发病率在头颈部恶性肿瘤中居首位。而甲状腺乳头状癌(papillary thyroid carcinoma,PTC)的发病率约占所有甲状腺癌发病类型的80%以上[1]。临床上PTC常表现为甲状腺结节,但由于甲状腺结节构成复杂,良恶性很难鉴别,易过度治疗。研究表明,对不确定恶性患者的术后病理发现,仅20%~25%为甲状腺癌,另75%~80%的患者则接受了不必要的甲状腺手术[2]。2016年,《美国医学会杂志》已经将包裹性滤泡型PTC改称为“肿瘤”,虽然目前还没有标准化诊治规范,但诊断性甲状腺切除的概率会减少[3]。为此,需探索新的生物学靶标和诊治方法。膜联蛋白(annexins,ANX)是一类钙依赖性、能够结合带负电荷膜磷脂的蛋白超家族,是一种高丰度蛋白,而ANX A1是第一个被发现的家族成员,它主要介导细胞内糖皮质激素抗炎作用的效应分子,与细胞增殖、细胞凋亡的信号传导及肿瘤发生的机制都密切相关[4]。笔者的前期实验也发现,ANX A1在PTC原发灶、转移灶的表达明显高于癌旁正常组织,且与淋巴结转移和肿瘤大小相关[5]。因此,深入研究ANX A1在PTC中的作用是非常必要的。
双链小干扰RNA(small interfecting RNA,siRNA)由21~25个核苷酸组成,能引起RNA的干扰和抑制靶蛋白的表达[6-7]。为进一步明确ANX A1在PTC中的作用,本研究拟使用siRNA干扰ANX A1的表达,观察其对PTC细胞株TPC-1细胞的增殖、凋亡的生物学影响,从而进一步探讨ANX A1在PTC发生、发展中的作用。
1 材料与方法
1.1 主要材料及仪器 RPMI-1640培养基(HyClone公司);脂质体Lipofectamine2000(Invitrogen公司);RNA提取试剂盒(TaKaRa公司);PCR仪、凝胶图像系统、酶标仪(Bio-Rad公司);流式细胞仪(BD公司)。
1.2 方法
1.2.1 细胞培养 TPC-1细胞购自深圳百恩维生物公司,细胞在生长至90%汇合度时进行传代,在含10%~15%的胎牛血清的RPMI-1640培养基中,5% CO2、37 ℃恒温孵箱内培养。
1.2.2 ANX A1 siRNA设计 使用Version2.0软件设计出针对ANX A1基因的特异性片段3对及无关序列siRNA片段1对。以上siRNA由广州锐博生物科技有限公司复核并合成。
1.2.3 细胞转染 将TPC-1细胞以4.5×105~5.0×105个/孔的密度接种于6孔板生长24 h,使其生长至80%汇合度或刚好铺满培养板且处于对数生长期进行转染。根据Lipfectamine2000(Invitrogen美国)说明书操作,将带有荧光标记的siRNA转染至TPC-1细胞内。实验分为:实验组(分别转染3对siRNA)、阴性对照组(转染无关序列siRNA)和空白组(不转染)及脂质体组,其中实验组又包括ANX A1-siRNA1组、ANX A1-siRNA2组、ANX A1-siRNA3组。
1.2.4 半定量逆转录PCR(RT-PCR) 在GeneBank中检索出人ANX A1和β-actin全长序列,用 Oligo6.0软件分别设计引物,将逆转录所得的cDNA模板进行PCR扩增反应,以β-actin为内参对照。反应条件:预变性94 ℃ 5 min;变性94 ℃ 30 s,退火 56 ℃ 30 s, 72 ℃ 45 s,30个循环;72 ℃延伸10 min。PCR反应结束后4 ℃保存。将PCR扩增产物及DNA marker在1.0%~1.5%的琼脂糖凝胶上电泳,嗅氛蓝染色,在凝胶成像系统上观察扩增的条带,采集图片后,用图像分析软件PDQuest进行分析,测量灰度值,计算mRNA的相对表达量。
1.2.5 细胞凋亡检测 根据Annexin V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)双染细胞凋亡检测试剂盒说明书操作:将细胞以1×105~2×105接种于6孔板,转染72 h后收集约1×105个细胞,加入500 μL Binding Buffer悬浮细胞,TPC-1细胞悬液中先加入5 μL Annexin V-FITC室温孵育5 min后再加入5 μL PI 双染混合液混匀,室温避光反应15~20 min,1 h内进行流式细胞仪的检测。数据结果的分析与统计用软件为WinMDI2.9。
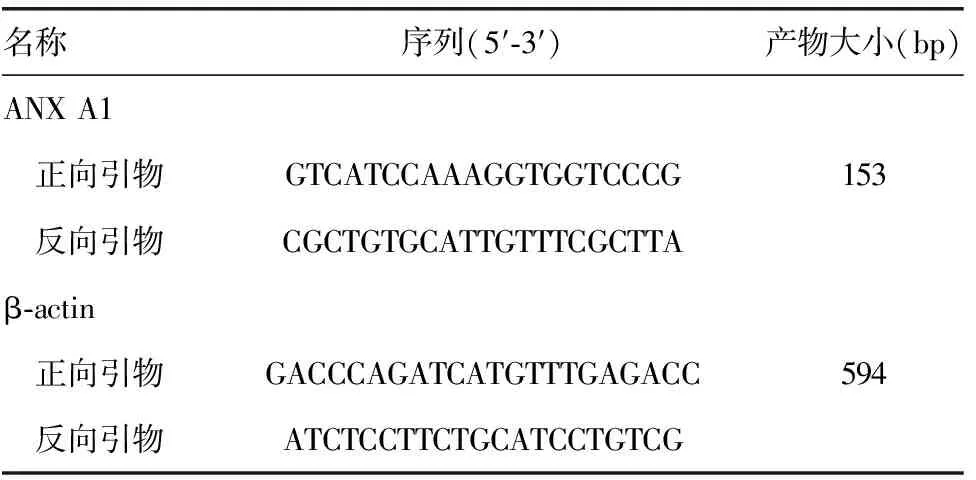
表1 目的基因上、下游引物及产物大小
2 结 果
2.1 转染效率 分别细胞转染于转染24、48、72 h后在荧光显微镜下观察转染情况,计数转染荧光阳性的细胞,估算转染效率,在48~72 h转染效率达80%以上。见图1。
A:ANX A1-siRNA3组;B:阴性对照组;C:空白组
图1 TPC-1细胞转染24 h后荧光显微镜下图像(×200)
2.2 RT-PCR检测各组ANX A1 mRNA表达情况 各组TPC-1细胞中ANX A1 mRNA的比较,RT-PCR结果表明,转染72 h后,ANX A1基因的PCR扩增产物经电泳及凝胶成像后,由PDQuest软件分析ANX A1/β-actin的比值:ANX A1-siRNA1组、ANX A1-siRNA2组、ANX A1-siRNA3组基因mRNA表达水平分别为0.51±0.11、 0.49±0.08、0.41±0.14,空白组、脂质体组及阴性对照组的基因mRNA表达水平分别为1.34+0.17、1.15+0.10、1.25+0.18 。各实验组mRAN表达水平较其他组明显下降(P<0.05),其中,ANX A1-siRNA3组下降最明显。而空白组、脂质体组及阴性对照组的基因mRNA表达无明显变化,差异无统计学意义(P>0.05)。见图2。
2.3 凋亡能力 siRNA干扰ANX A1基因后对TPC-1细胞凋亡能力的影响:转染72 h后,ANX A1-siRNA3组细胞凋亡率为 (18.93±1.16)% ,而阴性对照组和空白组的细胞凋亡率分别为(6.04±0.72)%、(5.19±0.65)%,ANX A1-siRNA3组与阴性对照组和空白组比较凋亡增加,差异有统计学意义(P<0.05),而阴性对照组与空白组比较差异无统计学意义(P>0.05)。见图3。
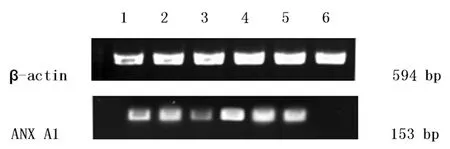
1、2、3分别为ANX A1-siRNA1、2、3组;4:阴性对照组;5:空白组;6:脂质体组
图2 RT-PCR检测ANX A1基因mRNA的表达

A:ANX A1-siRNA3组;B:阴性对照组;C:空白组。
图3 Annexin A1基因对甲状腺乳头状癌TPC-1细胞凋亡率的影响
3 讨 论
PTC是TC的最常见类型。PTC的治疗方法有药物治疗、手术治疗、放射治疗、放射性131I治疗、甲状腺激素(TSH)抑制治疗、靶向治疗等[8]。PTC虽然恶性程度较低、生存期长,但易转移和复发,其中尤以手术导致的喉返神经损伤引起声音嘶哑、呼吸困难甚至窒息等为甲状腺手术的严重并发症。因此,深入探讨如何提高PTC的疗效,改善患者的生活质量具有重要的临床价值。PTC的发生不仅仅由环境、电离辐射等因素引起,更是多基因、多通路、多因素共同调控的结果。其中,多基因调控如已知的有 BRAF、RAS、RET/PTC 癌基因,多通路则包括磷酸肌醇(-3)激酶(PI3K)/AKT信号通路和丝裂原活化蛋白激酶(MAPK)信号通路等。ANX A1是一类钙依赖型、高丰度蛋白,与细胞增殖、细胞凋亡的信号传导及肿瘤发生机制密切相关。目前,关于ANX A1的研究已成为肿瘤治疗领域的热点。ANX A1与组织学不同类型的肺癌关联,它在肺腺癌和小细胞肺癌表达比在肺鳞癌更丰富[9];研究还发现ANX A1在直结肠癌中表达上调,可促进结肠癌的发生[10]。ANX A1蛋白的周期调控,参与恶性肿瘤的发生和发展过程可能与ANX A1和酪氨酸蛋白激酶的底物结合,且有多个磷酸化位点,参与细胞内信号传递有关[11]。 ANX A1也参与MAPK信号通路传导、基因转录因子激活及各种生长因子蛋白结合等,引发一系列反应,导致细胞增殖、凋亡细胞分化和炎性反应[12]。故猜测ANX A1与PTC的发生有一定程度的关联性。
目前,关于ANX A1与PTC关系研究的文献,国内外报道极少,国内已有ANX A2在TC中及PTC中的表达及意义的研究。国外有关于ANX A1在TC类组织中的表达情况研究,包括乳头状癌、滤泡状癌、未分化癌。但都是仅研究了表达情况,未做进一步基因阻低试验[13]。还有关于ANX A1在甲状腺未分化癌中的基因阻低试验[14],但也未见ANX A1与PTC的阻低试验的报道。
本实验前期的研究发现,ANX A1蛋白在PTC组织及淋巴结转移组织中高表达,在癌旁正常组织中低表达,并与淋巴结转移和肿瘤大小相关。也提示了ANX A1与PTC发生的相关性。这为ANX A1在PTC的分子诊断、治疗方法、疗效及预后评估上的研究提供了很好的着眼点,抑制ANX A1基因功能是否影响PTC的生物学特性成为本次研究的目的。研究也证明,ANX A1在肿瘤的发生、发展中有很重要的作用,通过干扰其活性显示很好的抑制小细胞肺癌的效果[15]。分子靶向治疗PTC显示出一定的治疗前景,如索拉菲尼、舒尼替尼靶向血管内皮生长因子(VEGF)通道,小分子多靶点酪酸激酶抑制剂凡德他尼等。但这些靶向治疗也存在一些不足,如是否提高总体生存率,能否恢复放射性131I治疗的敏感性等,且这些靶向药物缺乏直接比较研究,有没有一种靶向治疗的药物都优于所有的药物也尚未明确。
siRNA能引起RNA的沉默和抑制靶蛋白的表达。因此,siRNA对很多疾病(如肿瘤、基因疾病、病毒性干扰等)具有极好的治疗前景。本研究结果显示,设计并合成的siRNA在mRNA水平显著抑制了ANX A1的表达,具有高效性和专一性。进而利用筛选的效率最高的siRNA作为研究工具,进行细胞转染,观察干扰后对细胞凋亡的影响。结果表明siRNA显著干扰了ANX A1蛋白的表达,促进了TPC-1细胞的凋亡。这可能与ANX A1和PTC基因中的某些通路有相似的结构域和与特异配体相结合,参与细胞内信号传递有关[11-12]。这也与已有文献报道的ANX A1抑制在甲状腺未分化癌的凋亡结果一致[16]。提示ANX A1在PTC中可能作为一个癌基因。ANX A1在癌组织中高表达,运用siRNA技术干扰ANX A1在PTC中的表达,有促进细胞凋亡的作用,这为PTC的临床治疗提供了新思路,即通过靶向抑制ANX A1蛋白表达来抑制肿瘤的生长,从而达到控制肿瘤的作用。但是ANX A1通过何种方式参与,其具体机制还不十分清楚。本实验的缺陷在于siRNA干预方法虽然高效,但容易降解,价格昂贵,干扰或沉默时效短,不适合做长期的基因抑制研究,未对ANX A1通过何种机制来调控PTC细胞的增殖、凋亡等生物学行为进行深入探讨,这也是下一步需改进和研究的方向。
总之,本实验设计合成并筛选了高效专一的能够抑制ANX A1基因的siRNA,成功干扰了PTC细胞ANX A1基因的表达,抑制ANX A1表达的同时,促进了肿瘤细胞的凋亡,这为ANX A1作为PTC治疗靶点提供了新方向。
[1]Liu X,Li S,Lin XE,et al.AXIN2 is Associated With Papillary Thyroid Carcinoma[J].Iran Red Crescent Med J,2016,18(2):e20960.
[2]Gomez Saez JM.Diagnostic and prognostic markers in differentiated thyroid cancer[J].Curr Genomics,2011,12(8):597-608.
[3]Hodak S,Tuttle RM,Maytal G,et al.Changing the cancer diagnosis:the case of follicular variant of papillary thyroid Cancer-Primum Non nocere and NIFTP[J].Thyroid,2016,26(7):869-871.
[4]Rescher U,Gerke V.Annexins--unique membrane binding proteins with diverse functions[J].J Cell Sci,2004,117(Pt 13):2631-2639.
[5]钟雪梅,陈敏,邓世山,等.AnnexinA1在甲状腺乳头状癌中的表达及临床意义[J].重庆医学,2015,44(25):3488-3490.
[6]Higuchi DY,Kawakami S,Hashida M.Strategies for in vivo delivery of siRNAs:recent progress[J].Biodrugs,2010,24(3):195-205.
[7]Ren T,Qing Y,Dai N,et al.Apurinic/apyrimidinic endonuclease 1 induced upregulation of fibroblast growth factor 2 and its receptor 3 induces angiogenesis in human osteosarcoma cells[J].Cancer Sci,2014,105(2):186-194.
[8]Ardito G,Revelli L,Polistena A,et al.Complications of neck dissections in papillary thyroid carcinoma:a modified procedure to reduce parathyroid morbidity[J].In Vivo,2016,30(3):303-308.
[9]Liu YF,Zhang PF,Li MY,et al.Identification of annexin A1 as a proinvasive and prognostic factor for lung adenocarcinoma[J].Clin Exp Metastasis,2011,28(5):413-425.
[10]He ZY,Wen H,Shi CB,et al.Up-regulation of hnRNP A1,Ezrin,tubulin β-2C and Annexin A1 in sentinel lymph nodes of colorectal cancer[J].World J Gastroenterol,2010,16(37):4670-4676.
[11]Monastyrskaya K,Babiychuk EB,Draeger A.The annexins:spatial and temporal coordination of signaling events during cellular stress[J].Cell Mol Life Sci,2009,66(16):2623-2642.
[12]D′Acquisto F,Piras G,Rattazzi L.Pro-inflammatory and pathogenic properties of Annexin-A1:the whole is greater than the sum of its parts[J].Biochem Pharmacol,2013,85(9):1213-1218.
[13]Petrella A,Festa M,Ercolino SF,et al.Annexin-1 downregulation in thyroid cancer correlates to the degree of tumor differentiation[J].Cancer Biol Ther,2006,5(6):643-647.
[14]Petrella A,Festa M,Ercolino SF,et al.Induction of annexin-1 during TRAIL-induced apoptosis in thyroid carcinoma cells[J].Cell Death Diffe,2005,12(10):1358-1360.
[15]Fang Y,Guan XY,Cai TH,et al.Knockdown of ANXA1 suppresses the biological behavior of human NSCLC cells in vitro[J].Mol Med Rep,2016,13(5):3858-3866.
[16]Alldridge LC,Bryant CE.Annexin 1 regulates cell proliferation by disruption of cell morphology and inhibition of cyclin D1 expression through sustained activation of the ERK1/2 MAPK signal[J].Exp Cell Res,2003,290(1):93-107.
Influnence of siRNA interfering Annexina A1 expression on apoptosis of papillary thyroid carcinomar TPC-1 cells*
ZhongXuemei1,LinYimin2△,ZhouYuan1,DengShishan3,DingHao1
(1.DepartmentofClinicalMedicine,ChongqingMedicalandPharmaceuticalCollege,Chongqing401331,China;2.DepartmentofClinicalLaboratory,ChongqingCancerInstitute,Chongqing400030,China;3.SchoolofBasicMedicalSciences,NorthSichuanMedicalCollege,Nanchong,Sichuan637000,China)
Objective To investigate the effect of ANX A1 on the biological characteristics of papillary thyroid carcinom cells by interfering with the expression of Annexina A1 (ANX A1) in papillary thyroid carcinoma cells through small interfering RNAs (siRNA).Methods The designed highly efficient siRNA was used to conduct the specific interfence on ANXA1 expression in the papillary thyroid carcinoma TPC-1 cells.The effect of ANXA1 on TPC-1 apoptosis in PTC was observed by flow cytometry.Results The designed siRAN could efficiently inhibit the expression of ANXA1 mRNA in PTC,enhanced the cell apoptosis in TPC-1 cells in vitro.Conclusion siRNA can interfere with the expression of ANXA1 and promote the apoptosis of papillary thyroid carcinoma which suggesting that ANXA1 may be an important biological target for the treatment of papillary thyroid carcinoma.
thyroid neoplasms;papilloma;annexin A1;TPC-1 cells;RNA,small Interfering; apoptosisec
国家自然科学基金资助项目(81172496)。
钟雪梅(1980-),讲师,硕士,主要从事内分泌基础与临床研究。
△通信作者,E-mail:3102175660@qq.com。
10.3969/j.issn.1671-8348.2017.23.004
R736.1
A
1671-8348(2017)23-3180-04
2017-03-10
2017-04-20)
论著·基础研究
