酪酸梭菌对食物过敏小鼠肠道屏障功能的影响*
2017-09-12刘思濛丁一芮白利梅郑鹏远
李 旌,黄 煌,梅 璐,于 泳,刘思濛,丁一芮,白利梅,蒋 杰,郑鹏远
(郑州大学第五附属医院消化科,郑州 450052)
·论 著·
酪酸梭菌对食物过敏小鼠肠道屏障功能的影响*
李 旌,黄 煌,梅 璐,于 泳,刘思濛,丁一芮,白利梅,蒋 杰,郑鹏远△
(郑州大学第五附属医院消化科,郑州 450052)
目的 探讨产丁酸的益生菌酪酸梭菌通过调节肠上皮细胞双孔钾通道Trek1的表达对过敏小鼠肠道屏障功能的影响。方法 建立小鼠食物过敏模型,ELISA法、流式细胞仪检测相关指标验证造模效果,尤斯室检测小肠组织通透性变化,Western blot及免疫荧光法检测Naïve组、Saline组、SIT组、SIT/SB组、SB组、SIT/CB组、CB组、SIT/CB/Spadin组小鼠空肠组织中Trek1的表达;Transwell系统中使用T84细胞建立单层上皮细胞层,分别暴露于过敏介质,qRT-PCR和Western blot检测Trek1 mRNA和蛋白的表达;分别使用生理盐水、SIT、SIT/SB、SB、SIT/CB、CB、SIT/CB/Spadin不同疗法对过敏小鼠进行治疗,了解小鼠肠道Trek1的表达情况、肠道屏障功能及过敏反应指标的变化情况。结果 相对于对照组,食物过敏小鼠小肠Trek1蛋白表达水平显著下降,肠黏膜通透性显著升高,差异有统计学意义(P<0.05);T84细胞暴露于过敏介质后,Trek1 mRNA和蛋白的表达显著下降(P<0.05),但预先加入p38抑制剂可以拮抗这种改变;SIT治疗、酪酸梭菌和丁酸钠单独应用均可以提高食物过敏小鼠肠道Trek1的表达,减轻过敏反应(P<0.05),但SIT与酪酸梭菌或丁酸钠的联合应用效果更加显著(与SIT组相比P<0.05),并且可以显著降低小肠黏膜通透性,改善肠道屏障功能(P<0.05)。结论 丁酸钠或者产丁酸的益生菌酪酸梭菌可以通过提高Trek1的表达来恢复过敏小鼠的肠道屏障功能,减轻过敏反应,并且加强SIT治疗的效果。
食物过敏;Trek1;肠道屏障功能;益生菌
近年来,过敏性疾病的发病率逐渐增高,其中约有8%的儿童和5%的成年人发生过针对某些特定食物抗原的食物过敏。食物过敏是一种Th2细胞因子驱动的免疫紊乱疾病,症状包括腹痛、呕吐、荨麻疹、腹泻等,严重者可发生过敏性休克。肠道屏障功能对于维持机体的免疫稳态有着重要的意义,研究发现食物过敏的婴儿及成人均存在肠道屏障功能受损的现象[1]。肠道屏障功能障碍的主要表现为肠上皮层对大分子物质的通透性增高,可能导致某些食物抗原通过跨细胞途径或细胞间途径通过上皮屏障,从而激活肠道免疫系统,导致肠道过敏的发生[2]。双孔钾通道Trek1(TWIK-related potassium channel-1)定位于上皮细胞,在肺泡上皮细胞[3]、心血管内皮细胞[4]和肠道上皮细胞均有表达[5]。近期有研究表明,Trek1有调整肺泡上皮屏障[3]、中枢神经系统免疫-细胞屏障的功能[6]。益生菌在多种疾病的辅助治疗中都取得了良好的效果,笔者的前期研究发现,产丁酸的酪酸梭菌可显著改善IBS小鼠的肠道屏障功能[7]。基于以上这些研究,笔者推测Trek1有调整肠道屏障功能的作用,食物过敏小鼠肠道Trek1表达可能有异常,酪酸梭菌可通过上调Trek1的表达来改善食物过敏小鼠的肠道屏障功能,减轻过敏反应。
1 材料与方法
1.1 实验动物及主要材料 BALB/c小鼠100只(6~8周龄,20~25 g)购于河南省动物实验中心。小鼠饲养于SPF环境中,随意饮水及进食,12 h日夜循环,动物实验由郑州大学伦理委员会批准。主要材料:酪酸梭菌(#1987252:285-289)由深圳科兴生物有限公司惠赠; T84人结肠上皮细胞系购于上海中科院细胞库;IL-4、IL-5、IL-13 ELISA试剂盒购于美国R&D公司;卵清蛋白(OVA)特异性IgE ELISA试剂盒购于英国AbD Sertec公司;Trek1(C-20)抗体购于Santa Cruz Biotech公司;IL-4、IL-5、IL-13,肥大细胞蛋白酶-1(mMCP-1)和TNF-α重组蛋白购于上海Biomart公司;丁酸钠、p38抑制剂PD169316及辣根过氧化物酶(horseradish peroxidase,HRP)购于美国Sigma公司。
1.2 方法
1.2.1 实验动物分组及干预 (1)食物过敏模型:按照本团队之前建立的方法[8],6~8周龄SPF级BALB/c小鼠随机分为Saline组和Allergy组,每组10只。OVA 0.1 mg和霍乱毒素20 μg溶解于0.3 mL生理盐水中,给予Allergy组BALB/c小鼠灌胃,连续5周。Saline组予等量生理盐水灌胃。过敏效果的检测包括ELISA法测定血清 Th2型细胞因子(IL-4、IL-5、IL-13)及OVA特异性IgE的水平,小肠黏膜上肥大细胞(MC)和嗜酸性粒细胞(EO)计数,以及抗原特异性CD4+T细胞增殖的百分比。(2)抗原特异性免疫疗法(antigen-specific immunotherapy,SIT):按照文献[9]报道方法进行,按以下程序逐渐增加OVA的剂量,将相应剂量OVA加入0.3 mL生理盐水中灌胃,共14 d。第1~2天:0.01 mg;第3~4天:0.05 mg;第5~7天0.10 mg;第8~9天0.25 mg;第10~14天0.50 mg。(3)过敏小鼠的治疗:根据处理方式不同,将小鼠随机分为8组,每组10只。未致敏小鼠为Naïve组,予生理盐水腹腔注射及灌胃。致敏后小鼠分为7组,分别按以下方式干预:Saline组予生理盐水腹腔注射及灌胃;SIT组按上文方法进行处理,生理盐水腹腔注射;SIT/SB组每日SIT处理前予丁酸钠(sodium butyrate,SB)腹腔注射(50 mmol/L溶于0.5 mL生理盐水中);SB组予SB腹腔注射,生理盐水腹腔灌胃;SIT/CB组每日SIT处理前予酪酸梭菌(C.Butyricum,CB)灌胃(109CFU/只,混于0.3 mL生理盐水中);CB组每日予CB灌胃,生理盐水腹腔注射;SIT/CB/Spadin组在每日SIT治疗前,分别给予Trek1拮抗剂Spadin(10 mmol/L溶于0.1 mL生理盐水)腹腔注射和CB灌胃。
1.2.2 小肠黏膜MC及EO计数 小鼠处死后取两块空肠黏膜迅速放入液氮冷冻后制作冰冻切片。冰冻切片使用冷丙酮固定,分别对EO和MC染色。光镜下分别对MC和EO计数,共20个视野,以1 mm2的细胞数计数结果。
1.2.3 抗原特异性的CD4+T细胞增殖功能测定 首先进行免疫细胞分离,小鼠处死后立即取脾脏,按试剂盒说明书使用免疫磁珠对脾脏细胞悬液中的树突状细胞(dendritic cells,DCs)和CD4+CD25-T细胞进行分离。流式细胞仪鉴定细胞纯度大于98%。在分离出的T细胞中加入5 μmol/L CFSE进行标记,将标记过的T细胞与DC细胞按照5∶1的比例混合,在加入了10 μg/mL OVA的培养液中培养72 h。流式细胞仪检测CFSE阳性的细胞。
1.2.4 免疫荧光法检测Trek1的表达 小鼠处死后取空肠组织制作冰冻切片。组织切片使用冷丙酮固定20 min,BSA封闭30 min,一抗室温孵育1 h,异硫氰酸荧光素(FITC)标记的荧光二抗室温孵育1 h,PI染核。每次孵育后使用PBS洗涤3次。甘油封片剂封片,待封片剂凝固后用共聚焦显微镜观察并采集图片。
1.2.5 Western blot检测Trek1的表达 向组织中按比例加入蛋白裂解液,充分匀浆,提取结肠总蛋白,BCA法测蛋白浓度,调整各样本蛋白浓度相等。加等量蛋白于加样孔中,电泳,转膜,丽春红染膜,5%脱脂奶粉封闭,一抗孵育过夜,洗膜,二抗孵育,洗膜,显色。
1.2.6 Real-Time qRT-PCR检测Trek1 mRNA和蛋白的表达 向小鼠空肠组织中加入适量的RNAiso Plus,提取总RNA,按逆转录试剂盒说明合成cDNA。GenBank 获得目的基因mRNA 全长序列,利用 Primer5.0设计引物序列,经局部序列比对基本检索工具(BLAST)分析证实引物序列具有特异性。以β-actin为内参照,引物序列:Trek1:上游5′-CAA TTC GAC GGA GCT GGA TG-3′;下游5′-CTT CTG TGC GTG GTG AGA TG-3′。β-actin:上游5′-CGC AAA GAC CTG TAT GCC AA-3′;下游5′-CAC ACA GAG TAC TTG CGC TC-3′。使用TOYOBO的SYBR Green Realtime PCR Master Mix试剂盒,ABI 7500 fast Real-time PCR系统,循环条件为:95 ℃预变性60 s,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s;共40个循环。以目的基因与β-actin的2-△△CT的比值表示Trek1的表达水平。本实验重复3次。
1.2.7 T84单层上皮细胞培养 人结肠上皮细胞系T84细胞使用DMEM培养基培养(含10%胎牛血清、100 U/mL青霉素、0.1 mg/mL的链霉素、2 mmol/L L-谷氨酰胺)4~6 d,收集细胞,以106cells/mL的密度种植于无包被的0.4 μm的Millpore transwell细胞跨膜培养系统, Millicell-ERS电阻测量仪检测T84细胞层的跨膜电阻TER,当TER≥1 000 Ω/cm2时提示细胞条件成熟,可进行后续实验。
1.2.8 CB的培养 CB冻干菌粉使用含10 g葡萄糖,10 g蛋白胨,2 g KH2PO4,0.5 g酵母提取物,0.5 g MgSO4·7H2O和1 g L-半胱氨酸的肉汤培养基,37 ℃恒温厌氧培养过夜。使用前将菌液以8 500×g的转速离心10 min,收集沉淀,PBS洗涤3次,加入生理盐水制成悬液。每只小鼠以1×109CFU/只的剂量灌胃。
1.2.9 尤斯室测定肠道屏障功能 小鼠处死后,取小肠组织,去除肌层及浆膜,固定于0.3 cm2的有机玻璃夹中,装入尤斯室灌流系统。向系统中注入Kreb′s液,并在浆膜面加入10 mmol/L的葡萄糖作为能量来源,黏膜面加入10 mmol/L的甘露醇平衡渗透压。组织放入尤斯室后平衡30 min,待短路电流(Isc)稳定后,开始记录Isc、组织电导率(G)。同时,在黏膜面加入10-5mol/L的HRP(44×103)作为蛋白探针,每30分钟取浆膜面样品0.5 mL测定HRP活性,共2 h。
1.2.10 HRP流量采用修正的Worthington法测定[10]150 μL待测样品加入800 μL含0.003% H2O2和80 μg/mL邻联茴香胺的PBS中。分光光度计测出460 nm处的A值,代表HRP酶的活性。通过公式计算出HRP流量,以pmol·cm-2·h-1表示。
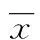
2 结 果
2.1 食物过敏小鼠小肠Trek1表达下调,肠道屏障功能受损 本研究成功建立了肠道致敏的小鼠模型, 表现为:Allergy组小鼠的血清Th2型细胞因子IL-4、IL-5、IL-13水平和血清特异性IgE、小肠组织MC和EO计数、特异性CD4+T细胞增殖的百分比均显著高于Saline组(P<0.05)(图1A~D)。Western blot检测Allergy组小鼠小肠上皮Trek1蛋白表达水平显著低于Saline组(P<0.05),免疫荧光检测Allergy组小鼠小肠上皮组织中Trek1蛋白表达水平显著低于Saline组(图1E~G)。肠道屏障功能的检测在尤斯室内进行,以Isc、G反映肠道黏膜通透性,以HRP流量来反映肠道对大分子物质的通透性。尤斯室中记录的Allergy组小鼠的Isc、G以及各时间段HRP流量均显著高于Saline组,尤斯室中记录的Allergy组小鼠的Isc、G以及各时间段HRP流量均显著高于Saline组(图1 H~K)。
2.2 过敏介质通过p38 MAPK途径抑制T84结肠上皮细胞Trek1的表达 在T84细胞的培养液中分别加入IL-4(520 ng/mL),IL-5(530 ng/mL),IL-13(550 ng/mL),小鼠mMCP-1(520 ng/mL)或TNF-α(510 ng/mL)培养72 h,设置阴性对照(Saline)和无关蛋白对照(BSA)。暴露于这5种细胞因子中的任意一种,均可以显著降低T84细胞Trek1 mRNA和蛋白的表达(P<0.05),见图2。在培养液中预先加入了p38抑制剂(PD169316,25μmol/L)后,重复上述实验过程,结果Trek1 mRNA和蛋白的表达与对照组差异无统计学意义(P>0.05)。
2.3 酪酸梭菌可上调食物过敏小鼠肠道Trek1的表达 为了模仿临床患者的脱敏过程,对小鼠进行了SIT治疗。通过检测Naïve组、Saline组、SIT组、SIT/SB组、SB组、SIT/CB组、CB组、SIT/CB/Spadin组血清Th2型细胞因子、血清抗原特异性IgE、小肠组织中MC,EO和抗原特异性CD4+T细胞增殖功能,结果提示与Saline组相比,CB、SB、SIT单独治疗均可提高过敏小鼠肠道Trek1的表达并减轻过敏反应(P<0.05),但SIT与CB或SB的联合治疗效果更加显著(与SIT组相比,P<0.05)。将Trek1抑制剂spandin与SIT与CB合用后,结果SIT与CB的联合治疗对过敏的抑制作用消失。
2.4 酪酸梭菌治疗显著改善食物过敏小鼠肠道屏障功能 与Saline组相比,两个联合治疗组SIT/SB组、SIT/CB组的Isc、G以及0~30 min,30~60 min,60~90 min的HRP流量均显著降低(P<0.05),见图3。

A:血清Th2型细胞因子检测(ELISA);B:血清抗原特异性IgE检测(ELISA);C:小肠组织中MC和EO计数;D:抗原特异性CD4+T细胞增殖功能测定(FCM);E:小肠上皮Trek1蛋白表达(Western blot);F~H:检测小肠上皮组织Trek1蛋白表达(免疫荧光)。I:小肠组织Isc测定;J:小肠组织G测定;K:各时段HRP流量测定;a:P<0.05,与Saline组比较
图1 建立小鼠食物过敏模型前后的病例变化

A:Trek1 mRNA检测(qRT-PCR);B:Trek1蛋白检测(Western blot);a:P<0.05,与Saline组比较
图2 过敏介质及p38抑制剂对Trek1表达的影响
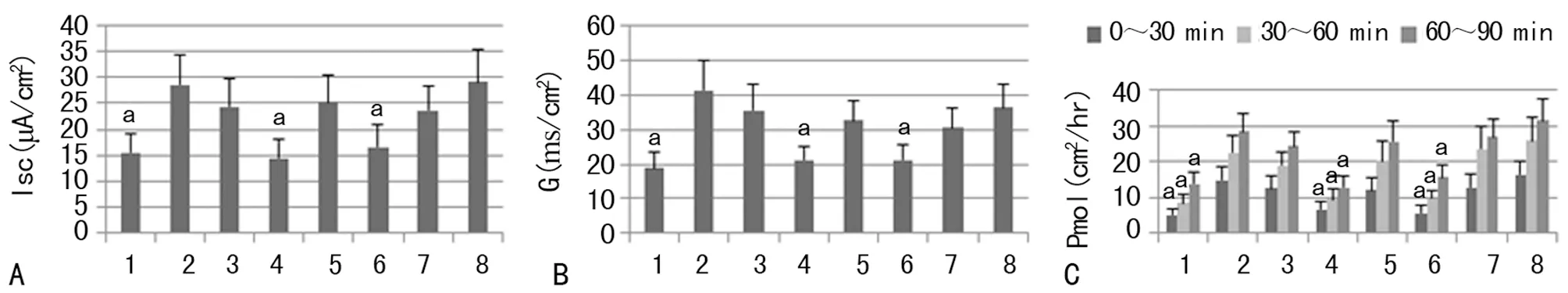
A:小肠组织Isc测定;B:小肠组织G测定;C:各时段HRP流量测定;1:Naïve组;2:Saline组;3:SIT组;4:SIT/SB组;5:SB组;6:SIT/CB组;7:CB组;8:SIT/CB/Spadin组;a:P<0.05,与Saline组比较
图3 尤斯室试验
3 讨 论
近20年来,食物过敏的发病率在全球范围内迅速增高,出现这种情况的原因尚不明确,导致对于食物过敏的治疗方法非常有限。而肠道屏障功能对于维持免疫稳态有着重要的意义,肠道屏障功能障碍可能是食物过敏病理生理过程中的中心环节。影响肠道屏障功能的因素众多,所以找到一个有效的治疗靶点至关重要。本研究发现,食物过敏小鼠肠道上皮细胞Trek1的表达下降,肠道通透性增高;过敏介质是通过抑制p38 MAPK途径来抑制T84结肠上皮细胞层Trek1的表达的;酪酸梭菌及其代谢产物丁酸钠均可上调过敏小鼠小肠上皮细胞Trek1的表达,从而改善肠道上皮屏障功能,并减轻过敏反应。
Trek1是一种双孔钾离子通道,研究表明其与多种屏障功能相关。Roan等[3]报道Trek1可以调节牵拉导致的肺泡上皮细胞层的损伤。Bittner等[6]的研究表明Trek1对于维持血脑屏障的功能有重要的意义。还有研究表明,小鼠结肠背侧神经节的神经元表达机械敏感性Trek1通道,Trek1活性的下降可使结肠的机械敏感性增强,最终导致肠道炎症的发生[11]。本研究发现,一系列过敏介质(IL-4、IL-5、IL-13、TNF-α、mMCP-1)均可抑制Trek1的表达,进而导致肠道屏障功能障碍。此结果表明Trek1可能是肠道过敏发生过程中的关键因素。
为了改善肠道屏障功能,研究者已发现了一些很有潜力的治疗方法。比如使用TNF-α抗体阿达木单抗对T84和Caco-2单层上皮细胞进行干预,可以抑制肌球蛋白轻链的磷酸化及p38 MAPK信号系统、NF-κB的激活,从而改善TNF-α导致的肠道屏障功能障碍[12]。Colgan等[13]发现暴露于IL-4可导致结肠上皮屏障功能障碍,用IL-4抗体和IL-4受体抗体处理后,可显著拮抗这一现象。然而,参与过敏反应发生的是一系列促炎因子,仅仅干预一种或两种细胞因子的作用意义不大,所以找到一个共同的作用点对于改善肠道屏障功能障碍有重要的意义。本研究发现过敏介质均可以通过p38 MAPK途径抑制上皮细胞中Trek1的表达,所以Trek1是过敏介质共同的作用对象,是潜在的治疗靶点,这对于肠道过敏的治疗有着重要的意义。
酪酸梭菌又称酪酸梭状芽孢杆菌,是一种专性厌氧的革兰阳性芽孢杆菌。酪酸梭菌制剂为新一代芽孢类微生态制剂,对胃酸和温度有更好的耐受性,可以常温保存,能和某些抗生素联合使用。酪酸梭菌的主要代谢产物丁酸是可促进肠道上皮细胞再生和修复主要营养物质。酪酸梭菌在治疗腹泻、抗生素相关性肠炎、新生儿黄疸中已取得了良好的效果。笔者前期研究也表明,酪酸梭菌能够上调应激小鼠肠道上皮细胞occludin、zo-1、claudin-1的表达,改善小鼠肠道屏障功能[14]。本研究中,为了模仿临床患者的脱敏治疗,给予了过敏小鼠SIT治疗。而单独给予SIT治疗改善了过敏小鼠的上皮屏障功能和过敏反应,单独使用酪酸梭菌或者丁酸钠也是如此。但给予过敏小鼠SIT和酪酸梭菌或者SIT和丁酸钠联合治疗,肠道Trek1蛋白的表达显著上调,并且明显修复了肠道屏障功能,同时SIT抑制肠道过敏反应也显著增强。为了解酪酸梭菌或者丁酸钠改善肠道屏障和过敏反应的作用是否是通过上调Trek1实现的,在联合治疗中加入了Trek1的抑制剂spadin,发现抑制过敏反应和改善肠道屏障功能的作用被拮抗了,这个现象提示Trek1是酪酸梭菌治疗的作用靶点,酪酸梭菌可通过提高Trek1的表达显著降低肠道上皮屏障的通透性,进而改善过敏反应。
综上所述,小鼠肠道上皮细胞表达Trek1,抑制Trek1的表达会导致肠道上皮屏障障碍。暴露于过敏介质会抑制上皮细胞Trek1的表达。酪酸梭菌辅助SIT治疗能够上调肠道上皮细胞Trek1的表达,最终修复受损的肠道屏障功能,并且抑制肠道过敏反应。这对食物过敏的益生菌治疗提供了有力的依据,开拓了新的思路。
[1]Groschwitz KR,Hogan SP.Intestinal barrier function:molecular regulation and disease pathogenesis[J].J Allergy Clin Immunol,2009,124(1):3-20.
[2]Weber CR.Dynamic properties of the tight junction barrier[J].Ann N Y Acad Sci,2012,1257(1):77-84.
[3]Roan E,Waters CM,Teng B,et al.The 2-pore domain potassium channel TREK-1 regulates stretch-induced detachment of alveolar epithelial cells[J].PLoS One,2014,9(2):e89429.
[4]Hund TJ,Snyder JS,Wu X,et al.beta(IV)-Spectrin regulates TREK-1 membrane targeting in the heart[J].Cardiovasc Res,2014,102(1):166-175.
[5]Gil V,Gallego D,Moha OMH,et al.Relative contribution of SKCa and TREK1 channels in purinergic and nitrergic neuromuscular transmission in the rat colon[J].Am J Physiol Gastrointest Liver Physiol,2012,303(3):G412-423.
[6]Bittner S,Ruck T,Schuhmann MK,et al.Endothelial TWIK-related potassium channel-1 (TREK1) regulates immune-cell trafficking into the CNS[J].Nat Med,2013,19(9):1161-1165.
[7]王玉玉,郑鹏远,陈东晖,等.双歧杆菌、酪酸梭菌及谷氨酰胺对慢性应激模型小鼠肠黏膜屏障的影响[D].郑州大学学报,2014.
[8]Liu ZQ,Wu Y,Song JP,et al.Tolerogenic CX3CR1+ B cells suppress food allergy-induced intestinal inflammation in mice[J].Allergy,2013,68(10):1241-1248.
[9]Zhang HP,Wu Y,Liu J,et al.TSP1-producing B cells show immune regulatory property and suppress allergy-related mucosal inflammation[J].Sci Rep,2013,3:3345.
[10]Yang PC,Jury J,Soderholm JD,et al.Chronic psychological stress in rats induces intestinal sensitization to luminal antigens[J].Am J Pathol,2006,168(1):104-114.
[11]La JH,Gebhart GF.Colitis decreases mechanosensitive K2P channel expression and function in mouse colon sensory neurons[J].Am J Physiol Gastrointest Liver Physiol,2011,301(1):G165-174.
[12]Fischer A,Gluth M,Pape UF,et al.Adalimumab prevents barrier dysfunction and antagonizes distinct effects of TNF-alpha on tight junction proteins and signaling pathways in intestinal epithelial cells[J].Am J Physiol Gastrointest Liver Physiol,2013,304(11):G970-979.
[13]Colgan SP,Resnick MB,Parkos CA,et al.IL-4 directly modulates function of a model human intestinal epithelium[J].J Immunol,1994,153(5):2122-2129.
[14]陈东晖,于泳,刘志强,等.酪酸杆菌联合谷氨酰胺对应激小鼠肠道紧密连接蛋白表达的影响[J].中华消化杂志,2014,34(8):544-549.
Effects of clostridium butyricum on intestinal barrier function in food allergic mice*
LiJing,HuangHuang,MeiLu,YuYong,LiuSimeng,DingYirui,BaiLimei,JiangJie,ZhengPengyuan△
(DepartmentofGastroenterology,FifthAffiliatedHospital,ZhengzhouUniversity,Zhengzhou,Henan450052,China)
Objective To investigate that butyrate-producing probiotic clostridium butyricum improves the intestinal epithelial barrier function in food allergic mice by regulating TWIK-related potassium channel-1(Trek1) expression in intestinal epithelial cells.Methods An intestinal allergy mouse model was created,then the model construction effect was verified by detecting the related indicators by ELISA,flow cytometer.The change of small intestinal tissue permeability was detected by the Ussing chambers.The Trek1 expressions in mouse jejunum tissue in control group and allergy group were detected by Western blot and immunofluorescent method;in the Transwell system,T84 cells were used to establish epithelial cellular monolayer for exposing to the allergic mediators,the Trek1 mRNA and protein expression were detected by qRT-PCR and Western blot.Then the allergic mice were grouped and treated by different methods including normal saline,SIT,SIT/SB,SB,SIT/CB,CB,SIT/CB/Spadin,the expression of mice intestinal Trek1,intestinal barrier function and allergic reaction indicators were detected.Results Compared with the control group,the small intestinal Trek1 protein and tissue expression level in the food allergic mice were significantly decreased,the intestinal mucosal permeability was significantly increased,the differences were statistically significant(P<0.05);after T84 cells exposing to the allergic mediators,Trek1 mRNA and protein expression were significantly decreased(P<0.05),but adding p38 inhibitor in advance could antagonize this change;the single use of SIT,clostridium butyricum and sodium butyrate could increase the intestinal Trek1 expression in food allergic mice,and alleviated the allergic reaction(P<0.05),whereas the combined use of SIT and clostridium butyricum or sodium butyrate had more significant effect(compared with the SIT group,P<0.05),moreover could significantly decrease small intestinal mucosal permeability and improved the intestinal barrier function(P<0.05).Conclusion Sodium butyrate or butyrate-producing probiotic clostridium butyricum can restore the intestinal barrier function,alleviates the allergic reaction and strengthens the SIT curative effect in allergic mice by increasing Trek1 expression.
food hypersensitivity;Trek1;epithelial barrier;probiotics
10.3969/j.issn.1671-8348.2017.22.002
国家自然科学基金资助项目(81370494);国家973计划前期研究专项(2011CB512006) ;河南省科技创新杰出人才基金(134200510022);郑州市创新型科技人才队伍建设工程基金(131PLJRC656)。 作者简介:李旌(1990-),在读硕士,主要从事胃肠道感染与免疫的研究。△
,E-mail:medp7123@126.com。
R574.4
A
1671-8348(2017)22-3028-05
2016-12-18
2017-03-06)
