不同进展速度兔腹主动脉瘤的PET/CT活体成像研究
2017-09-12李昕禾赵全明聂毛晓闫云峰冯婷婷赵欣张学慧
李昕禾,赵全明,聂毛晓,闫云峰,冯婷婷,赵欣,张学慧
· 论著 ·
不同进展速度兔腹主动脉瘤的PET/CT活体成像研究
李昕禾1,赵全明1,聂毛晓1,闫云峰1,冯婷婷1,赵欣1,张学慧1
目的 探讨PET/CT用于评估腹主动脉瘤(AAA)进展速度的价值及其机制。方法 成年新西兰雄性大白兔30只,随机抽签分为两组,A组动脉瘤组(15只),B组高血压动脉瘤组(15只),均采用高浓度弹力蛋白酶(100 IU/ml)在腔内灌注的方法制备肾下AAA模型。B组于手术成功后次日起持续以1000 ng/(kg·min)速度泵注AngⅡ。监测血压,超声动态随访,观察血清单核细胞趋化蛋白(MCP-1)、基质金属蛋白酶(MMP9、MMP2),对比术后14 d时PET/CT扫描平均标准化摄取值(SUVmean)结果。PET/CT后,两组各处死10只家兔,留取瘤体组织观察病理改变(HE、弹力纤维EVG、胶原纤维masson)及测定巨噬细胞(CD68)、基质金属蛋白酶(MMP9)。结果 与A组比较,B组家兔血压明显升高,术后14 d时动脉瘤增长速度明显快于A组,血清MMP9、MMP2,免疫组化CD68、MMP9结果均增加,差异有统计学意义(P<0.01),而两组间血清MCP-1差异无统计学意义。病理结果显示A组动脉壁组织层次较为紊乱,弹力纤维变细、断裂、碎片及空泡形成,胶原纤维增多;B组动脉壁组织层紊乱,相比于A组弹力纤维断裂、破碎程度较重。PET/CT方面,相较于A组,B组瘤体部位SUVmean升高明显(P<0.01),相关性分析显示SUVmean值与巨噬细胞阳性累积光密度值(IOD)(r=0.751,P<0.01)及MMP9 IOD(r=0.597,P<0.05)呈正相关。结论 PET/CT可以客观反映腹主动脉瘤局部炎症浸润状态,并可通过SUVmean值定性评估腹主动脉瘤的进展速度。
PET/CT;腹主动脉瘤;兔模型;进展速度
腹主动脉瘤(abdominal aortic aneurysm,AAA)是指腹主动脉某一段的异常扩张或局限性膨胀程度大于原正常动脉内径的50%,因其有较高潜在致死率而被大家关注[1,2]。目前临床判断动脉瘤风险大小仍主要以瘤体直径为标准,但已有很多临床资料表明瘤体直径较小的腹主动脉瘤同样会发生破裂[3]。因此,单纯依据AAA直径大小不足以满足AAA的诊断及治疗需求。近年来以18F-脱氧葡萄糖(18F-FDG)为显像剂的PET/CT技术可反应局部组织炎性活动[4],为AAA的诊断提供了新的方向。已有研究显示AAA管壁对18F-FDG摄取率明显增高[5],而对于不同进展速度的AAA局部18F-FDG摄取率有无变化,能否为临床诊断提供参考尚缺乏相关研究。本文通过建立不同进展速度的兔AAA模型并对其进行系统的PET/CT活体成像研究,探讨PET/CT用于评估AAA进展速度的价值及其机制。
1 材料和方法
1.1 实验材料 健康新西兰雄兔30只(北京市海淀区兴旺动物养殖场,许可证号:SCXK(京)2006-0006),体重(2.50±0.20)kg,自由摄食和进水,独笼饲养;浓度为100 U/ml的猪胰弹力蛋白酶溶液(45124,美国Sigma-aldrich公司产品);血管紧张素Ⅱ(AngⅡ美国Sigma公司产品),0.9%氯化钠(山东华鲁制药有限公司产品),4F Forgaty双腔球囊导管(北京生命绿洲科技有限责任公司),EVG染色、马松染色、CD68染色试剂盒(武汉谷歌生物科技公司),戊巴比妥钠(Bioszune公司,USA),肝素钠注射液(北京双鹤药业有限公司),GE Discovery ST16 型 PET/CT(美国通用电气公司),彩超仪(荷兰飞利浦公司),正置光学显微镜(日本尼康),多普勒流量检测仪(美国派克医用电子公司),基质金属蛋白酶(MMP9、MMP2)及血清单核细胞趋化蛋白(MCP-1)ELISA试剂盒(上海岚派生物科技有限公司,中国)。
1.2 实验方法
1.2.1 建立模型 对30只动物进行编号,采用抽签法按照1:1比例将动物随机分为两组,A组15只,为动脉瘤组,腔内灌注弹力蛋白酶制备肾下型AAA模型;B组15只,为高血压动脉瘤组,腔内灌注弹力蛋白酶制备肾下型AAA模型后皮下植入渗透性微泵,泵注AngII。模型建立过程:①所有试验动物严格无菌操作。②游离股总动脉约0.5~1 cm。③打开腹腔,游离肾下腹主动脉段约1.5~2.0 cm。④经股动脉将导管送入游离出的主动脉段内,将腹主动脉近心端用动脉夹+橡胶滤线阻断,远心端用橡胶滤线阻断,形成与导管相通的封闭官腔,⑤通过双腔导管加压150 kPa将100 IU/ml的猪胰弹力蛋白酶溶液注入动脉腔内,灌注保持10 min后抽回溶液,经副管注入肝素盐水反复盥洗动脉腔。⑥恢复主动脉血流,缝合关腹。⑦B组实验家兔,局麻后肩胛区皮下植入内涵AngII的渗透性微泵[以1000 ng/(kg·min)速度释放],缝合手术切口。⑧术后给予青霉素80万U/只,连续腹腔注射3 d。
1.2.2 血压结果 自术前3 d起开始规律测量实验家兔血压,于每日18时应用多普勒流速测定仪测量兔前肢血压,每只每次测量3次,记录平均值。
1.2.3 彩超检查 分别进行矢状位及横位检查,测量管腔扩张最大直径,取平均值作为该实验动物瘤体直径,并计算腹主动脉扩张率:腹主动脉平均内径=(瘤上端内径+瘤下
端内径)/2;扩张率=(腹主动脉瘤内径-腹主动脉平均内径)/腹主动脉平均内径;腹主动脉瘤增长率=其后一周动脉瘤扩张率-前一周动脉瘤扩张率。
1.2.4 血清ELISA检测 分别于术前、术后2周时行耳缘静脉采血,分离血清,用ELISA试剂盒检测样本血清MMP-2、MMP-9及MCP-1实际浓度。
1.2.5 18F-FDG PET/CT扫描及后期处理 术后2周进行PET/CT扫描,扫描前动物禁食水4 h,经耳缘静脉注射18F-FDG(1mCi/kg)。注射显像剂120 min后行腹腔内麻醉,先行CT平扫定位,然后开始PET图像采集,根据家兔体重、18F-FDG注射量及药物代谢时间选定区域的SUVmean。
1.2.6 标本病理染色 石蜡包埋及组织切片后行MMP9及CD68巨噬细胞染色、弹力纤维染色(EVG染色)、马松染色(Masson染色);免疫组化染色测定应用Image-Pro Plus 6.0软件选取相同的棕黄色作为判断所有照片阳性的统一标准,测定每张照片阳性的累积光密度值(IOD)。
1.2.7 统计学分析 使用SPSS 20.0进行统计分析。计量资料以均数±标准差表示。组间的比较,若方差齐,则采用两独立样本t检验;方差不齐时,采用两独立样本校正t检验。相关性分析采用Pearson相关。检验设定为双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 血压结果 B组家兔于持续AngII泵注,2 d后血压开始升高,4 d后达到高点并稳定,与A组间差异有统计学意义差异(P<0.01,表1)。
2.2 超声结果 两组实验动物术后2周超声检查均显示有动脉瘤形成,成瘤率为100%。随访发现A组动脉瘤扩张率分别为:50%(1周)、84%(2周)、88%(3周),B组动脉瘤扩张率分别为:53%(1周)、98%(2周)、118%(3周);2周后A组动脉瘤趋于稳定,增长率为4.3±0.8%,B组仍有较快增长,速率为20.2±5.4%,差异有统计学意义差异(P<0.05)(图1,表2)。

表1 两组试验家兔血压随访情况(x±s)

图1 两组动脉瘤同时期超声随访(横断面)
2.3 血清ELISA结果 与自身术前对照,A组动脉瘤组与B组高血压动脉瘤组间MMP9、MMP2及MCP-1术后2周数值均升高,差异有统计学有意义(P<0.05);组间比较,高血压动脉瘤B组2周血清MMP9、MMP2结果较A组均增加,差异有统计学有意义(P<0.01),而血清MCP-1间差异无统计学意义,见表3。
2.4 病理学及免疫组织学结果 2周病理结果示A、B组均可见HE示动脉壁结构破坏,中膜平滑肌排列紊乱EVG示弹力纤维层次不清,曲度变直,可见断裂、变细、碎片、缺如及空泡形成。Masson染色示中膜原弹力纤维区域及外膜胶原纤维增多。相比于A组,B组弹力纤维断裂、破碎程度较重,见图2。免疫组织化学染色结果示,A组巨噬细胞阳性染色累积光密度值(IOD)为5624.5±985.9,B组巨噬细胞阳性染色累积光密度值(IOD)为8936.9±1020.6,两组差异有统计学意义(P<0.001)。A组MMP9阳性染色累积光密度值(IOD)为4715.8±948.9,B组MMP9阳性染色累积光密度值(IOD)为6921.0±908.0,两组差异有统计学意义(P<0.001),见图3。
2.5 PET/CT结果分析 术后2周A组15只家兔,B组15只家兔,全部顺利完成PET/CT影像学检查。两组实验动物手术部位均可见腹主动脉局限性扩张,达到腹主动脉瘤诊断标准。经PET/CT后台处理系统定量及统计学分析显示,A组SUVmean为0.79±0.08,B组SUVmean为1.13±0.14,B组FDG摄取率明显高于A组,差异有统计学有意义(P<0.001)。

表2 实验动物超声随访结果

表3 两组实验家兔血清MMP9、MMP2、MCP-1结果

图2 常规病理染色

图3 免疫组化染色
2.6 数据的相关性分析
2.6.1 腹主动脉瘤段SUVmean与同一动脉段CD68染色累积光密度值的相关性分析显示:r=0.751,P<0.01,二者呈显著线性正相关,见图4。
2.6.2 腹主动脉瘤段SUVmean与同一动脉段MMP9染色累积光密度值的相关性分析显示:r=0.597,P<0.05,二者呈正相关,见图5。
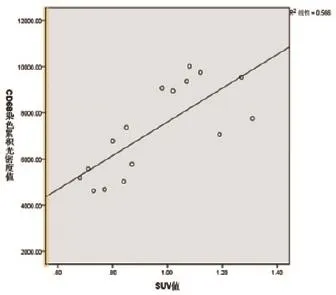
图4 动脉段SUVmean与该动脉段CD68染色累积光密度值的相关性分析
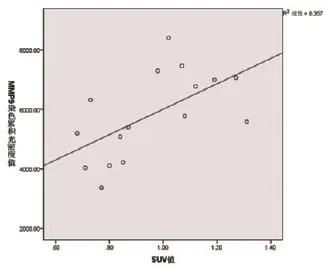
图5 动脉段SUVmean与该动脉段MMP9染色累积光密度值的相关性分析
3 讨论
本实验成功制造两组不同进展速度的AAA模型,对比发现,在AAA形成过程中其外周血中MMP9及MMP2水平均有所升高,且在进展快速的高血压动脉瘤组升高幅度更大;同时与进展速度缓慢的动脉瘤组比较,进展较快的高血压动脉瘤组PET/CT下动脉瘤局部SUVmean值更高,局部组织炎症反应明显,CD68、MMP9阳性累积光密度值显著高于进展速度较慢的动脉瘤组。相关性分析显示SUVmean值与动脉瘤局部CD68及MMP9阳性累积光密度值正相关。经本实验表明PET/CT可用于诊断评估AAA,通过测定动脉瘤管壁SUVmean值可反应AAA的进展速度,对临床预测动脉瘤破裂风险及早期治疗提供一定帮助。
AAA发生发展的危险因素有很多,近年研究者们发现炎症反应贯穿着动脉瘤发生发展全程,包括单核巨噬细胞在内的多种炎症细胞通过释放炎性因子,分泌组织蛋白酶和基质金属蛋白酶(如MMP-12、MMP-2及MMP-9)等降解酶[6,7],影响动脉壁结构自我再塑过程,动脉壁弹力纤维降解,中膜平滑肌细胞凋亡,最终使动脉壁变薄[8],无法抵抗主动脉内压力而导致AAA破裂。
18F-FDG作为一种PET显像示踪剂,可被巨噬细胞大量摄取,并随着巨噬细胞的趋附在炎症部位大量累积。PET/CT可定量显示局部组织积累FDG的剂量,反映病变部位的炎症水平[9,10]。早在2002年有法国学者尝试运用PET观察人AAA,并在瘤附近发现FDG高摄取,初步证实PET具有反映腹主动脉瘤瘤壁组织代谢活性的能力[11]。Laure等也通过大鼠AAA模型结合病理证实SUV摄取值与炎症细胞浸润程度呈正相关,显示PET技术可用于反应AAA局部的炎症状态[12],这一结果也在本实验中进一步得到证实。
值得关注的是,本实验通过制造两组进展速度不同的AAA发现在进展较快的动脉瘤局部聚集有更多的巨噬细胞,PET/CT技术所测局部SUV摄取值明显高于进展速度缓慢的AAA,且SUV值与局部巨噬细胞数量及MMP9都存在正相关性,该技术可评估AAA的进展速度,预测破裂风险。此前国际上就有学者提出PET/CT可能通过反应炎症状态进而用于预测AAA的进展。Reeps等[13]对AAA患者术前进行PET/CT扫描,并将扫描结果与手术获得的人AAA标本进行相关性分析,发现PET/CT可精确测算管壁的炎症程度,且在存在相关症状的腹主动脉瘤患者,其瘤壁摄取率显著高于无相关症状的患者(P<0.001)。Sakalihasan等在对26例腹主动脉瘤患者进行PET/CT扫描后随访中发现,PET结果阳性的10例患者中,5例出现相关临床症状,3例出现动脉瘤增大、突发破裂,剩余2例无症状出现,而其余16例PET显示阴性患者再观察期间未见不良反应出现[14]。据此结果作者们均认为AAA局部炎症程度与其发展存在正相关性,FDG-PET/CT技术可以用于评估腹主动脉瘤的进展风险。本实验通过建立动物模型结合病理组织分析客观证实了通过观测FDG-PET/ CT技术下SUV摄取值高低可反应腹主动脉瘤的进展速度这一观点,为PET/CT在AAA风险评估领域的应用提供理论支持。
但同时,国际上目前对FDG-PET/CT技术在评估AAA进展领域的应用价值尚存在争议。Kotze等曾对经全血管PET/CT扫描的AAA患者进行为期1年的US监测,却发现血管平均FDG摄取率较低的腹动脉瘤扩张速率更大,破裂风险更高[15,16]。Tegler等[17]以手术前AAA患者为研究对象,通过对手术切除的动脉瘤组织进行病理观察,发现存在大量炎症细胞浸润,但PET/CT并没有显示FDG摄取增高。但Marini等[18]近期的研究却给出了另外一种可能,该研究发现动脉壁结构破坏、平滑肌细胞减少可严重影响FDG摄取,因此在AAA进展的晚期或终末状态,当动脉壁结构已被严重破坏的情况下,很可能存在PET/CT与炎症无法对应的情况。本实验并未对破裂前期的AAA进行PET/ CT扫描,故对于AAA病程终末阶段的PET/CT应用价值尚有待于进一步研究。
综上所述,PET/CT可以客观反映腹主动脉瘤局部炎症浸润状态,并可通过SUV摄取值评估腹主动脉瘤的进展速度。但因腹主动脉瘤病程复杂,对于AAA病程终末阶段的PET/CT应用价值尚有待于进一步研究。
[1] 周晓雯,郭立. 腹主动脉瘤的影像诊断及进展[J]. 医学综述,2014,20(17):3204-6.
[2] Michel JB,Martin-Ventura JL,Egido J,et al. Novel aspects of the pathogenesis of aneurysms of the abdominal aorta in humans[J]. Cardiovascular research,2011,90(1):18-27.
[3] Vorp DA. Bio-mechanics of abdominal aortic aneurysm[J].Biomech, 2007,40:1887-902.
[4] Szanda I,Mackewn J,Patay G,et al. National Electrical Manufacturers Association NU-4 performance evaluation of the PET component of the NanoPET/CT preclinical PET/CT scanner[J]. Journal of nuclear medicine:official publication.Society of Nuclear Medicine,2011,52 (11):1741-7.
[5] Truijers M,Kurvers HA,Bredie SJ,et al. In vivo imaging of abdominal aortic aneurysms: increased FDG uptake suggests inflammation in the aneurysm wall[J]. Journal of endovascular therapy : an official journal of the International Society of Endovascular Specialists,2008,15(4):462-7.
[6] Eliason JL,Hannawa KK,Ailawadi G,et al. Neutrophil depletion inhibits experimental abdominal aortic aneurysm formation[J]. Circul ation,2005,112(2):232-40.
[7] Li DY,Zhang Q,Che Y,et al. [Effects of macrophage infiltration and related gene expression on the pathogenesis of early abdominal aortic aneurysm][J]. Zhonghua yi xue za zhi,2003,83(18):1624-7.
[8] Wang Q,Ren J,Morgan S,et al. Monocyte chemoattractant protein-1(MCP-1)regulates macrophage cytotoxicity in abdominal aortic aneurysm[J]. PloS one,2014,9(3):920-53.
[9] Choke E,Thompson MM,Dawson J,et al. Abdominal aortic aneurysm rupture is associated with increased medial neovascularization and overexpression of proangiogenic cytokines[J]. Arterioscler Thromb Vasc Biol,2006,4:129-49.
[10] Davidson JM,Montilla-Soler JL,Broussard E. F-18 FDG PET-CT imaging of a mycotic aneurysm[J]. Clin Nucl Med,2005,30:483-7.
[11] Sakalihasan N,Van Damme H,Gomez P,et al. Positron emission tomography (PET) evaluation of abdominal aortic aneurysm (AAA)[J]. Eur J Vasc Endovasc Surg,2002,23:431-6.
[12] Courtois A,Nusgens BV,Hustinx R,et al. 18F-FDG uptake assessed by PET/CT in abdominal aortic aneurysms is associated with cellular and molecular alterations prefacing wall deterioration and rupture[J]. Journal of nuclear medicine : official publication, Society of Nuclear Medicine,2013,54(10):1740-7.
[13] Reeps C,Essler M,Pelisek J,et al. Increased 18F-fluorodeoxyglucose uptake in abdominal aortic aneurysms in positron emission/computed tomography is associated with inflammation, aortic wall instability, and acute symptoms[J]. Vasc Surg,2008,48:417-23.
[14] Sakalihasan N,Hustinx R,Gomez P,et al. Can positron emission tomography (PET) predict the risk of rupture of abdominal aortic aneurysm (AAA)? In: Controversies and updates in vascular surgery 2008. Torino, Italy: Ed. Minerva Medica,2008,3:15-22.
[15] Barwick TD,Lyons OT,Mikhaeel NG,et al. 18F-FDG PET-CT uptake is a feature of both normal diameter and aneurysmal aortic wall and is not related to aneurysm size[J]. Eur J Nucl Med Mol Imaging,2014,41 (12):2310-8.
[16] English SJ,Piert MR,Diaz JA. Increased 18F-FDG uptake is predictive of rupture in a novel rat abdominal aortic aneurysm rupture model[J]. Ann Surg,2015,261(2):395-404.
[17] Tegler G,Ericson K,Sorensen J,et al. Inflammation in the walls of asymptomatic abdominal aortic aneurysms is not associated with increased metabolic activity detectable by 18-fluorodeoxglucose positron-emission tomography[J]. Journal of vascular surgery,2012,5 6(3):802-7.
[18] Marini C,Morbelli S,Armonino R,et al. Direct relationship between cell density and FDG uptake in asymptomatic aortic aneurysm close to surgical threshold: an in vivo and in vitro study[J]. European journal of nuclear medicine and molecular imaging,2012,39(1):91-101.
本文编辑:陈亚磊,田国祥
PET/CT imaging study of rabbit abdominal aortic aneurysm with different progression rate
Li Xinhe*, Zhao Quanming, Nie Maoxiao, Yan Yunfeng, Feng Tingting, Zhao Xin, Zhang Xuehui.
*Department of 21th ward, Beijing Anzhen Hospital, Capital Medical University, Beijing institute of heart, lung and blood vessel disease, Beijing 100029, China.
Corresponding author: Zhao Quanming, E-mail: zhaoquanming@sina.com
Objective To explore the role of PET/CT in assessment of abdominal aortic aneurysm (AAA) progress. Methods We selected 30 New Zealand male rabbits, randomly classified them into 2 groups: the AAA group (group A, n=15) and the hypertension AAA group (group B, n=15). Both two groups are perfused with high elastic protease (100 iu/ml) to establish AAA model. Group B is injected angiotensin Ⅱ(AngⅡ) sequentialy after the surgery. The boold pressure and development of AAA were monitored, Serum monocyte chemoattractant protein (MCP-1), matrix metalloproteinase (MMP9, MMP2) and mean standardized uptake value (SUVmean) of two week-PET/CT scans for both groups were analyzed. Pathological staining (HE,EVG and masson), CD68, MMP9 through immunohistochemical were measured. Results Compared with group A, the blood pressure of rabbits in group B was significantly higher than that in group A. At 14 days postoperatively, the aneurysm growth rate in group B was significantly faster than that in group A. The levels of serum MMP9, MMP2, immunohistochemistry CD68 and MMP9 in group B were all increased, the difference was statistically significant (P<0.01). There was no significant difference in serum MCP-1 between the two groups. Pathological results showed that the level of arterial wall tissue in group A was more turbulence, the elastic fibers were thinner, broken, fragmented and vacuolated, collagen fibers increased; the pathologic changes in group B were more serious. Compared with group A, the number of SUVmean in group B was significantly higher than that in group A (P<0.01). There was a positive correlation between SUVmean and macrophage positive density (IOD) (r=0.751, P<0.01) and MMP9 IOD (r=0.597, P<0.05). Conclusions PET/ CT can detect inflammatory infiltration of local lumen and assess the advance rate of AAA of AAA by SUVmean.
PET/CT; Abdominal aortic aneurysm; Rabbit model; Rate of progress
R5
A
1674-4055(2017)08-0912-05
国家自然学基金资助(81370437)
1100029 北京,首都医科大学附属北京安贞医院 北京市心肺血管疾病研究所21病房
赵全明,E-mail:zhaoquanming1@sina.com
10.3969/j.issn.1674-4055.2017.08.04
