曲古霉素A(TSA)对人宫颈癌细胞的杀伤作用
2017-09-11黄凤华姚依兰张西锋
黄凤华,姚依兰,冯 阁,舒 畅,张西锋
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
曲古霉素A(TSA)对人宫颈癌细胞的杀伤作用
黄凤华,姚依兰,冯 阁,舒 畅,张西锋
(武汉轻工大学 生物与制药工程学院,湖北 武汉 430023)
研究探讨了曲古霉素A(TSA)对人宫颈癌Hela细胞的杀伤作用。通过TSA处理Hela细胞,利用MTT法、乳酸脱氢酶(LDH)和活化氧(ROS)的检测法,以及荧光定量PCR方法等进行研究。结果表明:TSA抑制了细胞的增殖,增加了细胞内LDH和ROS的产生,促进了凋亡相关基因的表达,诱导细胞凋亡。
曲古霉素A;宫颈癌细胞;凋亡
1 引言
肿瘤已经成为了威胁人类健康的主要疾病之一,其治疗难度大,致死率高,给人类生活带来严重的负面影响。发展中国家所面临的形势更加严峻,是影响国内居民身体健康的主要疾病,我国的癌症病例呈现逐年上升的趋势,同时死亡率也有所增加。宫颈癌对女性健康的影响不言而喻,癌症的治疗显得尤为重要,同时治疗方法的改善以及创新都有深远的意义。宫颈癌的发生与基因和表观遗传的异常调控相关,包括组蛋白H3的磷酸化和乙酰化,全DNA的低甲基化和抑癌基因的高甲基化[1-2]。其中通过特异性组蛋白乙酰化酶和去乙酰化酶的作用,使组蛋白N末端的乙酰化和去乙酰化,从而影响基因的调控[3]。
近年来,对组蛋白去乙酰化抑制剂的研究取得了一定的进展,为治疗肿瘤提供了新的思路和潜在的治疗方法。HDAC抑制剂是一类新的有效的HDAC特异性抑制剂,抑制多种癌症[4-5]。曲古抑菌素A(TSA)是几种抑制剂之一,当与放射治疗或化疗联合使用时,对多种癌细胞都有潜在的治疗效果[6-7]。TSA在多种癌细胞中通过抑制细胞活力,激活凋亡相关蛋白质引起细胞凋亡,包括人胃癌,卵巢癌和小细胞肺癌细胞[8-10]。本研究以人宫颈癌Hela细胞为细胞模型,探讨TSA对Hela细胞的杀伤作用,及用于宫颈癌治疗的可能机制。
2 材料与方法
2.1 材料
TSA和细胞培养相关试剂购自Sigma公司,其它所用试剂均为国产分析纯试剂;MTT、LDH和ROS检测试剂盒购自Beyotime公司,RT-PCR试剂盒购自Takara公司。
2.2 仪器与设备
荧光倒置显微镜及显微图像分析系统 Nikon TE2000U;CO2培养箱 Thermo。
2.3 方法
2.3.1 RT-PCR
RT-PCR的实验操作参考试剂盒的说明书进行。所用的引物见表1。
表1 引物序列
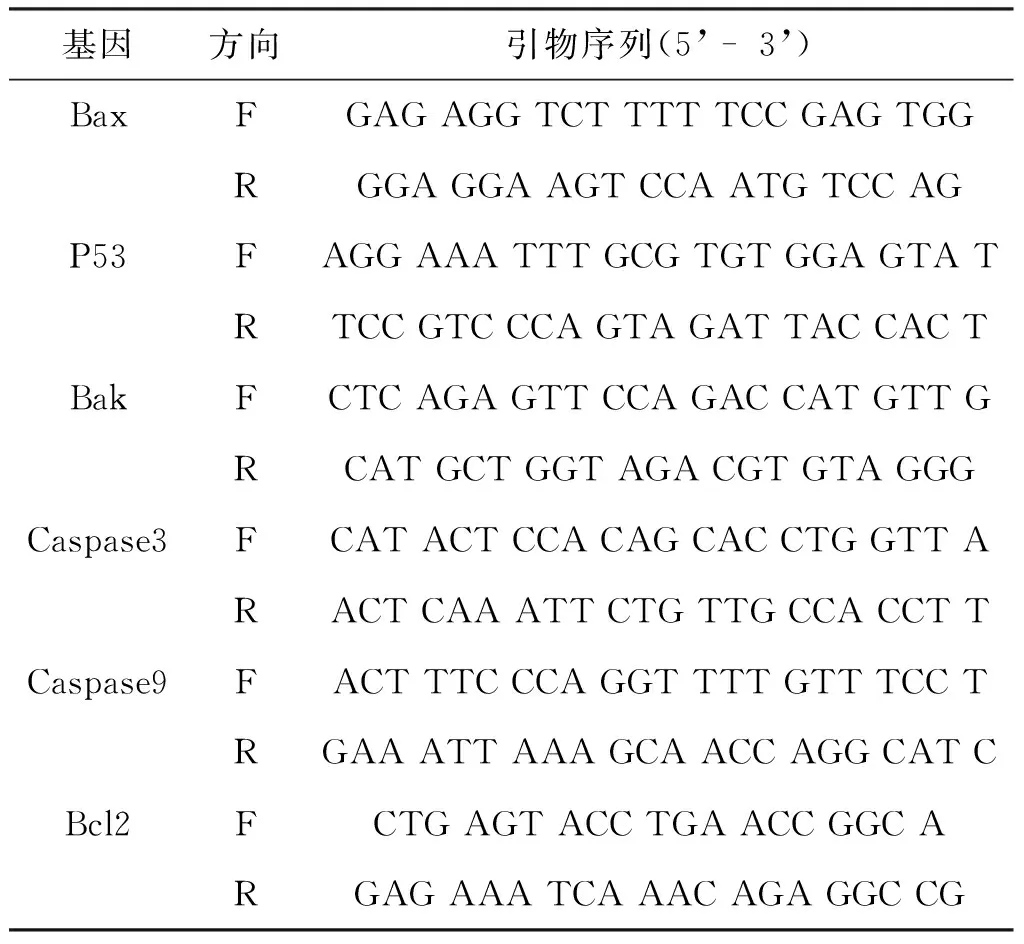
基因方向引物序列(5’-3’)BaxFGAGAGGTCTTTTTCCGAGTGGRGGAGGAAGTCCAATGTCCAGP53FAGGAAATTTGCGTGTGGAGTATRTCCGTCCCAGTAGATTACCACTBakFCTCAGAGTTCCAGACCATGTTGRCATGCTGGTAGACGTGTAGGGCaspase3FCATACTCCACAGCACCTGGTTARACTCAAATTCTGTTGCCACCTTCaspase9FACTTTCCCAGGTTTTGTTTCCTRGAAATTAAAGCAACCAGGCATCBcl2FCTGAGTACCTGAACCGGCARGAGAAATCAAACAGAGGCCG
2.3.2 细胞的培养、MTT检测、LDH检测和ROS检测
参照文献11和文献12[11-12]进行细胞培养和各项检测。
3 结果与分析
3.1 细胞活力的 MTT检测
研究梯度浓度的TSA对宫颈癌细胞生长的抑制作用,如图1所示,TSA的抗肿瘤细胞活性比较明显,并且对于HeLa细胞50%抑制浓度为100 nM。由此表明TSA可以有效并且明显地降低宫颈癌细胞的活性(*P<0.05)。
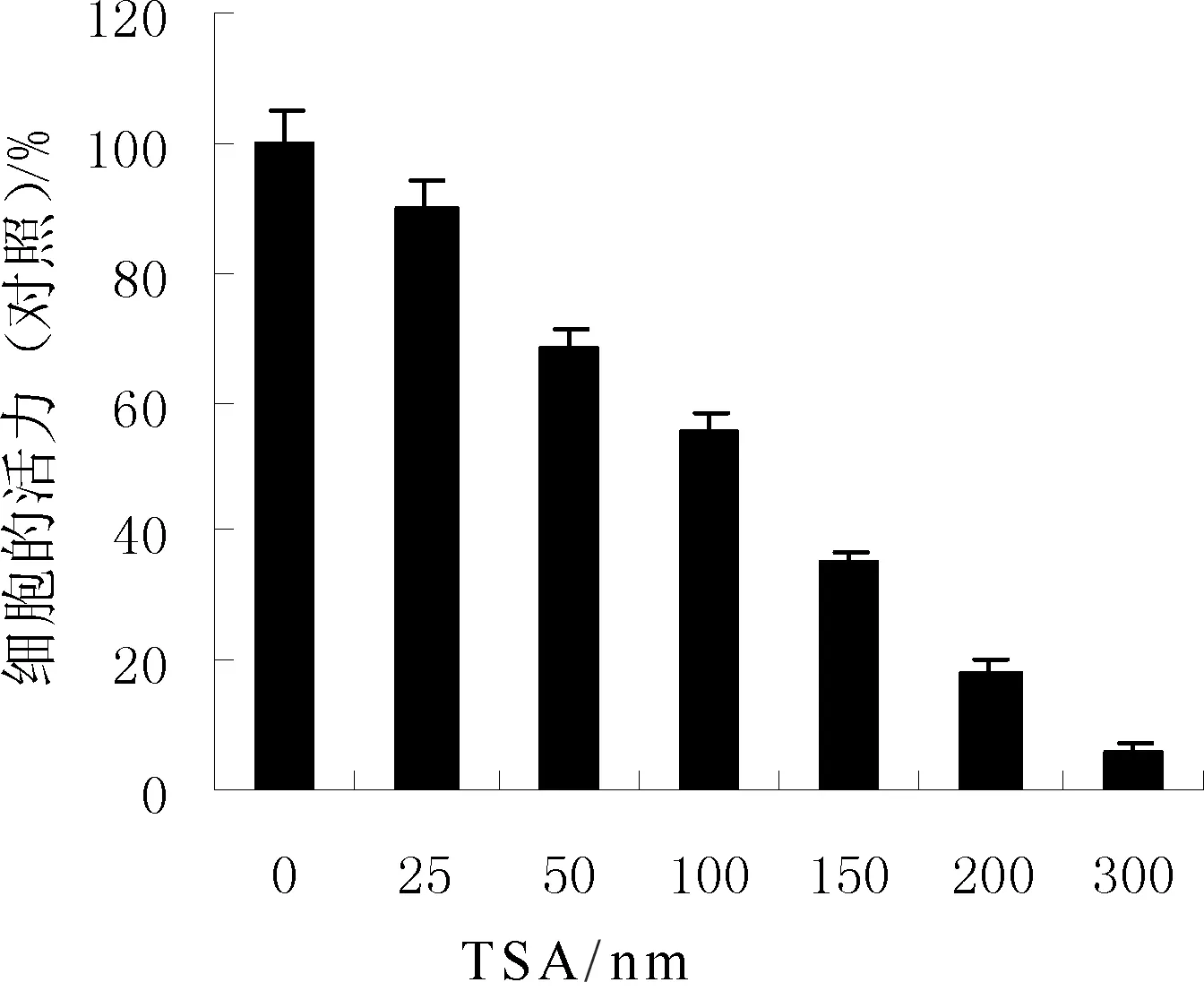
图1 Hela细胞暴露TSA后细胞活力的检测
3.2 TSA对细胞内LDH和ROS产生的检测
检测对照组和处理组细胞外的LDH含量,在实验中加入N-乙酰半胱氨酸(N-acetyl-L-cysteine, NAC)和H2O2作为对照(图2)。NAC是一种常用的抗氧化剂,H2O2作为活性氧供体。图2A所示,TSA处理组与对照组相比,LDH的泄漏量都有所提高(*P<0.05)。在添加NAC的处理组,LDH的泄漏量均有下降,而且只比对照组的泄漏量略有升高。H2O2处理组的LDH泄漏量是最高的,但是加入NAC后,泄漏量也显著降低。
在实验组中活性氧(reactive oxygen species, ROS)的水平检测时,同样添加NAC和H2O2作为对照。活性氧是分子氧在参加反应过程中的所产生的一系列的中间产物,其中活性氧包括了以自由基形式存在和不以自由基形式存在的具有高活性的中间产物,比如过氧化氢(hydrogen peroxide, H2O2)和羟基自由基(hydroxyl radicals,·HO)。
图2B,TSA处理组与对照组相比, DCF的荧光强度增强,ROS有所提高,H2O2处理组的ROS水平是最高的(*P<0.05)。处理组中NAC的有无对其结果有明显的差异。很显然的是,NAC会强烈抑制活性氧的生成,在TSA和H2O2这两个处理组中都有明显的效果。
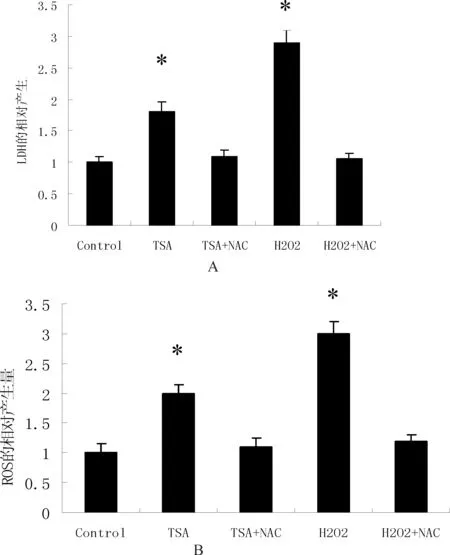
图2 TSA对Hela细胞内LDH和ROS生产的影响
3.3 TSA破坏线粒体膜电位(MMP)和增强Caspase-3活性
在细胞凋亡的过程中往往伴随着线粒体跨膜电位的破坏,这被广泛认为是细胞凋亡过程中最早发生的事件之一。JC-1是线粒体膜电位的检测方法之一。凋亡细胞,线粒体跨膜电位去极化,JC-1从线粒体内释放,浓度降低,逆转为发射绿色荧光的单体形式。故而可以通过检测绿色和红色荧光来定性(细胞群的偏移)定量(细胞群的荧光强度)的检测线粒体膜电位的变化。加入依托泊苷(Etoposide, ET)作为阳性对照,ET是细胞周期特异性抗肿瘤药。HeLa细胞经过TSA和ET处理24 h后,加入JC-1来测定MMP。图3A中可以看到与对照组相比,处理组的红/绿荧光强度比都有所下降,也就是说明两个处理组细胞MMP去极化严重。
线粒体释放出的细胞色素c会激活caspase家族的级联反应[13],影响细胞中caspase-3的水平。在检测细胞中caspase-3的水平时。加入caspase-3的抑制剂(Z-DEVD)和依托泊苷(Etoposide, ET)作为对照实验。由图3B可以看到不加caspase-3抑制剂的处理组,caspase-3活性都较对照组有明显提高。加入caspase-3抑制剂的实验组结果都大致相同,caspase-3活性都在一个较低的水平(*P<0.05)。
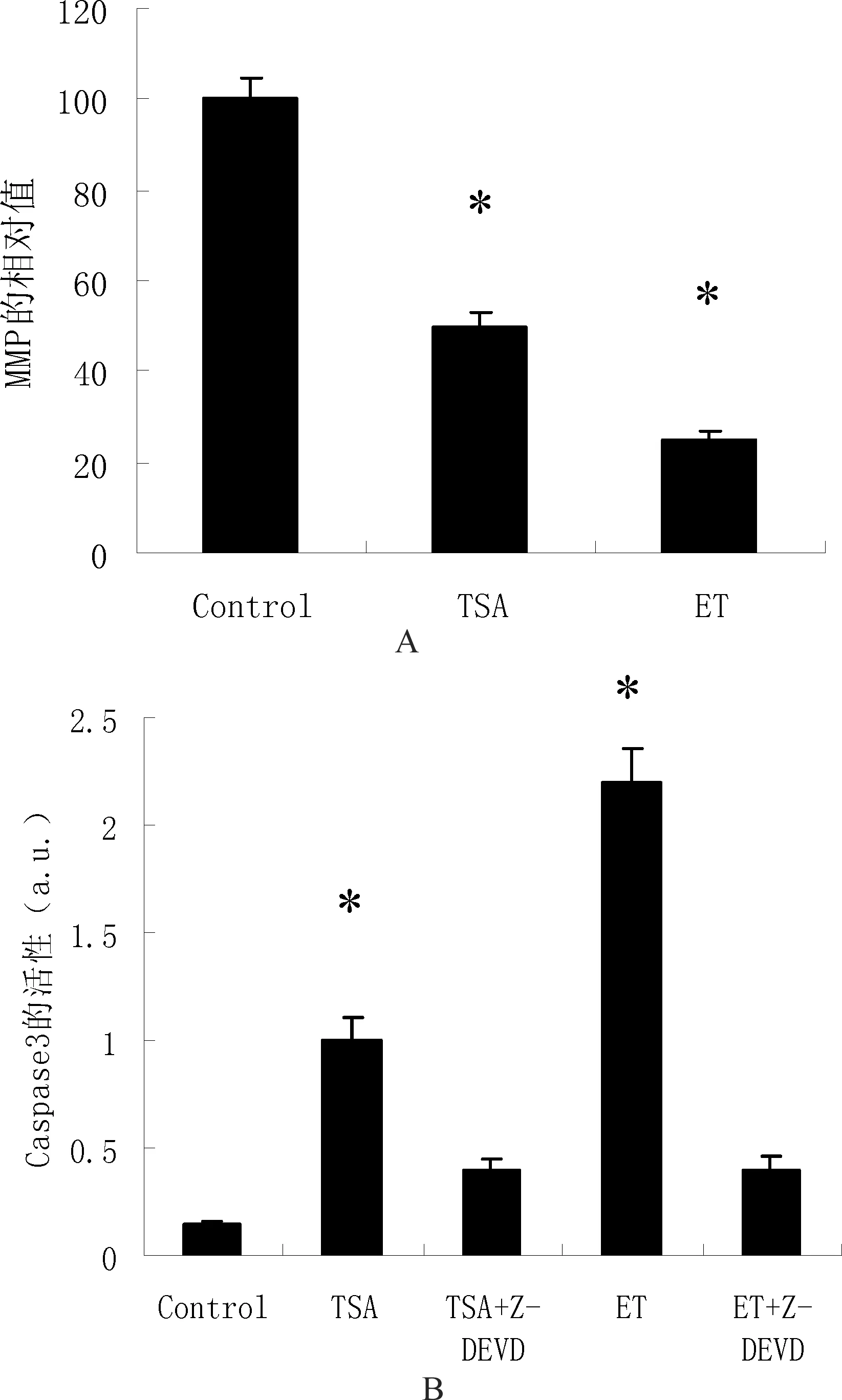
图3 TSA对MMP和Caspase-3活性的影响
3.4 TSA上调促凋亡基因的表达
众所周知,各种促凋亡和抗凋亡蛋白调控细胞死亡通路,通过检测p53 ,Bax, Bak,caspase-3/9以及Bcl2的mRNA水平来研究细胞凋亡与TSA处理组之间的联系。如图4,与对照组相比,处理组中p53, Bax, Bak和, caspase-3/9的mRNA水平均有所上升;同时处理组中Bcl-2的mRNA水平均下降(P<0.05)。经过处理的HeLa细胞中caspase3/9的表达量会上升,表明TSA诱导细胞凋亡的分子机制和Bcl-2蛋白家族有关系。
4 结论与讨论
通过MTT来研究TSA对癌细胞活性的影响,发现TSA对细胞的毒性都有浓度依赖性。对于HeLa细胞,TSA50%抑制浓度为100 nM。Vigushin等人研究了TSA对8种不同乳腺癌细胞系的抑制活性,发现TSA的50%抑制浓度在26.4—308.1 nM[14]。Wu等人发现用低浓度的TSA(0.1—1.0μM)处理HeLa细胞,在12 h以内会出现轻微促进细胞增殖的情况,接着会略微抑制细胞增殖,但即使24 h以后也不会诱导细胞死亡。用更高浓度的TSA(1.0 μM和2.0 μM)来处理细胞24 h,会使细胞的生长完全受到抑制[15]。我们的实验结果和上述结果是一致的,还有研究表明TSA抑制宫颈癌细胞增殖是不仅有剂量依赖性而且还有时间依赖性的[16]。
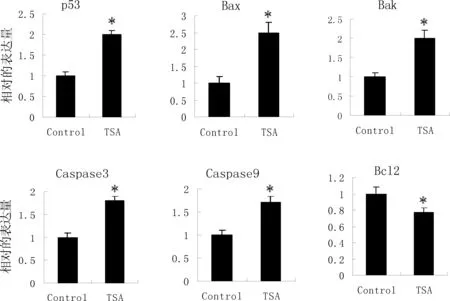
图4 TSA对细胞凋亡相关基因mRNA表达量的影响
许多研究表明TSA与其他药物组合使用会使抑制细胞活性的作用得到增强, Yan等人证明了姜黄素(curcumin)和TSA联用处理细胞,有抑制细胞活性的作用从而加强抗癌效果[17]。还有实验提到了将5μM的槲皮素和82.5 nM的TSA组合使用,会有效地提高对肺癌细胞A549的细胞毒性[18]。
有文献提到原发性肝星状细胞(primary hepatic stellate cell)经过TSA(1,10,100 nM)处理后,LDH的泄漏量会提高[19]。文献中提到在白血病、前列腺和宫颈癌细胞中,组蛋白去乙酰化酶(histone deacetylase, HDAC)抑制剂会通过提高细胞中ROS的水平,从而诱导细胞死亡[20]。
TSA的抗癌活性是由于激活了必要的信号通路导致了细胞的凋亡[21],Bcl-2蛋白家族在破坏线粒体膜电位(mitochondrial membrane potential, MMP)和释放细胞色素c(cytochrome c)的过程中有着重要的角色。包括TSA在内的HDAC抑制剂通过增加Bcl2家族的BH3-only的表达来破坏细胞MMP。MMP去极化会影响细胞正常的呼吸,并且一般认为MMP的下降是细胞早期凋亡的一个标志,而DNA降解为片段是细胞凋亡的一个重要标志。
TSA会下调Bcl2的表达量并上调凋亡相关基因的表达量,从而诱导癌细胞凋亡,Bax/Bcl2比例的升高也会造成MMP下降,同时诱导细胞凋亡[22]。所以TSA是通过Bcl2蛋白家族来诱导细胞凋亡。
[1] Anton M, Hork M, Kuchtícková S. Immunohistochemical detection of acetylation and phosphorylation of histone H3 in cervical smears[J]. Ceská gynekologie / Ceská lékarská spolecnost [J]. Ev Purkyne, 2004, 69(1):3-6.
[3] Zhong S, Fields CR, Su N. Pharmacologic inhibition of epigenetic modifications, coupled with gene expression profiling, reveals novel targets of aberrant DNA methylation and histone deacetylation in lung cancer[J]. Oncogene, 2007, 26(18):2621-2634.
[4] Kim IA, Kim IH, Kim HJ, et al. HDAC Inhibitor-Mediated Radiosensitization in Human Carcinoma Cells: A General Phenomenon[J]. Journal of Radiation Research, 2010, 51(3):257-63.
[5] Sharma V, Koul N, Joseph C. HDAC inhibitor, scriptaid, induces glioma cell apoptosis through JNK activation and inhibits telomerase active[J]. Journal of Cellular & Molecular Medicine, 2010, 14(8):2151-2161.
[6] Ranganathan P, Rangnekar V M. Exploiting the TSA connections to overcome apoptosis-resistance[J]. Cancer Biology & Therapy, 2005, 4(4):391-392.
[7] Hajji N, Wallenborg K, Vlachos P.Combinatorial action of the HDAC inhibitor trichostatin A and etoposide induces caspase-mediated AIF-dependent apoptotic cell death in non-small cell lung carcinoma cells[J]. Oncogene, 2008, 27(22):3134-3144.
[8] Platta C S, Greenblatt DY, Kunnimalaiyaan M. The HDAC inhibitor trichostatin A inhibits growth of small cell lung cancer cells[J]. Journal of Surgical Research, 2007, 142(2):219-226.
[9] Wu Zhi-qun, Zhang Rui, Connie Chao. Histone deacetylase inhibitor trichostatin A induced caspase-independent apoptosis in human gastric cancer cell[J].Chinese Medical Journal, 2007, 120(23):2112-2118.
[10] Sonnemann J, Hüls I, Sigler M. Histone deacetylase inhibitors and aspirin interact synergistically to induce cell death in ovarian cancer cells[R].Oncology Reports, 2008, 20(1):219-224.
[11] Changou CA, Chen YR, Xing L.Arginine starvation-associated atypical cellular death involves mitochondrial dysfunction, nuclear DNA leakage, and chromatin autophagy[J].Proc Natl Acad Sci U S A. 2014 Sep 30;111(39):14147-14152.
[12] Zhang XF, Choi YJ, Han JW. Differential nanoreprotoxicity of silver nanoparticles in male somatic cells and spermatogonial stem cells[J]. Int J Nanomed, 2015,10: 1335-1357.
[13] Srinivasula SM, Ashwell JD. IAPs: what's in a name[J].Molecular Cell, 2008, 30(2):123-135.
[14] Vigushin DM, Ali S, Pace PE. Trichostatin A Is a Histone Deacetylase Inhibitor with Potent Antitumor Activity against Breast Cancer in Vivo[J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2001, 7(4):971.
[15] Wu P, Meng L, Wang H. Role of hTERT in apoptosis of cervical cancer induced by histone deacetylase inhibitor[J]. Biochemical & Biophysical Research Communications, 2005, 335(1):36-44.
[16] You BR, Park WH. Trichostatin A induces apoptotic cell death of HeLa cells in a Bcl-2 and oxidative stress-dependent manner[J]. International Journal of Oncology, 2013, 42(1):359-66.
[17] Yan G, Eller M S, Elm C. Selective Inhibition of p300 HAT Blocks Cell Cycle Progression, Induces Cellular Senescence, and Inhibits the DNA Damage Response in Melanoma Cells[J].Journal of Investigative Dermatology, 2013, 133(10):2444.
[18] ChanST, Yang NC, Huang CS. Quercetin Enhances the Antitumor Activity of Trichostatin A through Upregulation of p53 Protein Expression In Vitro and In Vivo[J]. Plos One, 2012, 8(1):e54255.
[19] Niki T, Pekny M, Hellemans K. Class VI intermediate filament protein nestin is induced during activation of rat hepatic stellate cells[J]. Hepatology, 1999, 29(2):520-527.
[20] Rosato RR, Almenara JA, Dai Y. Simultaneous activation of the intrinsic and extrinsic pathways by histone deacetylase (HDAC) inhibitors and tumor necrosis factor-related apoptosis-inducing ligand (TRAIL) synergistically induces mitochondrial damage and apoptosis in human leukemia cells[J].Molecular Cancer Therapeutics, 2003, 2(12):1273.
[21] Zohre S, Kazem NK, Abolfazl A. Trichostatin A-induced apoptosis is mediated by Kruppel-like factor 4 in ovarian and lung cancer[J]. Asian Pacific Journal of Cancer Prevention Apjcp, 2014, 15(16):6581658-6.
[22] Martinou JC, Youle RJ. Mitochondria in Apoptosis: Bcl-2 family Members and Mitochondrial Dynamics[J].Developmental Cell, 2011, 21(1):92.
Cytotoxicity of Trichostatin A on human cervical carcinoma cell
HUANGFeng-hua,YAOYi-lan,FENGGe,SHUChang,ZHANGXi-feng
(School of Biology and Pharmaceutical Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
The aim of this study was to investigate the cytoxicity of Trichostatin A on human cervical carcinoma cell. Hela cells were treated with Trichostatin A, and the methods of MTT, check of Lactate dehydrogenase (LDH) and activated oxygen(ROS), RT-PCR were used for this experiment. The results show that TSA effectively inhibits cell viability, increases the LDH leakage and the fluorescence intensity of ROS, and promotes the expression of apoptosis-related genes, induce cell apoptosis.
trichostatin A; cervical carcinoma cell;apoptosis
2017-05-04.
黄凤华(1990-),女,硕士研究生,E.mail:867134498@qq.com.
张西锋(1977-),男,博士,副教授,E.mail:zhangxf9465@163.com.
国家自然科学基金(B020704).
2095-7386(2017)02-0036-05
10.3969/j.issn.2095-7386.2017.02.007
R 737.11
A
