茉莉酸甲酯对橡胶草生理生化及乳管分化的影响
2017-09-07马海霞何丽娜海春燕曹新文雷骥良闫洁祝建波
马海霞,何丽娜,海春燕,曹新文,雷骥良,闫洁*,祝建波
(石河子大学生命科学学院,新疆 石河子832003)
茉莉酸甲酯对橡胶草生理生化及乳管分化的影响
马海霞,何丽娜,海春燕,曹新文,雷骥良,闫洁*,祝建波
(石河子大学生命科学学院,新疆 石河子832003)
为了研究喷施不同浓度茉莉酸甲酯(MeJA)对橡胶草(Taraxacum kok-saghyz Rodin,TKS)农艺性状和乳管分化相关生理生化指标的影响,分析这些指标的变化与乳管分化的关系,明确促进橡胶草乳管分化的最佳MeJA喷施浓度,本试验选择1个月生的盆栽橡胶草为材料,设5个浓度的MeJA处理水平,即0.25、0.50、1.00、2.00和5.00 mmol/L,以喷施含2.2%无水乙醇的蒸馏水处理的橡胶草为对照,研究喷施不同浓度MeJA对橡胶草农艺形状、叶片叶绿素含量、根系活力、根系内源激素含量、根系PAL活性、根系木质素含量及根部韧皮束圈数的影响。结果显示:与对照相比,喷施不同浓度MeJA可增加橡胶草的主根长度、主根粗度和根冠比,但抑制了叶片的生长。喷施不同浓度MeJA提高了叶片叶绿素含量和根系活力;橡胶草根系内源玉米素核甘(ZR)、生长素(IAA)和MeJA含量均呈增加趋势,且均大于对照处理;随着MeJA处理浓度的增大,脱落酸(ABA)和赤霉素(GA3)含量呈先增加后减小的趋势;6-苄氨基腺嘌呤(6-BA)含量与对照无显著差异。适宜浓度MeJA可增加橡胶草根部苯丙氨酸解氨酶(PAL)活性,提高根系木质素含量,增加韧皮束圈数。经0.25、0.50和1.00 mmol/L MeJA处理后植株韧皮束圈数与对照呈显著差异,与对照相比分别增加了29.4%、35.3%和47.0%。喷施适宜浓度的MeJA可促进根部的生长,优化地上部与地下部的关系;加速根部IAA、MeJA、GA3、ZR和ABA代谢;提高植株PAL活性,增加木质素含量,提高乳管分化能力。因此,可以通过叶面喷施浓度为1.00 mmol/L的MeJA最大限度的促进橡胶草根部乳管分化。
橡胶草;茉莉酸甲脂;乳管分化
世界上存在约2500种产胶植物,只有少数物种产生的天然橡胶物理性能符合工业生产需要,如巴西橡胶树、银胶菊和橡胶草[1]。据调查,中国绝大部分的进口橡胶均来源于东南亚。随着我国国民经济的快速发展,天然橡胶的需求量不断增加,所以亟须寻找开发新的可用天然橡胶资源[2]。在对天然橡胶资源的探寻中,研究最为成功的是银胶菊和橡胶草[3],橡胶草橡胶与巴西橡胶树橡胶的结构和性能相似,是具有良好开发前景的产胶植物[3]。但由于橡胶草含胶率低、生产成本较高,限制着其应用范围。因此,研究喷施茉莉酸甲酯(MeJA)对橡胶草根部乳管细胞分化(简称为乳管分化)的影响,明确与乳管分化关系最密切的生理生化指标及其变化规律,对进一步提高橡胶草产量和促进橡胶草产业的开发有极其重要的现实意义。
前人研究表明,茉莉酸(JA)和MeJA作为茉莉酸类物质(JAs)的代表具有刺激橡胶树乳管分化的作用[3],刘惠芳等[4]认为同时使用适宜浓度的JA和6-苄氨基腺嘌呤(6-BA)能增加乳管分化程度,而脱落酸(ABA)与JA共同施用则减弱了JA对乳管分化的诱导作用,然而单独使用ABA则不能诱导乳管的形成[5-8]。郑杰[6]认为喷施乙烯利能够促进橡胶树乳管分化,提高橡胶产量,但乙烯利能够引起橡胶树树皮的局部死亡和坏死。郝秉中等[7]认为JA可诱导橡胶树乳管分化,是调节乳管分化和发育的重要信号,其前体亚麻酸能够诱导橡胶树萌条分化出乳管,促进成龄橡胶树乳管再分化。橡胶树乳管的分化还与植物抗性有密切关系,外源喷施JA能提高植物苯丙氨酸解氨酶(PAL)活性,诱导植物体系统获得抗性[9]。曾日中等[10]认为当橡胶树受外源JA刺激时不仅可诱导PAL活性增强和木质素含量增加,还促进乳管分化。
前人主要集中在影响橡胶树乳管生长发育相关蛋白、基因及生态因子的研究方面,而关于橡胶草叶面喷施MeJA对其乳管分化、根部内源激素变化和植株抗性影响的研究相对较少。本研究以1个月生橡胶草植株为材料,研究喷施不同浓度MeJA处理的橡胶草根部乳管分化与农艺性状、叶绿素含量、根系活力、内源激素含量、PAL活性、木质素含量的关系,探讨不同浓度的MeJA对橡胶草乳管分化的影响,以明确影响橡胶草乳管分化的生理生化因子,以期为进一步提高橡胶草产胶量提供理论基础。
1 材料与方法
1.1 材料
试验中所选用的茉莉酸甲酯(MeJA)购自于北京博奥拓达科技有限公司,主要成分为茉莉酸甲酯(Methyl Jasmonate,反 -3-氧代 -2-(顺 -2-戊烯基)-环戊乙酸甲酯)。试验中所用的草炭土由丹麦Pinstrup公司生产。
1.2 方法
2015-2016年,试验在石河子大学生命科学学院实验室进行,试验中橡胶草种子于2014年6月采自新疆石河子市北泉镇农田沟渠旁。采用盆栽试验,试验用花盆规格为15 cm×15 cm的塑料盆,橡胶草培养所用的基质为草炭土和蛭石,两者按草炭土∶蛭石=3∶1(体积比)比例进行混合。种子经10%双氧水消毒15 min,清水漂洗数次后播种于培养皿中,待种子发芽后将生长健康且长势均匀的幼苗移栽到混合的基质中。光照培养架上的光强设为25000 Lux,光照时间为12 h/d,光照培养的温度为室温。幼苗生长至1个月时用MeJA喷施。
试验共设5个不同MeJA浓度处理,分别为:0.25、0.50、1.00、2.00 和 5.00 mmol/L。各处理均采用叶面喷施的方法施用MeJA。含2.2%无水乙醇的蒸馏水处理的植株为对照(CK)。选取长势健康且均匀一致的橡胶草植株,进行叶面喷施,每2 d天喷施1次,共喷施5次。MeJA具有挥发性,喷施后立即套上黑袋子,能延长其对橡胶草的处理时间。5次喷施结束之后第3天测定根部内源激素(IAA、GA3、ABA、IAA、6-BA、MeJA)、PAL活性、根系活力及叶绿素含量,在喷施后第20天测定农艺性状、木质素含量及根部解剖学结构。
1.2.1 测定项目及方法
1.2.2 农艺性状的测定
农艺形状的测定于喷施后20 d开始,每处理选取长势均匀且有代表性的橡胶草植株5盆(共计15株),每盆选择相同部位的5片叶片测定。叶长、叶宽、主根长、主根粗用游标卡尺测量,叶面积参照吉田昌一[11]的方法,计算公式为:叶面积=叶长×叶宽×0.75。
1.2.3 叶绿素含量的测定
叶绿素含量的测定于喷药后3 d开始,每处理随机选取5片倒三叶,且被选择的叶片喷药前生长健康,参照Linchtenthaler等[12]的测定方法。叶绿素含量的计算公式为:叶绿素 a(mg/g):Ca=(12.72A663-2.59A645)×V/(1000×W),叶绿素 b(mg/g):Cb=(22.88A645-4.68A663)×V/(1000×W),叶绿素总量(mg/g):CT=(8.02A663+20.29A645)×V/(1000×W)。以上各式中,A663、A645分别在波长663、645 nm条件下叶绿素提取液的吸光度值;V是80%丙酮提取液的体积(mL);W是提取橡胶草叶片鲜重(g)。
1.2.4 根系活力的测定
根系活力的测定于喷药后3 d开始,每处理重复3次。参照张志良等[13]的测定方法(TTC法)。
1.2.5 内源激素含量的测定
内源激素含量的测定采用酶联免疫吸附法(ELISA)测定,测定单位为中国农业大学作物化学控制研究中心王宝明课题组。取样方法:挖取橡胶草根部,流水冲洗干净后,用滤纸吸干根部表面的水分,准确称取0.2 g,迅速放到5 mL离心管中,然后置于液氮中速冻,冷冻的根样保存在-80℃超低温冰箱中备用。
1.2.6 PAL活性的测定
PAL活性的测定于喷药后3 d开始,每处理重复3次。参照张志良等[13]的测定方法。
1.2.7 木质素含量的测定
木质素含量的测定于喷施后20 d开始,每处理重复3次。取橡胶草根部,用流水冲洗干净,吸干根部表面的水分,选取靠近叶基的根进行木质素含量的测定。参照Syros等[14]的测定方法。
1.2.8 根部韧皮束圈数的测定
根部韧皮束圈数的测定于喷施后20 d开始,每处理重复3次。样本处理参照史自强等[15]的测定方法,并在此基础上加以改进。从每个浓度处理下的植株中选取有代表性的植株3株,切去叶基以上约0.5 cm的部分,选取以下不大于1 cm的根部放入FAA固定液(50%无水乙醇配制)中固定24 h,经脱水、变性、透明、切片和染色等步骤,在显微镜下对韧皮束圈数进行统计,求取同浓度处理下3株植株韧皮束圈数的平均值。
1.2.3 数据分析
数据采用Microsoft Excel 2010统计和作图,通过SPSS 20软件进行方差分析检验其差异显著性,方差比较采用Duncan法。
2 结果与分析
2.1 喷施不同浓度MeJA对橡胶草农艺性状的影响
由表1可知,与对照相比,喷施5个不同浓度MeJA处理对橡胶草的主根粗度和根冠比无显著影响;喷施 0.25、0.50、1.00和 2.00 mmol/L的 4个处理显著提高了主根长度;0.25和0.50 mmol/L 2个处理对橡胶草的叶长、叶宽和叶面积无显著影响,但1.00、2.00和5.00 mmol/L 3个浓度处理均显著降低了橡胶草的叶长、叶宽和叶面积,其中尤以5.00 mmol/L浓度处理的降低效果最显著。这说明喷施0.25-0.50 mmol/L的MeJA既能促进地下部根的生长,又对地上部叶片生长的抑制作用较小。
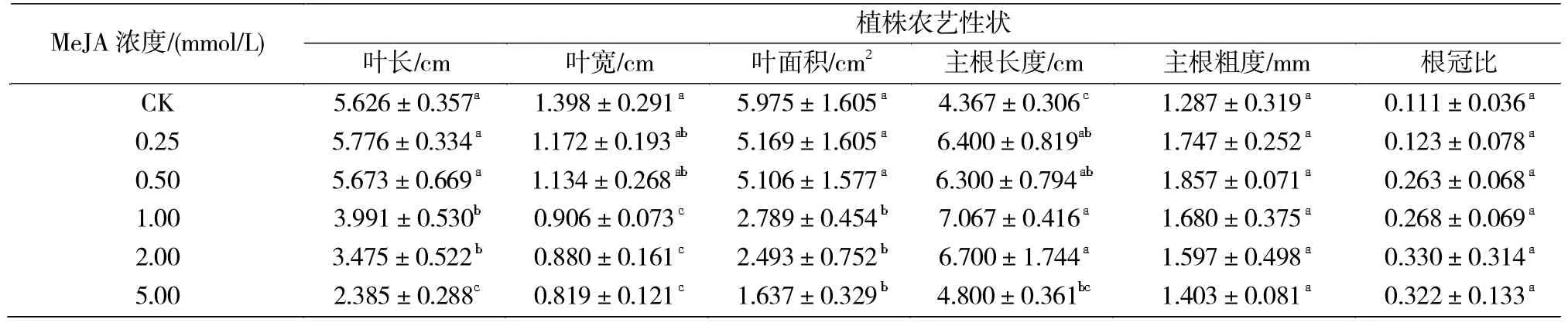
表1 喷施不同浓度MeJA对橡胶草农艺性状的影响Tab.1 Effects of spraying the different concentrationon of MeJA on agronomic traits of TKS
2.2 喷施不同浓度的MeJA对橡胶草叶片叶绿素含量的影响
叶绿素在光合作用中对光能的吸收、传递和转化中起着极为重要的作用。由表2可知,喷施不同浓度MeJA处理后,橡胶草叶片的叶绿素a、叶绿素b及总叶绿素含量较对照均呈增加趋势;其中0.25和0.50 mmol/L处理下的叶绿素a和总叶绿素含量与对照无显著差异;与对照相比,1.00、2.00和5.00 mmol/L 3个浓度处理均显著提高了叶片的叶绿素a、叶绿素 b及总叶绿素含量(P<0.05)。
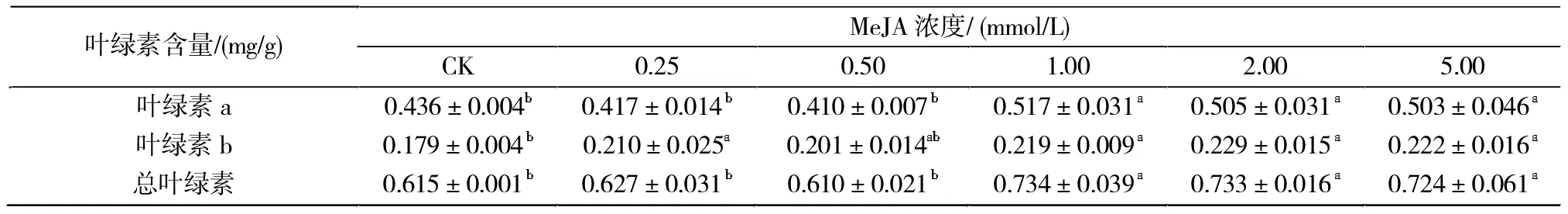
表2 喷施不同浓度MeJA对橡胶草叶片叶绿素含量的影响Tab.2 Effects of spraying the different concentrations of MeJA on leaves chlorophyll content of TKS
2.3 喷施不同浓度MeJA对植株根系活力的影响
根系活力的强弱直接影响植株地上部分的生长发育快慢及产量的高低。由表3可知,喷施MeJA能增强橡胶草根系活力,且根系活力的变化随着喷施MeJA浓度的增加呈先增加后减小的趋势。喷施MeJA后橡胶草根系活力均较对照处理的橡胶草根系活力大,其中 0.50、1.00、2.00和 5.00 mmol/L 4个浓度处理的根系活力与对照相比达到显著水平(P<0.05),其中尤以喷施0.5 mmol/L处理对根系活力的促进作用更显著(表3)。

表3 喷施不同浓度MeJA对植株根系活力的影响Tab.3 Effects of spraying the different of MeJA concentrations on root activity of TKS
2.4 喷施不同浓度MeJA对橡胶草根部内源激素的影响
由表4可知,橡胶草喷施不同浓度MeJA处理的IAA、MeJA含量均呈增加趋势,且均大于对照处理,2.00和5.00 mmol/L处理下其含量与其他各处理显著差异。ZR含量在2.00 mmol/L处理下达最大值,且显著高于其余处理(P<0.05)。6-BA含量呈单峰曲线变化,在0.50 mmol/L处理下达最大值,0.50和5.00 mmol/L处理的植株6-BA含量与其余各处理显著差异。ABA和GA3含量呈先增加后减小的趋势,ABA含量在0.50和1.00 mmol/L的2个浓度处理下高于对照处理,ABA含量在0.25、0.50和1.00 mmol/L处理下显著高于其他各处理(P<0.05);GA3含量在1.00 mmol/L处理下达最大值且与其余各处理显著差异(P<0.05)。
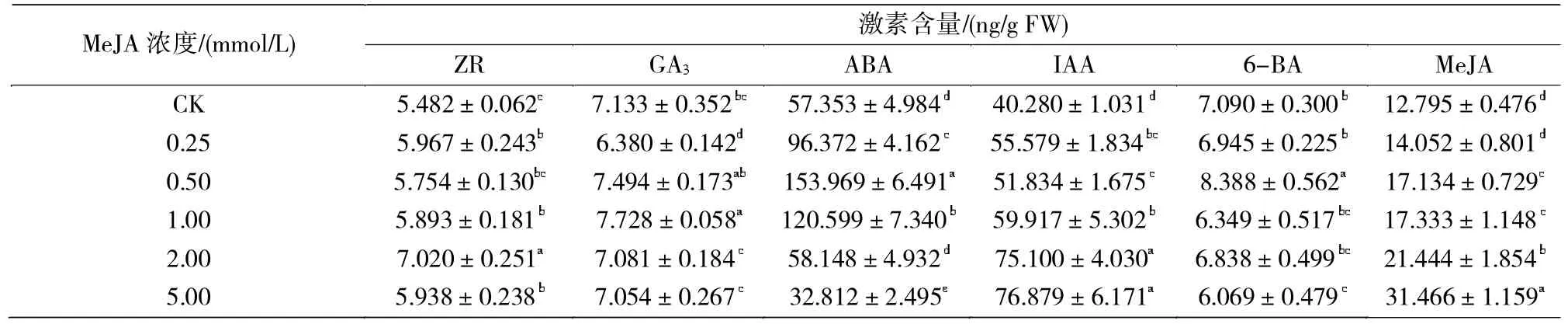
表4 喷施不同浓度MeJA对橡胶草根系内源激素的影响Tab.4 Effects of spraying the different concentrations of Methyl jasmonate on root endogenous hormones of TKS
2.5 喷施不同浓度的MeJA对橡胶草根系PAL活性的影响
PAL活性经各浓度MeJA处理后均高于对照,在0.50和5.00 mmol/L处理下与对照显著差异,其他3个浓度处理的PAL活性与对照无显著差异(表5)。

表5 喷施不同浓度MeJA对橡胶草根系PAL活性的影响Tab.5 Effects of spraying the different concentrations of MeJA on root PAL activity of TKS
2.6 喷施不同浓度MeJA对橡胶草根系木质素含量的影响
由表6可知,喷施不同浓度MeJA处理的橡胶草根部木质素含量总体先增加后减小,在1.00 mmol/L 处理下显著高于对照处理(P<0.05),0.25、0.50和2.00 mmol/L处理下的木质素含量与对照无显著差异,5.00 mmol/L处理的木质素含量最小,显著低于对照。

表6 喷施不同浓度MeJA对橡胶草根系木质素含量的影响Tab.6 Effects of spraying the different concentrationons of MeJA on root lignin content in koksaphyz
2.7 喷施不同浓度MeJA对橡胶草根部乳管分化的影响
由表7可知,喷施MeJA处理的橡胶草根部乳管的分化随喷施MeJA浓度的增加呈先增加后减小的趋势。与对照相比,0.25、0.50和1.00 mmol/L 3个处理的根部韧皮束圈数较对照处理显著增加,且这3个处理间无显著差异;而2.00和5.00 mmol/L 2个处理的根部韧皮束圈数显著小于对照处理。表明叶面喷施浓度为0.25-1.00 mmol/L的MeJA可有效促进橡胶草根部乳管的分化。

表7 不同浓度MeJA对橡胶草根部乳管分化的影响Table 7 Effects of different concentrations of MeJA on root laticifer differentiation of TKS
3 讨论
3.1 橡胶草喷施MeJA对植株地上部和地下部生长,根系活力与乳管分化的影响
研究表明,喷施高浓度的MeJA能抑制叶片的正常生长,使光合作用面积减小[16],造成地上部分同化产物量降低[17]。龚小贵[18]对马兰的研究中也认为较高浓度的MeJA抑制植物叶片的生长,但可显著提高叶片叶绿素含量。根系是植物的主要吸收器官,根系活力是反映植株吸收能力的综合指标,根系活力强则有利于植株对水分及矿物养分的吸收[19]。本研究表明,橡胶草叶面喷施MeJA抑制了叶片的生长,减小了叶面积;这可能是因为喷施MeJA促进了叶片中GA向根部运输,使叶片中GA的含量减小,进而抑制叶面积增加。Wang等[20]认为叶片内源GA合成减少,导致植株的横向生长受到抑制。橡胶草喷施适宜浓度的MeJA能促进根的纵向伸长和横向生长,使植株根冠比变大,优化植株地上部和地下部生长,这一方面可能是因为根部GA和IAA合成增加,使得根部的生长加快;另一方面喷施MeJA能提高根系活力,这有利于植株对水分及矿物养分的吸收,使光合产物优先向根部转移,增加根系生物量,进而提高根冠比[21]。同时叶片叶绿素含量的增加,提高了叶片对光能的吸收、传递和转化,增加了光合同化产物的积累,使叶片有更多的光合产物向根部运输,为乳管分化提供了物质保障。
3.2 橡胶草喷施MeJA对内源激素的影响及与乳管分化的影响
细胞分化是一个极其复杂的生理生化变化,是植物体内各种因素综合作用、相互协调的结果[22],最终使植株表现出相应生理生化变化。前人研究表明,JA和MeJA具有刺激橡胶树乳管分化的作用[3],IAA是管状分子分化的一个基础性诱导因子[23],能够促进橡胶树再生树皮中乳管列数的增加。但很多激素并未诱导乳管分化的作用,它们在外源MeJA的诱导下含量发生变化,各激素间相互作用,可能对乳管的分化产生影响。本研究表明,叶面喷施适宜浓度的 MeJA能够增强根部内源 IAA、MeJA、GA3、ZR及ABA代谢,使其含量增加。ZR含量与MeJA处理浓度未表现出紧密的相关性,6-BA和GA3含量分别在0.50和1.00 mmol/L处理下达到最大,与韧皮束圈数相符,此浓度处理下的6-BA和GA3含量变化可能与MeJA共同作用促进橡胶草乳管的分化;IAA的含量变化与韧皮束圈数并未表现出高度一致,随IAA含量的逐渐增多,韧皮束圈数在2.00和5.00 mmol/L处理下减小,这可能是由于高浓度的IAA抑制了橡胶草根系的生长和分化。ABA的主要生理作用为抑制植物生长,除此之外还能够提高植物的抗旱和耐盐力,IAA、GA和细胞分裂素(CTK)对其生理作用有抵消效应;另外,ABA能够刺激乙烯的合成,有效的调整植物的根冠比。ABA含量的变化与韧皮束圈数的变化趋势一致,体现出了高浓度抑制低浓度促进细胞分化的效应,这与曹婧等[24]用不同浓度ABA处理对异子蓬黑色种子生长和发育的研究结果相似。随叶面喷施MeJA浓度增大,根系内源MeJA含量也增大,而韧皮束圈数减少,这可能是由于高浓度的MeJA对橡胶草的生长产生了抑制效应[2 5],阻碍了乳管的分化。
3.3 橡胶草喷施MeJA对根系PAL活性、木质素含量及与乳管分化的影响
前人研究表明,外源喷施JA可提高植物的PAL活性,诱导植物体系统获得抗性[9]。巴西橡胶树的乳管被认为是一种参与防御反应的保护结构,而乳管中的乳胶是橡胶树在受到环境胁迫时起保护作用的细胞质[26],因此JA诱导橡胶树与JA在植物防御反应中的作用一致。曾日中等[10]认为,当橡胶树受外源JA刺激使得PAL活性增加,使植株体内抗性物质和木质素含量增加。木质素的沉积被认为是细胞分化的重要标志之一[27],在植物细胞的生长、分化以及抗性上具有重要的意义[28-29]。本研究表明,橡胶草喷施MeJA能促进根系PAL活性,且PAL活性随MeJA处理浓度的增大总体呈增大趋势;同时使橡胶草根部木质素含量增加,但是当喷施MeJA浓度过高时反而抑制了橡胶草根部木质素的合成,使木质素含量降低。这可能是因为橡胶草喷施MeJA使得根部的PAL活性增加,促进了根部木质素的合成,根部木质素含量的增加又促进乳管的分化。但过高浓度MeJA抑制了橡胶草根部木质素的合成,这可能是因为高浓度的MeJA抑制或者减弱了木质素合成途径中其它酶的活性或者一些木质素合成关键因素被限制,从而使木质素含量降低。
4 结论
叶面喷施适宜浓度MeJA可促进橡胶草根部乳管分化,增加韧皮束圈数。喷施MeJA可促进根部的生长,优化地上部与地下部的关系;可提高根部内源IAA、MeJA、GA3、ZR及 ABA代谢水平,进而促进植株的生长和细胞的分化;可提高植株PAL活性、增加木质素含量、增强植物抗性。因此,建议在生产中通过叶面喷施浓度为1.00 mmol/L的MeJA来最大限度的促进橡胶草根部乳管分化;同时,在此浓度下根系内源ABA含量、DAC活性和木质素含量均高于对照,这有助于橡胶草抗性的增强。
[1]代龙军,曾日中.产胶植物橡胶转移酶的研究进展[J].植物生理学报,2013,49(10):1000-1008.Dai L J,Zeng R Z.Research advances in rubber transferases of the rubber-producing plants[J].Plant Physiology Journal,2013,49(10):1000-1008.
[2]安峰,林位夫,谢贵水,等.国内外巴西橡胶树替代作物及技术研发现状[J].热带作物学报,2012,33(6):1134-1141.An F,Lin W F,Xie G S,et al.Present si tuation of research and development of alternative crops and technology of Brazil rubber tree[J].Chinese Journal of Tropical Crops,2012,33(6):1134-1141.
[3]张立群,张继川,王锋,等.全球天然橡胶发展趋势及我国多元化发展之路(下)[J].中国橡胶,2013,29(22):18-20.Zhang L Q,Zhang J C,Wang F,et al.Global natural rubber trends and Chinese diversified development[J].China Rubber,2013,29(22):18-20.
[4]刘惠芳,吴继林,郝秉中.茉莉酸和其它激素对巴西橡胶树乳管分化的协同作用[J].热带作物学报,2001,22(3):6-16.Liu H F,Wu J L,Hao B Z.Synergistic effect of jasmonic acid and other hormones on Brazilian rubber tree laticifer differentiation[J].Chinese Journal of Tropical Crops,2001,22(3):6-16.
[5]Hao B Z,Wu J L.Laticifer differentiation in hevea brasiliensis:induced by exogenous jasmonic acid and linolenic acid[J].Annals of Botany,2000,85(1):37-43.
[6]郑杰.乙烯利在橡胶树上应用的研究进展[J].安徽农业科学,2007,35(19):5686-5688.Zheng J.Advances in the application of ethephon in rubber tree[J].Journal of Anhui Agricultural Sciences,2007,35(19):5686-5688.
[7]郝秉中,田维敏,谭海燕,等.茉莉酸在巴西橡胶树伤害防卫结构形成中的作用[J].热带作物学报,2002,23(4):1-6.Hao B Z,Tian W M,Tan H Y,et al.The role of jasmonic acid in the formation of Brazil rubber tree damage defense structure[J].Chinese Journal of Tropical Crops,2002,23(4):1-6.
[8]Nichiporovich A A,Ivanjtzkaja E F.On the working condition of the foliageasa factor of differentiation of lactiferous vessels in kok-saghyz roots[J].Comp Rend(Doklady)Acad Sci,URSS,1945,46(1):36-39.
[9]李文彬.昆虫抗菌肽介导的抗桉树青枯病基因工程研究[D].海口:华南热带农业大学,2000.
[10]曾日中,白先权,黎瑜,等.外源茉莉酸诱导巴西橡胶树乳管分化的酶学研究(Ι)[J].热带作物学报,2001,22(3):17-23.Zeng R Z,Bai X Q,Li Y,et al.Enzymatic study on the induction of breast ductal differentiation of rubber tree by exogenous jasmonic acid(Ι)[J].Chinese Journal of TropicalCrops,2001,22(3):17-23.
[11]吉田昌一.稻作科学原理[M].厉葆初.杭州:浙江科技出版社,1984:21-28,35-37.
[12]Lichtenthaler H K.Chlorophylls and carotenoids pigments of photosynthetic biomembranes[J].MethodsEnzymology,1987,148:350-382.
[13]张志良,瞿伟菁.植物生理学实验指导[M].3版.北京:高等教育出版社,2003:277-278.
[14]Syros T,Yupsanis T,Zafiriadis H,et al.Activity and isoforms of peroxidases,lignin and anatomy,during adventitious rooting in cuttings ofEbenus creticaL.[J].Journal Plant Physiology.,2004,161(1):69-77.
[15]史自强,胡正海.植物含橡胶组织的制片[J].植物学报,1965,13(2):179-183.Shi Z Q,Hu Z H.The production method of rubbercontaining of plant[J].Acta Botanica Sinica,1965,13(2):179-183.
[16]杨传杰,罗毅,孙林,等.水分胁迫对覆膜滴灌棉花根系活力和叶片生理的影响[J].干旱区研究,2012,29(5):802-810.Yang C J,Luo Y,Sun L,et al.Effects of water stress on cotton root activity and leaf physiology of plastic mulched drip irrigation[J].Arid Zone Research,2012,29(5):802-810.
[17]王利军,李家永,战吉成,等.水杨酸对受高温胁迫的葡萄幼苗光合作用和同化物分配的影响[J].植物生理学通讯,2003,39(3):215-216.Wang L J,Li J Y,Zhan J C,et al.Effects of Salicylic acid on photosynthesis and assimilate distribution of grape seedlings under heat stress[J].Plant Physiology Journal,2003,39(3):215-216.
[18]龚小贵.不同浓度茉莉酸甲酯对马蓝生理与蛋白质的影响[D].福州:福建农林大学,2001.
[19]路文静,李奕松.植物生理学实验教程[M].北京:中国林业出版社,2012:17-20.
[20]Wang L,Mu C,Du M W,et al.The effect of mepiquat chloride on elongation of cotton(Gossypium hirsutumL.)internode is associated with low concentration of gibberellic acid[J].Plant Science,2014,225:15-23.
[21]郭德军,宋蛰存.基于灰度共生矩阵的纹理图像分类研究[J].林业机械与木工设备,2005,33(7):33-34.Guo D J,Song Z C.A study on texture image classifying based on gray-level cooccurrence matrix[J].Forestry Machinery&Woodworking Equipment,2005,33(7):33-34.
[22]郜爱玲,李建安,刘儒,等.高等植物花芽分化机理研究进展[J].经济林研究,2010,28(2):131-136.Gao A L,Li J A,Liu R,et al.Advances in research on flower bud differentiation mechanism in higher plants[J].Nonwood Forest Research,2010,28(2):131-136.
[23]Milioni D,Sado P,Stacey N J,et al.Differential expression of cell wall related genes during the formation of tracheary elements in theZinniamesophyllcellsestem[J].Plant molecular Bioogyl,2001,47(1/2):221-238.
[24]曹婧,李晓荣,王翠,等.外源激素ABA新疆荒漠盐生植物异子蓬异型种子萌发机制 [J].生态学报,2015,35(20):6666-6677.Cao J,Li X R,WANG C,et al.Effects of exogenous abscisic acid on heteromorphic seed germination ofSuaeda aralocaspica,a typical halophyte of Xinjiang desert region[J].Acta Ecologica Sinica,2015,35(20):6666-6677.
[25]田爱梅,王国强,曹家树.莉酸类物质对农作物的生理效应研究[J].安徽农业科学,2008,36(30):13037-13039.Tian A M,Wang G Q,Cao J S.Study on the physiological effects of jasmonates on crops[J].Journal of Anhui Agricultural Sciences,2008,36(30):13037-13039.
[26]刘惠芳.茉莉酸和其它激素对巴西橡胶树乳管分化作用的研究[D].海口:华南热带农业大学,2000.
[27]丛斌,杨茂成,粟波,等.小麦根尖细胞分化过程中木质素合成及其相关酶的活性变化[J].复旦学报(自然科学版),1997,36(5):550-554.Cong B,Yang M C,Li B,et al.Lignin biosynthesis and activity of related enzymes during wheat root tip cells differentiation[J].Jourlal of Fudan Uniersity(Natural Science),1997,36(5):550-554.
[28]徐东花,郭俊娥,徐璐,等.多胺氧化酶活性及木质素沉积与菊花花芽分化的关系[J].华北农学报,2014,29(3):164-169.Xu D H,Guo J E,Xu L,et al.The relationship between polyamine oxidase activity and lignin deposition and chrysanthemum flower bud differentiation[J].Acta Agriculturae Boreali-Sinica,2014,29(3):164-169.
[29]Moerschbacher B,Heck B,Kogel K H.An elicitor of the hypersensitive lignification response in wheat leaves isolated from the rust fungusPuccinia graminisf.s ptriticiⅡ.Induction of enzymes correlated with biosynthesis of lignin[J].Zeitschrift Für Naturorsch,1986,41(9):839-844.
Effects of Methyl jasmonate on physiology,biochemistry and laticifer differentiation ofTaraxacum kok-saghyz
Ma Haixia,He Lina,Hai Chunyan,Cao Xinwen,Lei Jiliang,Yan Jie*,Zhu Jianbo
(College of Life Sciences,Shihezi University,Shihezi,Xinjiang 832003,China)
The objective of this study was to compare the effects of different concentrations of methyl jasmonate (MeJA)on the agronomic traits and the physiological and biochemical indexes ofTaraxacum kok-saghyzRodin (TKS).Analysis was also conducted to determine the relationship between those indexes and laticifer differentiation in TKS.The optimal MeJA concentration was determined to promote laticifer differentiation.One-month-old TKS seedlings were sprayed with 0.25,0.5,1,2,and 5 mmol/L MeJA.In the control treatment,TKS seedlings were sprayed with a 2.2%solution of ethanol in distilled water.The following variables were then measured in each treatment:agronomic traits,leaf chlorophyll content,root activity,endogenous hormone concentration,root phenylalanine ammonialyase (PAL)activity,root lignin content,and number of phloem bundles in the roots.The results showed that MeJA increased taproot length,taproot thickness,and the root shoot ratio,but inhibited leaf growth.Exogenous MeJA also increased leaf chlorophyll,and root activity.In roots,the concentrations of zeatin (ZR),auxin (IAA),and MeJA were significantly greater in the MeJA treatments than in the control.Low MeJA concentrations increased abscisic acid(ABA)and gibberellin (GA3)in roots,whereas high MeJA reduced ABA and GA3.There was no significant difference in 6-benzylaminoadenine(6-BA)between the MeJA treatments and the control.The appropriate concentration of MeJA increased thePAL activity,lignin content and the number of phloem bundles in TKS roots.The 0.25,0.5 and 1 mmol/L MeJA treatments increased the number of phloem bundles by 29.4,35.3,and 47.0%,respectively,compared with the control.In conclusion,MeJA can promote the growth of shoots and roots,thus optimizing their relationship.In roots,MeJA can increase the metabolism of MeJA,GA3,ZR and ABA,PAL activity,and lignin content.Exogenous MeJA at a concentration of 1 mmol/L MeJA can promote the differentiation of TKS roots.
Taraxacum kok-saghyzRodin;Methyl jasmonate;laticifer differentiation
S576;Q945.78
A
10.13880/j.cnki.65-1174/n.2017.04.010
1007-7383(2017)04-0451-07
2016-12-20
国家自然科学基金项目(31360060)
马海霞(1988-),女,硕士研究生,专业方向为植物生长发育代谢调控,e-mail:mahx0819@163.com。
*通信作者:闫洁(1969-),女,副教授,从事生物化学与分子生物学研究,e-mail:jiey@shzu.edu.cn。
