环境温度对无机水合盐相变材料过冷行为的影响机理
2017-09-07马颖刘益才朱晓涵朱声浩
马颖,刘益才,朱晓涵,朱声浩
环境温度对无机水合盐相变材料过冷行为的影响机理
马颖,刘益才,朱晓涵,朱声浩
(中南大学能源科学与工程学院,湖南长沙,410083)
建立过冷度测试装置,通过绘制相变过冷曲线、差示扫描量热曲线(DSC)等,研究环境温度对无机水合盐过冷行为的影响,分析环境温度与相变过冷度、相变驱动力的关系,并提出其影响机理。研究结果表明:相变升温持续时间随环境温度升高而延长,相变开始时间随环境温度升高而延迟,相变过冷度随环境温度升高而降低;相变材料与环境发生热交换损失的热量(ΔE)、成核结晶部位的迁移热(q)作为相变阻力,对无机水合盐过冷行为产生较大影响,导致CaCl2·6H2O相变过冷度随所处环境温度的升高而降低,变化幅度为0.1~19.9 ℃。
相变材料;环境温度;过冷行为
相变储能技术作为有效利用现有能源、优化使用可再生能源和提高能源利用效率的重要技术,已成为当前的交叉热点问题[1−2]。结晶水合盐是低温相变储能材料中的重要一类,具有使用范围广、储热效率高、导热系数大、相变时体积变化小等优点,近年来,受到国内外研究者的广泛重视[3]。六水氯化钙(CaCl2·6H2O) 的相变温度为29.7 ℃,与人体舒适温度相近,相变潜热可达192 J/g,能够较好地满足低温余热资源利用的要求[4]。但无机水合盐相变材料存在不同程度的过冷现象,冷却至相变温度时不能重新结晶放出所储存的热量,严重影响了热物理性能,是水合盐储能技术投入实际应用需要解决的最主要难题之一[5−6],目前主要通过添加成核剂、配制混合无机水合盐、引入外场能量等方法来解决其过冷现象,陈娇 等[7−9]对无机水合盐相变材料结晶动力学和材料的成核作用进行了研究,分析了不同成核剂对降低CaCl2·6H2O过冷度的影响;李刚等[10−11]研究了不同配比的混合水合盐相变材料过冷度特征,比较了不同成核剂、增稠剂对CaCl2·6H2O和MgCl2·6H2O混合盐相变储能材料过冷性质的影响;FANG等[12]通过研究发现超声波能缩短成核诱导期,大幅度降低相变材料过冷度。然而,大部分研究者未将实验结果与实验过程中的环境温度进行关联分析。经研究发现,当环境温度不同时,相变材料的过冷度存在明显的差异[13],且较低环境温度下材料的过冷度普遍比环境温度较高时的过冷度高。TAYLOR等[14]研究了2种相变材料在3种环境温度下的过冷行为,过冷度随环境温度升高而减小,最大相差约16 ℃;张巨松等[15]研究了3种环境温度下相变材料的节能率,发现节能率随环境温度降低而降低,并提出实际使用中应充分考虑环境温度动态变化带来的影响;刘晓宇等[16]研究了典型天气与温度条件下相变温室内的温度、墙表面温度等变化规律;柴国荣等[17−18]研究了相变材料储热能力随环境温度的变化规律。可见,目前对相变材料受环境温度影响的研究主要集中在2~3种典型环境温度下成核剂性能、储热能力等方面,对相变材料过冷度随环境温度连续变化的变化规律、特点及形成内因缺乏深入研究。为此,本文作者研究CaCl2·6H2O相变过程过冷度与环境温度之间的关系,并提出其相变机理。
1 实验材料与方法
1.1 试剂与仪器
实验材料为CaCl2·6H2O,30 g,分析纯,成都市科龙化工试剂厂生产,在实验中作为相变材料。仪器设备如下:CF−C型标准恒温油浴锅,温度控制精度为±0.1℃;HY6002温度记录仪,温度测量范围为−55~125 ℃,测量精度为±0.01 ℃;美国Perkin Elmer差示扫描量热仪(Diamond DSC),量热精度为±0.1%,温度控制精度为±0.01℃,温度范围为−180~725 ℃,氮气保护气氛,升降温速度为0.01~100 ℃/min。测试装置在使用前均已校正。
1.2 实验方法
1.2.1 溶解−冷却实验
采用“步冷曲线法”对相变材料的溶解−冷却行为进行研究,实验装置如图1所示。实验材料均匀置于试管中,将温度记录仪的温度传感器固定于试管中心位置并插入到底部,试管口塞入打孔软木塞。将试管放入恒温油浴锅,油浴温度为95 ℃,加热至试剂变为澄清溶液并稳定10 min后取出,置于包覆了保温材料的密封恒温箱中自然冷却,通过温度记录仪连续采集试管内试剂温度随时间的变化。在实验过程中,恒温箱外的室温为30.0 ℃,恒温箱中放置适量冰,并安装空气对流装置,使箱体内均匀保持设定的环境温度,控制精度为±0.5 ℃。
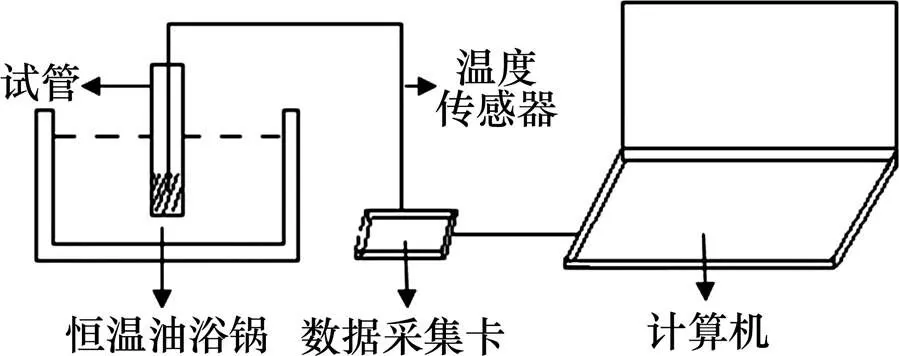
图1 实验装置
为研究温度场影响无机水合盐相变过冷行为的主要因素,本文采用“步冷曲线法”在相同条件下进行平行实验,研究不同环境温度下相变材料过冷行为的变化规律。CaCl2·6H2O试样自然冷却至与恒温箱内环境温度一致,恒温箱内环境温度分别为0,3.0,6.0,9.0,12.0,15.0,18.0,21.0,24.0,27.0和29.5 ℃。
1.2.2 DSC测试
为研究温度场影响无机水合盐相变材料过冷行为的其他因素,采用差示扫描量热仪对试样进行热分析,分析相同环境温度下降温速率等对相变材料过冷行为的影响。室内温度为25 ℃,试样质量为12.260 mg,炉内气体为高纯氮气(质量分数为99.99%),氮气流量为10 mL/min,CaCl2·6H2O试样分别以2,6和10 ℃/min速率从50 ℃匀速降温至−10 ℃。
1.3 实验结果分析
试样温度与时间的关系如图2所示。试样通过油浴加热到90 ℃后,在不同环境温度下自然降温时,均可发生液−固相变,释放出相变潜热,且相变温度差别较大,呈现出以下趋势和规律:液−固相变过程从开始升温至升温结束的持续时间随环境温度升高而延长;当环境温度为24.0~−29.5 ℃时,相变温度与环境温度接近,相变发生时试样与外界环境发生的热交换较少,相变升温峰较平缓,升温持续时间较长,相变时间宽度约为51 min;当环境温度低于24.0 ℃时,相变温度远高于环境温度,试样与外界环境热交换作用明显,相变升温持续时间相对较短,相变升温峰的峰形较尖锐;当环境温度为0 ℃时,相变时间宽度仅为2.7 min。因此,当试样所处的环境温度较高时,相变放热时间持续较长;当所处的环境温度较低时,相变放热时间明显缩短,需通过添加成核剂、引入超声波等外场作用等,以强化其热物理性能。
相变开始时间随环境温度升高而延迟,如图2所示。一方面,环境温度越高,试样从开始降温至发生相变经历时间越长;另一方面,随着环境温度升高,试样发生相变的开始时间差别越大,环境温度为 29.5 ℃;当接近理论相变温度时,试样从第75 min才开始发生相变,而环境温度为18.0 ℃时,试样从11 min即开始发生相变;随着环境温度降低,相变开始时间逐渐接近,当环境温度为0~12.0 ℃时,试样在5~9 min内均可开始发生相变。

环境温度/℃:1—0;2—6.0;3—12.0;4—18.0;5—24.0;6—29 .5。
相变材料过冷度−环境温度关系见图3。从图3可见:相变过冷度随环境温度升高而降低;当环境温度为0~29.5 ℃时,试样发生液−固相变均存在一定程度的过冷现象,且过冷度随环境温度上升而降低;当环境温度为24.0~29.5 ℃时,过冷度可控制在2.4 ℃以内;当环境温度接近其理论相变温度时,过冷度可降低至0.1 ℃;随着环境温度降低,过冷度逐渐增大;当环境温度为0 ℃时,过冷度可达19.9 ℃。因此,当试样所处的环境温度高于24.0 ℃时,相变过冷度较低,可直接作为储能材料使用;当所处的环境温度低于24.0 ℃时,相变过冷度较高,需通过添加成核剂、引入超声波等外场作用来强化其热物理性能。
图4所示为试样的DSC分析结果。试样分别以2,6和10 ℃/min速率从50 ℃均匀降温至−10 ℃,由于试样处于绝热环境,不能与仪器外部发生热交换,且质量仅为12.260 mg,本文近似认为3组实验中试样温度与试样在仪器内所处的环境温度保持同步。如图4所示,3组实验中试样所处的环境温度一致,相变温度也基本一致,均为21 ℃左右,过冷度约为9 ℃。因此,试样过冷度主要取决于环境的起始温度和终点温度,试样的降温速率对过冷度影响较小。

图3 相变材料过冷度与环境温度的关系
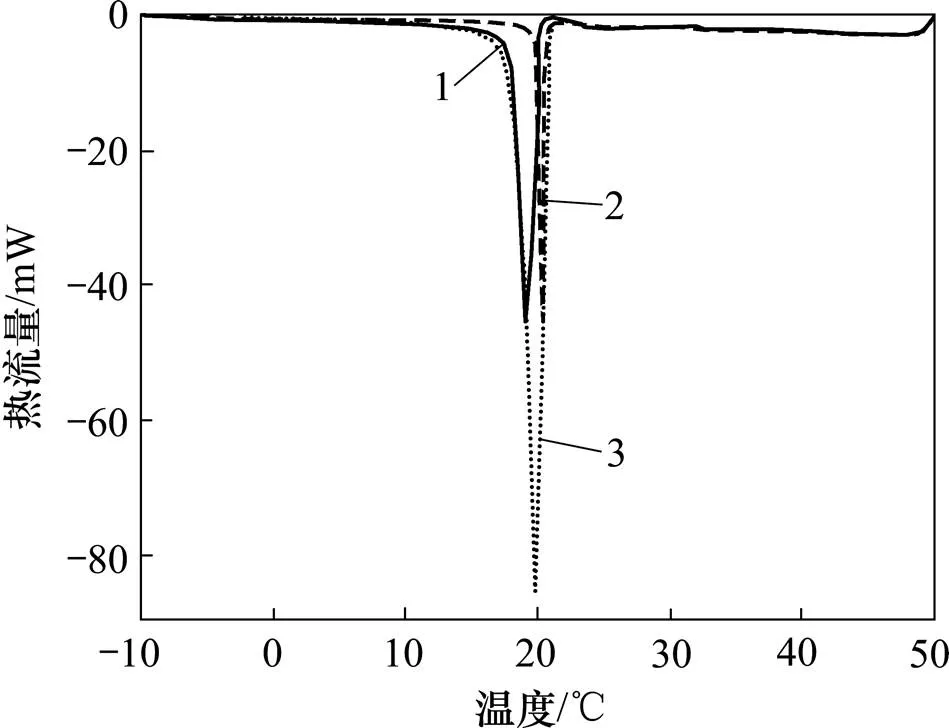
速率/(℃·min−1):1—2;2—6;3—10。
因此,环境温度是影响无机水合盐相变材料过冷度的重要因素。当CaCl2·6H2O作为储能材料在24 ℃以上的环境温度中使用时,过冷度较低,相变升温持续时间较长,基本达到储能材料的性能要求。但当其所处的环境温度低于24 ℃时,随着环境温度降低,相变升温持续时间逐步缩短,过冷度增加,不能满足作为储能材料的要求,需引入添加剂、超声波等外场作用以强化其热物理性能[19]。
2 环境温度对无机水合盐过冷度的影响机理
2.1 环境温度、相变驱动力与过冷度的对应关系式
相变驱动力固−液相单位体积自由能差(ΔV)与过冷度()的关系为[20]
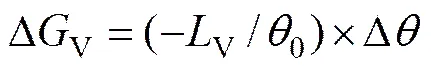
式中:V为相变潜热;为相变临界温度。V和为已知常数,因此,相变驱动力ΔV与过冷度成正比。结合发上实验结果,当环境温度不同时,试样的相变过冷度不同,因此,试样处在不同的环境温度下发生相变时,其相变驱动力不同。计算得到不同环境温度下CaCl2·6H2O相变驱动力ΔV如表1所示。

表1 不同环境温度下CaCl2·6H2O的相变驱动力ΔGV
由表1可知:对于无机水合盐相变材料CaCl2·6H2O,当环境温度为0 ℃到29.5 ℃时,相变驱动力ΔV随环境温度升高而增加。环境温度与相变驱动力的关系式为

联立式(1)与式(2),当环境温度为0~29.5 ℃时,过冷度与环境温度成反比,关系式为
(3)
相变驱动力与环境温度的关系见图5。
2.2 无机水合盐相变过冷机理
根据经典形核理论[21],在凝固过程中,相变驱动力系统自由能变化(Δ)与液固相间的单位体积自由能差(ΔV)、液固相间的界面自由能(ΔS)、液固相间的单位体积应变能()有关,其中ΔV为相变驱动力,ΔS和为相变阻力,过冷度越大,相变驱动力ΔV越大。由热力学可知,ΔV,ΔS和均与试样本身有关,为试样自身温度的函数,与环境温度无关,不随环境温度变化而变化。因此,CaCl2·6H2O发生液−固相变时,当试样温度从某一温度下降至另一较低温度时,无论环境温度如何变化,其自由能变化值Δ为同一固定值。但由实验结果和相关文献报道,体系的过冷度随环境温度变化明显,当试样所处的环境温度越低时,过冷度越高,即CaCl2·6H2O从液态变为固态需要的自由能变化值Δ越大。因此,由于环境温度不一致,试样发生相变时的自由能变化值ΔV并不一致。
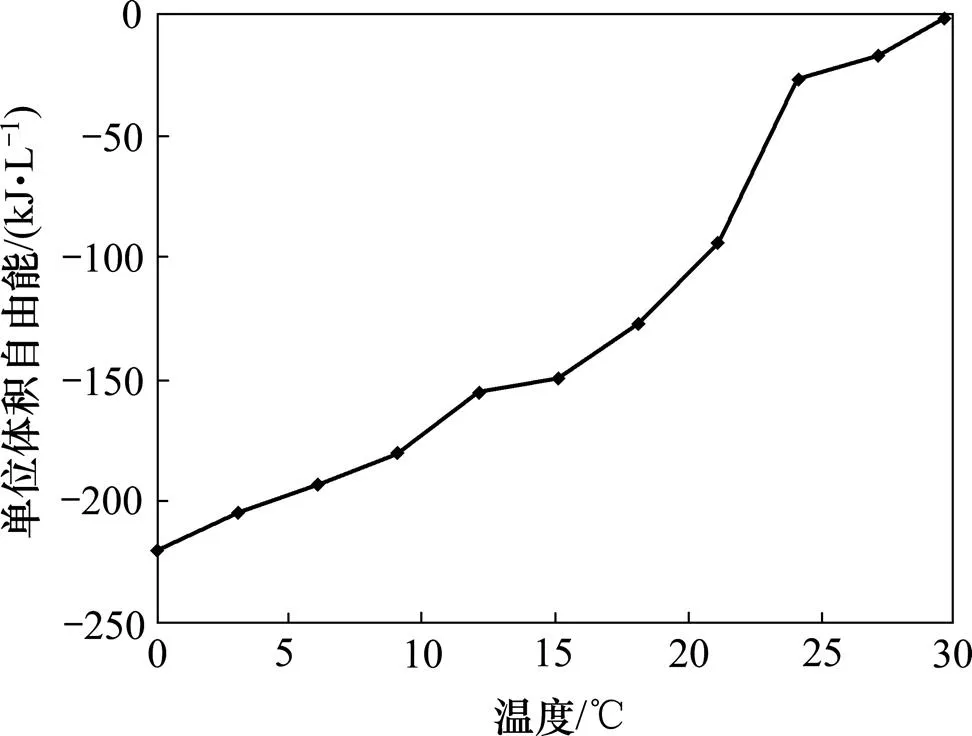
图5 相变驱动力与环境温度的关系
一方面,上述ΔV的差异可能与试样和外界环境的热交换有关。当试样发生相变时,其单位体积自由能ΔV除了需抵消ΔS和外,还需抵消相变材料与环境发生热交换损失的热量ΔE,因此,环境温度越低,需要抵消的能量越多,ΔV越小,过冷度越大。如图4所示,当环境温度的起始和终点温度一致时,相变材料与环境发生热交换损失的热量ΔE一致,此时,尽管3组实验的降温速率不一致,其过冷度仍基本相同。
另一方面,上述Δ的差异可能与试样内部的热扩散作用有关。试样在试管中从90 ℃开始持续降温,由于降温方式为自然降温,试样与试管交界处的温度、试样中心部位、成核结晶部位均存在一定温度梯度,温度梯度受试样的几何外形、体积影响,能量由试样热端自发向冷端发生迁移。试样发生相变时,其单位体积自由能ΔV还需抵消成核结晶部位损失的迁移热q。环境温度越低,试样中心部位与试管壁处的温度梯度越大,试样内部发生的热扩散作用越强烈,成核结晶部位损失的迁移热q越多,导致ΔV越小,过冷度越大。成核结晶部位的迁移热q[22]为
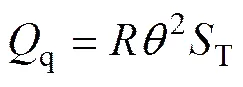
式中:T为热扩散系数(J/s)。综上所述,无机水合盐液−固相变过程体系自由能变化值Δ还与ΔE和q有关,ΔV为相变推动力,ΔS,,ΔE和q为相变阻力。环境温度越低,相变阻力ΔE和q越高,体系相变过冷度越大。
(5)
3 结论
1) 相变升温持续时间随环境温度升高而延长,相变开始时间随环境温度升高而延迟,相变过冷度随环境温度降低而增大。因此,在研究无机水合盐相变材料性能时,应与其使用时所处的环境温度相结合。
2) 提出了环境温度影响相变材料过冷度的机理。当环境温度越低时,试样在相变过程中与外界环境热交换损失能量ΔE、成核结晶部位的迁移热(q)越高,相变阻力越大,因此,导致单位体积自由能越小,过冷度越高。
3) 环境温度的起始温度和终点温度对无机水合盐相变过冷度影响较大,液−固相变时试样的降温速度与过冷度无关。
4) CaCl2·6H2O作为储能材料在24.0 ℃以上的环境温度中使用时,基本可达到作为储能材料的性能要求。在低于24.0 ℃以下的环境温度中使用时,需考虑引入添加剂、超声波等外场作用,以强化其热物理性能。
5) 建立了特定实验体系下,环境温度为0~29.5 ℃时,CaCl2·6H2O相变驱动力、环境温度与过冷度之间的关系式。
[1] 李传, 葛志伟, 金翼, 等. 基于复合相变材料储热单元的储热特性[J]. 储能科学与技术, 2015, 4(2): 169−175. LI Chuan, GE Zhiwei, JIN Yi, et al. Heat transfer behaviour of thermal energy storage components using composite phase change materials[J]. Energy Storage Science and Technology, 2015, 4(2): 169−175.
[2] HUANG Jin, WANG Tingyu. Molecular dynamics simulations of melting behaviour of n-hexacosane as phase change material for thermal energy storage[J]. Asian Journal of Chemistry, 2013, 25(4): 1839−1841.
[3] 顾晓滨, 秦善, 牛菁菁. 相变储能矿物材料研究现状及其展望[J]. 矿物岩石地球化学通报, 2014, 33(6): 932−940. GU Xiaobin, QIN Shan, NIU Jingjing. Research status and prospect on phase change mineral materials[J]. Bullitin of Mineralogy Petrology and Geochemistry, 2014, 33(6): 932−940.
[4] KASHAVER S H. Nuclear magnetic resonance relaxometry and thermoelectrodynamic spectroscopy study of heat accumulating/ emitting salt Cacl2·6H2O[J]. Chemical and Materials Engineering, 2014, 2(3): 51−57.
[5] 铁生年, 柳馨, 铁健. 相变储能材料的腐蚀性与封装材料研究进展[J]. 材料导报A:综述篇, 2015, 29(6): 138−143. TIE Shengnian, LIU Xin, TIE Jian. Research progress of corrosivity of phase change material and relevant packaging materials[J]. Materials Review A: Summary, 2015, 29(6): 138−143.
[6] 李海丽, 季旭, 冷从斌. 膨胀石墨/五水硫代硫酸钠相变储能复合材料热性能[J]. 复合材料学报, 2016, 33(12): 2941−2951. LI Haili, JI Xu, LENG Congbin. Thermal performance of EG/Na2S2O3·5H2O phase change energy storage composite[J]. Acta Materiae Compositae Sinica, 2016, 33(12): 2941−2951.
[7] 陈娇, 张焕芝, 孙立贤, 等. CaCl2·6H2O/多孔Al2O3复合相变材料的制备与热性能[J].应用化工, 2014, 43(4): 590−593. CHEN Jiao, ZHANG Huanzhi, SUN Lixian, et al. Preparation and thermal properties of calcium chloride hexahydrate multiporous alumina composites as phase change materials[J]. Applied Chemical Industry, 2014, 43(4): 590−593.
[8] 孔德玉, 潘罗晟, 詹树林, 等. 无机水合盐相变陶粒的制备与性能[J]. 硅酸盐学报, 2016, 44(7): 1051−1058.KONG Deyu, PAN Luoshen, ZHAN Shulin, et al. Preparation and properties of phase change ceramisite loaded with inorganic[J]. Journal of the Chinese Ceramic Society, 2016, 44(7): 1051−1058.
[9] 赵有璟, 时历杰, 康为清, 等. 相变温度可调的无机混盐体系相变储能材料[J]. 材料科学与工程学报, 2014, 32(1): 79−84. ZHAO Youjing, SHI Lijie, KANG Weiqing, et al. Preparation of PCMs with adjustable phase-change temperatures by mixed inorganic hydrated salts[J]. Journal of Materials Science and Engineering, 2014, 32(1): 79−84.
[10] 李刚, 孙庆国, 韩继龙. CaCl2·6H2O-MgCl2·6H2O相变材料的改性研究[J]. 太阳能学报, 2016, 37(1): 147−151.LI Gang, SUN Qingguo, HAN Jilong. The modification research of CaCl2·6H2O-MgCl2·6H2O PCM[J]. Acta Energiae Solaris Sinica, 2016, 37(1): 147−151.
[11] 祝丹婷, 钱静, 蔡蓉. 混合水合盐作为储热相变材料的热物性能研究[J]. 包装工程, 2015, 36(1): 65−69.ZHU Danting, QIAN Jing, CAI Rong. Thermal characteristics of hydrated salt mixture as a phase change material for heat storage[J]. Packaging Engineering, 2015, 36(1): 65−69.
[12] FANG Yutang, LIU Xin, LIANG Xianghui, et al.Ultrasonic synthesis and characterization of polystyrene/n-dotriacontane composite nanoencapsulated phase change material for thermal energy storage[J]. Applied Energy, 2014, 132(11): 551−556.
[13] 盛强, 邢玉明, 王泽. 成核剂对八水氢氧化钡相变材料过冷度的影响[J]. 化工新型材料, 2015, 43(2): 100−102. SHENG Qiang, XING Yuming, WANG Ze.Influence of nucleating agents on the supercooling of Ba(OH)2·8H2O as phase change material[J]. New Chemical Materials, 2015, 43(2): 100−102.
[14] TAYLOR R A, NAOMI T. Experimental characterisation of sub-cooling in hydrated salt phase change materials[J]. Applied Thermal Engineering, 2016, 93: 935−938.
[15] 张巨松, 刘志鑫, 黄灵玺. 相变材料在不同条件下节能效果的实验[J]. 沈阳建筑大学学报(自然科学版), 2013, 29(1): 116−119. ZHANG Jusong, LIU Zhixing, HUANG Linxi. Experimental study on the energy-saving effects of PCM in the different conditions[J]. Journal of Shenyang Jianzhu University (Natural Science), 2013, 29(1): 116−119.
[16] 刘晓宇, 何翠, 杜亮. 相变材料墙体在郑州地区下沉式日光温室中的保温作用[J]. 中国农业气象, 2014, 35(2): 174−179. LIU Xiaoyu, HE Cui, DU Liang. Heat preservation experimental study on phase change wall materials for sinking solar greenhouse in Zhengzhou[J]. Chinese Journal of Agrometeorology, 2014, 35(2): 174−179.
[17] 柴国荣. 外贴定形相变材料的混凝土墙体节能特性分析[J]. 山西建筑, 2015, 41(1): 191−192. CHAI Guorong. Energy saving characterisitics analysis on concrete wall with shape-stabled PCM[J]. Shanxi Architecture, 2015, 41(1): 191−192.
[18] 盛强, 邢玉明. Ba(OH)2·8H2O/泡沫铜相变复合材料的制备及传热性能[J]. 复合材料学报, 2014, 31(6): 1566−1572. SHENG Qiang, XING Yuming. Preparation and heat transfer performance of Ba(OH)2·8H2O/copper foam phase change composites[J]. Acta Materiae Compositae Sinica, 2014, 31(6): 1566−1572.
[19] 张晓燕. 材料科学基础[M]. 2版. 北京: 北京大学出版社, 2014: 188. ZHANG Xiaoyan. Material science foundation[M]. 2nd ed. Beijing: Peking University Press, 2014: 188.
[20] 李晓野. 温室无机相变材料性能优化研究[J].安徽农业科学, 2015, 43(26): 366−368. LI Xiaoye. Study on Performance optimization of inorganic phase change materials in greenhouse[J]. Journal of Anhui Agriculture Science, 2015, 43(26): 366−368.
[21] 徐祖耀, 金学军, 张骥华. 材料相变[M]. 1版. 北京: 高等教育出版社, 2013: 79. XU Zuyao, JIN Xuejun, ZHANG Jihua. Material phase transition[M]. 1st ed. Beijing: Higher Education Press, 2013: 79.
[22] 程晓农, 戴起勋, 邵红红. 材料固态相变与扩散[M]. 1版. 北京: 化学工业出版社, 2006: 145. CHEN Xiaonong, DAI Qixun, SHAO Honghong. Material solid-state phase transformation and diffusion[M]. 1st ed. Beijing: Chemical Industry Press, 2006: 145.
(编辑 陈灿华)
Influence mechanism of ambient temperature on inorganic salt hydrate PCM subcooling behavior
MA Ying, LIU Yicai, ZHU Xiaohan, ZHU Shenghao
(School of Energy Science and Engineering, Central South University, Changsha 410083, China)
Subcooling testing device was established, cooling curve and DSC diagram were drawn to research the influence of ambient temperature on inorganic salt hydrate PCM subcooling behavior,the relationship among ambient temperature, subcooling and phase change driving force were analyzed, and the mechanism was proposed. The results show that with the increase of the ambient temperature, the heat release duration of phase change increases, the phase change start time postpones, and the subcooling decreases. ΔEandqwhich are taken as phase change resistance have impact on subcooling behavior of inorganic salt hydrate PCM, which leads subcooling temperature of CaCl2·6H2O to reduce with the increase of the ambient temperature, and the temperature varying range is 0.1−19.9 ℃.
phase change material; ambient temperature; subcooling behavior
10.11817/j.issn.1672-7207.2017.07.33
TG113.1
A
1672−7207(2017)07−1930−06
2017−01−13;
2017−03−20
国家自然科学基金资助项目(51276201);湖南省2015年省重点研发计划项目(2015JC3047) (Project(51276201) supported by the National Natural Science Foundation of China; Project(2015JC3047) supported by 2015 Priority Research of Hunan Province)
刘益才,博士,教授,从事热声热机、斯特林制冷机、高效蓄冷蓄热材料、微型低温制冷机以及微型制冷系统振动和噪声抑制等研究;E-mail: lyccsu@csu.edu.cn
