右美托咪定应用于法洛四联症患儿术后辅助拔管的可行性研究
2017-09-06杨琦梅举汤敏
杨琦 梅举 汤敏
药物与临床
右美托咪定应用于法洛四联症患儿术后辅助拔管的可行性研究
杨琦 梅举 汤敏
作者单位:200092 上海市,上海交通大学医学院附属新华医院心胸外科
目的 比较吗啡-咪唑安定二联镇静与右美托咪定单联镇静对婴幼儿先天性心脏病法洛四联症术后拔管的影响。方法 回顾分析我院2014年1月至2015年12月期间婴儿期行法洛四联症(TOF)根治术的68例患儿的临床资料,其中男性39例、女性29例,月龄6.2~15.5(10.1±2.1)个月。根据术后镇静方案分为吗啡-咪唑安定组(A组)32例和右美托咪定组(B组)36例。A、B两组皆在术后出现自主呼吸或肢体活动后开始镇静治疗。A 组给予吗啡 0.1~0.5 mg·kg-1·h-1、咪唑安定 0.1~0.5 mg·kg-1·h-1,当患儿开始呼吸锻炼时停药;B组给予右美托咪定0.2~0.7 μg·kg-1·h-1,应用至患儿拔管后1 h。比较各时间心率(HR)和平均动脉压(MAP),拔管时两组患儿的Ramsay评分,拔管后2 h二插发生率及拔管相关并发症的发生情况。结果A、B两组人口统计学及手术情况数据未见统计学差异。两组患儿均拔除气管插管,无院内死亡。B组拔管时间(20.18±5.84)h,明显短于 A 组(36.12±9.42)h(P<0.05),且拔管时 B 组患儿较 A 组患儿更能配合拔管指令。对循环的影响,两组患儿在镇静镇痛药物应用期间,HR、MAP未见统计学差异。A组患儿自拔管时起,HR及MAP上升显著,明显高于B组患儿(P<0.05),后逐步下降,HR至拔管后6 h、MAP至拔管后2 h方与B组差异减小(P>0.05)。B组患儿自右美托咪定应用起至拔管6 h期间,各时间点记录HR及MAP数值均未见统计学差异(P>0.05)。A组患儿拔管后2 h内有3例发生拔管相关并发症(呼吸抑制1例、严重喉头水肿2例),均二次插管;B组患儿未发生拔管相关并发症。结论 右美托咪定用于先天性心脏病法洛四联症术后辅助拔管效果满意,优于吗啡-咪唑安定二联镇静。
右美托咪定; 先天性心脏病; 拔管
法洛四联症(tetralogy of Fallot,TOF)是临床上常见的青紫型先天性心脏病[1],大部分患儿需要在婴幼儿期接受外科手术矫治,并且如果在术后24 h内患儿氧合满意、血流动力学平稳可以尝试拔除气管,恢复自主呼吸[2-4]。过去我科使用吗啡联合咪唑安定作为术后镇静镇痛药物,在开始呼吸锻炼时停药。停药后婴幼儿患者缺乏临床配合能力,躁动不安、呼吸抑制,往往使拔管过程延长,甚至不成功。2015年1月起我科开始尝试应用右美托咪定作为TOF患儿术后镇静镇痛药物。现对2014年1月至2015年12月在我科进行一期TOF根治患儿的临床资料进行回顾分析,并前后对比,探索右美托咪定应用于TOF患儿辅助拔管的可行性。
1 资料与方法
1.1 一般资料 共有68例患儿入选本次研究。对于不应用镇静镇痛药物即拔除气管插管、接受姑息手术、接受二次手术、术前即存在肝肾功能损害、术前存在Ⅱ度或Ⅲ度房室传导阻滞的患儿不纳入本次研究。患儿术前人口统计学资料见表1。
1.2 方法 患儿在接受外科根治术后入ICU,常规给予镇静镇痛治疗。A组为对照组,共32例,术后给予吗啡联合咪唑安定;B组为右美托咪定组,共36例,术后给予右美托咪定。A、B两组皆在术后出现自主呼吸或肢体活动后开始镇静镇痛治疗。A组给予咪唑安定 0.1~0.5 mg·kg-1·h-1、吗啡0.1~0.5 mg·kg-1·h-1,当患儿开始呼吸锻炼时停药;B 组给予右美托咪定 0.2~0.7 μg·kg-1·h-1,应用直至患儿拔管后1 h。定义苏醒时间为患儿入ICU到开始呼吸锻炼的时间;拔管时间为入ICU到拔除气管插管的时间。分别记录两组患儿苏醒时间及拔管时间。记录各时间点(镇静镇痛药物应用前、应用后1 h、2 h、6 h,拔管时,拔管后 1 h、2 h、6 h 分别标记为 T0、T1、T2、T3、T4、T5、T6、T7)心率(HR)、平均动脉压(MAP);记录拔管时两组患儿的Ramsay评分,以2~4分为理想镇静深度,可以配合拔管指令;记录拔管后2 h二插发生率及拔管相关并发症的发生情况。
1.3 统计学方法 采用SPSS 19.0统计软件包进行统计学处理。所有计量资料均符合正态分布,以±s表示,采用配对t检验、独立样本t检验进行统计分析;计数资料采用χ2检验进行统计分析。P<0.05为差异有统计学意义。
2 结果
所有患儿皆在全麻体外循环下接受TOF根治术。两组患儿手术及术后心功能情况见表1。两组患儿均拔除气管插管,无院内死亡。
综合分析两组临床病史资料,结果如下。
2.1 对拔管相关指标的影响 比较两组患儿苏醒时间,A 组为(1.74±1.59)h,B 组为(1.97±1.32)h(P>0.05);拔管时间 A 组为(36.12±9.42)h,B 组为(20.18±5.84)h(P<0.05)。比较两组患儿在拔管时Ramsay评分,A组32例患儿中18例达到理想镇静深度,B组36例患儿中33例达到理想镇静深度(P<0.05)。由此可见,两组患儿苏醒时间未见差异;B组呼吸锻炼时间明显短于A组,且拔管时患儿更能配合拔管指令。
2.2 两组患儿HR、MAP变化情况 两组患儿在镇静镇痛药物应用期间(T0、T1、T2、T3),HR、MAP 数值未见统计学差异(P>0.05)。A组患儿自拔管时起(T4),HR及MAP上升显著,明显高于B组患儿(P<0.05),后逐步下降,HR 至拔管后 6 h(T7)、MAP至拔管后2 h(T6)方与B组差异减小(P>0.05)。B组患儿自右美托咪定应用起至拔管6 h期间,各时间点记录HR及MAP数值均未见统计学差异(P>0.05)。见表2。 由此可见,在围气管插管期,B组患儿较A组患儿循环波动小,更为稳定。
表1 两组患儿统计学资料及手术情况比较(±s)

表1 两组患儿统计学资料及手术情况比较(±s)
注:A组:对照组;B组:右美托米定组。McGoon比=(左肺动脉在肺段动脉分支前的直径+右肺动脉在肺段动脉分支前的直径)/降主动脉膈肌水平的直径;LVEF:左心室射血分数;LVFS:左心室缩短率;SpO2:血氧饱和度
术后LVFS(%)A 组 32 19/13 9.8±1.9 8.5±2.7 1.38±1.80 64.7±4.3 32.7±2.2 70.9±8.2 92.0±16.4 61.7±13.0 61.1±6.9 30.6±3.3 B 组 36 20/16 10.5±2.2 9.2±2.2 1.34±1.81 66.6±5.4 33.6±2.7 73.6±9.3 96.2±20.5 59.9±11.0 63.5±6.8 31.1±3.4 P值组别 例数 男/女 月龄(月)体重(kg)McGoon比术前LVEF(%)术前LVFS(%)术前SpO2体外循环时间(min)主动脉阻断时间(min)术后LVEF(%)0.89 0.17 0.18 0.31 0.13 0.13 0.20 0.35 0.53 0.15 0.49
2.3 拔管后情况 A组患儿拔管后2 h内有3例患儿发生二次插管,原因分别为呼吸抑制1例、严重喉头水肿2例;B组患儿有1例2 h内二次插管,原因为心功能不全导致肺水肿。
A、B两组患儿术后ICU滞留时间分别为(7.1±2.2)d和(5.4±2.0)d,术后住院总时间分别为(14.2±3.2)d 和(11.1±3.5)d,B 组均显著少于 A 组,差异有统计学意义(P<0.05)。
3 讨论
随着心脏外科监护水平的不断提高,越来越多的临床医生开始注意到术后快通道治疗方案的重要性[5-7]。术后快通道治疗包括早期拔除气管插管、早期拔除各类植入性导管及早期喂养[8],而快通道治疗的核心是早期拔除气管插管。大量国内外研究证实,术后快通道治疗可以有效地降低包括围术期呼吸机相关肺炎在内的各类并发症的发生,优化患儿的预后[2,5-8]。右美托咪定作为新一代高选择性α2肾上腺素能激动剂,通过激动位于蓝斑的肾上腺素能受体,在镇静的同时兼有抗焦虑及镇痛作用。相对于传统的阿片类、苯二氮卓类、丙泊酚等药物,右美托咪定不抑制呼吸,因此在呼吸锻炼、撤机拔管的过程中无需停药。目前右美托咪定被广泛应用于成人心脏术后早期拔管的镇静镇痛治疗中。研究表明,右美托咪定应用于拔管期不影响患者苏醒时间,能够显著缩短气管插管时间,提高拔管成功率[9-11]。
国内学者对先天性心脏病术后应用右美托咪定进行围术期镇静镇痛的研究进行了Meta分析。该分析包括了5项随机对照研究和9项临床观察研究,共有2229例患者入选。结果显示,婴幼儿先天性心脏病术后应用右美托咪定较应用阿片类药物,血流动力学更为平稳,能够显著改善患儿的预后[12]。Lam等[13]回顾分析了34例先天性心脏病术后及16例心脏移植术后患儿应用右美托咪定的临床资料,结果显示,右美托咪定不仅能够维持血流动力学平稳,更能减少同期正性肌力药物的剂量。另外,大量国内外的文献报道,婴幼儿围术期应用右美托咪定能够显著缩短机械通气时间,这可能与应用右美托咪定能减少同期阿片类、苯二氮卓类镇静镇痛药物用量,减少呼吸抑制的发生有关[14-16]。本研究也得到类似的结果,并且本研究结果还显示,拔管期给予单联右美托咪定即可以达到理想的镇静深度,配合拔管,且未发生喉头水肿、呼吸抑制等拔管相关并发症,未发生二次插管。
本研究中使用右美托咪定的剂量范围是0.2~0.7μg·kg-1·h-1。虽然在右美托咪定应用初期出现了不同程度的HR、MAP下降,但各时间点的变化都未见统计学差异,且都无需临床干预处理。国内外文献报道显示,在 0.1~1.4 μg·kg-1·h-1的剂量范围内,婴幼儿应用右美托咪定安全可靠[17-19]。Su等[20]的研究还显示,在 0.25~0.75 μg·kg-1·h-1的剂量范围内,剂量越大,拔除气管插管时间越短,这可能是因为高剂量组同期应用其他镇静药物较少,且高剂量组呼吸锻炼过程中患儿的舒适度更高,更能配合拔管指令。应用右美托咪定常见的不良反应是低血压及心动过缓[18,20,21]。低血压一般给予补充容量即可恢复,不需要增加正性肌力药物剂量。心动过缓也多在正常范围低限,不需要特殊处理,甚至有学者认为适当的心率下降,减少了心脏做功,能够改善预后[22,23]。
表2 两组患儿术后各时间点HR、MAP比较(±s)
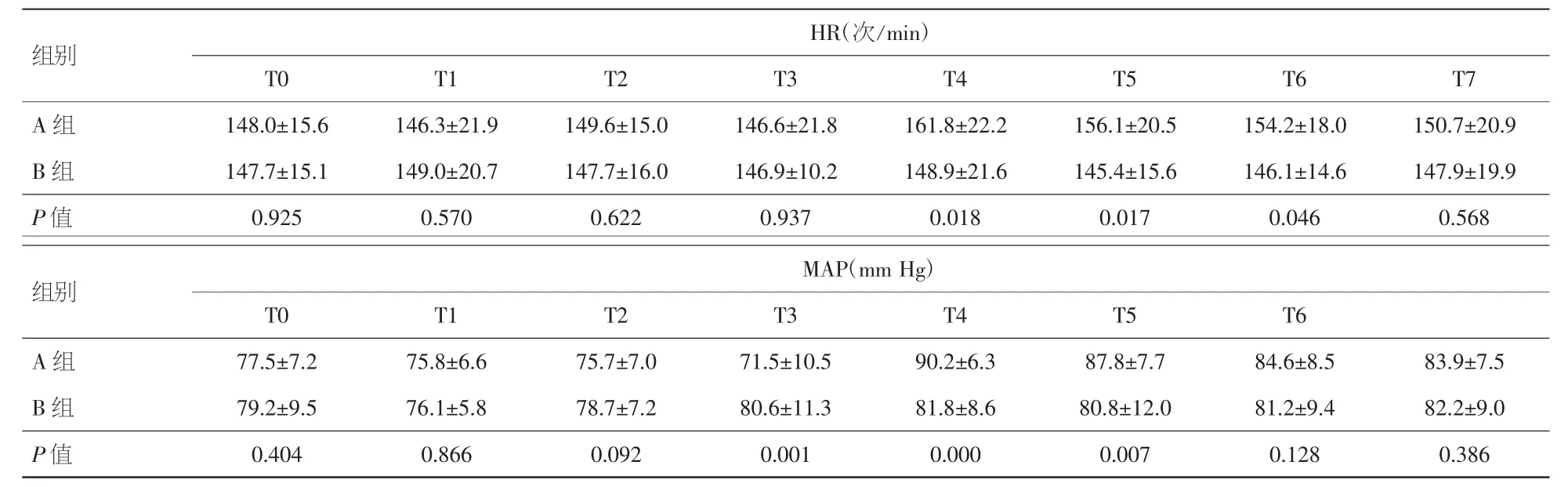
表2 两组患儿术后各时间点HR、MAP比较(±s)
注:A组:对照组;B组:右美托米定组;HR:心率;MAP:平均动脉压
HR(次/min)T0 T1 T2 T3 T4 T5 T6 T7 A 组 148.0±15.6 146.3±21.9 149.6±15.0 146.6±21.8 161.8±22.2 156.1±20.5 154.2±18.0 150.7±20.9 B 组 147.7±15.1 149.0±20.7 147.7±16.0 146.9±10.2 148.9±21.6 145.4±15.6 146.1±14.6 147.9±19.9 P值 0.925 0.570 0.622 0.937 0.018 0.017 0.046 0.568组别MAP(mm Hg)T0 T1 T2 T3 T4 T5 T6 A 组 77.5±7.2 75.8±6.6 75.7±7.0 71.5±10.5 90.2±6.3 87.8±7.7 84.6±8.5 83.9±7.5 B 组 79.2±9.5 76.1±5.8 78.7±7.2 80.6±11.3 81.8±8.6 80.8±12.0 81.2±9.4 82.2±9.0 P值 0.404 0.866 0.092 0.001 0.000 0.007 0.128 0.386组别
因此,右美托咪定单联方案用于先天性心脏病法洛四联症术后辅助拔管效果满意,优于吗啡-咪唑安定二联镇静方案。
[1]Karl TR,Stocker C.Teralogy of Fallot and its variants.Pediatr Crit Care Med,2016,17:s330-336.
[2]Rajaqopal SK,Thiaqarajan RR.Perioperative care of children with tetralogy of fallot.Curr Treat Options Cardiovasc Med,2011,13:464-475.
[3]Mahle WT,Jacobs JP,Jacobs ML,et al.Early Extubation After Repair of Tetralogy of Fallot and the Fontan Procedure:An Analysis of The Society of Thoracic Surgeons Congenital Heart Surgery Database.Ann Thorac Surg,2016,102:850-858.
[4]Li S,Zhang Y,Li S,et al.Risk Factors Associated with Prolonged Mechanical Ventilation after Corrective Surgery for Tetralogy of Fallot.Congenit Heart Dis,2015,10:254-262.
[5]Akhtar MI,Hamid M,Minai F,et al.Safety profile of fast-track extubation in pediatric congenital heart disease surgery patients in a tertiary care hospital of a developing country:An observational prospective study.J Anaesthesiol Clin Pharmacol,2014,30:355-359.
[6]Akhtar MI,Hamid M,Anwar-UI-Haq,et al.Feasibility and safety of on table extubation after corrective surgical repair of tetralogy of Fallot in a developing country:a case series.Ann Card Anaesth,2015,18:237-241.
[7]Howard F,Brown KL,Garside V,et al.Fast-track paediatric cardiac surgery:the feasibility and benefits of a protocol for uncomplicated cases.Eur J Cardiothorac Surg,2010,37:193-196.
[8]Yamasaki Y,Shime N,Miyazaki T,et al.Fast-track postoperative care for neonatal cardiac surgery:a single-institute experience.J Anesth,2011,25:321-329.
[9]Arpino PA,Kalafatas K,Thompson BT.Feasibility of dexmedetomidine in facilitating extubation in the intensive care unit.J Clin Pharm Ther,2008,33:25-30.
[10]Gupta S,Singh D,Sood D,et al.Role of dexedetomidine in early extubation of the intensive care unit patients. J Anaesthesiol Clin Pharmacol,2015,31:92-98.
[11]李静,董补怀,郝定均.盐酸右美托咪定在全身麻醉患者围拔管期的临床疗效.中南大学学报:医学版,2015,40:898-901.
[12]Pan W,Wang Y,Lin L,et al.Outcomes of dexmedetomidine treatmentin pediatric patientsundergoing congenitalheart disease surgery:a meta-analysis.Paediatr Anaesth,2016,26:239-248.
[13]Lam F,Bhutta AT,Tobias JD,et al.Hemodynamic effects of dexmedetomidine in critically ill neonates and infants with heart disease.Pediatr Cardiol,2012,33:1069-1077.
[14]Jiang L,Ding S,Yan H,et al.A retrospective comparison of dexmedetomidine versus midazolam for pediatric patients with congenital heart disease requiring postoperative sedation.Pediatr Cardiol,2015,36:993-999.
[15]Cheng X,Zuo Y,Zhao Q,et al.Comparison of the Effects of Dexmedetomidine and propofol on hemodynamics and oxygen balance in children with complex congenitalheartdisease undergoing cardiac surgery.Congenit Heart Dis,2015,10:E123-130.
[16]Chrysostomou C,Di Fillippo S,Manrique AM,et al.Use of dexmedetomidine in children after cardiac and thoracic surgery.Pediatr Crit Care Med,2006,7:126-131.
[17]Oschman A,McCabe T,Kuhn RJ.Dexmedetomidine for opioid and benzodiazepine withdrawal in pediatric patients.Am J Health Syst Pharm,2011,68:1233-1238.
[18]Gupta P,Whiteside W,Sabati A,et al.Safety and efficacy of prolonged dexmedetomidine use in critically ill children with heart disease.Pediatr Crit Care Med,2012,13:660-666.
[19]Burbano NH,Otero AV,Berry DE,et al.Discontinuation of prolonged infusions of dexmedetomidine in critically ill children with heart disease.Intensive Care Med,2012,38:300-307.
[20]Su F,Nicolson SC,Zuppa AF.A dose-response study of dexmedetomidine administered as the primary sedative in infants following open heart surgery.Pediatr Crit Care Med,2013,14:499-507.
[21]Eremenko AA,Chernova EV.Dexmedetomidine use for intravenous sedation and delirium treatment during early postoperative period in cardio-surgical patients.Anesteziol Reanimatol,2013,5:4-8.
[22]Haseqawa T,Oshima Y,Maruo A,et al.Dexmedetomidine in combination with midazolam after pediatric cardiac surgery.Asian Cardiovasc Thorac Ann,2015,23:802-808.
[23]Constantin JM,Momon A,Mantz J,et al.Efficacy and safety of sedation with dexmedetomidine in critical care patients:a meta-analysis of randomized controlled trials.Anaesth Crit Care Pain Med,2016,35:7-15.
Feasibility of Dexmedetomidien in facilitating mextubation in infants after TOF repair operation
YANG Qi,MEI Ju,TANG Min.Department of Cardiothoracic Surgery,Xinhua Hospital Affiliated to Shanghai Jiaotong University School of Medicine,Shanghai 200092,China
MEI Ju,E-mail:ju_mei@yahoo.cn
ObjectiveTo compare the outcome between two sedation methods,Morphine-Midazolam and Dexmedetomidine,in infants after TOF repair operation.MethodsWe retrospectively analyzed the clinical data of 68 infants who underwent TOF repair operation in Xinhua Hospital in 2014 and 2015.There were 39 males and 29 females aged 6.2-15.5(10.1±2.1)months.Sedation support was started when the patients started to breathe spontaneously or had body movement.There were 32 patients in group A with Morphine-Midazolam(Morphine 0.1-0.5 mg·kg-1·h-1,Midazolam 0.1-0.5 mg-1·kg·h-1),and 36 patients in group B with Dexmedetomidine 0.2 ~0.7 μg·kg-1·h-1.In group A,the sedation support stopped when the patients started breathing exercises.While in group B,the sedation support was given until 1 h after extubation.ResultsThere was no statistical difference between two groups in demography data and operative data.The extubation time was shorter in group B(36.12 h vs 20.18 h,P<0.05).Patients in group B were more likely to cooperate the extubation.There was no difference in HR and MAP before the extubation.In group A,HR and MAP increased from the extubation,and then fell gradually.There was no difference between two groups in HR until 6 h after extubation and in MAP until 2 h after extubation.In group B,HR and MAP changed more smoothly.After extubation,there were 3 patients reintubated in group A due to the extubation related complications(Respiratory depression in 1 patient,severe laryngeal edema in2 patients),while none was reintubated in group B.ConclusionThe sedation method,Dexmedetomidine,is better than Morphine-Midazolam for infants after TOF repair operation.
Dexmedetomidine; Congenital heart disease; Extubation
梅举,E-mail:ju_mei@yahoo.cn
10.3969/j.issn.1672-5301.2017.02.019
R654.2
A
1672-5301(2017)02-0165-04
2016-09-06)
