CK2α通过PI3K/Akt/GSK-3β信号通路调控肺腺癌A549细胞的侵袭及迁移
2017-09-05吴爱兵黎明春麦宗炯李姝君杨志雄
吴爱兵 黎明春 麦宗炯 李姝君 杨志雄
肺癌已成为全球癌症相关性死亡的首要原因之一,每年肺癌的新发病例人数与死亡病例人数都在逐渐增加,每年约有160万人死于肺癌[1]。而非小细胞肺癌(non-small cell lung cancer, NSCLC)在所有肺癌类型中所占比例将近85%,是最常见的发病类型,其中肺腺癌是主要的病理类型。超过57%的患者被发现时已被诊断为肺癌晚期。已有远处转移的晚期患者,5年生存率<5%,中位生存时间<12个月。远处转移是导致肺癌患者的死亡原因之一,因此研究NSCLC的侵袭转移的机制具有重要意义。
蛋白激酶CK2,曾称为酪蛋白激酶2或II(casein kinase 2 or II),是一种高度保守信使非依赖性丝氨酸苏氨酸蛋白激酶。它是由两个催化亚基(α/α’)和两个调节亚基β构成的不均一四聚体[2,3]。CK2是一种多功能的蛋白激酶,其磷酸化底物具有多样性,迄今已发现它有300多种底物[4],涉及到细胞的生长、增殖、凋亡、分化、侵袭和转移[5-7]。研究发现CK2在肾癌[8]、肺癌[9]、头颈部癌[10]、前列腺癌[11]、乳腺癌[12]、大肠癌[13]、白血病[14]等多种肿瘤中高表达。CK2通过磷酸化它的底物促进肿瘤细胞的增殖、侵袭和转移,而抑制细胞凋亡,在肿瘤的发生发展中起重要作用。Kim等[15]发现在肺癌细胞株A549中,CK2抑制剂CX-4945能抑制Smad2/3、Twist、Snail、Akt等调节上皮-间充质转化(mesenchymal-to-epithelial transition, EMT)的整个过程,可以抑制A549细胞的迁移和侵袭并伴有MMP-2和MMP9的下调。Liu等[16]发现CK2α靶向抑癌基因BRMS1核导出和降解来促进肺癌侵袭转移。但是CK2α在NSCLC侵袭转移的机制还是不清楚。
本研究利用RNA干扰技术,干扰肺腺癌A549细胞中CK2α的表达,分析对肺癌A549细胞的侵袭迁移能力的影响以及机制的初步研究。
1 材料和方法
1.1 一般材料 pSilencerTM4.1-shRNA载体购于Ambion公司,限制性内切酶BamH I和限制性内切酶Hind III(Fermentans公司),DH5a感受态细胞购于Auragene公司,琼脂糖凝胶DNA回收试剂盒购于TIAGEN公司,DNA Ladder Marker购自日本Takara公司,脂质体LipofectamineTM2000、G418试剂盒,RPMI-1640为美国Invitrogen公司产品。胎牛血清、蛋白裂解液、PVDF膜购自华奇盛公司。PTEN、p-PTEN、Akt、p-Akt473、p-Akt308、p-GSK-3β、p-PDK1、p-c-Raf、E-cadherin、Vimentin、β-catenin、Snail、MMP2、MMP9、β-actin抗体购于Cell Signaling Technology公司,二抗购于中杉金桥公司,Transwell小室购于Corning公司。
1.2 细胞培养 人肺腺癌细胞株A549为贴壁细胞,为广东医科大学附属医院临床科研中心保存,培养于含10%胎牛血清和1%的青-链双抗的RPMI-1640培养基中,置于5%CO2、37oC恒温细胞培养箱中培养,2 d-3 d传代,细胞生长状态良好时用于实验。
1.3 载体构建及转染细胞 由长沙艾佳生物技术有限公司设计3个靶点siRNA序列,选择最有效CK2α的siRNA片段,具体的序列为:shCK2α1028:Sense 5’-GATCCCAG AAGATTTATATGACTATTCAAGAGATAGTCATATAAAT CヰCTGA-3’,shCK2α1028 Antisense:5’-AGCヰCAGAAG ATTTATATGACTATCTCTTGAATAGTCATATAAATCTT CTGG-3’。在T4 DNA连接酶催化下将载体与退火后的互补引物连接,重组体转化大肠杆菌DH5α,利用氨苄霉素进行筛选,挑选阳性克隆进行测序,将阳性克隆在大肠杆菌DH5α中扩增,提取质粒。用LipofectamineTM2000脂质体介导转染重组质粒,包装病毒,感染A549细胞,进行单克隆挑选,利用qPCR和Western blot鉴定干扰效果,CK2α引物Sense:5’-CAAACTGCTGCGATATGACCAC-3’;Antisense:5-GGCACTGAAGAAATCCCTGAC-3,建立稳定干扰CK2α的A549细胞株。
1.4 细胞迁移实验 取生长状态良好的培养细胞,用PBS液洗3次,0.25%胰酶消化细胞制成单细胞悬液。调整细胞浓度为1×106/mL。在24孔板内加入500 μL含10%胎牛血清的培养液。小室内加入100 μL(含1×105个细胞)的无血清单细胞悬液,12 h-14 h后收小室。利用棉签擦拭小室内的细胞,加PBS液清洗。将小室放入500 μL甲醇的24孔板内,固定约15 min。取出小室,擦干小室内的甲醇,浸入苏木精染液中染色20 min,在空气中风干。400倍显微镜下随机5个视野观察细胞,计数,实验重复3次。
1.5 细胞侵袭实验 利用4oC预冷的无血清培养基稀释Matrigel(按1:8稀释),在chamber上室底部中央垂直加入100 μL稀释后的Matrigel,37oC温育4 h-5 h使其干成胶状,取对数生长期细胞、胰酶消化、加培养基终止消化,离心2 min 800 rpm,用无血清培养基重悬,调整细胞加100 μL无血清细胞悬液于小内室,在24孔板下室加入500 μL含20%FBS的培养基然培养箱孵育16 h。收集小室,利用棉签擦拭小室内细胞,在甲醇内室温下固定15 min,自然晾干,用苏木精应用染液染色20 min,在PBS液清洗3遍,空气风干。400倍显微镜下随即选取5个视野观察细胞,记数。实验重复3次。
1.6 Western blot实验 取对数生长期细胞,提取蛋白,测蛋白浓度,配制不同浓度的SDS聚丙烯酰胺凝胶,并加入每泳道40 μg蛋白进行电泳。电泳结束后,转移蛋白至PVDF上。3%牛血清白蛋白封闭后,分别加入PTEN、p-PTEN、Akt、p-Akt473、p-Akt308、p-GSK-3β、p-PDK1、p-c-Raf、E-cadherin、Vimentin、β-catenin、Snail、MMP2、MMP9和β-actin抗体进行孵育。然后用二抗进行孵育,用奥德赛条带扫描仪扫描蛋白条带。
1.7 统计学方法 采用SPSS 13.0统计软件处理数据,各指标以均值±标准差(Mean±SD)来表示,多组采用单因素方差分析(One-Way ANOVA),细胞间多重比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果
2.1 siRNA干扰CK2α表达的效率 为检测CK2α表达干扰效率,利用荧光定量RT-PCR鉴定干扰后单克隆细胞中CK2α的表达,结果显示:与空载对照(Con)组和正常对照(NC)组相比,sh870、sh1028组干扰率最高,其干扰效率均大于80.0%,结果显示各细胞中CK2α的表达有显著差异(F=46.900, P<0.001)(图1A)。为进一步检测CK2α表达干扰效率,利用Western blot检测干扰后CK2α蛋白的表达,以β-actin蛋白为内参,根据各条带的CK2α灰度值与β-actin灰度值比率计算各单克隆细胞中CK2α 的表达有显著差异(F=339.528, P<0.001)(图1B),其中sh870和sh1028组的干扰效率最高,选取这两株细胞进行实验。
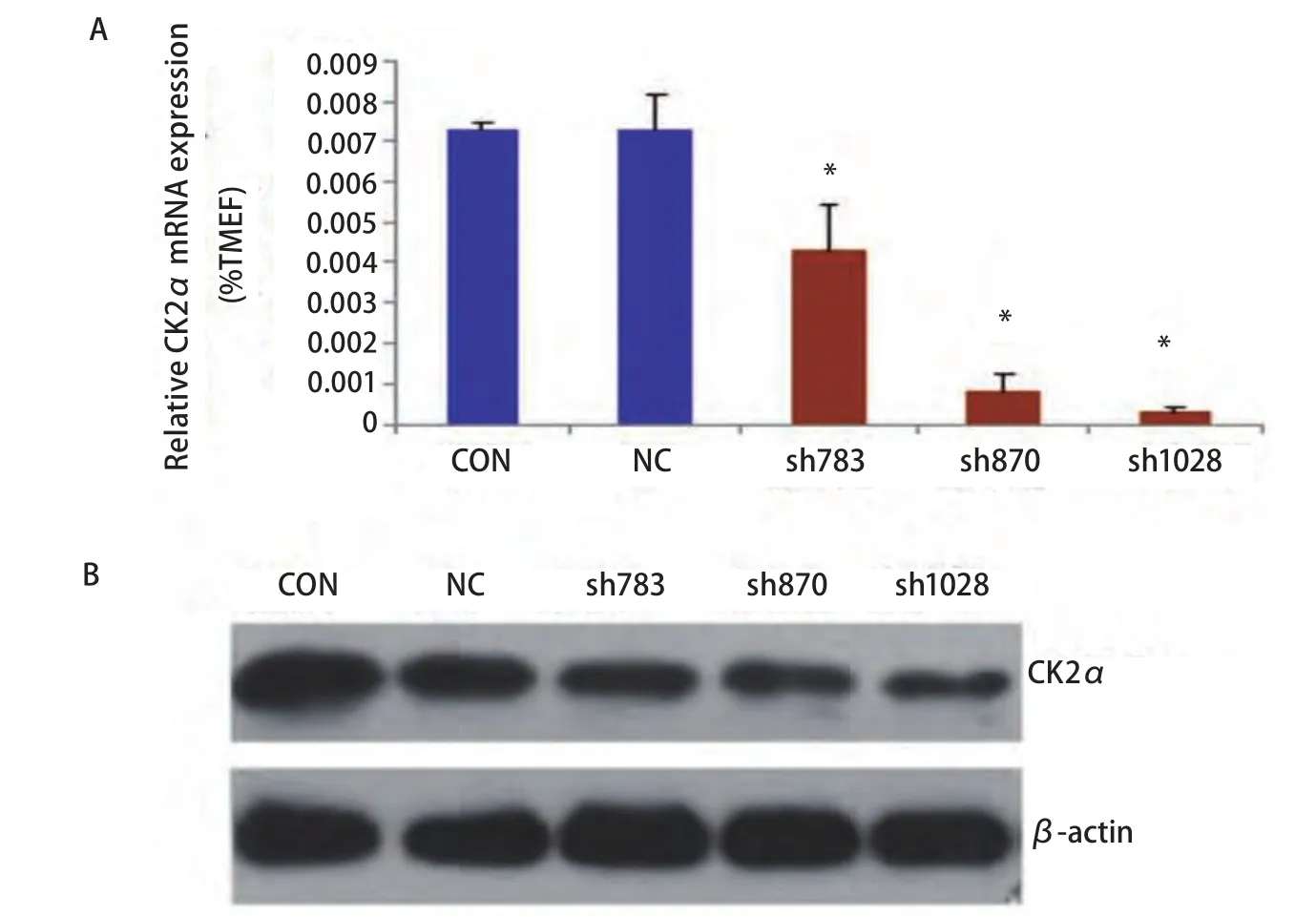
图 1 siRNA干扰CK2α表达的效率 A:荧光定量PCR检测CK2α的表达水平;B:Western blot检测CK2α的表达水平。*:P<0.05。Fig 1 Analyzing the efficiency of down-regulated CK2α with siRNA. A: Testing the expression of CK2α by Real-time PCR; B: Testing the expression of CK2α by Western blot. *: P<0.05.
2.2 CK2α基因干扰对A549细胞体外迁移和侵袭能力的影响 为检测细胞的迁移能力,采用Transwell小室实验检测CK2α表达干扰后四组细胞体外迁移能力的变化,结果发现与Con组(333.67±31.565)和NC组(334.00±31.000)细胞相比,sh870(88.33±6.807)、sh1028组(96.00±10.817)穿过膜的细胞数明显减少(P<0.05,图2A)。为进一步检测细胞的侵袭能力,采用Boyden小室实验的方法检测CK2α表达干扰后细胞体外侵袭能力的变化,结果显示,与Con组(134. 67±10.066)和NC组(134.67±7.638)细胞相比,sh870(62.00±6.000)与sh1028(61.33±5.686)细胞穿过基质胶的细胞数明显减少(P<0.05,图2B)。这都提示干扰CK2α表达后,A549细胞体外迁移侵袭能力明显降低。
2.3 检测干扰CK2α表达前后EMT相关蛋白及MMP2和MMP9蛋白表达水平 为进一步证明CK2α参与肿瘤的侵袭迁移,我们利用Western blot检测干扰CK2α表达后四组细胞中EMT相关蛋白及MMP2和MMP9蛋白表达水平。结果显示,上皮细胞的分子标记E-cadherin在sh870和sh1028组中表达显著高于Con和NC组(P<0.01,图3);相反,间质细胞的分子标记物Vimentin、β-catenin,转录因子Snail在sh870和sh1028组中的表达显著低于NC组和Con组(P<0.01,图3)。我们进一步利用Western blot检测MMP2、MMP9的表达,结果显示,MMP2、MMP9在sh870和sh1028组中的表达显著低于NC组和Con组(P<0.01,图3)。

图 2 CK2α基因干扰对A549细胞体外迁移和侵袭能力的影响。A:Transwell实验检测A549细胞的迁移能力;B:Boyden小室实验检A549测细胞的侵袭能力。* P<0.05。Fig 2 Effects of knock-down CK2α expression Comment on invasion and migration of A549 cell line. A: Analyzing the migration of A549 cell line via Transwell assay; B: Analyzing the invasion of A549 cell line via Boyden assay. *P<0.05.

图 3 Western blot检测上皮细胞-间充质转化和转移相关蛋白的表达水平Fig 3 Testing proteins expression of mesenchymal-to-epithelial transition and relative metastasis by Western blot
实验结果表明,干扰CK2α表达可抑制EMT的发生,下调MMP2、MMP9的表达,抑制细胞的侵袭迁移。
2.4 Western blot检测干扰CK2α表达前后PI3K/Akt信号通路相关蛋白表达水平 为探讨CK2α可能调控EMT的机制,我们利用Western blot检测干扰CK2α表达前后PI3K/Akt信号通路中蛋白的表达水平,结果显示:抑癌基因PTEN在sh870和sh1028组中表达显著高于Con和NC组,而Akt、p-Akt473、p-Akt308、p-PTEN p-PDK1、p-c-Raf、p-GSK-3β基因在sh870和sh1028组中表达均显著下调(图4)。

图 4 Western blot检测PI3K/Akt信号通路相关蛋白表达水平Fig 4 Testing proteins expression of PI3K/Akt signaling pathway by Western blot
实验结果提示,干扰CK2α表达可上调PTEN,减少PTEN的磷酸化及Akt的活化,从而阻止所有由Akt调控的下游信号传导事件,即使Akt、p-Akt473、p-Akt308、p-GSK-3β、p-PDK1、p-c-Raf蛋白表达下调。从而表明,干扰CK2α表达可抑制Akt的活化,抑制细胞的侵袭和转移。
3 讨论
肺癌侵袭转移是一个复杂过程,其涉及多个癌基因与抑癌基因和多条信号通路的调控。虽然近年来肺癌的诊断和治疗水平有很大的提高,但是总的生存时间没有多大的提高,导致肺癌治疗失败的主要原因之一就是侵袭转移。因此探究肺癌细胞侵袭和转移生物学行为,对于指导肺癌的诊断、治疗及预后评判十分重要。CK2是多功能的蛋白激酶,其磷酸化底物具有多样性,涉及到细胞的生长、增殖、分化、凋亡。近年来,有研究[15,16]显示CK2参与肿瘤的侵袭转移,但在肺癌中机制还不是很清楚。
我们利用siRNA技术,干扰肺腺癌A549细胞中CK2α的表达,结果发现干扰CK2α的表达后,肺腺癌A549细胞的侵袭迁移能力显著降低,同时检测到MMP2和MMP9蛋白也明显下调,这都提示CK2α参与肺腺癌的侵袭迁移的过程。但是具体机制不清。上皮细胞-间充质细胞转化,是具有极性的上皮细胞转换成具有活动能力、能够在细胞基质间自由移动的间质细胞的过程。越来越多的证据证明EMT在肿瘤的侵袭、转移过程中起着重要作用[17,18]。我们利用Western blot检测干扰CK2α的表达后EMT相关蛋白的表达,发现上皮分子标记物E-cadherin蛋白上调,而间质细胞的分子标记物Vimentin、β-catenin及转录因子Snail蛋白下调。这提示CK2α通过EMT来参与肺腺癌的侵袭迁移。但是CK2α通过哪条信号通路调控EMT来参与肺腺癌的侵袭迁移?
PI3K/Akt信号通路是细胞内重要的信号转导途径之一,参与很多重要的生物学过程的调控,其通过影响下游多种效应分子的活化状态,在细胞内发挥着抑制凋亡、促进增殖的关键作用。几年来研究发现,CK2与PI3K/Akt信号通路具有相互作用。Ryu等[19]发现在人类前列腺癌LNCaP细胞株中,CK2抑制剂CX4945抗雄激素受体活性,其通过抑制Akt-survivin信号通路发挥抗肿瘤作用。Maira等[20]发现CK2能磷酸化并上调Akt/PKB,产生抗凋亡,促进肿瘤的发生。Shehata等[21]发现CK2抑制剂在慢性淋巴细胞白血病细胞中减少了PTEN和Akt的磷酸化,促进了肿瘤细胞的凋亡,产生抗肿瘤作用。近年来有研究表明,PI3K/Akt信号通路可通过调控EMT,对肿瘤起着促进侵袭转移。Grille等[22]发现PI3K/AKT信号通路参与诱导鳞癌细胞EMT的发生,促进肿瘤细胞的侵袭性和转移性。PI3K/AKT信号通路是怎样调控EMT的?
GSK-3β是一种由丝氨酸/苏氨酸组成的多功能激酶,在调节糖原代谢起关键作用。它是PI3K/AKT信号通路下游基因,可磷酸化Snail转录因子调控EMT。Li等[23]发现在肺癌中OLA1通过GSK3β/Snail/E-cadherin调控EMT,从而调节肺癌的侵袭转移。同样在乳腺癌和胃癌中也发现PI3K/AKT/GSK3β信号通路调控EMT[24,25]。因此可以认为,PI3K/AKT信号通路下游基因GSK-3β磷酸化Snail转录因子调控EMT,从而参与肿瘤的侵袭转移。我们干扰肺腺癌A549细胞中CK2α的表达后,抑癌基因PTEN表达升高,而Akt、p-Akt473、p-Akt308、p-PTEN p-PDK1、p-c-Raf、p-GSK-3β基因表达均显著下调,同时EMT相关蛋白E-cadherin蛋白上调,而间质细胞的分子标记物Vimentin、β-catenin及转录因子Snail蛋白下调。我们认为CK2α可能是通过PI3K/AKT/GSK3β信号通路调控Snail转录因子来调节EMT,从而参与肺腺癌A549细胞侵袭转移。
综上所述,PI3K/Akt信号通路与EMT存在复杂的调控关系,我们认为CK2α可能是通过PI3K/AKT/GSK3β信号通路调控Snail转录因子来调节EMT,因此,CK2α是通过PI3K/AKT/GSK3β/Snail信号通路调控肺腺癌A549细胞侵袭转移。是否CK2α可能还通过其他信号通路对EMT的调控,还需要更多实验去验证。
