牙鲆NR4A1基因在甲状腺素诱导仔鱼变态中的表达调控分析
2017-09-04付元帅
施 杨,居 慧,喻 杰,付元帅
牙鲆NR4A1基因在甲状腺素诱导仔鱼变态中的表达调控分析
施 杨1,居 慧2,喻 杰2,付元帅2
(1.上海市食品研究所,上海 200235;2.上海海洋大学水产与生命学院,上海 201306)
NR4A1基因是一个重要的转录因子,在信号转导早期通过对靶基因的特异性转录调控发挥着重要的作用。从牙鲆(Paralichthys olivaceus)中克隆了NR4A1基因cDNA序列,检测了其在牙鲆变态中和成鱼各组织中的表达模式,分析了其在外源甲状腺素(TH)以及硫脲(TU)处理仔鱼中的表达变化。结果表明,牙鲆NR4A1 cDNA全长3264 bp,编码568个氨基酸;牙鲆NR4A1基因与其它物种具有很高的同源性,在系统进化树中与鱼类聚为一支;牙鲆NR4A1基因在成鱼心、肌肉和鰓中高表达;在变态过程中,NR4A1水平逐渐升高,且在25 dph达到最高,之后逐渐降低;TH组中的NR4A1基因水平在变态早期和高峰期显著低于正常组,TU组的水平在变态中后期和结束期显著高于正常组;TU组中变态被抑制的仔鱼在正常海水和0.1 mg·L-1TH海水中饲养6 d后,能够顺利变态,且NR4A1基因在拯救组(TU抑制变态仔鱼在正常海水和0.1 mg·L-1TH海水中饲养)中的表达水平与TU对照组相比显著降低,与正常组中同时期的水平一致。结果表明,牙鲆NR4A1基因可能在仔鱼变态调控中扮演着非常重要的角色。
牙鲆;变态发育;NR4A1;基因表达
NR4A家族属于及早反应基因家族,一些化学刺激(如生长因子、激素和神经递质等)和物理刺激(膜去极化、机械搅拌和磁场等)能够在短时间内诱导该家族基因快速表达[1]。NR4A1是NR4A家族中的一员,也是一个重要的转录因子和一种响应蛋白,通过对靶基因的特异性转录调控,在信号传导的早期发挥着重要的调控作用[1]。NR4A1作为一种核受体,在接受刺激信号后,其分子构象迅速发生改变,与靶基因的调控区发生特异性的识别和结合,发挥其对基因的转录调控作用,参与细胞周期、细胞凋亡、组织器官发育、肿瘤发生、机体免疫应答以及内分泌调控等各种生命活动[2]。NR4A1蛋白主要由6个保守的功能结构域组成:AF-1结构域(氨基端长度可改变的转录激活域,负责与其它转录因子相互作用)、DBD结构域(包含两个锌指结构的DNA结合域,与DNA识别元件结合,调控基因表达)、构象可变的铰链区、LBD结构域(包含二聚化位点的配体结合域,是一分子开关,与特异性配体结合改变核受体的分子构象,激活转录)、AF-2结构域(配体依赖的转录激活域)、未知功能的可变羧基端[2]。NR4A1广泛存在于多种生物体中,如:人类(Homo sapiens)、家鼠(Musmusculus)、半滑舌鳎(Cynoglossussemilaevis)、斑马鱼(Danio rerio)[3]、非洲爪蟾(Xenopus laevis)[4]等。目前为止,NR4A1基因在牙鲆(Paralichthys olivaceus)中未见报道。
牙鲆属鲽形目(Pleuronectiforms),牙鲆科(Paralichthyidae),牙鲆属,是我国一种重要的海水养殖经济鱼类。在牙鲆胚后从仔鱼向稚鱼的发育过程中有一剧烈的变态过程,称为牙鲆的变态发育。在仔鱼变态过程中,其右眼移向身体左侧,冠状幼鳍消长,体位从侧卧变为平卧,浮游生活变为底栖生活,同时这些过程也伴随一系列生理学变化[5]。1985年日本学者INUI等[8]研究发现外源性甲状腺激素(TH)能显著加速牙鲆仔鱼的变态,而硫脲(TU)则造成牙鲆仔鱼的变态抑制[6-9]。本研究采用同源克隆和RACE法得到牙鲆NR4A1基因cDNA全长,观察了NR4A1在牙鲆变态发育各时期以及成鱼的表达水平,检测了外源TH和TU对NR4A1表达的影响及其在拯救实验中的变化,初步阐释了NR4A1基因在牙鲆变态发育过程中的表达调控以及可能扮演的重要角色,以期为进一步揭示牙鲆变态的分子机制提供重要的研究积累。
1 材料与方法
1.1 实验鱼和样品采集
牙鲆仔鱼实验主要在中国水产科学研究院北戴河中心实验站于2015年5月29日完成。将孵化后14 d(14 dph,days post hatching)的3 000 ind仔鱼平均分为3个组:正常发育对照组(control),甲状腺激素(TH,Sigma公司)处理组和硫脲(TU,Sigma公司)处理组,3组仔鱼分别养在正常海水、TH处理的海水(0.1 mg·L-1)和TU处理的海水(30 mg·L-1)中,其它饲养条件相同,至正常仔鱼变态结束。在变态抑制仔鱼拯救实验中,将35 dph TU组仔鱼分成3组:TU组继续用含30 mg·L-1TU的海水养殖;TU-NC组改用自然海水养殖;TU-TH组改用含0.1 mg· L-1的海水养殖,6 d后观察各组仔鱼变态情况。
样品采集根据MINAMI[10]的划分方法结合实际养殖情况确定取样时间点,即:16 dph(变态前,眼睛左右对称)、21 dph(变态早期,右眼开始移位)、25 dph(变态中前期,右眼移至背侧附近,从左眼侧还无法看到右眼)、28 dph(变态高峰期,右眼到达背中线附近,可在左眼侧看到右眼)、31 dph(变态后期,右眼到达背中线并开始向左侧移动)、35 dph(变态结束期,右眼位于背中线左侧)和41 dph(变态完成,两只眼睛均位于头部左侧)。每个时间点均分别取正常对照组、TH组和TU组的3个生物学重复样品,即n=3,DEPC水冲洗,放入RNAstore保存液(天根公司),置于-80℃保存备用[11]。
牙鲆成鱼购自上海市芦潮港水产品市场,活体解剖后取其肌肉、脑、心脏、鳃、肾、胃、肝脏、肠、性腺组织等各3份(n=3),经DEPC水清洗,置于液氮,-80℃保存备用。
1.2 总RNA提取和反转录
利用Trizol®Reaget(Invitrogen),根据该试剂的操作说明将上述采集样品进行RNA提取。利用NANODROP 2000C测定总RNA OD260/OD280值及浓度(1.8~2.0范围的RNA纯度较好),再根据1.5%琼脂糖凝胶电泳检测RNA质量(28SrRNA和18SrRNA条带清晰可见,RNA质量较好),所有RNA样品均符合实验要求后,置-80℃保存备用。
将上述RNA样品用DNase I(Promega)处理后,在无RNase的离心管中加入2μg总RNA,1 μL Oligo dT Primer(50μmol·L-1),1μL dNTP Mixture(10 mmol·L-1each),补充RNase free ddH2O至10μL;然后65℃5min,冰上2min;再加入5×PrimeScript Buffer4μL,RNase Inhibitor(40 U·μL-1)0.5μL,PrimeScript RTase(200 U ·μL-1)1μL,补充RNase free ddH2O至20μL;然后进行反转录,25℃,10 min;37℃,60 min;95℃,5 min,最后冰上放置2 min,cDNA产物-20℃保存备用。
1.3 牙鲆NR4A1基因的克隆
根据NR4A1基因在物种中的序列比对结果,在保守区设计3对PCR引物(表1),用牙鲆的混合cDNA(不同时期和不同组织的cDNA)为模板,运用Taq DNA聚合酶进行PCR扩增。反应条件为94℃预变性3 min;94℃变性30 s、58℃退火30 s、72℃延伸45 s,35个循环;72℃延伸1 min。PCR产物经1.5%琼脂糖电泳分离纯化后连接到pMDTM19-T Vector(Takara,日本),转化大肠杆菌DH5α,37℃培养过夜,蓝白斑筛选阳性克隆扩大培养后送上海生工生物工程有限公司测序。所得测序结果采用DNAman中的序列拼接程序进行拼接。
在牙鲆NR4A1拼接序列的基础上,设计RACE的特异性引物(表1),通过Full RACE Kit(Takara)试剂盒进行RACE PCR扩增,将产物经1.5%琼脂糖凝胶电泳分离,再回收目的片段进行连接、转化、克隆和测序。

表1 实验中用到的引物序列Tab.1 Primers used in this study
1.4 基因序列结构和进化分析
运用DNAMAN软件将所得的牙鲆NR4A1片段序列进行重新拼接间,获得基因全长。用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf)程序获得NR4A1基因的开放阅读框和氨基酸序列。运用BLAST program(http://blast.ncbi.nlm.nih.gov/)对牙鲆和其它物种的NR4A1基因进行氨基酸序列比对分析,分析该基因的保守型。运用MEGA 5.0[12]软件,采用NJ(Neighbor-Joining)法构建进化树。从GenBank数据库提取的NR4A1氨基酸序列的代码如下:[Homo sapiens](GI|48145525|);[Mus musculus](GI|71059903|);[Danio rerio](GI|182889142|);[Xenopus laevis](GI|33416666|);[Cynoglossus semilaevis](GI|657779658|);[Stegastes partitus](GI|657528683|);[Poecilia reticulata](GI|658859882|)。
1.5 荧光定量PCR
NR4A1基因的定量分析在CFX96 TouchTMReal-Time PCR Detection System(Bio-Rad,美国)上进行。首先制备目的基因和内参基因(β-actin)的标准曲线。然后对不同组织、不同变态阶段、TH和TU处理以及拯救实验中的仔鱼,按照以下条件进行相对定量分析。反应体系(20 μL):1.0μL cDNA,0.5μL NR4A1 qPCR-F(10 μM)和0.5μL NR4A1 qPCR-R(10μM),10.0μL 2×iQTM SYBR Green Supermix(Bio-Rad,USA)和8.0μL ddH2O;反应条件:95℃1 min;95℃10 s,60℃20 s,40个循环。该实验中,生物学重复n=3,技术重复2次,β-actin为参考基因;NR4A1基因和内参基因的扩增效率(E)均介于95%~100%之间,R值均大于0.98,并且二者之间的E值相差小于0.1。
上述NR4A1 mRNA结果,运用2-ΔΔCT方法[13]进行数据处理。运用Sigmaplot 12.0软件进行作图分析,数值采用平均值±标准误差(mean± SE)表示,n=3。不同样品间的相对表达差异分析利用该软件中的One-Way和Two-Way方差分析法(ANOVA)进行统计分析,P<0.05代表差异显著。
2 结果与分析
2.1 NR4A1的克隆及结构分析
利用分子克隆方法,获得了牙鲆NR4A1基因全长3264 bp,包括43 bp的5′-UTR、1517 bp的3′-UTR和1704 bp的CDS,预测其编码568个氨基酸(图1)。在NCBI中,NR4A1基因的氨基酸序列结构比对分析结果显示,其有6个高度保守的结构域,分别为NR_DBD_NGFI-B、NR_LBD_NGFI-B、zf-C4、ZnF_C4、HOLI和Hormone_recep,这与其它已知物种中的NR4A1结构相似(图2)。
2.2 NR4A1序列比对及进化树构建
NR4A1基因系统进化树结果显示(图3),牙鲆与其它鱼类聚在一支,与深裂眶锯雀鲷(Stegastes partitus)和半滑舌鳎的系统进化距离相对较近。多物种间NR4A1基因氨基酸序列同源性比对结果显示,牙鲆与半滑舌鳎为78.13%,与斑马鱼为68.34%,与网纹鳉(Poecilia reticulate)为68.19%,与深裂眶锯雀鲷为84.59%(图4)。

图1 牙鲆NR4A1基因的cDNA和推导的氨基酸序列Fig.1 cDNA and deduced am ino acid sequences of Paralichthys olivaceus NR4A1 gene

图2 牙鲆NR4A1基因的6个保守性结构域预测分析Fig.2 Six conservative domains proghosis of Paralichthys olivaceus NR4A1 gene

图3 NR4A1基因在脊椎动物中的系统进化树分析(Neighbor-joining,1 000 bootstrap)Fig.3 Phylogenetic tree analysis of NR4A1 in the vertebrate by the neighbor-joining method(1 000 bootstrap)
2.3 牙鲆NR4A1基因在变态发育阶段和成鱼各组织中的表达
定量PCR结果显示(图5):牙鲆NR4A1基因在成鱼各组织中均有表达到,但肌肉、心脏和鳃中表达量较高,在心脏中最高;牙鲆NR4A1基因在仔鱼变态发育的各个阶段均有表达,并且表达变化趋势与变态发育进展相符,即出膜后第16天(16 dph)时,牙鲆NR4A1基因的表达较低,到21 dph时有增长,但与16 dph无显著差异,在25 dph时其表达水平达到顶峰(约为16 dph的8倍,差异显著),之后逐渐降低,到35 dph和41 dph时降至最低。
2.4 甲状腺激素(TH)及硫脲(TU)处理后NR4A1的表达
通过定量PCR方法分析NR4A1基因在TH和TU处理仔鱼中的表达变化,结果显示:在变态早期和变态高峰期的TH组仔鱼中,其NR4A1水平显著低于正常发育组(control),而在变态中后期至变态结束的TU组仔鱼中,NR4A1水平显著高于正常发育组,这些结果表明NR4A1基因的表达直接或间接的受到TH的调控(图6)。外源甲状腺激素(TH)加速牙鲆仔鱼变态,而硫脲(TU)则抑制其变态。
2.5 硫脲处理组牙鲆的变态拯救实验
为了探讨硫脲(TU)抑制变态的仔鱼能否被拯救(TU抑制变态的仔鱼完成变态过程),我们将35 dph TU组仔鱼分别放入自然海水中(TUNC组)和含0.1 mg·L-1TH的海水中(TU-TH组)饲养。经过6 d的拯救实验后,从外型判断TU-TH组和TU-NC组仔鱼均完成变态(图7),而TU对照组仔鱼变态依然被抑制。同时分析了NR4A1基因在仔鱼变态拯救前后的表达变化,结果显示:NR4A1在TU-NC组和TU-TH组中的表达水平相对TU对照组显著降低,与正常发育组以及TH处理组41 dph时的表达水平相近(图9),这些结果表明NR4A1基因可能在牙鲆仔鱼变态中发挥重要的作用。

图4 NR4A1基因在牙鲆和其它物种间的氨基酸序列对比Fig.4 Am ino acid sequences for NAR4AI alignment of Paralichthys olivaceus and other species
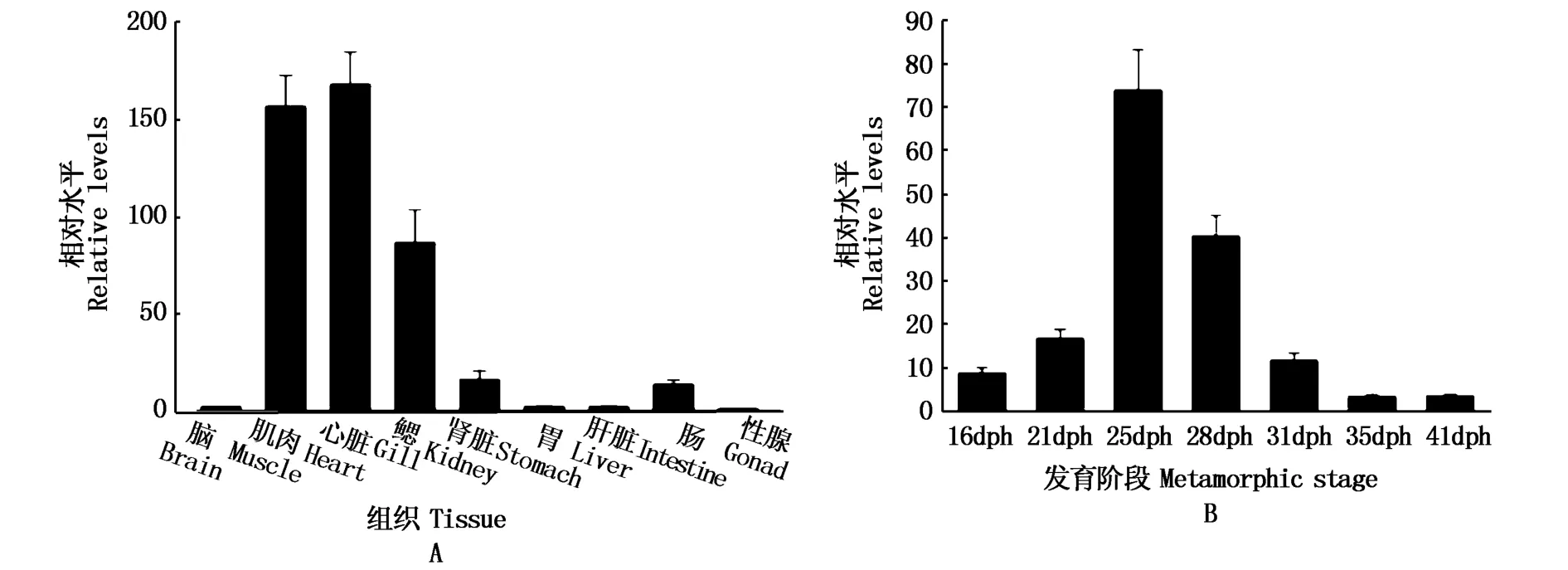
图5 牙鲆NR4A1在成鱼组织和变态阶段的表达模式(A:成鱼组织;B:变态发育)Fig.5 Relative expression of NR4A1 m RNA in adult fish tissues and metamorphic stages of Paralichthys olivaceus(A:adult tissues,B:metamorphosis)

图6 NR4A1 m RNA在正常、TH和TU组仔鱼变态过程中的相对表达Fig.6 Relative expression of NR4A1 mRNA in the control,TH-treated and TU-treated larvae duringmetamorphosis
3 讨论
已有研究表明,NR4A1基因在细胞信号传导中发挥着重要作用,参与了一系列发育和代谢相关的生命活动[1,14]。本研究中,我们克隆了牙鲆NR4A1基因序列,并分析了该基因在物种间的系统进化、同源性以及保守性,NR4A1基因在牙鲆与其它物种间具有很高的同源性和保守性,这为进一步分析其在牙鲆发育中的功能奠定基础。同时,NR4A1基因在牙鲆变态过程中的表达分析表明,它的表达水平随着变态发育逐渐增长,在变态高峰期达到峰值,随后逐渐降低至变态结束。这些结果显示,NR4A1的表达变化与牙鲆的变态发育进程是呈正相关的,可能在牙鲆变态过程中发挥着非常重要的作用。在成鱼中的组织分布表明,NR4A1基因可能在肌肉、心脏和鳃的发育以及生理代谢中发挥着重要作用。
牙鲆的变态发育受到许多激素的调控,而甲状腺激素和其受体在其变态过程中发挥着关键性的调控作用,控制着仔鱼变态的进程以及成败[15-17],JANSEN等[18]以及BISBAL等[19]对牙鲆眼睛移位的研究结果揭示,牙鲆眼睛的移位是受TH控制的,且在此过程中,甲状腺激素的水平有大幅度的增加,它的浓度分布有着组织性和时间上的特异性[20]。研究表明,外源性的TH能够加速牙鲆仔鱼的变态过程[8],而与之相反的是,用甲状腺素抑制剂硫脲(TU)处理后会导致牙鲆仔鱼的变态停滞[7-8,21-22]。本次实验使用外源性的TH和TU处理牙鲆尚未开始变态的仔鱼,以研究TH和TU对NR4A1基因表达的影响。结果发现,在牙鲆变态过程中,NR4A1基因的mRNA水平明显受TH和TU的影响,并且二者对NR4A1的表达几乎具有相反的调节作用。在变态前期和高峰期,外源性TH显著抑制了NR4A1基因的表达水平;在变态高峰期和后期,TU组仔鱼体内的TH水平被抑制,导致NR4A1基因一直处于高水平,这些结果显示NR4A1基因表达受到TH直接或间接的调控,并且在仔鱼变态调控中可能起着负调控的作用。因此我们推测TH通过抑制NR4A1基因的表达水平,从而间接地减少仔鱼变态负调控基因的表达,控制仔鱼正常变态的进程;外源TH的加入,提升了体内TH的水平,更快更早的抑制了NR4A1基因的表达,造成变态抑制基因更早的被抑制,促使仔鱼变态的加速。
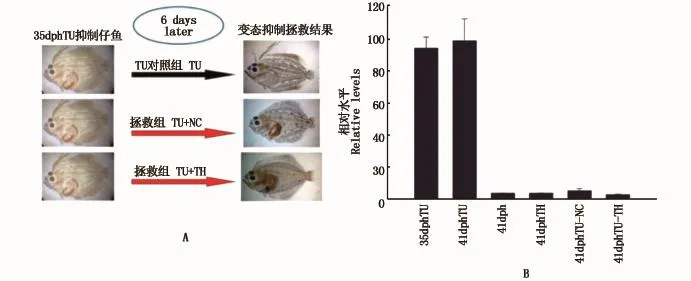
图7 NR4A1基因在TU抑制变态仔鱼拯救中的表达变化(A:变态抑制拯救前后的形态变化;B:NR4A1在变态抑制仔鱼拯救前后的表达变化)Fig.7 Relative expression levels of NR4A1 mRNA in the rescued larvae inhibited by TU(A:morphologic changes before and after rescue;B:relative levels of NR4A1 m RNA before and after rescue)
为了进一步探究NR4A1基因在牙鲆变态中的作用,笔者设计了TU抑制组仔鱼的拯救实验。实验结果证明,TU组变态抑制的仔鱼在去除TU抑制即放入正常海水和TH处理的海水,仍能快速地完成仔鱼的变态;同时我们检测了NR4A1基因的表达变化,结果发现:与TU对照组相比,拯救组中的NR4A1基因水平显著降低,这可能是因为被TU抑制变态仔鱼体内TH去抑制的结果,这进一步表明NR4A1基因的表达直接或间接地受TH调节,并可能在仔鱼的变态中通过负调控的方式发挥着重要的作用。
[1] MARUYAMA K,TSUKADA T,OHKURA N,etal.The NGFI-B subfamily of the nuclear receptor superfamily[J].International Journal of Oncology,1998,12(6):1237-1280.
[2] 谷亚龙,张新东,金保方.核受体NR4A1功能及调控的研究进展[J].中华临床医师杂志,2014,8(8):1507-1511.
[3] CHENG Y Y,TAOW J,CHEN JL,etal.Genomewide identification,evolution and expression analysis of nuclear receptor superfamily in Nile tilapia,Oreochromis niloticus[J].Gene,2015,569(1):141-152.
[4] KLEIN S L,STRAUSBERG R L,WAGNER L,et al.Genetic and genomic tools for Xenopus research:The NIH Xenopus initiative[J].Developmental Dynamics,2002,225(4):384-391.
[5] FUKUHARA O.Morphological and functional development of Japanese flounder in early life stage[J].Nippon Suisan Gakkaishi,1986,52(1):81-91.
[6] TANANGONAN JB,TAGAWA M,TANAKA M,et al.Changes in tissue thyroxine level of metamorphosing Japanese flounder Paralichthys olivaceus reared at different temperatures[J].Nippon Suisan Gakkaishi,1989,55(3):485-490.
[7] MIWA S,TAGAWA M,INUIY,et al.Thyroxine surge in metamorphosing flounder larvae[J].General and Comparative Endocrinology,1988,70(1):158-163.
[8] INUI Y,MIWA S.Thyroid hormone induces metamorphosis of flounder larvae[J].General and Comparative Endocrinology,1985,60(3):450-454.
[9] DE JESUS EG,HIRANO T,INUIY.Changes in cortisol and thyroid hormone concentrations during early development and metamorphosis in theJapanese flounder,Paralichthys olivaceus[J].General and Comparative Endocrinology,1991,82(3):369-376.
[10] MINAMI T.The early life history of a flounder Paralichthys olivaceus[J].Nippon Suisan Gakkaishi,1982(48):1581-1588.
[11] ZHAIW,ZHANG J,SHI Z,et al.Identification and expression analysis of IGFBP-1 gene from Japanese flounder(Paralichthys olivaceus)[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2012,161(4):413-420.
[12] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[13] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[14] KIM BY,KIM H,CHO E J,etal.Nur77 upregulates HIF-αby inhibiting pVHL-mediated degradation[J].Experimental and Molecular Medicine,2008,40(1):71-83.
[15] Schreiber A M,Specker J L.Metamorphosis in the summer flounder(Paralichthys dentatus):stagespecific developmental response to altered thyroid status[J].General and Comparative Endocrinology,1998,111(2):156-166.
[16] GALAY BURGOSM,POWER D M,LLEWELLYN L,et al.Thyroid hormone receptor expression during metamorphosis of Atlantic halibut(Hippoglossus hippoglossus)[J].Molecular and Cellular Endocrinology,2008,281(1):56-63.
[17] LAUDET V.The origins and evolution of vertebrate metamorphosis[J].Current Biology,2011,21(18):R726-R737.
[18] JANSEN J,ENGER P.NADPH diaphorase activity is asymmetrically distributed in the optic tectum during the period of eye migration in turbots[J].Acta physiologica scandinavica,1996,157(4):515-517.
[19] BISBALG A,BENGTSON D A.Reversed asymmetry in laboratory-reared summer flounder[J].The Progressive Fish-culturist,1993,55(2):106-108.
[20] TAGAWA M,MIWA S,INUIY,et al.Changes in thyroid hormone concentrations during early development and metamorphosis of the flounder,Paralichthys olivaceus[J].Zoological Science,1990,7(1):93-96.
[21] INUIY,YAMANO K,MIWA S.The role of thyroid hormone in tissue development in metamorphosing flounder[J].Aquaculture,1995,135(1):87-98.
[22] 苏艳芳,付元帅,施志仪,等.牙鲆SRF基因的克隆及真核表达载体的构建[J].海洋渔业,2015,37(4):331-340.
SU Y F,FU Y S,SHI Z Y,et al.Cloning of SRF from Paralichthys olivaceus and eukargotic expression veetor construction[J].Marine Fisheries,2015,37(4):331-340.
Expression regulation of Paralichthys olivaceus NR4A1 gene in themetamorphic larvae induced by thyroid hormone
SHIYang1,JU Hui2,YU Jie2,FU Yuan-shuai2
(1.Shanghai Food Research Institute,Shanghai 200235,China;2.ShanghaiOcean University,Shanghai 201306,China)
NR4A1 gene,an important transcription factor,regulates the specific expression of targetgenes and plays a key role in the early signal transduction.In this study,the full-length cDNA of Paralichthys olivaceus NR4A1 gene was cloned,and its structure was analyzed by the bioinformaticsmethod,while its expression patterns during the metamorphosis and in different tissues of adult fish were detected using the real-time quantitative PCR technology.The expression responses of NR4A1 to exogenous thyroid hormone(TH)and thiourea(TU)during themetamorphosiswere also detected.Finally,a rescue assay was performed and the changes of NR4A1 during the rescuewere detected.The results showed that NR4A1 contained 3 264 bp cDNA sequence and encoded 568 amino acids.NR4A1 of Japanese flounder showed high homology compared to the other reported species.NR4A1 of Japanese flounder wasmainly expressed in heart,muscle and gill.During themetamorphosis,the expression level of NR4A1 increased gradually,and reached the peak at 25 dph,subsequently declined gradually.In the TH group,the expression levels were significantly lower than the control at the pre-metamorphosis and the climaxmetamorphosis period(P<0.05).While in the TU group the experssion levelswere higher than the control in the latemetamorphosis period.Themetamorphic inhibition of 35 dph TU larvae can be rescued in the normal seawater and the TH-treated seawater(P<0.05),and NR4A1 was significantly down-regulated in the rescued larvae compared with the TU-treated larvae(P<0.05).These results demonstrate that NR4A1 plays a key role in regulatingmetamorphosis in the Japanese flounder.
Paralichthys olivaceus;metamorphosis;NR4A1;gene expression
Q 959.468
A
1004-2490(2017)04-0433-10
2016-06-15
国家自然科学基金(41506159);上海市自然科学基金(15ZR1420600);中科院海洋所海洋生物学重点实验室开放课题(KF2015No.01)
施 杨(1988-),男,助理工程师,研究方向为食品分子检测。E-mail:602483415@qq.com
付元帅(1981-),讲师。E-mail:ysfu@shou.edu.cn
