不同饲养条件对苏尼特羊背最长肌中MyomiRs表达及屠宰性能的影响
2017-09-03张利霞郭月英苏日娜
张利霞,郭月英,要 铎,苏日娜,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
不同饲养条件对苏尼特羊背最长肌中MyomiRs表达及屠宰性能的影响
张利霞,郭月英,要 铎,苏日娜,靳 烨*
(内蒙古农业大学食品科学与工程学院,内蒙古 呼和浩特 010018)
选择不同饲养条件下12 月龄苏尼特羊的背最长肌为实验材料,通过测定6 种miRNAs的表达量及苏尼特羊的屠宰性能,研究不同饲养条件对miRNAs表达量及屠宰性能的影响。结果表明:放牧苏尼特羊生长性状(体长、体高、胸围)、宰前活质量、胴体质量均显著高于圈养(P<0.05),圈养苏尼特羊屠宰率、净肉率高于放牧。放牧苏尼特羊miRNAs表达量均高于圈养苏尼特羊。放牧苏尼特羊miR-1表达量与体高、胴体质量、净肉质量、净肉率显著正相关(P<0.05),miR-133表达量与净肉质量呈显著正相关性(P<0.05),圈养苏尼特羊miR-128表达量与净肉率显著负相关(P<0.05)。说明不同饲养条件对miRNAs的表达有影响,进一步影响屠宰性能。
饲养条件;苏尼特羊;MyomiRs;表达量;屠宰性能
MicroRNAs(miRNAs)是一类新发现的进化上保守的由内源性基因编码的长约18~25 个核苷酸的单链小分子RNA,这类RNA在动物基因组中广泛表达,其主要通过与靶mRNA的3’UTR完全或部分互补配对,负调控转录后基因表达[1-3]。动物体内约30%的基因受miRNAs的调控,在肌肉发育、免疫、细胞凋亡、细胞增殖、分化和代谢等许多生物学过程发挥重要作用[4-6]。
苏尼特羊肉具有高蛋白、低能量、低胆固醇、氨基酸含量丰富等特点,有很高的营养价值[7-9]。目前主要有放牧、放牧补饲料和舍饲育肥3 种饲养方式[10]。不同研究显示,不同的饲养方式对肉质和屠宰性能有很大的影响[11-13]。已有研究证明在小鼠、猪等物种中与肌肉相关的miRNAs对骨骼肌的发育有重要作用[14-15]。例如miR-1、miR-206、miR-23a可调控肌细胞分化,成肌细胞增殖,对骨骼肌结构、功能的维持,肌纤维类型转化和肌管生成等发挥重要作用[16-21]。
因此,本研究选取骨骼肌特异的基因miR-1、miR-206、miR-128、miR-486、miR-133、miR-23a(属于MyomiRs成员)作为研究对象,利用实时定量聚合酶链式反应(polymerase chain reaction,PCR)技术,研究不同饲养条件对苏尼特羊肌肉特异性miRNAs表达量的影响,并结合屠宰性能,探索饲养方式对miRNAs表达量及其与屠宰性能的相关性,尝试从分子水平解释饲养方式对羊肉屠宰品质的影响,为改善合理饲养管理、提高产肉量提供参考。
1 材料与方法
1.1 动物与试剂
于内蒙古巴彦淖尔市乌拉特中旗农区畜牧业专项推进办公室的巴美肉羊育种园区,随机选择放牧和圈养两种饲养条件下12 月龄苏尼特羊各10 只,其中公、母各5 只。圈养组舍施育肥3 个月,以食用农区饲草料为主,放牧组以食用乌拉特中旗草原自然生长的牧场为主。将该20 只羊现场屠宰并记录,宰后1 h内取苏尼特羊的背最长肌肌肉100 mg左右放入2 mL无酶管中,并迅速将其投入液氮中保存,带回实验室后,置于-80 ℃冰箱中保存待用。
miRNeasy Mini Kit(50)、RevertAid First Strand cDNA Synthesis Kit、Maxima SYBR Green qPCR Master Mix 美国Thermo Fisher Scientific公司;RNase-free水北京天根生物技术有限责任公司;无水乙醇 天津市风船化学试剂科技有限公司;核酸染料 北京百泰克生物技术有限公司;琼脂糖 法国Biowest基因公司。
1.2 仪器与设备
ZHJH-C1112C超净工作台 上海智城分析仪器制造有限公司;ND-1000型微量紫外分光光度计 基因有限公司;5430R低温台式冷冻离心机、移液枪(1 000、200、100、20、10、2.5 μL) 德国Eppendorf生物公司;BG-power5000型稳压稳流电泳仪、水平电泳槽 北京百晶生物技术有限公司;凝胶成像系统、实时定量PCR仪(CFX96) 美国Bio-Rad公司;普通PCR仪 美国Applied Biosystems公司。
1.3 方法
1.3.1 RNA的提取和反转录
RNA的提取按照miRNeasy Mini Kit(50)试剂盒说明书进行,所提RNA用微量紫外分光光度计测定其吸光度(A260nm/A280nm)及浓度。并用1.5%琼脂糖凝胶电泳检测RNA的质量,最后置于-80 ℃冰箱保存。提取的RNA用设计的茎环式反转录引物和RevertAid First Strand cDNA Synthesis Kit说明书分别进行反转录,反转录引物序列如表1所示。
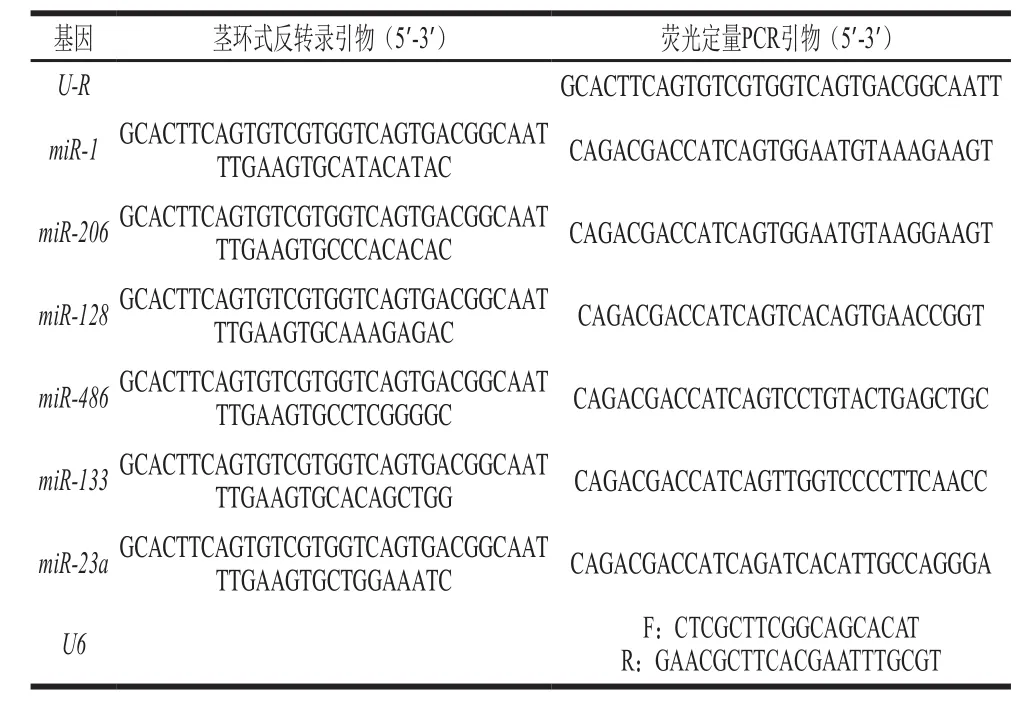
表1 引物序列Table 1 Primer sequences used in this study
1.3.2 引物的设计与合成
目的基因和管家基因U6的引物参照miRbase中提供的miRNAs成熟序列进行设计,包括茎环式反转录引物,实时定量PCR扩增引物。引物序列如表1所示。引物均由上海生工生物工程有限公司合成。
1.3.3 实时定量PCR
根据Chen Caifu等[22]提出的Stem-loop实时定量PCR方法对miRNAs进行定量。以miRNAs反转录产物为模板,SYBR为荧光染料,使用Maxima SYBR Green qPCR Master Mix说明书进行操作,反应程序使用三步循环进行荧光定量PCR扩增,所用仪器为CFX96,引物最佳退火温度均为60 ℃,反应条件为:前处理50 ℃、2 min;预变性95 ℃、10 min;变性95 ℃、15 s;退火60 ℃、30 s;延伸72 ℃、30 s;变性、退火、延伸进行40 个循环。每个样本重复测定3 次,定量完成后得到各miRNAs在不同样本中的Ct值,以U6为内参基因,采用Δ ΔCt法计算目的基因的相对表达量。
1.3.4 屠宰性能测定
屠宰前禁食12 h、停水2 h,同时分别测量体长、体高、胸围和宰前活质量。按照伊斯兰教屠宰要求进行屠宰,参照GB/T 9961—2008《鲜、冻胴体羊肉》进行胴体分割与各项分析,再逐羊测定胴体质量、骨质量、净肉质量等屠宰数据,包括体长、体高、胸围、屠前活质量和胴体质量,并按公式(1)~(3)计算其屠宰率、净肉率和肉骨比。

1.4 数据统计分析
1.4.1 实时定量PCR数据分析
本实验选用相对表达量法,以U6为内参基因,选择标准样本,比较待测样本相对标准样本的表达量,采用2-ΔΔCt法进行相对表达量分析。计算见公式(4)、(5)。

式中:Ct1为对照目的基因平均Ct值;Ct2为对照内参基因平均Ct值;Ct1’为处理前目的基因平均Ct值;Ct2’为处理前内参基因平均Ct值。
1.4.2 统计分析
用SPSS 19.0软件对实验数据进行统计分析,所有实验结果数值均用表示。选用单因素方差分析(ANOVA LSD),Duncan多重比较和双变量相关分析。
2 结果与分析
2.1 不同饲养条件对苏尼特羊屠宰性能的影响

表2 放牧、圈养苏尼特羊屠宰性能比较Table 2 Comparison of carcass traits of Sunit sheep under different feeding conditions
由表2可知,放牧苏尼特羊的体长、体高、胸围、宰前活质量、胴体质量、净肉质量高于圈养组,且差异显著(P<0.05),尤其宰前活质量放牧比圈养苏尼特羊高12.1 kg。而圈养苏尼特羊的屠宰率高于放牧组,且差异显著(P<0.05);同时圈养苏尼特羊的净肉率也高于放牧苏尼特羊,但差异不显著。因此,在生长性状方面(体长、体高和胸围),放牧苏尼特羊有优势,但是在屠宰率和净肉率方面,圈养苏尼特羊稍有优势。
2.2 RNA提取结果

图1 RNA提取结果Fig. 1 Electrophoretogram of total mRNA extracted from longissimus dorsi
用试剂盒提取苏尼特羊背最长肌mRNA后用1.5%琼脂糖凝胶电泳检测,经凝胶成像结果如图1所示,28S、18S和5S处的3 条带清晰明亮,表明所提取的RNA完整性较好,基本没有降解。用微量紫外分光光度计测得A260nm/A280nm均在1.8~2.1之间,表明质量较好。没有被DNA或蛋白污染,可用于cDNA反转录及实时定量。
2.3 不同饲养条件对苏尼特羊miRNAs表达的影响
对放牧与圈养条件下,苏尼特羊背最长肌基因miR-1、miR-206、miR-128、miR-486、miR-133、miR-23a经过实时定量PCR检测,相对表达量对比结果如图2所示。
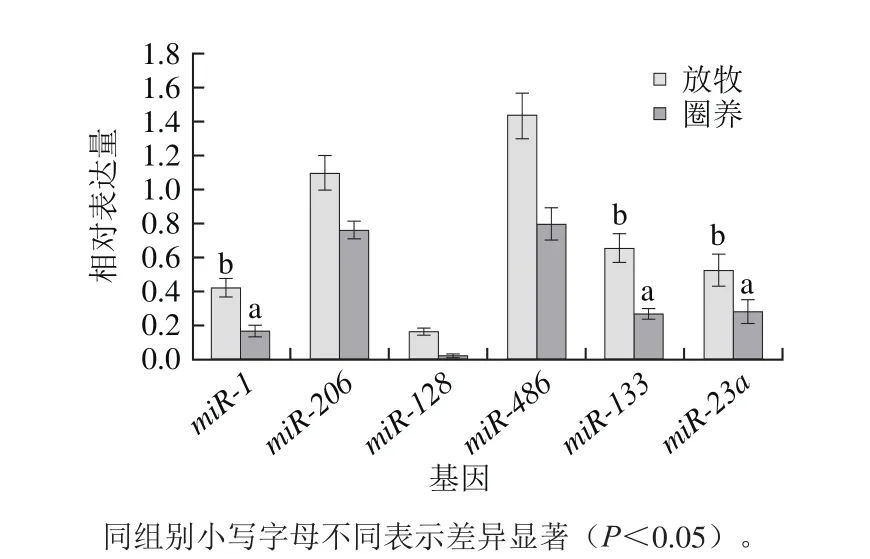
图2 放牧、圈养苏尼特羊miRNAs基因相对表达量比较Fig. 2 Comparison of the relative expression levels of miRNAs in Sunit sheep under grazing and stall-feeding conditions
由图2可知,两种饲养条件下,6 个miRNAs在苏尼特羊背最长肌中均有表达,且不同样本间相对表达量存在差异,整体上放牧苏尼特羊的miRNAs相对表达量均高于圈养组,其中放牧苏尼特羊的miR-1、miR-133和miR-23a相对表达量差异显著(P<0.05),且分别是圈养条件下同基因相对表达量的两倍左右。两种饲养方式下,以miR-206和miR-486相对表达量为最高,miR-128相对表达量最低,利用SPSS 19.0对这6 个miRNAs进行相关性分析发现(数据未列出),两种饲养方式下,miR-206相对表达量与miR-486相对表达量呈极显著正相关性(P<0.01),预示着此对miRNAs可能成对表达。由此表明,不同饲养条件对miRNAs的表达有影响。因此放牧条件的不同导致miRNAs的表达量不同。
2.4 不同饲养条件下性别因素对苏尼特羊miRNAs表达的影响

表3 不同饲养条件苏尼特羊不同性别miRNAs相对表达量比较Table 3 Comparison of the relative expression levels of miRNAs in make and female Sunit sheep under different feeding conditions
由表3可知,在放牧条件下,整体上公羊中miRNAs表达量均高于母羊,且miR-1表达量差异显著(P<0.05),其余miRNAs在公母中都没有显著差异。圈养条件下,公羊中miR-128表达量显著高于母羊(P<0.05),其余基因的表达量在公母中差异不显著,但是各miRNAs表达量都有差异。由此表明,miRNAs在同一饲养条件下,同一部位表达量的差异与性别有关。以上说明,在同一饲养条件下性别因素可以影响miRNAs的表达。
2.5 不同饲养条件下苏尼特羊miRNAs表达量与屠宰性能相关性分析
放牧与圈养条件下苏尼特羊miR-1、miR-206、miR-128、miR-486、miR-133、miR-23a基因表达量与体长、体高、胸围、宰前活质量、胴体质量、屠宰率屠宰数据的相关性分析结果如表4所示。放牧苏尼特羊miR-1表达量与体高、胴体质量、净肉质量、净肉率呈显著正相关(P<0.05)。且miR-133表达量与净肉质量也呈显著正相关性(P<0.05)。预示着miR-1和miR-133在放牧苏尼特羊的生长发育过程中对屠宰性能起正向调控作用;miR-128表达量与胸围显著正相关(P<0.05)。miR-206和miR-486与苏尼特羊体长相关性为负数,但是都没有达到统计学上的显著性。宰前活质量、骨质量和屠宰率与基因表达间均没有显著或极显著相关性(P>0.05)。圈养苏尼特羊整体miRNAs表达量与屠宰性能相关性大都为负数,生长性状方面,体长与miRNAs表达量都呈负相关。骨质量与各miRNAs都呈正相关,miR-128与净肉率之间呈显著负相关(P<0.05),miR-486与净肉率和净肉质量相关系数r值分别达-0.573和-0.544,净肉质量与miR-128表达量r值为-0.553,但是都没有达到统计学意义上的相关性。其余miRNAs基因表达量与屠宰性能均没有发现显著的相关性。说明miR-1和miR-133表达量增加可提高放牧苏尼特羊净肉质量而提高产肉量,而圈养苏尼特羊中,降低miR-128和miR-486表达量可提高其净肉率,净肉率是衡量肉产出量的一个重要指标。以上分析显示,miRNAs表达量与苏尼特羊屠宰性能有一定的相关性,说明肌肉特异性miRNAs的表达对苏尼特羊骨骼肌发育有重要作用。

表4 不同饲养条件苏尼特羊屠宰性能与基因miRNAs相对表达量相关性Table 4 Correlation between miRNAs expression and carcass traits in Sunit sheep under different feeding conditions
3 讨 论
研究表明不同饲养条件影响屠宰性能,张宏博等[23]研究证实苏尼特羊的屠宰率随着月龄增长,屠宰率下降,且8 月龄苏尼特羊屠宰率为42.05%,与本实验得到的两种饲养条件下苏尼特羊屠宰率较低相吻合。吴铁梅[24]研究表明,圈养育肥条件下,山羊胴体质量、屠宰率会显著增加,但同时非胴体组成部分(皮、血)和脏器(心、肝、脾、肺和胰腺)的质量也会显著增加,而本研究圈养苏尼特羊从8月份开始集中育肥,屠宰前育肥期较短(3 个月),羊处于适应性间段,生长缓慢,因此可能导致胴体质量、净肉质量较低[24]。毕力格等[25]研究苏尼特羊育成母羊和育成羯羊发现其平均内脏脂肪质量和平均尾重较高,说明舍饲育肥苏尼特羊贮积脂肪能力强且主要积于脂尾,可能导致圈养苏尼特羊净肉质量偏低。
不同饲养条件苏尼特羊背最长肌中肌肉特异性miRNAs表达存在差异,放牧这种饲养方式会提高肌肉特异性miRNAs的表达量,所以其生长性状高于圈养,且miRNAs在公羊中表达量高,这与韩志玲等[26]研究背最长肌中miRNAs的表达量的差异与性别有关,并且一般公羊高于母羊的结论一致,另外也从分子水平上部分解释了已有研究的胴体质量和净肉质量在同条件下公羊高于母羊[26-27];圈养条件下miRNAs与某些屠宰性能没有达到统计学上的相关性,可能在于不同miRNAs与其靶标miRNAs之间的作用影响不同蛋白质的量,进而造成屠宰性能的表现不显著。圈养这种饲养方式会增加苏尼特羊的屠宰率和净肉率,屠宰率是衡量产肉量的重要指标之一,所以圈养可提高苏尼特羊背最长肌产肉量。周迪[28]研究表明,miR-23a与鲤鱼的体高显著负相关,可能对鲤鱼的生长性状具有负调控作用。贾夏丽[29]对羊尾脂组织中miRNAs表达进行研究,发现性别对miRNAs的表达有显著影响。韦伟[30]研究证实miR-29表达上调会促进猪和小鼠的骨骼肌发育。Ling Yinghui等[31]发现miR-1和miR-133在山羊背最长肌中的表达量最高。进一步说明miRNAs的表达影响骨骼肌的发育而作用于屠宰性能,影响产肉量。
4 结 论
放牧苏尼特羊背最长肌生长性能(体长、体高和胸围)优于圈养,而净肉率和屠宰率圈养稍优于放牧,圈养可以提高苏尼特羊背最长肌的产肉量。与绵羊肌肉发育相关的6 个miRNAs表达量放牧高于圈养,且放牧苏尼特公羊高于母羊,miR-1和miR-133的高表达可提高放牧苏尼特羊的生长性状、胴体质量、净肉质量和净肉率,miR-128和miR-486的低表达可提高圈养苏尼特羊净肉质量和净肉率。
两种饲养条件下,屠宰性能各有优势,圈养可提高屠宰率和净肉率。肌肉特异性的6 个代表miRNAs的表达有异同且其表达的差异性会影响苏尼特羊的屠宰性能,同时该研究中未涉及苏尼特羊的其他肌肉组织,结论有待进一步确认。另外miRNAs及其作用的靶标mRNA,这些mRNA翻译蛋白的功能,以及miRNA-mRNA-蛋白-屠宰性能及肉品质之间的精密调控网络关系还待进一步探讨。
[1] KIM J Y, PARK Y K, LEE K P, et al. Genome-wide profiling of the microRNA-mRNA regulatory network in skeletal muscle with aging[J]. Aging, 2014, 6(7): 524-544.
[2] WU J, ZHU H, SONG W, et al. Identification of conservative microRNAs in Saanen dairy goat testis through deep sequencing[J]. Reproduction in Domestic Animals, 2014, 49(1): 32-40. DOI:10.1111/ rda.12217.
[3] 赵拴平. 猪骨骼肌生长发育相关基因和microRNA鉴定及其网络互作分析[D]. 杨凌: 西北农林科技大学, 2012: 1-144.
[4] BAROZAI M Y K. The novel 172 sheep (Ovis aries) microRNAs and their targets[J]. Molecular Biology Reports, 2012, 39(5): 6259-6266. DOI:10.1007/s11033-012-1446-x.
[5] SHENG Xihui, SONG Xuemei, YU Yan, et al. Characterization of microRNAs from sheep (Ovis aries) using computational and experimental analyses[J]. Molecular Biology Reports, 2011, 38(5): 3161-3171. DOI:10.1007/s11033-010-9987-3.
[6] HITACHI K, TSUCHIDA K. Role of microRNAs in skeletal muscle hypertrophy[J]. Frontiers in Physiology, 2014, 4: 408. DOI:10.3389/ fphys.2013.00408.
[7] 吉尔嘎拉, 满达, 姚明. 苏尼特羊肉的营养和保健价值的研究[J]. 中国草食动物, 2005, 25(6): 55-56.
[8] 罗玉龙, 王柏辉, 靳志敏, 等. 两种饲养条件对苏尼特羊肉营养品质的影响[J]. 食品科学, 2016, 37(19): 227-231. DOI:10.7506/spkx1002-6630-201619038.
[9] 解进. 育肥方式对呼伦贝尔及呼杜杂交羔羊育肥性能及羊肉品质的影响[D]. 呼和浩特: 内蒙古农业大学, 2014: 1-64.
[10] 苏日古嘎. 育肥模式对绒山羊成年母羊肉品质的影响及其与羔羊肉品质比较研究[D]. 呼和浩特: 内蒙古农业大学, 2013: 1-55.
[11] 闫素梅, 吴铁梅, 荷花, 等. 不同饲养模式对阿尔巴斯白绒山羊羔羊育肥增重及屠宰性能的影响[J]. 饲料工业, 2013(8): 1-7. DOI:10.3969/j.issn.1001-991X.2013.08.001.
[12] ZERVAS G, TSIPLAKOU E. The effect of feeding systems on the characteristics of products from small ruminants[J]. Small Ruminant Research, 2011, 101(1): 140-149. DOI:10.1016/ j.smallrumres.2011.09.034.
[13] 黄金玉, 焦金真, 冉涛, 等. 放牧与舍饲条件下山羊肌肉发育和抗氧化能力变化研究[J]. 中国农业科学, 2015, 48(14): 2827-2838. DOI:10.3864/j.issn.0578-1752.2015.14.014.
[14] KOGELMAN L J A, BYRNE K, VUOCOLO T, et al. Genetic architecture of gene expression in ovine skeletal muscle[J]. BMC Genomics, 2011, 12(1): 1. DOI:10.1186/1471-2164-12-607.
[15] PARRA P, SERRA F, PALOU A. Expression of adipose microRNAs is sensitive to dietary conjugated linoleic acid treatment in mice[J]. PLoS ONE, 2010, 5(9): e13005. DOI:10.1371/ journal.pone.0013005.
[16] CHEN Jianfu, TAO Yazhong, LI Juan, et al. MicroRNA-1 and microRNA-206 regulate skeletal muscle satellite cell proliferation and differentiation by repressing Pax7[J]. The Journal of Cell Biology, 2010, 190: 867-879.
[17] CHEN Jianfu, MANDEL E M, THOMSON J M, et al. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J]. Nat Genet, 2006, 38: 228-233. DOI:10.1038/ng1725.
[18] WANG Xiaonan. MicroRNA in myogenesis and muscle atrophy[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2013, 16(3): 258. DOI:10.1097/MCO.0b013e32835f81b9.
[19] XU Jing, LI Rongshan, WORKENEH B, et al. Transcription factor FoxO1, the dominant mediator of muscle wasting in chronic kidney disease, is inhibited by microRNA-486[J]. Kidney International, 2012, 82(4): 401-411. DOI:10.1038/ki.2012.84.
[20] DAI Yang, ZHANG Weiran, WANG Yimin, et al. MicroRNA-128 regulates the proliferation and differentiation of bovine skeletal muscle satellite cells by repressing Sp1[J]. Molecular and Cellular Biochemistry, 2016, 414(1/2): 37-46. DOI:10.1007/s11010-016-2656-7.
[21] HUDSON M B, PRICE S R. Calcineurin: a poorly understood regulator of muscle mass[J]. The International Journal of Biochemistry & Cell Biology, 2013, 45(10): 2173-2178. DOI:10.1016/ j.biocel.2013.06.029.
[22] CHEN Caifu, RIDZON D A, BROOMER A J, et al. Real-time quantif i cation of microRNAs by stem-loop RT-PCR[J]. Nucleic Acids Research, 2005, 33(20): e179-e179. DOI:10.1093/nar/gni178.
[23] 张宏博, 刘树军, 靳烨, 等. 性别因素对巴美肉羊屠宰品质的影响[J].食品科学, 2014, 35 (19): 82-85. DOI:10.7506/spkx1002-6630-201419017.
[24] 吴铁梅. 不同饲养模式对绒山羊羔羊育肥性能, 屠宰性能及肉品质的影响[D]. 呼和浩特: 内蒙古农业大学, 2013: 1-72.
[25] 苏德斯琴, 毕力格巴特尔, 阿日贡其布日, 等. 苏尼特羊育成羊屠宰性能研究[J]. 畜牧与饲料科学, 2014, 35(3): 20-22. DOI:10.16003/ j.cnki.issn1672-5190.2014.03.015.
[26] 韩志玲, 赵德超, 付绍印, 等. 绒山羊骨骼肌miRNAs及其靶基因表达谱分析[J]. 畜牧兽医学报, 2012, 43(10): 1539-1546.
[27] 张宏博, 刘树军, 腾克, 等. 巴美肉羊屠宰性能与胴体质量研究[J].食品科学, 2013, 34(13): 10-13. DOI:10.7506/spkx1002-6630-201313003.
[28] 周迪. mef2基因家族与MyomiRs在鲤鱼肌肉中的表达分析[D]. 哈尔滨: 东北林业大学, 2014: 1-61.
[29] 贾夏丽. 绵羊尾脂的全基因组microRNA表达谱分析及其与性状的关联性研究[D]. 太谷: 山西农业大学, 2015: 1-82.
[30] 韦伟. MIR-29和MIR-195/497调节骨骼肌生长发育的功能研究[D].武汉: 华中农业大学, 2014: 1-119.
[31] LING Yinghui, WANG Lijuan, DING Jianping, et al. Expression analysis of MiR-1 and MiR-133 in three developmental stages of goat skeletal muscle[J]. Journal of Animal and Plant Sciences, 2015, 25(1): 146-152.
Effect of Different Feeding Conditions on MyomiRs Expression in Longissimus doris Muscle Slaughter Performance of Sunit Sheep
ZHANG Lixia, GUO Yueying, YAO Duo, SU Rina, JIN Ye*
(College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China)
The study was undertaken to investigate the effect of different feeding conditions on MyomiRs expression in longissimus dorsi and slaughter performance of 12-month-old Sunit sheep. The results showed that growth traits (length, height and chest girth), live weight and carcass weight of sheep in the grazing group were signif i cantly higher than those of sheep in the stall-fed group (P < 0.05), and dressing percentage and lean meat yield of pen-fed sheep were higher than those of grazing sheep. The level of miRNA expression in longissimus dorsi of grazing sheep was higher than in stall-fed sheep. The miR-1 expression in grazing sheep had a signif i cant positive correlation with height, carcass weight and lean meat yield (P < 0.05), and miR-133 expression was also signif i cantly positively correlated with lean meat yield (P < 0.05). But a signif i cant negative correlation between miR-128 expression and lean meat yield was noted for the stall-fed group (P < 0.05). Accordingly, different feeding conditions have an impact on miRNAs expression, thereby further affecting slaughter performance.
feeding conditions; Sunit sheep; MyomiRs; expression; slaughter performance
10.7506/spkx1002-6630-201715011
TS251.5
A
1002-6630(2017)15-0063-06
张利霞, 郭月英, 要铎, 等. 不同饲养条件对苏尼特羊背最长肌中MyomiRs表达及屠宰性能的影响[J]. 食品科学, 2017,
38(15): 63-68.
10.7506/spkx1002-6630-201715011. http://www.spkx.net.cn
ZHANG Lixia, GUO Yueying, YAO Duo, et al. Effect of different feeding conditions on MyomiRs expression in
longissimus doris muscle slaughter performance of Sunit sheep[J]. Food Science, 2017, 38(15): 63-68. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201715011. http://www.spkx.net.cn
2016-07-14
国家自然科学基金面上项目(31360393)
张利霞(1992—),女,硕士研究生,研究方向为食品质量与安全性。E-mail:18847164886@163.com
*通信作者:靳烨(1964—),男,教授,博士,研究方向为畜产品加工安全。E-mail:jinyeyc@sohu.com
