5-氯-1-(4-氟苯基)-1H-吲哚的合成反应动力学研究
2017-09-03白洪涛
王 宇,白洪涛,方 佳
(天津辰力工程设计有限公司,天津 300400)
5-氯-1-(4-氟苯基)-1H-吲哚的合成反应动力学研究
王 宇,白洪涛,方 佳
(天津辰力工程设计有限公司,天津 300400)
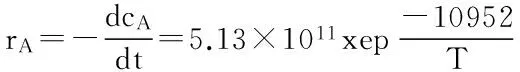
对氟溴苯 ;5-氯吲哚 ;5-氯-1-(4-氟苯基)-1H-吲哚 动力学
5-氯-1-(4-氟苯基)-1H-吲哚是制备抗精神病药物舍吲哚[1-2]的关键中间体,近年来,该产品的市场需求量日益增加,已经引起了国内外的重视。5-氯-1-(4-氟苯基)-1H-吲哚生产成本较高,反应条件苛刻[3],严格制约着该产品的工业化生产。为此,我们开展5-氯-1-(4-氟苯基)-1H-吲哚的合成动力学研究,为合成5-氯-1-(4-氟苯基)-1H-吲哚工艺路线和条件提供依据。反应方程式如下:
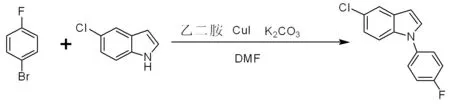
5-氯吲哚和对氟溴苯的反应属于液-固表面反应,产物5-氯-1-(4-氟苯基)-1H-吲哚的生成速率涉及到扩散、吸附、表面反应、脱附等诸多步骤,是一种多相反应。但由于在反应过程中碳酸钾作为缚酸剂不断的吸收反应生成的酸,并且逆反应速率远小于正反应速率,所以该合成反应可以视为不可逆反应。为了方便起见,我们以A代表对氟溴苯,B代表5-氯吲哚,C代表产物5-氯-1-(4-氟苯基)-吲哚。将上式简单表示如下:
(1)
若生成5-氯-1-(4-氟苯基)-吲哚的动力学方程式如下:

(2)
如果在反应中保持或看做CB不发生变化(在反应中,我们控制B物质大大过量,A缓慢滴加,相对B来说,滴加的A物质量很少,我们可以看做CB不发生变化),则上式可以简化为:
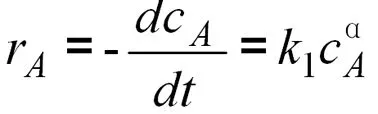
(3)
我们假设反应为一级不可逆反应,即 =1。则上式可以积分如下:
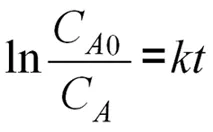
(4)
亦可表示为:
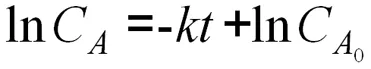
(5)
针对这种假设,实验需要测定不同温度下对氟溴苯的浓度变化(LnCA)与时间(t)之间的关系。
1 实验部分
1.1 主要仪器与试剂
为了对水压进行有效的监督,对子系统进行保压,保证试水的工作能够顺利的进行,建筑中和室内的管道相贴合的地方定是要进行压力表的安装。与此同时,在进行消防栓安装时务必要考虑的是消防栓与外墙之间的距离,一定要确保二者之间的距离是在5~40m间,同时和路旁的距离要设置在2m之内[4]。除此之外,以双速风机在控制上的理念作为依据,在控制箱的上方进行手动和自动按键开关的设置,低速和停高以及地启排风挡的设计也需要是健全的,从而使在低俗运转时火灾的信号可以及时、准确捕捉到,促进排烟挡高速的运转,为了使消防的安装变得更加有效,进行施工的时候对直流开关的实验是必不可少的。
GC9800型气相色谱仪(上海科创色谱仪器有限公司);氢气发生器(输出 20 mL/min,北京怡丰瑞普科技有限公司);氮气发生器(输出70 mL/min,北京怡丰瑞普科技有限公司);CL - 200型集热式恒温加热磁力搅拌器(巩义市英予华仪器厂);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);R - 2010旋转蒸发器(郑州长城科工贸有限公司)。
5-氯吲哚(化学纯,上海睿腾化工有限公司);对氟溴苯(化学纯,武汉嘉凯隆科技发展有限公司);其他试剂均为市售分析纯。
1.2 实验步骤
在250 mL四口烧瓶中加入10 g 5-氯吲哚,0.95 g催化剂CuI,100 mL溶剂DMF,12 g碳酸钾,在达到指定温度时用滴液漏斗缓慢滴加对氟溴苯,控制温度范围在指定温度±0.5 ℃,滴加完毕后,每隔60 min取样分析,每次用移液管移取反应液1 mL,所取样品通过水洗除去溶剂和固体杂质,用气相色谱分析测定对氟溴苯的浓度变化。
1.3 分析方法
用气相色谱仪分析不同条件下的样品,采用面积归一法求出各个样品中对氟溴苯的浓度,根据对氟溴苯浓度的变化,确定出对氟溴苯浓度与时间的关系。
2 结果与讨论
2.1 内外扩散的影响和体积变化影响的排除
测定反应的动力学必须要排除内外扩散的影响[4]。当催化剂的用量在对氟溴苯摩尔数的5%左右范围内,对氟溴苯的转化率是不随催化剂的含量增加而增大。而且实验中使用的催化剂量相对整个反应体系很小,在该条件下,反应中内扩散的影响可以基本忽略。在实验中搅拌速率大于200 r/min,外扩散的影响可以排除。同时,本反应的反应过程中体积变化不大,而且每次移取反应液1 mL,所以可以忽略反应液体积变化对反应体系的影响。
2.2 反应时间与对氟溴苯浓度的关系
在5-氯-1-(4-氟苯基)-1H-吲哚的合成反应过程中,我们采取在相同的实验条件下,通过改变反应温度来考察反应时间对5-氯-1-(4-氟苯基)-1H-吲哚的合成反应的影响。分别考察反应温度为363.15 K、373.15 K、383.15 K、393.15 K、403.15 K时的实验数据,采用最小二乘法将实验测定的对氟溴苯的浓度与反应时间的数据进行数学模拟,进而确定此反应的反应级数。对氟溴苯浓度随反应时间的变化数据如表1和图1所示,进而计算出不同浓度时-LnCA的值,可以得出反应时间t与(-LnCA)线性关系图,如图2所示。
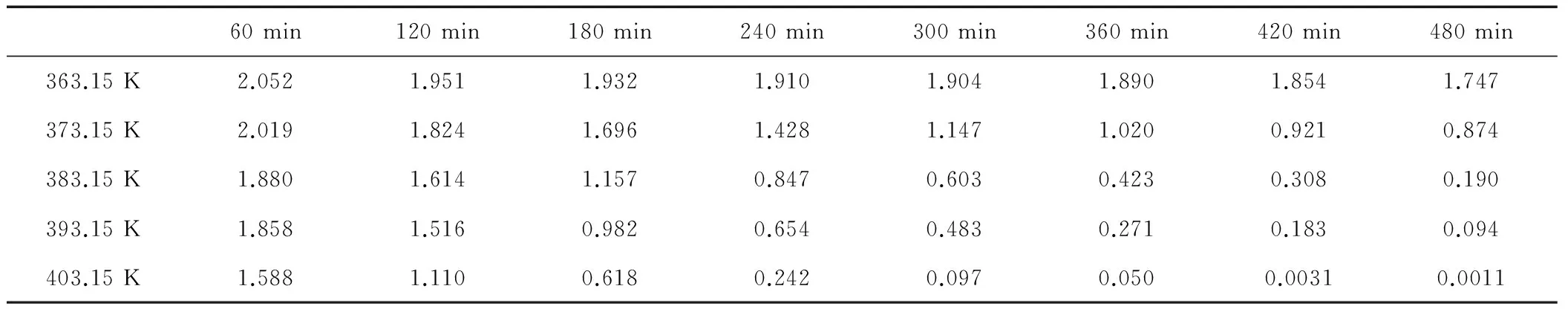
表1 不同温度和反应时间下的对氟溴苯浓度 mol·L-1
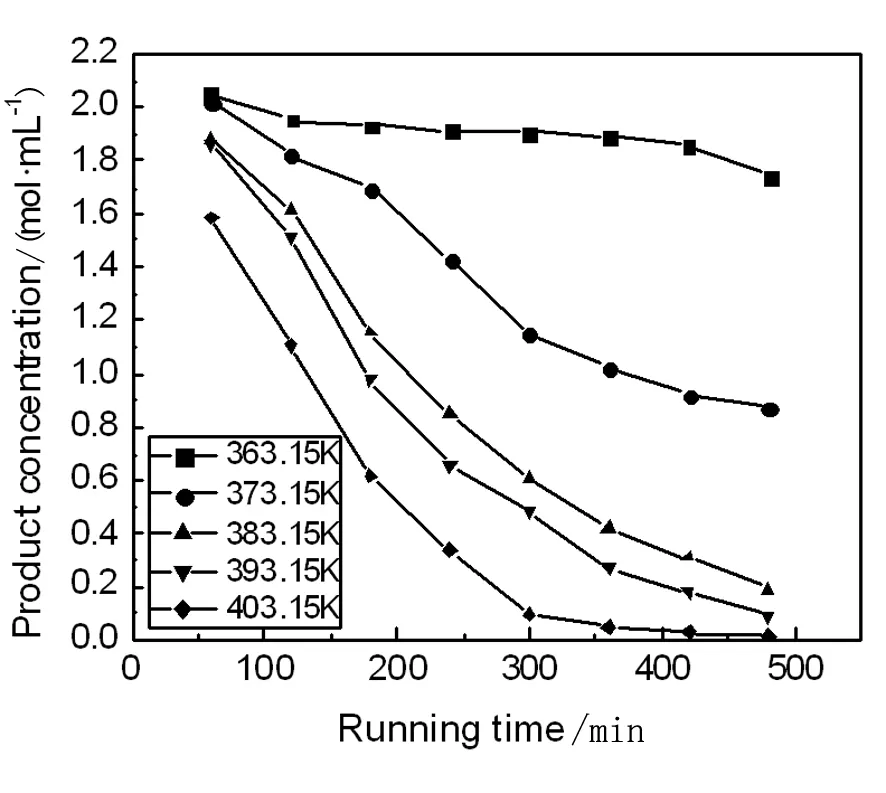
图1 对氟溴苯浓度与反应时间的关系
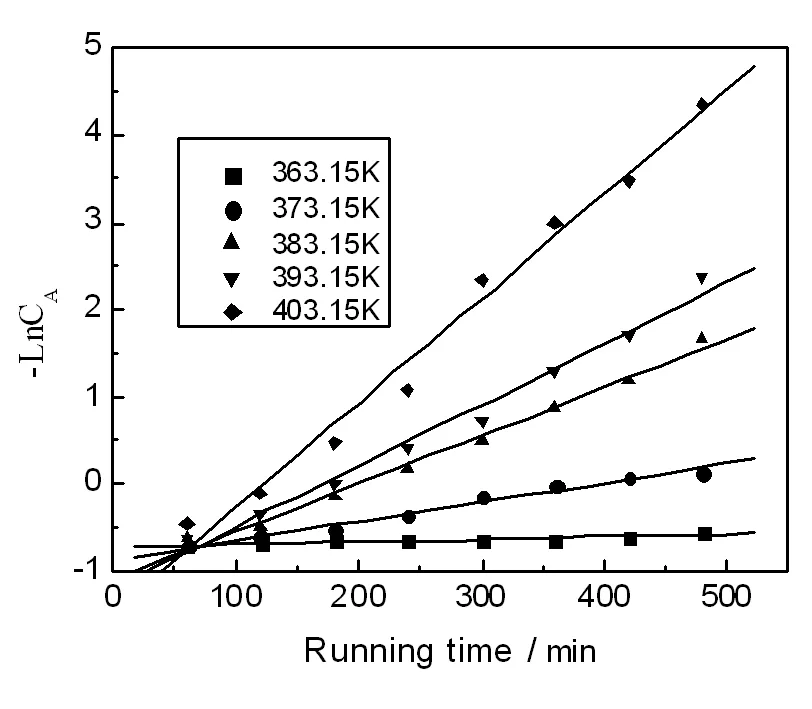
图2 t与(-LnCA)的线性关系
由图2可以看出,(-LnCA)与t之间呈现良好的线性关系,可以认为,5-氯-1-(4-氟苯基)-吲哚的合成反应动力学的表观反应级数为1级[5],其中线性拟合方程如表2所示。

表2 拟合方程
2.3 反应表观活化能的确定
为了考察反应温度对反应动力学方程的影响,我们根据不同反应时间对应的对氟溴苯的实测浓度,以及由t与(-LnCA)回归出来的动力学参数方程,可以得出不同温度下反应的表观反应速率常数k值(表3)。并以表中实验数据作Lnk-1/T图(图3),由图3可以看出,Lnk-1/T呈现较好的线性关系。
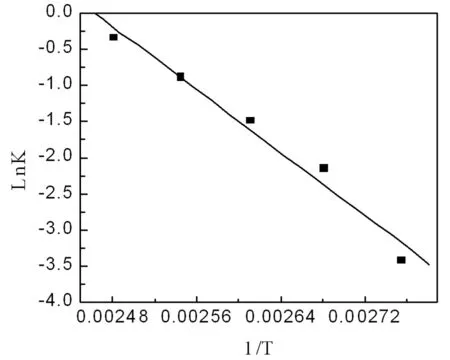
图3 速度常数与温度的关系
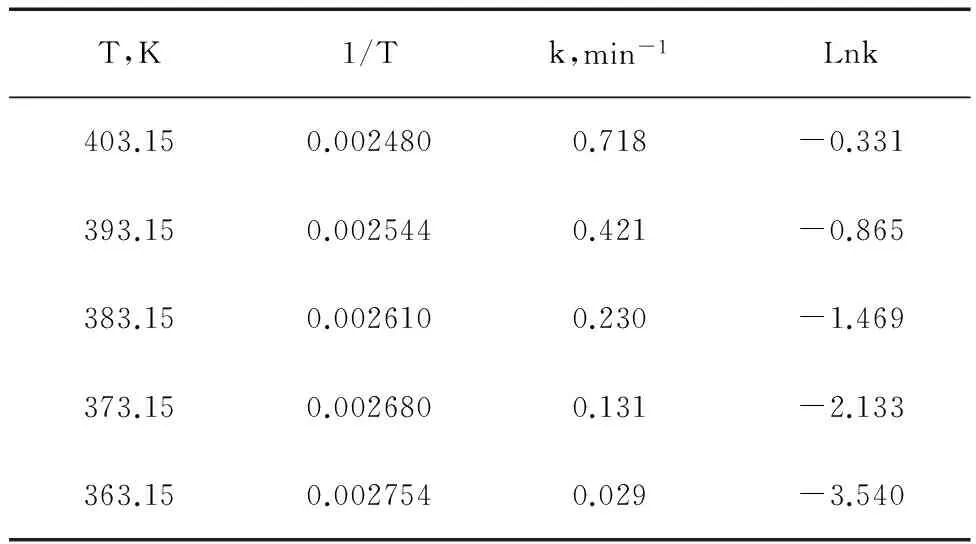
T,K1/Tk,min-1Lnk403.150.0024800.718-0.331393.150.0025440.421-0.865383.150.0026100.230-1.469373.150.0026800.131-2.133363.150.0027540.029-3.540
用实验数据拟合阿伦尼乌斯方程,得出Lnk与1/T的线性关系式为:
相关系数为0.97,由此可以计算出阿伦尼乌斯方程中的表观活化能和指前因子分别为:Ea=10952×8.3145=91.06 kJ/mol;K0= e26.964=5.13×1011min-1。
2.4 动力学方程验证
为了验证该反应动力学方程的可信度,现用积分式计算出温度为398.15 K,不同反应时间下所对应的对氟溴苯的浓度CA,cal,并将其与实测浓度CA,exp进行校验,其结果见表4,由表4数据可知,实验值与计算值的误差较小,二者符合较好,可见理论值是比较准确的。
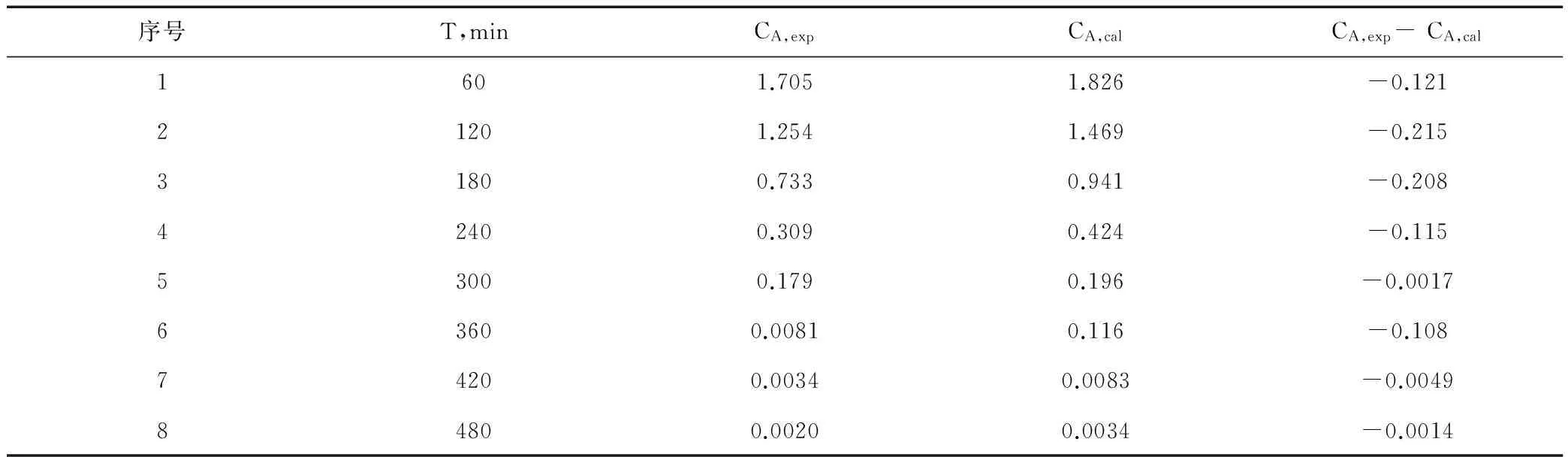
表4 温度为398.15 K时对氟溴苯实验值与计算值的比较
3 结论
(1)5-氯吲哚和对氟溴苯在催化剂作用下的Ullmann型交叉偶联反应属于一级反应,其反应速度与温度和对氟溴苯的浓度有关,其化学反应动力学表征方程可以表示为:
(2)在温度363.15~403.15 K范围内,反应的表观活化能Ea=91.06 kJ/mol,是介于一般化学反应活化能40~200 kJ/mol之间,属于化学反应控制过程。
[1]李建其, 叶雪雁, 黄丽瑛, 等. 一种制备舍吲哚的方法: 中国, 101362748A[P]. 2009-02-11.
[2] Katja K, Christine R K.Sertindole versus other atypical antipsychotics for schizophrenia[J].Wiley Interscience, 2009, 45: 257-268.
[3] J.扎农, M.维拉, F.恰尔德拉. 舍吲哚的制备方法:CN,1642942A[P].2005-07-20.
[4] Marafi A, Kam E, Stanislaus A. A kinetic study on non-catalytic reactions in hydro processing Boscan crude oil[J].Fuel, 2008, 87(11): 2131-2140.
[5] 王正烈, 周亚平, 李松林, 等. 物理化学[M]. 北京: 高等教育出版社, 2005:195-288.
(本文文献格式:王 宇,白洪涛,方 佳,等.5-氯-1-(4-氟苯基)-1H-吲哚的合成反应动力学研究[J].山东化工,2017,46(04):16-18.)
Kinetic Study on Synthesis of 5 -chloro-1-(4-fluorine phenyl)-1H-indole
WangYu,BaiHongtao,FangJian
(Tianjin Chen Li Engineering Design Co., Ltd., Tianjin 300400, China)
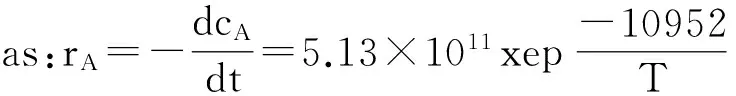
fluorobromobenzene; 5-chloro-indole; 5-chloro-1-(4-fluorine phenyl)-indole; kinetics
2017-01-11
王宇(1987—),工程师,通讯联系人。
O643.38
A
1008-021X(2017)04-0016-03
