经尿道灌注干细胞白血病重组基因慢病毒对糖尿病膀胱病变豚鼠膀胱功能的影响
2017-09-03余运运王勤章王子雄钱彪丁国富徐浩张思源
余运运,王勤章,王子雄,钱彪,丁国富,徐浩,张思源
(石河子大学医学院第一附属医院,新疆石河子832000)
·基础研究·
经尿道灌注干细胞白血病重组基因慢病毒对糖尿病膀胱病变豚鼠膀胱功能的影响
余运运,王勤章,王子雄,钱彪,丁国富,徐浩,张思源
(石河子大学医学院第一附属医院,新疆石河子832000)
目的 探讨经尿道灌注干细胞白血病重组(SCL)基因慢病毒对糖尿病膀胱病变(DCP)豚鼠膀胱功能的改善作用。方法 采用单次腹腔注射链脲佐菌素(STZ)法建立豚鼠糖尿病模型,培养12周后建立DCP模型。选取DCP豚鼠20只,随机分为模型组、SCL组各10只。取未造模的10只作为对照组。各组麻醉后经尿道插入自制尿管,排空尿液,对照组和模型组均经尿管灌注PBS液0.2 mL,SCL组经尿管灌注最佳感染复数(MOI)的SCL基因慢病毒0.2 mL(2×107IU)。灌注后结扎尿管,保留膀胱灌注液2 h。灌注后28 d时用代谢笼收集三组24 h尿量;行尿动力学检测,于膀胱排尿后即刻测残余尿量、最大膀胱容量、排尿期最大逼尿肌压、单次排尿周期灌注量、膀胱顺应性。切除完整膀胱,排尽尿液后称量膀胱湿重。结果 与对照组相比,模型组和SCL组24 h尿量、膀胱湿重、最大膀胱容量、残余尿量均增加,最大逼尿肌压、膀胱顺应性均降低(P均<0.05);与模型组相比,SCL组24 h尿量、膀胱湿重、最大膀胱容量、残余尿量均降低,最大逼尿肌压、膀胱顺应性均增加(P均<0.05)。结论 经尿道灌注SCL慢病毒能够显著改善DCP豚鼠的膀胱功能,为治疗DCP提供了新的途径与方法。
糖尿病膀胱病变;慢病毒;干细胞白血病基因;膀胱功能;Cajal间质细胞;豚鼠
糖尿病膀胱病变(DCP)是糖尿病导致的泌尿系统慢性并发症之一,发病率占糖尿病患者的25%~85%[1]。其临床特征表现为膀胱充盈功能受损,膀胱容量增大,收缩功能降低和残余尿量增加,严重影响患者的生活质量[2]。目前认为其发病机制包括神经功能障碍、逼尿肌功能改变和膀胱上皮功能障碍等,是多因素共同作用的结果[3]。近年研究发现,膀胱逼尿肌存在一种类似胃肠道的Cajal间质细胞(ICC),命名为膀胱ICC细胞,并推测该细胞就是膀胱的起搏细胞,能够调控逼尿肌的收缩。进一步研究发现,高糖环境导致的膀胱内ICC细胞功能受损和数量减少是DCP的发病机制之一[4]。膀胱ICC细胞能够特异性表达酪氨酸蛋白激酶生长因子受体(c-kit),c-kit 基因转录调控区存在干细胞白血病基因(SCL)结合位点,SCL能够通过c-kit基因启动子调节c-kit表达。研究发现,SCL过表达能上调c-kit的表达[5]。但目前,对于SCL在DCP治疗中的作用尚无明确认识。2016年2~8月,我们对DCP豚鼠经尿道灌注SCL基因重组慢病毒,探讨其对DCP膀胱功能的改善作用,为临床治疗DCP奠定理论基础。
1 材料与方法
1.1 实验动物及材料 普通级荷兰种健康雄性豚鼠60只,6~8周龄,体质量250~350 g,购自新疆医科大学动物实验中心。链脲佐菌素(STZ,Sigma公司);柠檬酸与柠檬酸钠(上海化工试剂公司);乌拉坦(国药集团化学试剂有限公司);血糖仪及试纸(美国强生公司);SCL慢病毒(上海吉凯恩公司);尿动力学检测仪(加拿大Laborie公司);大小鼠代谢笼(型号B6-10,江苏苏州市苏杭科技器材有限公司);眼科手术剪;自制豚鼠用尿管(由麻醉用的硬膜外导管改良而成,每次使用前后消毒灭菌)。
1.2 SCL基因慢病毒表达载体的构建及重组慢病毒的包装 对 SCL基因质粒进行PCR 扩增,上游引物序列为 5′-GAGGATCCCCGGGTACCGGTCGCCACCATGACCGAGCGGCCGCCGAG-3′,下游引物序列为5′-TCACCATGGTGGCGACCGGCCGAGGGCCGGCTC-CATC-3′。将人SCL基因质粒的PCR扩增产物提纯,通过In-Fusion转换酶的催化作用将人SCL基因质粒的PCR产物与GV287-EGF结合,形成重组质粒GV287-EGFP/SCL,即含人SCL基因慢病毒载体。提取重组质粒GV287-EGFP/SCL阳性克隆菌落PCG模板上的交换转化产物,直至长出菌落后加入到10 μL培养基混匀,抽取1 μL混合物设置模板,通过PCF法进行基因扩增,与阳性转化子对接后分装测序。以293T细胞为包装细胞,制备编码慢病毒的重组病毒质粒及2种辅助包装原件载体质粒,3种质粒分别进行高纯度无内毒素提纯,按照Lipofectamine2000转染试剂盒使用说明转染293T细胞,转染8 h后更换为完全培养基,培养48 h,收集含人SCL基因慢病毒载体的细胞上清液,对其浓缩后得到高低度的含人SCL基因慢病毒载体浓缩液,荧光法在293T细胞中测定病毒滴度为2×108IU。
1.3 动物模型制备及分组方法 60只豚鼠适应性喂养1周后,随机选取50只,禁食12 h后按200 mg/kg单次腹腔注射1%的STZ(0.1 mol/L、pH 4.4的枸橼酸缓冲液)制备糖尿病模型。全价饲养6周后剪耳法检测随机血糖,以随机血糖连续4周≥16.7 mmol/L为糖尿病模型制备成功。糖尿病模型诱导成功后继续全价饲养6周,参考糖尿病豚鼠DCP标准[6,7],STZ单次腹腔注射12周后88. 89%的糖尿病豚鼠发生DCP病变,建立较为可靠的DCP动物模型。选取DCP豚鼠20只,采用随机数字表法分为模型组、SCL组各10只。未造模的10只作为对照组,给予等量的枸橼酸缓冲液单次腹腔注射。
1.4 SCL基因慢病毒转染方法 各组禁食水6 h,200 g/L乌拉坦1.5 g/kg麻醉后经尿道插入自制尿管,排空尿液。对照组和模型组均经尿管灌注PBS液0.2 mL,SCL组灌注最佳感染复数(MOI)的SCL基因慢病毒0.2 mL(2×107IU)[8]。灌注后结扎尿管,保留膀胱灌注液2 h。
1.5 24 h尿量、膀胱湿重检测 慢病毒灌注后28 d时,用代谢笼收集三组豚鼠24 h尿量;在尿动力学检测结束后,切除完整膀胱,排尽尿液后称量膀胱湿重。
1.6 尿动力学检查 乌拉坦麻醉生效后,仰卧固定,碘伏消毒下腹部,耻骨上作切口显露膀胱。两个41/2号留置针分别自膀胱顶刺入,其中一个与微量泵相连,另一个与尿动仪压力感受器相连,结扎两侧输尿管。37 ℃生理盐水以0.25 mL/min的速度进行膀胱灌注,进行充盈性膀胱测压。连续记录10个排尿周期,待膀胱排尿后即刻测残余尿量。最大膀胱容量为单次充盈周期膀胱灌注量与残余尿量之和。排尿期最大逼尿肌压及单次排尿周期灌注量均取10个排尿周期中各指标的均值。膀胱顺应性为单次充盈周期膀胱灌注量与充盈期膀胱内压力变化的比值。以上各项参数均取3次实验的平均值。
2 结果
2.1 各组24 h尿量及膀胱湿重比较 与对照组比较,模型组和SCL组24 h尿量及膀胱湿重均增加(P均<0.05);与模型组比较,SCL组24 h尿量及膀胱湿重均降低(P均<0.05)。见表1。
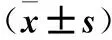
表1 各组24 h尿量、膀胱湿重比较
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
2.2 各组尿动力学参数比较 与对照组比较,模型组和SCL组最大膀胱容量、残余尿量均增加,最大逼尿肌压、膀胱顺应性均降低(P均<0.05)。与模型组比较,SCL组最大膀胱容量、残余尿量均降低,最大逼尿肌压、膀胱顺应性均增加(P均<0.05)。见表2。
表2 各组尿动力学参数比较±s)
注:与对照组比较,*P<0.05;与模型组比较,#P<0.05。
3 讨论
DCP是糖尿病的常见并发症之一,其进展呈隐匿性,在糖尿病早期即可发生,随着病程的延长膀胱功能损伤进行性加重[9,10]。Satriano等[11]研究认为,DCP膀胱肥大可能是尿量增多的适应性结果。而残余尿量增多与逼尿肌和膀胱顺应性降低有关,表明膀胱逼尿肌收缩和舒张功能受损是膀胱失代偿的结果。本研究结果显示,与对照组相比,模型组24 h尿量及膀胱湿重均增加,考虑为糖尿病利尿状态下,膀胱代偿性增生所致,长期进展导致膀胱出现结构和功能损害;与对照组比较,模型组最大膀胱容量、残余尿量均增加,最大逼尿肌压、膀胱顺应性均降低,提示DCP豚鼠出现膀胱功能受损,表现为最大膀胱容量、残余尿量明显增加,最大逼尿肌压、膀胱顺应性降低。
研究发现,膀胱ICC细胞具有维持逼尿肌的起搏功能和膀胱张力、协调逼尿肌运动功能[12,13]。ICC细胞在被抑制的情况下,膀胱逼尿肌收缩功能明显下降。ICC细胞膜上c-kit与其配体干细胞因子(SCF)结合后可启动SCF/c-kit信号通路,该信号通路在维持ICC细胞表型和功能中具有重要作用[14]。DCP患者膀胱内ICC细胞SCF/c-kit信号传导受阻,可导致ICC细胞功能受损、数量减少或消失。而SCL基因是c-kit上游重要的调控基因,能够作用于c-kit基因的启动子,具有强烈的促进c-kit表达的作用。研究发现,SCL 过表达可使 c-kit 表达升高,并对SCF 反应性恢复正常,修复受损的SCF/c-kit信号通路[15]。于建超等[16]通过SCL基因重组慢病毒高效地转染了体外培养的豚鼠膀胱ICC,并成功介导SCL在ICC中的表达。周建民等[17]以腺病毒为载体,将SCL基因导入体外高糖环境培养的ICC,成功上调c-kit mRNA和蛋白的表达,显著改善了ICC的形态以及功能损害,提示通过促进DCP膀胱中ICC细胞表型和功能的恢复,进而改善膀胱功能是可行的。本研究发现,与模型组相比,SCL组24 h尿量及膀胱湿重均降低,最大膀胱容量、残余尿量均减少,最大逼尿肌压、膀胱顺应性均增加,提示SCL组豚鼠排尿效率显著提高,膀胱功能得到一定程度的改善,表明SCL基因重组慢病毒能够改善DCP豚鼠的膀胱功能。其作用机制可能与上调c-kit表达,逆转SCF/c-kit信号通路相关,进而促进DCP膀胱中ICC细胞表型和功能的恢复。
基因治疗是DNA或RNA水平上人为地将某些外源性的基因导入相应的靶细胞,从而获得表达继而产生特定的生物学效应,以达到治疗的目的[18]。腺病毒、腺相关病毒、慢病毒以及非病毒载体等均可将目的基因整合至靶细胞,其中以慢病毒载体转染效率最高、容量大,能够感染原代细胞和非分裂细胞,保证转导的基因长期稳定表达,且无病毒蛋白的表达,自身免疫反应小,应用越来越广泛。传统的基因治疗多通过血管导入基因载体,这样基因载体可通过血流分布至全身,造成一定程度的浪费,且安全性差。近年来,通过膀胱灌注途径进行基因治疗泌尿系统上皮肿瘤已在国内外广泛应用。研究[8]表明,通过尿道将腺病毒等基因载体灌入小鼠膀胱内后,膀胱肿瘤细胞内能够检测到目的基因的蛋白产物,且未发现在肝、肺等其他组织表达,因此本研究构建的SCL基因重组慢病毒经由尿道途径灌注入膀胱内,可在保证较高转染率的同时,避免肝、肾等其他部位的毒性反应,也减少慢病毒的浪费。
综上所述,经尿道灌注将SCL基因慢病毒转染豚鼠DCP膀胱后,能够显著改善DCP豚鼠的膀胱功能,为治疗DCP提供了新的途径与方法。
[1] Shi Z. Prevalence of diabetes among men and women in China[J]. N Eng J Med, 2010,362(25):1090-1100.
[2] 石小霄,王艳滨,王瑞雪,等.糖尿病膀胱病的发病机制及诊断[J].中国综合临床,2015,31(4):368-369.
[3] 罗丰伟,黎玮.糖尿病膀胱功能障碍的研究进展[J].临床荟萃,2016,31(6):689-692.
[4] McCloskey KD. Interstitial cells in the urinary bladder-localization and function[J]. Neurourol Urodyn, 2010,29(1):79-82.
[5] Perrotte P, Wood M, Slaton JW, et al. Biosafety of in vivo adenovirus-p53 intravesical administration in mice[J]. Urology, 2000,56(1):155-159.
[6] 李维仁,王勤章,丁国富,等.豚鼠糖尿病膀胱模型的建立[J].现代泌尿外科杂志,2008,13(5):368-370.
[7] 罗广承,何志华,罗建珍,等.构建糖尿病膀胱病豚鼠模型及其尿动力学评价[J].中国组织工程研究,2014,18(7):1063-1068.
[8] 魏艳青,王江平,王勤章,等.经尿道灌注慢病毒转染豚鼠膀胱的研究[J].天津医药,2015,43(11):1275-1277.
[9] 王东文,双卫兵,吴博威.糖尿病膀胱尿动力学及逼尿肌功改变的相关性研究[J].中华泌尿外科杂志,2006,27(5):314-317.
[10] Sasaki K, Yoshimura N, Chancellor MB. Implications of diabetes mel1itus in urology[J]. Clin Urol North Am, 2003,30(1):1-12.
[11] Satriano J. Kidney growth, hypertrophy and the unifying mechanism of diabetic complications[J]. Amino Acids, 2007,33(2):331.
[12] Smet PJ, Jonavicius J, Marshall VR, et al. Distribution of nitric oxide svnthase immunoreactive nerves and identincation of the ceuular targets of nitric oxide in guinea-pig and human unary bladder by cGMP immunohistochemistry[J]. Neumscience,1996,71(2):337-348.
[13] Anderson UA, Carson C, McCloskev KD. KCNO currents and their conttibution to resting membrane potential and excitability of interstitial cells d cajal from the guinea pig bladder[J]. J Uml, 2009,182(3):330-336.
[14] Wang DW, Shuang WB, Wu BW. The relationship between urodynamic findings and detrusor changes of diabetic cystopathy [J]. Chinese J Urolo, 2006,27(5):314-317.
[15] Li F, Zhang L, Li C, et al. Adenovirus-mediated stem cell leukemia gene transfer induces rescue of interstitial cells of Cajal in ICC- loss mice[J]. Int J Colorectal Dis, 2010,25 (5):557-566.
[16] 于建超,王勤章,王江平,等.含人干细胞白血病基因慢病毒载体转染Cajal样间质细胞的效果研究[J]. 中国全科医学,2016,19 (15) :1796-1802.
[17] 周建民,丁国富,王勤章,等.应用 AdMax 载体系统构建 SCL基因重组腺病毒表达载体[J].中国现代医学杂志,2011,21(17): 1949-1952.
[18] 刘业六,张逖,杨晓钟,等.可调控慢病毒介导白细胞介素-12治疗结肠癌的研究[J].中华实验外科杂志,2014,31(8):1749-1751.
国家自然科学基金资助项目 (81360120)。
王勤章(E-mail: wqz1969@sina.com)
10.3969/j.issn.1002-266X.2017.30.008
R587.2
A
1002-266X(2017)30-0030-03
2017-03-12)
