叶黄素酯/α环糊精包合研究
2017-09-03蔡浩锋卜慧敏李文玎
蔡浩锋,薛 可,卜慧敏,陈 洋,李文玎,任 勇
(南京师范大学生命科学学院,江苏省医药超分子材料及应用重点实验室,江苏南京 210046)

蔡浩锋,薛 可,卜慧敏,陈 洋,李文玎,任 勇*
(南京师范大学生命科学学院,江苏省医药超分子材料及应用重点实验室,江苏南京 210046)
目的:研究叶黄素酯与α-环糊精的包合性能。方法:紫外法测定包合行为并计算表观包合常数;研磨法制备包合物;溶解度为指标确定包合比;DTA、DR-FTIR、UV-vis DRS验证包合物;与β-环糊精和混合环糊精的包合作用比较,测定其溶解度、稳定性。结果:叶黄素酯与α-环糊精表观包合常数Ka为127 L/mol;包合比1∶5时溶解度最佳;α-环糊精使叶黄素酯稳定性增强,溶解度提高为叶黄素酯原料的6倍以上。结论:α-环糊精应用于叶黄素酯性能优于β-环糊精和混合环糊精。
叶黄素酯,环糊精,包合物,溶解度,稳定性
叶黄素酯(Lutein esters),来源于万寿菊花,经过脱水粉碎、溶剂提取、低分子量醇纯化和真空浓缩等步骤生产而成,为深红棕色细小颗粒,是叶黄素与脂肪酸形成的酯类化合物,2008年被卫生部批准为新资源食品(卫生部公告2008年第12号),并标定主成分为叶黄素二棕榈酸酯(>55%)(图1),分子式C72H116O4,分子量1045.71 Da,主要用于食品行业及医药领域[1-2]。研究表明,叶黄素酯与叶黄素具有同样的生理功能[3-6],其生物利用度高于叶黄素单体[7-8]。然而其多个双键共轭形成C40的长链分子,对光、热、空气敏感,水溶性极差,生物利用度仍偏低[9]。
环糊精(Cyclodextrin,简称CD),外形似“锥筒”,“内疏水、外亲水”的独特结构特性对难溶性药物有包合和增溶作用[10],可防止药物挥发、升华、氧化和见光分解的作用,提高药物的生物利用度[11]。本实验室曾研究β-环糊精(β-CD)和羟丙基-β-环糊精(HP-β-CD)所形成的混合环糊精(CDs)对叶黄素酯的增溶作用,表明CDs使叶黄素酯溶解度提高到0.3961 μg/mL,且提高了对光、热、空气的稳定性。但是CDs用量过大(叶黄素酯与CDs质量比1∶10)、辅料成本高、增溶效果不显著[12]。α-环糊精(α-CD)溶解性和安全性均优于β-CD[11],且价格低于HP-β-CD,为此本文进一步探讨了α-CD对叶黄素酯包合作用,并与β-CD和CDs的包合效果进行对比,以期改进叶黄素酯产品应用的效果。
漫反射光谱技术是漫反射光进入样品内部后,经过多次反射、折射、衍射、吸收后返回表面,是分析光与样品内部分子发生了相互作用后的光谱,负载了样品结构和组分信息,是一种快速、无损的分析技术[13]。适用于固体粉末样品的直接测定以及材料的表面分析,试样处理简单,无需压片,并且不改变样品原有形态,更能够直观的反应物质的真实信息[14]。传统的验证包合物方法如X-射线衍射法、电镜扫描、红外光谱等[15]需要将样品进行一些前处理,如压片等,很有可能导致样品原有形态结构发生改变,因此采用漫反射傅立叶变换红外光谱[16](DR-FTIR)和紫外/可见漫反射光谱(UV-vis DRS)验证包合物更能够真实的反应物质的结合状态。
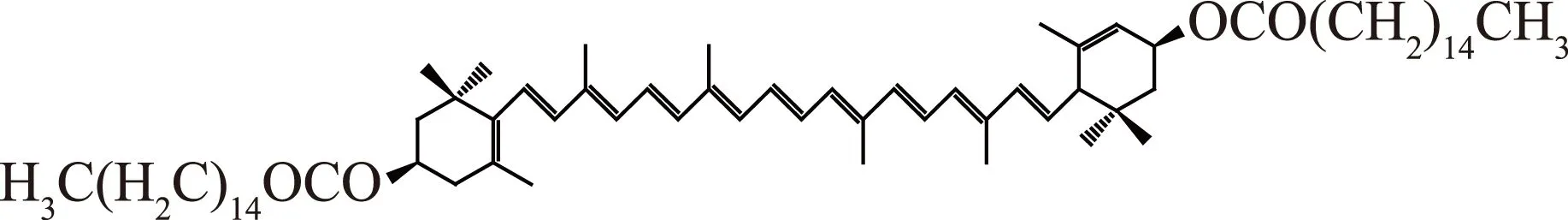
图1 叶黄素二棕榈酸酯化学结构图Fig.1 Chemical structure of lutein esters
1 材料与方法
1.1 材料与仪器
叶黄素酯(含量12%) 青岛同鑫天然产物有限公司,食品级;叶黄素 天津市尖峰天然产物研究开发有限公司(JF-NATURAL),HPLC纯度90%;α-环糊精(α-CD) 武汉远成共创科技有限公司;β-环糊精(β-CD) 安徽山河药用辅料股份有限公司;纯净水 南京上上贸易实业有限公司;其他所用试剂均为分析纯。
Explorer电子分析天平 Ohaus Corporation,USA;UV-2450型紫外可见分光光度计 日本岛津公司;GXZ型智能、PGX型多段光照培养箱 宁波东南仪器有限公司;KQ-250DB数控超声波清洗器 昆山市超声仪器有限公司;QHZ-123B组合式全温度振荡培养箱 太仓市华美生化仪器厂;DZX-1(6050B)真空干燥箱 上海福玛实验设备有限公司;NEXUS670傅立叶变换红外光谱仪 美国尼高力公司;Cary5000紫外/可见/近红外分光光谱仪 美国 VARIAN(瓦里安)公司。
1.2 叶黄素标准曲线的绘制
1.2.1 测定波长的确定 精密称定叶黄素对照品0.0500 g,无水乙醇溶解并定容至100 mL,作为储备液。精密吸取1.00 mL储备液,用无水乙醇稀释成质量浓度为20.00 μg/mL的样品溶液;另取约0.1000 g的叶黄素酯原料,无水乙醇溶解并稀释;配制CD(α-CD、β-CD、HP-β-CD)水溶液。分别在350~500 nm波长扫描。
1.2.2 标准曲线的绘制 储备液分别用无水乙醇稀释成0.0200~0.8000 μg/mL系列质量浓度的溶液,紫外光谱扫描,在446 nm处测定吸光度值。以叶黄素质量浓度C(μg/mL)为横坐标,吸光度值A为纵坐标,绘制标准曲线。
1.3 包合常数的测定(光度法)
pH6.86磷酸盐缓冲液配制叶黄素酯稀溶液(A液),称取0.1000 g的CD,用A液溶解并定容至10 mL,此为B液。移取2.50 mL A液,在350~500 nm内紫外扫描得紫外吸收值A0,依次向A液中加入定量的B液,涡旋振荡1 min后紫外扫描,得不同CD摩尔浓度体系的紫外吸收值A1~An,根据文献[17-18]关系式:
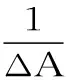
式中:ΔA是加入CD后叶黄素酯紫外吸收值的变化,[CD]0是环糊精的总浓度,[G]0叶黄素酯的总浓度,Δε为叶黄素酯与CD形成包合物前后摩尔吸收系数之差。以1/ΔA对1/[CD]0作图,得到一条直线,由所得的截距/斜率即可求得包合常数Ka值。
1.4 包合物的制备
将叶黄素酯与α-CD按照质量比例为1∶2、1∶3、1∶4、1∶5、1∶10、1∶15分别投料,加入适量水,室温避光研磨1 h呈糊状,20 ℃真空干燥24 h,过80目筛,得包合物备用。同法制得质量比例为1∶5的叶黄素酯/β-CD包合物,并参照文献[12]同法制得CDs包合物。
1.5 包合比例及溶解度的测定
取适量的上述包合物和叶黄素酯于50 mL的具塞棕色三角瓶中,分别加入25 mL纯净水,(37±1) ℃,200 r/min,恒温振荡24 h,形成过饱和溶液,滤纸过滤,滤液稀释一定倍数后,在446 nm处测定吸光值,代入“1.2.2”标线得包合物中叶黄素酯的溶解度,平行测定三次,取平均值,其溶解度最大者即为制备包合物的比例。
1.6 包合物的鉴定
1.6.1 差示热分析(DTA) 分别取适量叶黄素酯原料、α-CD、叶黄素酯与α-CD为1∶5的物理混合物(称取对应比例的两者装于小自封袋中充分混合均匀)及包合物,差示热分析检测[19]:参比:Al2O3;测定氛围:N2;样品量:4~5 mg;升温速率:10 ℃/min;升温范围:30~450 ℃。
1.6.2 UV-vis DRS 分别取适量叶黄素酯与α-CD为1∶5的物理混合物(同上)及包合物,紫外/可见漫反射实验检测:参比:BaSO4;波长范围:200~800 nm;狭缝:1nm。
1.6.3 DR-FTIR 分别取适量叶黄素酯与α-CD为1∶5的物理混合物(同上)及包合物,红外漫反射实验检测:参比:KBr;波长范围:400~4000 cm-1;分辨率4 cm-1;扫描次数32次。
1.7 稳定性实验
根据《中国药典》(2015版)Ⅱ部药物稳定性实验指导原则,以叶黄素酯原料为对照,将原料与包合物密封于无色透明的西林瓶中,分别在高温60 ℃、(4500±500) lx光照度的条件下放置10 d,于0、5、10 d取样观察并进行含量测定(按“1.2.2”标线计算),重复测定三次,取其平均值,结果分别与0 d样品和原料比较。
1.8 含量测定方法
叶黄素酯含量测定按下式计算:
式中:A-测试液的吸光值;b-叶黄素标曲的截距;V-样品提取液的体积,mL;f-样品稀释倍数;SLOPE-叶黄素标曲斜率;m-取样量,g。
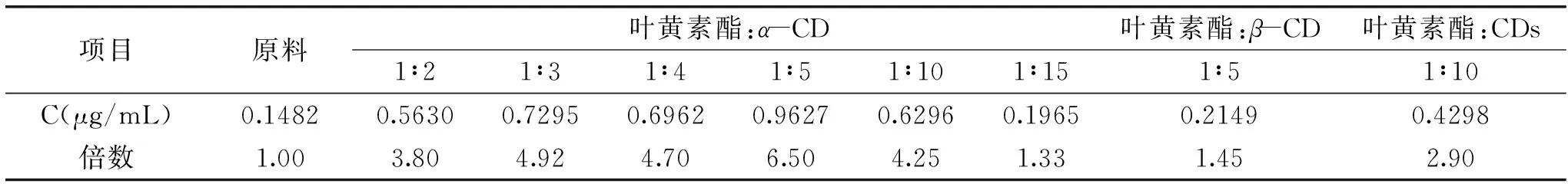
表1 不同比例包合物叶黄素酯溶解度(n=3)Table 1 Solubility of different proportions of lutein esters inclusion complex(n=3)
2 结果与分析
2.1 测定波长的选择
图2为叶黄素对照品与CD水溶液紫外扫描图,叶黄素分别在422、446、475 nm处有吸收峰,446 nm为最强吸收。图3为叶黄素酯与CD水溶液紫外扫描图,叶黄素酯吸收峰与叶黄素基本相一致,其最大吸收波长均蓝移1 nm,这可能跟叶黄素酯两侧的脂肪链产生共轭效应和空间位阻相关。另外两种图谱均显示CD在此范围内无紫外吸收,因此选定最强吸收446 nm处为叶黄素酯测定波长。
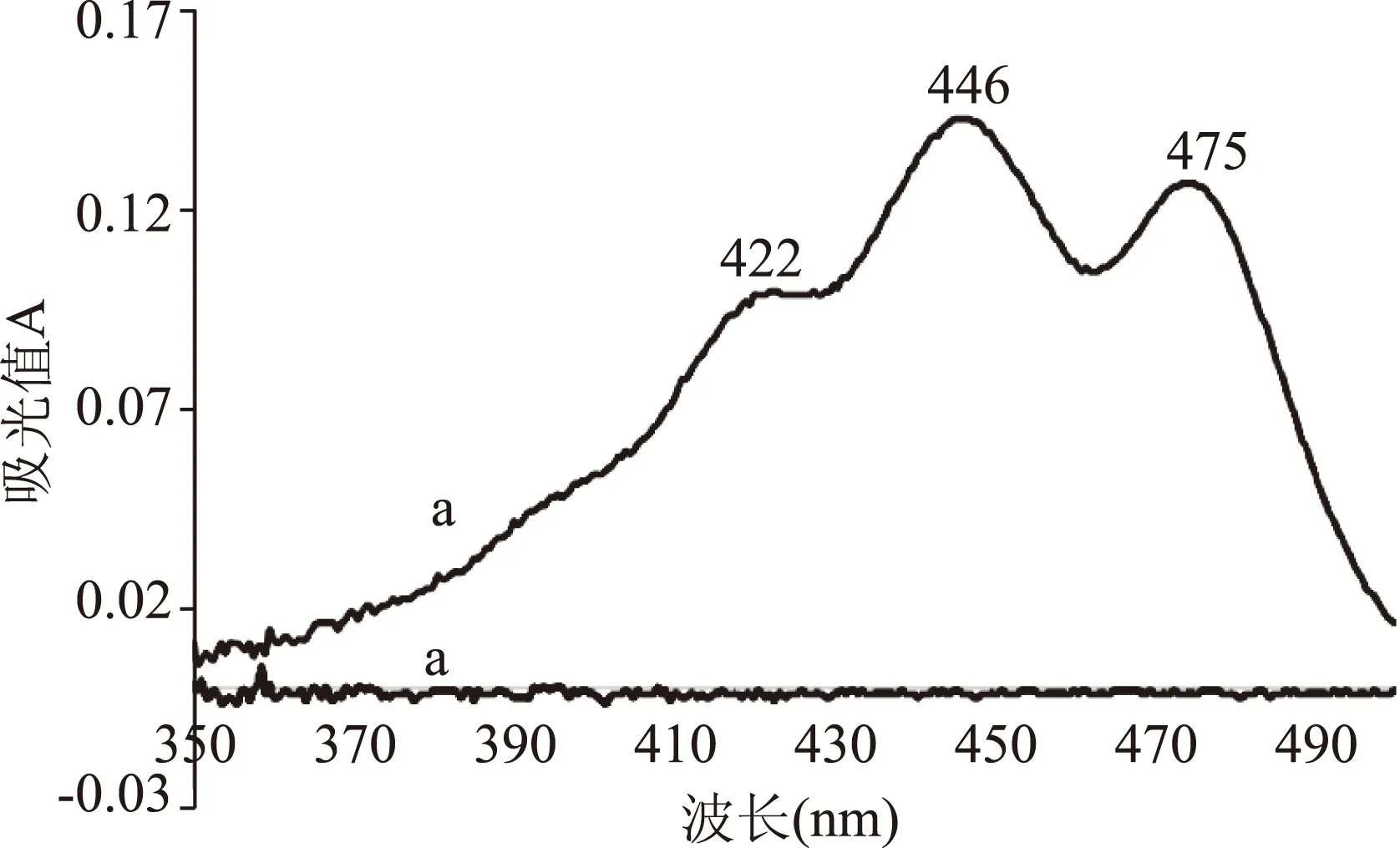
图2 叶黄素对照品与CD紫外扫描图谱Fig.2 UV scanning spectrum of lutein standard and CD注:a.叶黄素;b.CD,图3同。
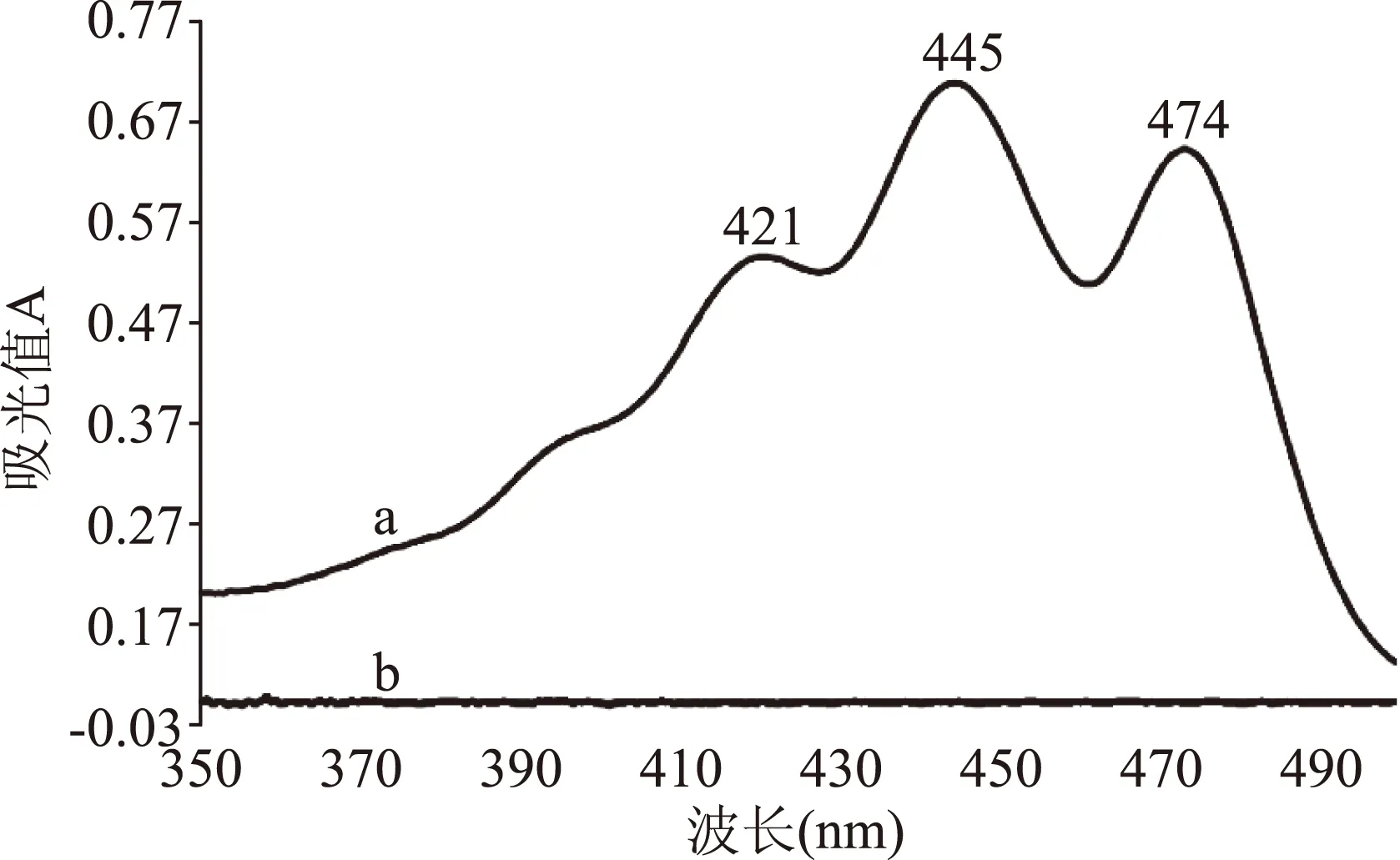
图3 叶黄素酯原料与CD紫外扫描图谱Fig.3 UV scanning spectrum of lutein esters and CD
2.2 标准曲线的绘制
叶黄素对照品在0.0200~0.8000 μg/mL的浓度范围内,吸光度(A)与相应的质量浓度(C)之间的线性回归方程为A=0.3002C+0.0031(R2=0.9997),表明在此范围内线性关系良好。
2.3 包合常数(Ka)的测定
紫外测定结果发现,随着CD浓度的增加,叶黄素酯吸光值呈规律性的增加,显示叶黄素酯与CD发生了相互作用,有形成包合物的可能。根据实验数据计算叶黄素酯与α-CD、β-CD的Ka分别为127、219 L/mol,表明叶黄素酯能够与两种CD形成稳定的包合物,但α-CD的Ka小于β-CD,揭示β-CD更容易与叶黄素酯形成包合物,这是因为β-CD比α-CD具有更大的空腔尺寸,更易于叶黄素酯进入其空腔中。
2.4 包合比例及溶解度的测定
不同比例的包合物对叶黄素酯的增溶效果(表1)存在明显的差异,叶黄素酯的溶解度先随着α-CD质量的增加而增加,质量比1∶5时出现最大值,随后继续增加α-CD的量,增溶幅度明显下降,表明CD对客体的包合存在一个合适的包合比,并非呈正相关。因此,本文选择叶黄素酯与α-CD的质量比1∶5作为制备包合物的比例。
α-CD包合物使叶黄素酯的溶解度最高达0.9627 μg/mL,β-CD和CDs包合物溶解度分别为0.2149 μg/mL和0.4298 μg/mL。另根据前期工作[12]可知,CDs使叶黄素酯溶解度达0.3961 μg/mL,基本与实验结果一致。由此可见,α-CD对叶黄素酯的增溶效果更为明显,优于β-CD和CDs(90%β-CD),这可能与α-CD的空腔尺寸和溶解度有关,由于α-CD的空腔尺寸小于β-CD,与叶黄素酯进行包合时很可能包裹尺寸相对较小的疏水性基团,出现多分子α-CD包合一分子的叶黄素酯情况,而其溶解度又明显优于β-CD,进而能够明显提高叶黄素酯的溶解度。
2.5 包合物的鉴定
2.5.1 差示热分析(DTA) DTA图4表明,原料在56.35 ℃显吸热脱水峰,随后体系缓慢放热,230.11、294.64、399.49 ℃分别有宽的吸热峰,为原料的特征吸收峰,399.49 ℃后迅速放热分解。α-CD在48.66 ℃和80.73 ℃有典型的脱水吸热峰,分别脱去自由水和结合水,141.75 ℃为特征相变峰,317.24 ℃后快速放热分解。物理混合物有α-CD的脱水峰、相变峰和原料230.11 ℃的特征峰,基本是两种物质的简单叠加。而包合物中上述特征峰均消失不见,熔融分解峰较物混后移到316.82 ℃,均不同于一般的物理混合物,表明已经形成了新的结构体系,包合物已经形成。
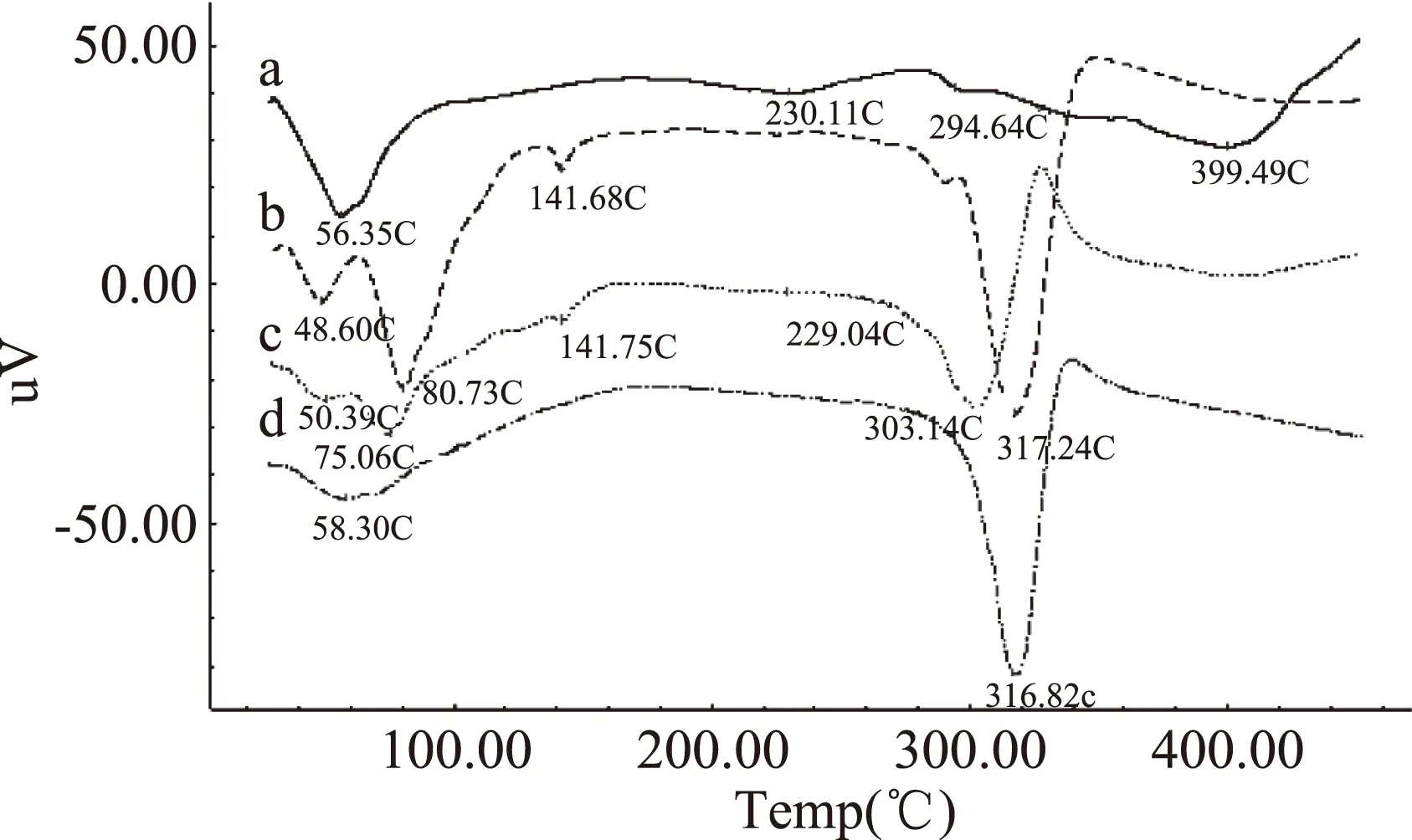
图4 样品差示热分析(DTA)图谱Fig. 4 Differential thermal analysis(DTA)diagram注:a.原料;b.α-CD;c.物理混合物;d.包合物。
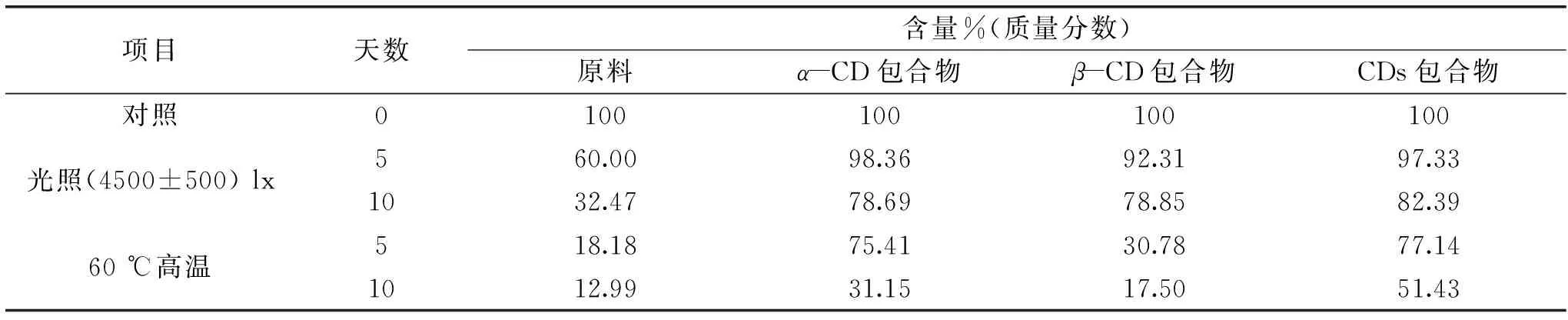
表3 叶黄素酯原料与包合物的稳定性实验(n=3)Table 3 Stability experiment of extract and inclusion compounds(n=3)
2.5.2 UV-vis DRS谱 样品的UV-vis DRS图谱(图5)显示,物理混合物出现了叶黄素酯的452 nm和483 nm特征吸收峰。包合物的谱图显示其吸光值明显增强,且叶黄素酯特征吸收产生红移,当叶黄素酯进入环糊精疏水性空腔时,α-CD富电子云的空腔增强了叶黄素酯的电子云密度,使电子从n-π*,π-π*的跃迁变得更加容易,由此跃迁所需的能量减小,几率增大,表现为吸光值增强,最大吸收波长红移[20],说明α-CD和叶黄素酯通过研磨形成了不同的物相(包合物)。
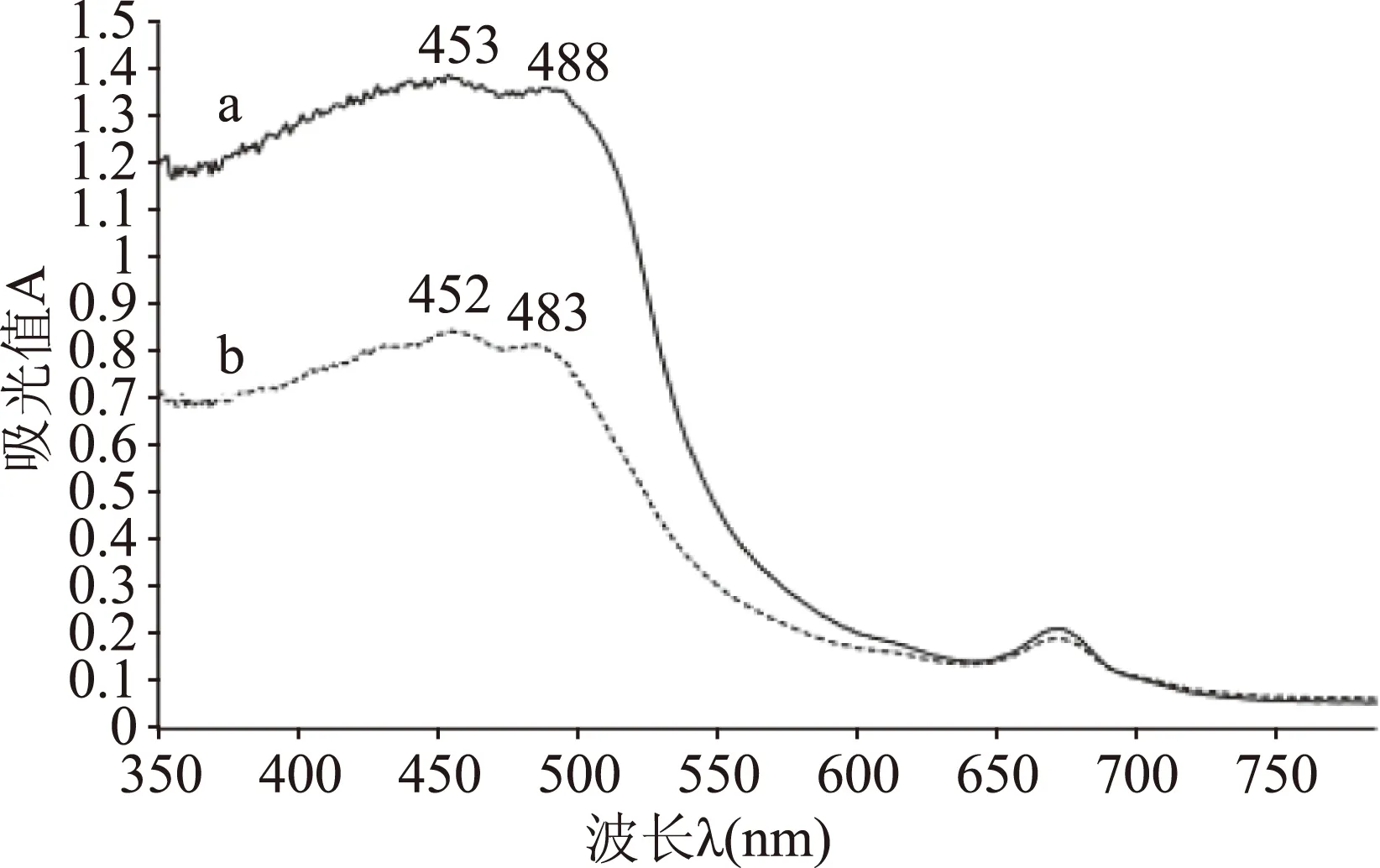
图5 样品UV-vis DRS图谱Fig. 5 UV-vis diffuse reflection spectrum注:a.包合物;b.物理混合物。
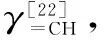
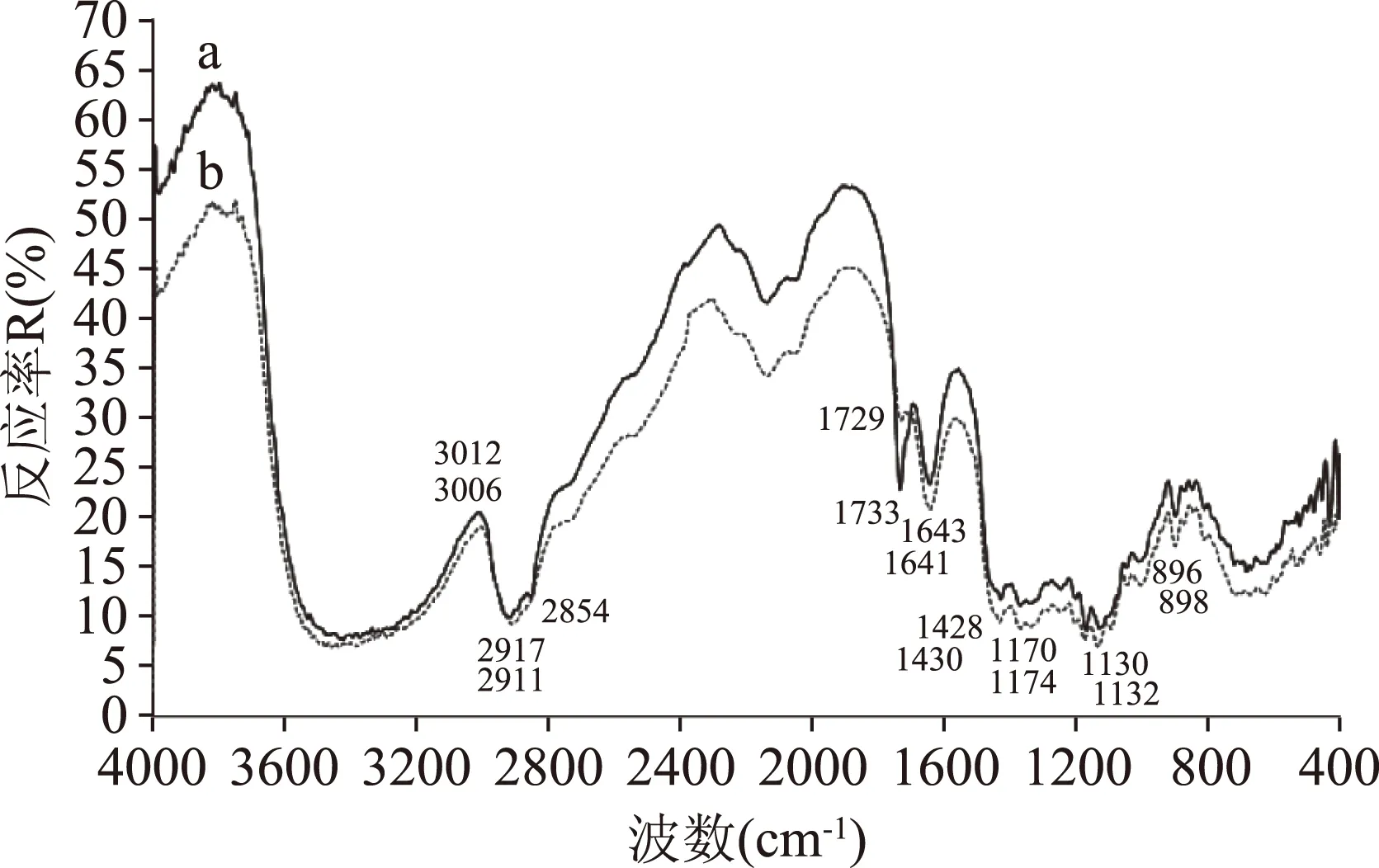
图6 样品红外漫反射(DR-FTIR)图谱Fig.6 Infrared diffuse reflection spectrum注:a.包合物;b.物理混合物;c.α-CD。
2.6 稳定性实验
样品稳定性实验结果见表3。数据表明三种包合物的稳定性均明显优于原料,CD与叶黄素酯进行包合后,避免了其直接暴露于光、热、空气中,因而提高了稳定性;高温实验中α-CD包合物优于β-CD包合物,表明α-CD在改善叶黄素酯稳定性方面比β-CD具有优势,这可能与两种CD的包合方式不同有关,α-CD尺寸较小,更易于与尺寸相对较小的脂肪侧链进行包合,存在多分子的α-CD包合叶黄素酯,β-CD尺寸相对较大,可能仅两分子β-CD对叶黄素酯两端的侧链进行包裹;α-CD与CDs包合物在稳定性方面相差不大,这跟CDs中HP-β-CD的引入有关,打破了β-CD自身分子内氢键,增加了与叶黄素酯分子间的氢键效应,提高了稳定性。此外,光照、高温10 d后,包合物中叶黄素酯含量下降比较明显,表明在生产、运输和保存过程中需避光以及避免高温。
3 讨论与结论
以叶黄素来标定叶黄素酯含量是现有文献[23]常采用的方法,但缺乏实验依据和说明,本文对比分析发现两者有相似的紫外吸收光谱特性,最大吸收波长以及峰形相同,表明叶黄素的酯化作用并不影响光谱吸收特征,以叶黄素制作标曲并标定叶黄素酯具有可行性。
Ka值测定对了解包合物的性质及包合物制备有重要意义,Ka的大小反映了CD与客体形成包合物的难易程度[24]。叶黄素酯与α-CD的Ka为127 L/mol,表明叶黄素酯能够与α-CD形成稳定的包合物。
叶黄素酯为天然混合物,无法准确测定摩尔数,因此难以采用等摩尔系列法[25-26]测定其包合摩尔比。本文采用包合质量比-溶解度实验确定包合比,最终叶黄素酯与α-CD质量比1∶5时溶解度最大,并以该比例制备包合物,研磨法制备中除少量水外无任何有机溶剂、工艺简单且安全无污染,产品无异味、性质佳、便于后期制剂,技术可行性强,适合大规模的工业生产。溶解度实验中α-CD使叶黄素酯的溶解度最高达0.9627 μg/mL,明显优于β-CD和CDs,可能与α-CD和叶黄素酯发生了其他形式的相互作用有关,如表面活性剂样胶束作用、α-CD分子之间或者包合物之间的自聚合作用等[17]共同促进了溶解度的提高,这对提高叶黄素酯的生物利用度具有重要意义。
DR-FTIR和UV-vis DRS验证包合物,能直观反映被测物质的真实信息,此法验证薏苡仁油包合物可获得满意的结果[27]。漫反射光谱试样处理简单、无需压片、不破坏样品结构,因此能够更好的验证包合物的形成。本文通过此法验证叶黄素酯包合物得到较全面的表征信息,为进一步的分析提供了技术支持。
本文在前期工作基础上,制得CD用量更少(本文为1∶5,文献[12]为1∶10),叶黄素酯增溶效果更好的包合物,这对增加安全性以及提高生物利用度具重要意义。另根据市场价格(HP-β-CD>α-CD>β-CD,相差数倍甚至十数倍)计算得α-CD包合物辅料成本低于CDs,且制备体系更加简化,实用性更强,取得了比前期更好的效果。因此本文的研究结果,为叶黄素酯的开发利用拓宽了渠道,在工业生产中有重要的实用价值和良好的应用前景。
[1]Sowbhagya H B,Sushma S B,Rastogi N K,et al. Effect of pretreatments on extraction of pigment from marigold flower[J]. J Food Sci Technol,2013,50(1):122-128.
[2]Mellado-Ortega E,Hornero-Mendez D. Isolation and identification of lutein esters,including their regioisomers,in tritordeum(xTritordeum Ascherson et Graebner)grains:Evidence for a preferential xanthophyll acyltransferase activity[J]. Food Chem,2012,135(3):1344-1352.
[3]Roldan-Fidalgo A,Martin Saldana S,Trinidad A,et al.Invitroandinvivoeffects of lutein against cisplatin-induced ototoxicity[J]. Exp Toxicol Pathol,2016,68(4):197-204.
[4]Disilvestro R A,Thomas S,Harrison E,et al. A pilot comparison of phospolipidated lutein to conventional lutein for effects on plasma lutein concentrations in adult people[J]. Nutr J,2015,14:104.
[5]Peng M-L,Chiu H-F,Chou H,et al. Influence/impact of lutein complex(marigold flower and wolfberry)on visual function with early age-related macular degeneration subjects:A randomized clinical trial[J]. Journal of Functional Foods,2016,24:122-130.
[6]Nwachukwu I D,Udenigwe C C,Aluko R E. Lutein and zeaxanthin:Production technology,bioavailability,mechanisms of action,visual function,and health claim status[J]. Trends in Food Science & Technology,2016,49:74-84.
[7]Luis N B,Hugo J I,Enrique B A,et al. An optimization study of solid-state fermentation:xanthophylls extraction from marigold flowers[J]. Appl Microbiol Biotechnol,2004,65(4):383-90.
[8]张志忠,张志华,史晓博,等. 一种由叶黄素浸膏纯化叶黄素酯的方法研究[J]. 中国食品添加剂,2013,(5):178-182.
[9]Vishwanathan R,Johnson E J. Lutein and zeaxanthin and eye disease[J]. 2013:215-235.
[10]Zhu G,Yi Y,Chen J. Recent advances for cyclodextrin-based materials in electrochemical sensing[J]. TrAC Trends in Analytical Chemistry,2016,80:232-241.
[11]Deng Y,Pang Y,Guo Y,et al. Host-guest inclusion systems of daidzein with 2-hydroxypropyl-β-cyclodextrin(HP-β-CD)and sulfobutyl ether-β-cyclodextrin(SBE-β-CD):Preparation,binding behaviors and water solubility[J]. Journal of Molecular Structure,2016,1118:307-315.
[12]吴秋燕,陈新建,裴会娜,等. 叶黄素浸膏的环糊精包合作用研究[J]. 食品工业科技,2009,30(11):105-108.
[13]冯宇艳,李晖,宋航,等. 紫外可见漫反射光谱技术快速、无损定量分析固体药物[C]. 2013中国药学大会暨第十三届中国药师周论文集,2013:1-6.
[14]许建华,陈清林,纪红兵. 原位漫反射红外光谱技术用于气固催化反应机理的研究[J]. 化学进展,2008,20(6):811-820.
[15]童继军. 环糊精及其衍生物的药学研究进展[J]. 医药导报,2011,30(8):1062-1065.
[16]Navas N,Romero-Pastor J,Manzano E,et al. Benefits of applying combined diffuse reflectance FTIR spectroscopy and principal component analysis for the study of blue tempera historical painting[J]. Anal Chim Acta,2008,630(2):141-9.
[17]金小江,周建平. 环糊精包合特性及包合常数的测定和预测[J]. 药学进展,2005,29(11):491-497.
[18]王亚娜,孙俊梅,余丽丽,等. 环糊精及衍生物/药物包合常数的测定方法及其应用[J]. 药学进展,2004,28(1):23-28.
[19]张崇,尚校军,马素英,等. 两种环糊精蓝萼甲素包合物的制备与抗肿瘤作用比较[J]. 医药导报,2013,32(11):1399-1402.
[20]谭正德,吴菲,林涛,等. 超分子体系β-环糊精与药物克拉霉素包合的研究[J]. 湖南工程学院学报(自然科学版),2007,17(4):61-65.
[21]刘冬,袁鹏,刘红梅,等. 利用氨吸附漫反射红外光谱法探测蒙脱石的固体酸性[J]. 矿物学报,2010,30(1):33-39.
[22]李蓉,缪铭,张涛,等. 甜玉米胚乳中水溶性葡聚糖的结构与性质初探[J]. 食品工业科技,2012,33(23):57-59,65.
[23]李大婧,刘春泉,方桂珍. 不同品系万寿菊花中叶黄素和叶黄素酯含量的测定[J]. 林产化学与工业,2007,27(2):105-108.
[24]李宏树,张岭,陈莉,等. 辣椒碱-β-环糊精包合物的研制及包合常数的测定[J]. 中国药物警戒,2015,(3):147-149.
[25]Del Valle E M M. Cyclodextrins and their uses:a review[J]. Process Biochemistry,2004,39(9):1033-1046.
[26]续浩,陈亮. 环糊精包结物包结比的测定[J]. 分析测试技术与仪器,2001,7(3):152-155.
[27]李卫红,王喜明,赵红革. 薏苡仁油β-环糊精包合工艺研究[J]. 中药新药与临床药理,2014,25(5):624-628.
Evaluation ofα-cyclodextrin inclusion compound of lutein esters
CAI Hao-feng,XUE Ke,BU Hui-min,CHEN Yang,LI Wen-ding,REN Yong*
(College of Life Sciences,Nanjing Normal University,Jiangsu Key Laboratory For Supramolecular Medicinal Materials & Applications,Nanjing 210046,China)
Object:To study properties ofα-cyclodextrin inclusion compound of lutein esters. Methods:Inclusion process was evaluated by UV spectroscopy and then binding constants was calculated,inclusion compound was prepared by trituration method,lutein solubility was used as the index to determine the appropriate inclusion ratio,inclusion compound was confirmed by differential thermal analysis,infrared diffuse reflection spectrum and UV-vis diffuse reflection spectrum,the solubility and the stability ofα-cyclodextrin,β-cyclodextrin and mixed cyclodextrins inclusion compounds of lutein esters were compared. Results:inclusion constants of lutein esters/α-cyclodextrin was 127 L/mol,optimum inclusion mass ratio of lutein esters andα-cyclodextrin was 1∶5,the solubility ofα-cyclodextrin inclusion compound was improved by more 6 times that of lutein esters,the stability of inclusion compound was enhanced. Conclusions:α-cyclodextrin is superior toβ-cyclodextrin and mixed cyclodextrins in preparation of lutein esters inclusion complex.
lutein esters;cyclodextrins;inclusion compound;solubility;stability
2016-12-29
蔡浩锋(1991-),男,硕士研究生,研究方向:药物超分子技术,E-mail:f949711833@163.com。
*通讯作者:任勇(1959-),男,博士,副教授,研究方向:药物化学与超分子药学研究,E-mail:renyongphd@126.com。
TS201.2
A
1002-0306(2017)15-0102-06
10.13386/j.issn1002-0306.2017.15.020
