蓝舌病病毒4型特异性竞争ELISA检测方法的建立
2017-09-03李佳璇臧明鑫谢双羽姜艳平崔文徐义刚刘敏乔薪瑗王丽周晗李一经唐丽杰
李佳璇,臧明鑫,谢双羽,姜艳平,崔文,徐义刚,刘敏,乔薪瑗,王丽,周晗,李一经,唐丽杰
东北农业大学 动物医学学院,黑龙江 哈尔滨 150030
蓝舌病病毒4型特异性竞争ELISA检测方法的建立
李佳璇,臧明鑫,谢双羽,姜艳平,崔文,徐义刚,刘敏,乔薪瑗,王丽,周晗,李一经,唐丽杰
东北农业大学 动物医学学院,黑龙江 哈尔滨 150030
李佳璇, 臧明鑫, 谢双羽, 等. 蓝舌病病毒 4型特异性竞争 ELISA检测方法的建立. 生物工程学报, 2017, 33(8):1284–1291.
Li JX, Zang MX, Xie SY, et al. Establishment of two competitive ELISAs for specific detection of bluetongue virus serotype 4.Chin J Biotech, 2017, 33(8): 1284–1291.
旨在建立蓝舌病病毒4型 (BTV-4) 特异性抗体ELISA检测方法,为蓝舌病的免疫学诊断提供新的技术。利用制备的两株抗4型BTV VP2蛋白的单克隆抗体4A-1G7和4B-1B6,建立BTV-4特异性竞争ELISA抗体检测方法。利用该方法同时对 50份羊和牛 BTV阴性血清进行检测,分别确定两种方法阻断率临界值为49%和40%。利用标准阳性血清检测的试验结果表明,该方法的敏感性、特异性和重复性符合OIE通用标准。同时,4A-1G7和4B-1B6两种竞争ELISA方法联合作用,可以检测感染4、18和20型BTV的血清。研究结果为建立以上各型BTV的检测方法提供了基础。
蓝舌病病毒,竞争ELISA,单克隆抗体,VP2蛋白
蓝舌病 (Bluetongue,BT) 是一种烈性非接触性传染病,主要经节肢动物 (库蠓和伊蚊等)传播,可感染反刍动物如牛、绵羊、山羊、鹿、非洲羚羊、骆驼等[1]。世界动物卫生组织将其列为必须通报的动物疫病,我国将其列为一类动物疫病[2]。BT广泛分布于热带、亚热带地区。蓝舌病病毒 (Bluetongue virus,BTV) 血清型众多,目前至少有27个血清型,新发现的28型和29型还在鉴定中[3-4]。通过BT流行病学调查,中国共在31个省、市 (区) 发现BTV抗体阳性家畜,并从云南、湖北和安徽等地自然感染羊体中分离获得 BTV[5]。据报道,我国已检测出BTV-1、BTV-2、BTV-3、BTV-4、BTV-5、BTV-7、BTV-10、BTV-12、BTV-15、BTV-16、BTV-20和 BTV-24等 12种血清型[6-7],目前 BTV-1、BTV-4和BTV-20是广西优势的血清型,在全区广泛分布;而江苏、内蒙古、云南等地区均检测到 BTV-1、BTV-7、BTV-10和 BTV-16型,当前国内BT流行的血清型有了新的变化[8-10]。
BTV是由10个基因片段组成的双股RNA病毒,分别编码7个结构蛋白 (VP1-VP7) 和4个非结构蛋白 (NS1、NS2、NS3/NS3a和NS4)[11]。VP2蛋白是BTV外壳蛋白的主要成分,同时是BTV血清型的主要决定因素[12-13]。VP2蛋白为型特异性蛋白,可以用来区别BTV各血清型间的不同[14]。
竞争ELISA (C-ELISA) 是检测BTV抗体的一种常用方法[15]。C-ELISA方法可用于多种动物血清抗原检测,其特异性和敏感性高、成本低,广泛用于临床蓝舌病的诊断检测中[16-17]。本实验采用针对BTV4型 (BTV-4) VP2蛋白的型特异性单克隆抗体[18]作为竞争性抗体与待检测抗体竞争,通过抑制率大小来判定样品血清的来源动物是否感染 BTV,建立了一种快速、敏感的BTV型特异性检测方法。
1 材料与方法
1.1 单克隆抗体、动物血清与主要试剂
抗BTV-4 VP2的单克隆抗体4A-1G7 (抗体亚类为 IgG1,抗原表位为160NH161)、4B-1B6 (抗体亚类 IgG1,抗原表位为501SRS503)和 BTV-4 VP2-A/B蛋白由本实验室保存[12];1-24型BTV标准阳性血清 (抗体滴度为 1∶640-1∶1 280)及阴性血清购自The Pirbright Institute蓝舌病参考实验室;HRP标记的山羊抗鼠IgG购自中杉金桥有限公司;BTV抗体 ELISA试剂盒 (TSI公司) 购自上海雅吉生物科技有限公司;70份血清样品中5份绵羊、5份山羊和10份牛血清样品来自于黑龙江的某养殖场,25份绵羊、25份山羊血清样品来自于内蒙古;TMB显色液购自北京奥拓达科技有限公司。
1.2 单抗的大量制备及纯化
用腹水法大量制备单抗4A-1G7和4B-1B6。将制备的腹水采用 Protein G蛋白纯化柱纯化(GE公司)。
1.3 优化C-ELISA反应条件
将 BTV-4 VP2-A/B蛋白分别以 1 μg/孔、2 μg/孔、5 μg/孔、10 μg/孔包被,分别包被 1 h、2 h、3 h;再将纯化的单抗 (4A-1G7和4B-1B6的蛋白浓度分别为 4.2 mg/mL和 5.3 mg/mL)用稀释液稀释至1∶500、1∶1 000、1∶2 000、1∶4 000倍;BTV-4标准阳性血清用PBS稀释液进行 1∶10、1∶20、1∶40、1∶80、1∶160、1∶320倍稀释选择最佳待检样品加入量,进行矩阵交叉BTV C-ELISA方法检测,确定最佳稀释倍数,将腹水稀释液和血清样品混合加入ELISA反应板中;同时,反应时间分别设置为1 h、2 h、3 h,确定各步骤最佳反应时间。TMB显色反应时间分别为10 min、15 min、20 min,确定最佳显色时间。根据优化反应剂量和时间的结果,确定该检测方法的标准操作程序。
1.4 血清样品的鉴定
按照BTV抗体ELISA试剂盒说明书,检测70份血清样品,确定样品血清的来源动物是否感染BTV。
1.5 判断标准的确定
利用1.3建立的检测方法,同时对50份阴性绵羊、山羊和牛阴性血清进行检测,测得血清OD450,计算阻断率,计算公式为 PI (阻断率)={1-(ODx-ODmin)/(ODmax-ODmin)}×100% (ODmax为不加样品时的吸光值,ODx为样品的吸光值,ODmin为空白对照孔的吸光值)。计算50份血清样本 PI值的平均值()和标准方差(s),根据统计学原则,将+2s设定为样本的阴、阳性血清的临界值。样本的PI值>+2s时,可以在99.9%的水平上判为阳性。
1.6 特异性试验
利用两种C-ELISA分别检测1-24型BTV标准阳性血清及阴性样品各10份,按照1∶200稀释倍数,每孔 100 μL加样。分别评价基于4A-1G7和4B-1B6的C-ELISA的特异性。
1.7 敏感性试验
将 BTV-4标准阳性血清做 1∶5、1∶10、1∶20、1∶40、1∶80、1∶160 和 1∶320 7 个稀释度,分别用基于4A-1G7和4B-1B6单抗建立的 C-ELISA检测不同稀释度血清,分析该C-ELISA可以检测到的标准阳性血清的最小稀释度,判断该方法的敏感性。
1.8 重复性试验
选取10份血清,用3次包被的酶标板,各进行3次重复试验,计算其变异系数,评价重复性。
1.9 临床样品的检测
以1.3方法确定的最佳反应条件,以1.5方法确定的阻断率临界值为标准,共检测了20份BTV阳性血清,并与群特异性BTV抗体ELISA试剂盒检测结果进行比较。
2 结果与分析
2.1 血清样品的鉴定
经BTV群特异性抗体ELISA试剂盒检测,70份血清样品中,50份血清样品检测结果为阴性,20份血清为阳性。
2.2 优化反应条件
反应体系及反应条件经优化后试剂的最佳稀释度和反应条件见表 1、2。该批次检测用抗原PBS稀释,待检样品每孔加入100 μL。

表1 基于4A-1G7的C-ELISA检测方法的反应条件优化结果Table 1 The optimized conditions for the 4A-1G7-based C-ELISA

表2 基于4B-1B6的C-ELISA检测方法的反应条件优化结果Table 2 The optimized conditions for the 4B-1B6-based C-ELISA
2.3 判断标准的确定
采用优化后的基于4A-1G7的C-ELISA检测方法对50份羊和牛BTV阴性血清进行检测,抑制率和血清份数分布见图1。测定OD450值,本次检测阻断率平均值为21%,标准差为13%,根据公式+2s计算,阳性和阴性结果判定的临界值为 49%。最终确定阴阳性判定阻断率临界值为抗原对照平均 OD450的 49%,即阻断率大于或等于49%的判为BTV阳性血清。
用优化后的基于 4B-1B6的 C-ELISA检测方法对50份羊和牛BTV阴性血清进行检测,抑制率和血清份数分布见图2。该方法检测阻断率平均值为23%,标准差为5%,根据公式计算,阳性和阴性结果判定的临界值为 33%,考虑到个别样品接近 40%的抑制率,最终确定阻断率大于或等于40%的判为BTV阳性血清。
2.4 敏感性分析
分别采用优化后的检测方法检测不同稀释度的标准BTV-4阳性血清,其中基于4A-1G7的C-ELISA检测结果为稀释度1∶80时,PI>49%;基于4B-1B6的C-ELISA检测结果为稀释度1∶40时,PI>40%。
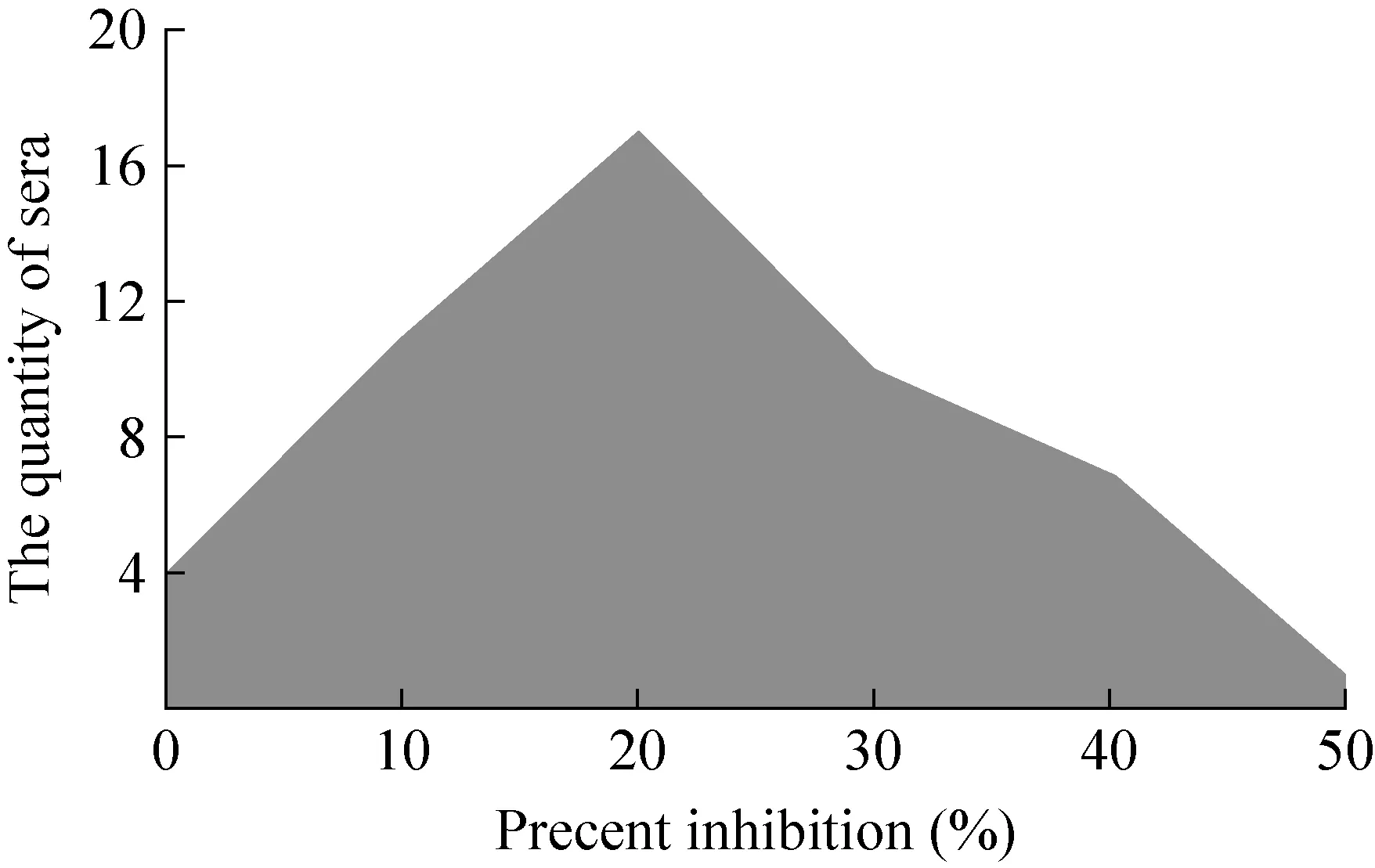
图1 基于4A-1G7的C-ELISA检测方法对阴性血清抑制率及对应血清份数分布图Fig. 1 The assay of negative serum samples of the 4A-1G7-based C-ELISA.
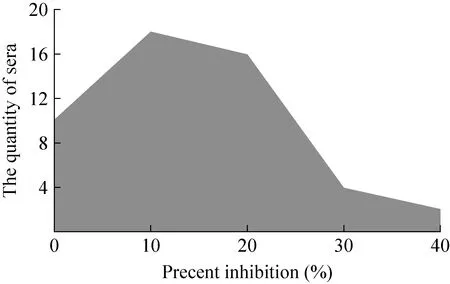
图2 基于 4B-1B6的 C-ELISA检测方法对阴性血清抑制率及对应血清份数分布图Fig. 2 The assay of negative serum samples of the 4B-1B6-based C-ELISA.
2.5 特异性分析
采用建立地方法检测1-24型BTV标准阳性样品及标准阴性样品,结果如表 3所示。结果表明两种检测方法可以检测到BTV-4标准阳性血清,但是对其他血清型的BTV病毒抗血清有一定的交叉反应。然而,两种检测方法联合应用时,当两种方法检测结果共同为阳性时,该样品为BTV-4、BTV-18或BTV-20感染的动物血清,即可以区分出BTV-4、BTV-18和BTV-20与其他血清型的BTV感染后的动物血清。

表3 BTV-4特异性竞争ELISA的特异性试验检测结果Table 3 The specificity test of BTV-4-specific competitive ELISAs
2.6 重复性分析
利用3批次试剂对10份绵羊血清分别用两种方法进行检测,所有试剂均为不同批次,检测结果表明同一份血清检测试剂批次间的变异系数在4%-10%,无显著差异。
2.7 临床样品检测
将经BTV群特异性ELISA试剂盒检测结果为阳性的20份BTV血清样品,经基于4A-1G7和4B-1B6的C-ELISA方法检测均为阳性的样品含有3个,该检测样品为BTV-4、BTV-18或BTV-20感染的动物血清,排除其他血清型的感染,可以初步区分检测样品来源动物感染 BTV的血清型。
3 讨论
近些年,随着全球气候变暖,蓝舌病在世界各地不断暴发,BTV血清型众多[19],且各型之间交叉免疫性差[20-21],因此建立一种可以检测BTV各血清型的快速、敏感性的检测方法尤为重要[22]。BT血清抗体效价检测是了解BT感染情况、检测疫苗免疫效果的必要手段,目前BT血清抗体检测的主要方法之一是竞争ELISA[23]。目前,国内主要研究了BTV群特异性的竞争ELISA方法,未见有对BTV的型特异性竞争ELISA方法建立。本研究中,分别采用4型BTV VP2-A/B蛋白为包被抗原,分别用抗BTV-4 VP2单克隆抗体4A-1G7、4B-1B6为竞争抗体,建立了两种竞争ELISA方法。
特异性强和敏感性高是ELISA检测方法的最大优点,微量的样品就能引起高效的抗原抗体反应[24],因此,准确选择抗原的包被浓度和血清样品的稀释度是ELISA实验的重要环节之一。通过对标准阳性样品、阴性样品和临床样品的检测,分析表明这两种方法具有良好的特异性和敏感性[25-26]。用两种C-ELISA方法的灵敏度进行了检测,确定该C-ELISA的检测灵敏度分别为1∶80、1∶40。国外有报道的类似产品可检测的血清稀释度范围为 1∶15–1∶220[25],可见,两种方法的灵敏度符合C-ELISA的鉴定范围。本研究建立的竞争ELISA方法的敏感性、特异性和重复性符合OIE《哺乳动物、禽类和蜜蜂A和B类疾病诊断试验和疫苗标准手册》标准[27]。
同时,利用基于 4A-1G7和 4B-1B6的C-ELISA方法联合应用可以区分出 BTV-4、BTV-18或 BTV-20感染的血清型。用基于4A-1G7的C-ELISA方法检测出的阳性样品,为BTV-3、BTV-4、BTV-11、BTV-13、BTV-16、BTV-18、BTV-19、BTV-20、BTV-22或 BTV-24感染的动物血清;用基于4B-1B6的C-ELISA方法检测出的阳性样品,为BTV-4、BTV-5、BTV-9、BTV-12、BTV-14、BTV-17、BTV-18、BTV-20 或BTV-21感染的动物血清。当同一个样品用两种方法检测结果均为阳性时,该样品为 BTV-4、BTV-18或BTV-20感染的动物血清,即可以区分出BTV-4、BTV-18和BTV-20与其他血清型的BTV感染后的动物血清。如果两种方法检测结果均为阴性,待检样品可能为BTV-1、BTV-2、BTV-6、BTV-7、BTV-8、BTV-10、BTV-15 或BTV-23型感染的动物血清;如果 4A-1G7的检测结果为阳性而 4B-1B6的结果为阴性,待检样品可能为BTV-3、BTV-11、BTV-13、BTV-16、BTV-19、BTV-22或 BTV-24型感染的动物血清;如果4A-1G7的检测结果为阴性而4B-1B6的结果为阳性,待检样品可能为 BTV-5、-9、-12、-14、-17或-21型感染的动物血清。BTV-4 VP2 (GenBank Accession No. AM132566356) 与BTV-18 VP2 (No. KX442585.1) 和BTV-22 VP2(No. AJ585141.1) 的氨基酸序列同源性分别为52%和70%。本实验对比分析4A-1G7 (160NH161)、4B-1B6 (501SRS503) 抗原表位与 BTV-18、BTV-20 VP2氨基酸序列,发现BTV-18 VP2的第 163–164位为 NH 片段,395–397位为 SRS片段;发现BTV-20 VP2 161–162位为NH片段,502–503位为 SRS片段。Maan等推测[12,28],BTV-18 VP2的 163–164位、395–397位,能够识别 BTV-18;BTV-20 VP2的 502–503位能够识别 BTV-20,与本实验所得结果相符合,即4A-1G7 C-ELISA和4B-1B6 C-ELISA两种方法检测BTV-4、BTV-18、BTV-20结果均应为阳性。
本研究采用针对BTV VP2型特异性单克隆抗体4A-1G7和4B-1B6建立C-ELISA,该检测方法短时间内 (3-4 h),可以用于初步区分不同型BTV感染的动物血清,并且实验条件要求低,具有型特异性,可用于大规模的血清抗体普查,并且本研究为下一步建立BTV型特异性检测方法奠定基础。
REFERENCES:
[1] Maan S, Maan NS, Nomikou K, et al. Complete Genome characterisation of a novel 26th bluetongue virus serotype from Kuwait. PLoS ONE, 2011,6(10): e26147.
[2] Song HM, Yang T, Ma JN, et al. Prokaryotic expression of bluetongue virus VP7 gene. Chin J Prev Vet Med, 2009, 31(12): 925–928 (in Chinese).宋红梅, 杨涛, 马健男, 等. 蓝舌病病毒VP7基因的原核表达. 中国预防兽医学报, 2009,31(12): 925–928.
[3] Maan S, Maan NS, Belaganahalli MN, et al.Full-genome sequencing as a basis for molecular epidemiology studies of bluetongue virus in India.PLoS ONE, 2015, 10(6): e0131257.
[4] Maan S, Maan NS, Batra K, et al. Reverse transcription loop-mediated isothermal amplification assays for rapid identification of eastern and western strains of bluetongue virus in India. J Virol Methods, 2016, 234: 65–74.
[5] Franco Mahecha OL, Ogas Castells ML,Combessies G, et al. Single dilution avidityblocking ELISA as an alternative to the bovine viral diarrhea virus neutralization test. J Virol Methods, 2011, 175(2): 228–235.
[6] Li N, Zhu JB, Xiao L, et al. Sequence analysis of bluetongue virus 1 M6 gene in Yunnan Province.China Anim Husb Vet Med, 2016, 43(2): 340–347(in Chinese).李楠, 朱建波, 肖雷, 等. 云南蓝舌病病毒 1型毒株 M6基因序列分析. 中国畜牧兽医, 2016,43(2): 340–347.
[7] Yang H, Lü MN, Sun MF, et al. Complete genome sequence of the first bluetongue virus serotype 7 isolate from China: evidence for entry of Africanlineage strains and reassortment between the introduced and native strains. Arch Virol, 2016,161(1): 223–227.
[8] Zhang YX. Virus neutralization test, insect vector investigation, isolation, identification and preliminary study on pathogenicity of bluetongue virus in Guangxi[D]. Nanning: Guangxi University, 2016(in Chinese).张怡轩. 广西 BTV感染及传播媒介调查、病毒分离鉴定与致病性初步研究[D]. 南宁: 广西大学, 2016.
[9] Zhang SN, Li HC, Zhu JB, et al. The epidemiological survey and serotype identification of bluetongue disease and the epizootic hemorrhage disease in Inner Mongolia in 2015. Chin J Prev Vet Med, 2016, 38(12): 939–943 (in Chinese).张胜男, 李华春, 朱建波, 等. 2015年内蒙古地区蓝舌病及流行性出血热流行病学调查及血清型鉴定. 中国预防兽医学报, 2016, 38(12): 939–943.
[10] Xiao L, Meng JX, Li N, et al. Isolation and identification of bluetongue virus in 2012 in Shizong county of Yunnan Province. Chin J Vet Parasitol, 2014, 22(4): 1–6 (in Chinese).肖雷, 孟锦昕, 李楠, 等. 云南省师宗县蓝舌病病毒的分离及鉴定. 中国动物传染病学报, 2014,22(4): 1–6.
[11] Verwoerd DW, Louw H, Oellermann RA.Characterization of bluetongue virus ribonucleic acid. J Virol, 1970, 5(1): 1–7.
[12] Maan S, Maan NS, Samuel AR, et al. Analysis and phylogenetic comparisons of full-length VP2 genes of the 24 bluetongue virus serotypes. J Gen Virol, 2007, 88(2): 621–630.
[13] Balam D, Daggupati S, Maddireddy H. Studies ofthe antigenic relationships between bluetongue virus serotypes 2, 9 & 15 isolated in Andhra Pradesh, India. Vet World, 2011, 4(10): 444–448.
[14] Wang WS, Sun EC, Xu QY, et al. Identification of two novel BTV16-specific B cell epitopes using monoclonal antibodies against the VP2 protein. Appl Microbiol Biotechnol, 2013, 97(13): 5933–5942.
[15] Naresh A, Prasad G. Relative superiority of c-ELISA for detection of bluetongue virus antibodies.Indian J Exp Biol, 1995, 33(11): 880–882.
[16] Fehrsen J, Van Wyngaardt W, Mashau C, et al.Serogroup-reactive and type-specific detection of bluetongue virus antibodies using chicken scFvs in inhibition ELISAs. J Virol Methods, 2005,129(1): 31–39.
[17] Xu QY, Sun EC, Yang T, et al. Isolation of a Bluetongue virus group-specific monoclonal antibody and application to a diagnostic competitive ELISA.Appl Microbiol Biotechnol, 2015, 99(2): 729–739.
[18] Liu Q. Prokaryotic expression of VP7 and VP2 of Bluetongue virus and preparation of monoclonal antibodies[D]. Harbin: Northeast Agricultural University, 2015 (in Chinese).刘琦. 蓝舌病病毒VP7和VP2蛋白的原核表达及其单克隆抗体的制备[D]. 哈尔滨: 东北农业大学, 2015.
[19] Oryan A, Amrabadi O, Mohagheghzadeh M.Seroprevalence of bluetongue in sheep and goats in southern Iran with an overview of four decades of its epidemiological status in Iran. Comp Clin Pathol, 2014, 23(5): 1515–1523.
[20] Savini G, Hamers C, Conte A, et al. Assessment of efficacy of a bivalent BTV-2 and BTV-4 inactivated vaccine by vaccination and challenge in cattle. Vet Microbiol, 2009, 133(1/2): 1–8.
[21] Mellor PS, Carpenter S, Harrup L, et al.Bluetongue in Europe and the Mediterranean Basin: history of occurrence prior to 2006. Prev Vet Med, 2008, 87(1/2): 4–20.
[22] Patel A, Roy P. The molecular biology of Bluetongue virus replication. Virus Res, 2014, 182: 5–20.
[23] Feenstra F, Pap JS, van Rijn PA. Application of bluetongue Disabled Infectious Single Animal(DISA) vaccine for different serotypes by VP2 exchange or incorporation of chimeric VP2.Vaccine, 2015, 33(6): 812–818.
[24] Afshar A, Thomas FC, Wright PF, et al.Comparison of competitive ELISA, indirect ELISA and standard AGID tests for detecting blue-tongue virus antibodies in cattle and sheep.Vet Rec, 1989, 124(6): 136–141.
[25] Crafford JE, Guthrie AJ, Van Vuuren M, et al. A competitive ELISA for the detection of group-specific antibody to equine encephalosis virus. J Virol Methods, 2011, 174(1/2): 60–64.
[26] Miao HS, Li L, Zhu JB, et al. Establishment of the blocking ELISA method for detection of the antibody titer against bluetongue virus. Chin J Prev Vet Med, 2014, 36(2): 111–115 (in Chinese).苗海生, 李乐, 朱建波, 等. 蓝舌病病毒阻断ELISA抗体检测方法的建立. 中国预防兽医学报, 2014, 36(2): 111–115.
[27] Kouba V. Book review: terrestrial animal health code 2005. Office International of Epizootics, 634 pages. Acta Veterinaria Brno, 2006, 75(3): 465–476.
[28] Maan NS, Maan S, Belaganahalli MN, et al.Identification and differentiation of the twenty six bluetongue virus serotypes by RT–PCR amplification of the serotype-specific genome segment 2. PLoS ONE, 2012, 7(2): e32601.
(本文责编 陈宏宇)
Establishment of two competitive ELISAs for specific detection of bluetongue virus serotype 4
Jiaxuan Li, Mingxin Zang, Shuangyu Xie, Yanping Jiang, Wen Cui, Yigang Xu,Min Liu, Xinyuan Qiao, Li Wang, Han Zhou, Yijing Li, and Lijie Tang
College of Veterinary Medicine, Northeast Agricultural University, Harbin 150030, Heilongjiang, China
To develop a clinical diagnosis technique for bluetongue virus infection, we established serotype-specific methods to detect serotype 4 of bluetongue virus (BTV-4). Two monoclonal antibodies (mAbs) against VP2 protein ofBTV-4, named 4A-1G7 and 4B-1B6, were used as competitive antibodies in the competitive enzyme-linked immunosorbent assays (C-ELISA). We detected 50 negative serum samples from sheep, goats and cattle by C-ELISA. The cut-off values of 4A-1G7 and 4B-1B6 mAbs were 49% and 40%, respectively. The results of the sensitivity, specificity and repeatability by detecting standard positive serum, were consistent with the general standard of Office International Des Epizooties.Furthermore, serum samples of BTV-4, BTV-18 and BTV-20 infection could be screened out through the combined C-ELISAs by 4A-1G7 and 4B-1B6 mAbs. Thus, this technique may diagnose BTV-4, BTV-18 and BTV-20 infections.
bluetongue virus serotype 4, competitive ELISA, monoclonal antibody, VP2 protein
March 25, 2017; Accepted: June 5, 2017
s:Lijie Tang. Tel: +86-451-55190824; E-mail: tanglijie@163.com Yijing Li. Tel: +86-451-55190363; E-mail: yijingli@163.com
Supported by: National Key Technology R&D Program of China (No. 2013BAD12B01).
国家科技支撑计划 (No. 2013BAD12B01) 资助。
