石灰性紫色水稻土不同土壤深度中厌氧氨氧化细菌对施肥的响应
2017-09-03王蓥燕卢圣鄂李跃飞涂仕华张小平辜运富
王蓥燕, 卢圣鄂, 李跃飞, 涂仕华, 张小平, 辜运富
石灰性紫色水稻土不同土壤深度中厌氧氨氧化细菌对施肥的响应
王蓥燕1, 卢圣鄂1, 李跃飞1, 涂仕华2, 张小平1, 辜运富1
(1四川农业大学资源学院微生物系,成都611130;2四川省农业科学院土壤肥料研究所,成都610066)
【目的】研究长期不同施肥处理对水稻土厌氧氨氧化细菌(anaerobic ammonium oxidation bacteria, AAOB)群落结构和垂直分布特征的影响,深入认识不同施肥处理下石灰性紫色水稻土厌氧氨氧化作用的微生物调控机制,为该地区科学施肥、培肥地力提供理论依据。【方法】利用化学分析、末端限制性片段长度多态性分析(T-RFLP)和荧光定量PCR技术分别对不同施肥处理下石灰性紫色水稻土理化性质、厌氧氨氧化细菌丰度及群落结构进行分析。【结果】理化性质结果显示,相对于无肥处理(CK),氮(N)、氮磷钾肥(NPK)及氮磷钾配施农家肥(NPKM)均会降低土壤pH和硝态氮含量,而增加土壤有机质、全氮和铵态氮含量。随土壤深度增加,土壤pH增加,全氮和硝态氮含量降低,铵态氮含量变化趋势不明显。qPCR结果显示,就土壤层次而言,厌氧氨氧化细菌在0—20 cm层的丰度最高,20—40 cm层最低;就施肥处理而言,氮肥(N)对厌氧氨氧化细菌的丰度促进最为明显。T-RFLP结果表明,厌氧氨氧化细菌在0—20 cm土层群落组成最为丰富,Shannon-wiener多样性指数最高;寡氮肥下其群落组成最为简单,无肥处理下群落结构最为复杂。厌氧氨氧化细菌优势种群属于。冗余梯度分析(RDA)显示,pH影响是石灰性紫色水稻土厌氧氨氧化细菌群落结构差异的主要环境因子。【结论】本研究显示寡氮处理会降低石灰性紫色水稻土中厌氧氨氧化细菌的多样性但促进其丰度。表层土(0—20 cm)是厌氧氨氧化细菌分布的主要层次。
长期定位施肥;石灰性紫色水稻土;T-RFLP;厌氧氨氧化细菌
0 引言
【研究意义】长久以来,反硝化作用被认为是土壤环境中氮素损失的唯一途径,但厌氧氨氧化作用的发现打破了这一定律[1]。厌氧氨氧化(anaerobic ammonium oxidation, anammox)是在厌氧条件下,以NH4+为电子供体,NO2−为电子受体,产物为氮气的生物反应,即NH4++ NO2−=N2+2H2O[2]。已有研究证实,海洋生态系统中氮素以厌氧氨氧化途径的流失量占总量67%[3]。而这一过程的执行者厌氧氨氧化菌(anaerobic ammonium oxidation bacteria, AAOB)是化能自养型细菌,以CO2或HCO3-为碳源,并从NH4+和NO2−的生物反应中获得能量。研究发现厌氧氨氧化菌属于浮霉状菌目()[4],而已知的厌氧氨氧化细菌仅有5个属:[5],[6],[7],[8],[9],10个种[10],其中大部分从污水处理厂[11]、实验室反应器[12]还有海洋和淡水环境[10,13]中分离得到。水稻土是一类重要的人工湿地生态系统,受人类水肥管理措施影响明显。近年来随着水稻产量的提高,氮肥的施用量也逐渐提高,氮肥通过各种途径特别是厌氧脱氮途径的损失量也在增加[14]。【前人研究进展】关于厌氧氨氧化细菌分布的研究,前期主要集中于海洋和人工水体系统,而陆地生态系统中厌氧氨氧化细菌的分布特征研究较少,尤其是农田土壤。近期研究表明:厌氧氨氧化细菌广泛存在于含氮低氧的农业土壤中。SHEN等[15]发现在干燥农田土壤中主要厌氧氨氧化细菌为,其多样性、群落结构和丰度均受土壤有机质显著影响。而蔬菜地里主要的厌氧氨氧化细菌种属为:,,以及,它们的活性和丰度受土壤铵态氮浓度制约[16]。同时,不少研究也发现,经施肥处理后的水稻土中厌氧氨氧化细菌的群落结构与其活性有明显相关性[14,17-19],而其活性的变化使得所占释放氮气的比例发生相应变化(4%—37%)[14]。上述研究主要集中于表层(0—20 cm)土壤,而关于厌氧氨氧化细菌在水稻土中的垂直分布特征却鲜有报道。【本研究切入点】石灰性紫色水稻土是四川乃至全国广泛分布的一种重要农业土壤,面积约为4.00×106hm2。该类土壤不仅土质疏松,有机质、氮、磷含量都相对较低,且其土层薄,保水抗旱能力差。为保护石灰性紫色水稻土,规范施肥管理措施,四川省于20世纪80年代在四川遂宁市船山区建立了稻麦轮作下的“NPK长期定位施肥试验”。前期研究主要表明长期定位施肥会对该类土壤的理化性质、作物产量、微生物学活性和群落结构产生明显影响[20-23]。但长期不同施肥处理下石灰性紫色水稻土厌氧氨氧化细菌群落结构的垂直分布特征尚无研究报道。【拟解决的关键问题】本文分析了石灰性紫色水稻土厌氧氨氧化细菌群落结构对长期不同施肥处理的响应特征和垂直分布特点。以期认识不同施肥处理下石灰性紫色水稻土厌氧氨氧化细菌的微生物驱动机制,为保护石灰性紫色水稻土质量提供基础理论依据。
1 材料与方法
1.1 试验设计
长期定位试验点位于四川遂宁市船山区联盟乡二村五组(30°10'50''N,105°03'26''E),亚热带湿润季风气候,年均降水992mm,年均温18.2℃。土壤为原生钙质紫色土属,遂宁组母质,二泥田土种。试验始于1982年,完全随机区组设计,采用4个施肥处理:(1)不施肥(CK);(2)氮肥(N);(3)氮磷钾肥(NPK);(4)氮磷钾肥+农家肥(NPKM)。农家肥:主成分为猪厩肥,有机质含量1.5 mg·kg-1,氮素含量0.55%。各处理每种肥料施用量为:氮肥(尿素:CO(NH2)2):55.2 kg·hm-2,2/3用做基肥,1/3在水稻分蘖后期追肥;钾肥(KCl):31.5 kg·hm-2;磷肥(P2O5):13.2 kg·hm-2;农家肥:3×104kg·hm-2。等氮量设计,3次重复,随机区组排列,共12个小区,每小区面积13.2 m2。小区间用水泥板隔开,重复间留排水沟。采用小麦/水稻轮作,按当地常规方法进行水稻栽培的田间管理。初始土壤的养分情况为:pH 8.6、有机质15.9 g·kg-1、全氮1.09 g·kg-1、碱解氮66.3 mg·kg-1、全钾26.9 g·kg-1、有效钾130.6 mg·kg-1、缓效钾699.4 mg·kg-1、全磷1.35 g·kg-1、有效磷3.9 mg·kg-1。
1.2 土样采集与预处理
对水稻田进行长期灌水处理(土面覆盖约2—5 cm水层),于2013年7月1日水稻分蘖期追肥后采集样品。在样方里按“梅花型”布点取样,基于土壤发生层次,用土钻(内径为5 cm)分别钻取4个层次土样(0—20 cm(L1)、20—40 cm(L2)、40—60 cm(L3)和60—90 cm(L4)),分层混匀,用无菌PET树脂袋封装放于冰盒中带回实验室。取混合均匀的新鲜土样立即提取土壤总DNA,另取部分土样于室温下风干后进行土壤理化性质测定,剩余土样于-20℃保存备用。
1.3 土壤基本理化性质测定
测定方法参照鲁如坤土壤农业化学分析方法[24]。
1.4 土壤AAOB群落结构的T-RFLP分析
1.4.1 土壤微生物总DNA提取 采用Fast DNA Spin Kit for Soil(Qbiogene, Carlsbad, CA,USA)的试剂盒方法。称取0.5 g新鲜土壤样品,重复3次,按试剂盒上的步骤进行土壤微生物总DNA的提取。
1.4.2 16S基因的PCR扩增 PCR过程采用Nested-PCR方法,首轮采用PCR 引物为:pla46f[25]和AMX1480r。反应体系:PCR Master Mix(TIANGEN BIOTECH. BEIJING)15mL,DNA模板5mL,引物各0.5 µL(10 pmol·µL-1),5mL土壤总DNA,加ddH2O至终体积30mL。反应程序:预变性94℃4 min,变性94℃30 s,退火55℃30s,延伸温度72℃1 min,共进行30个循环,72℃10 min,最后于4℃恒温保存。第二轮选取Amx368f*和Amx820r[12]。反应体系:PCR Master Mix 25mL,DNA模板1mL(以第一轮的PCR产物稀释10倍),引物各0.5 µL(10 pmol·µL-1),加ddH2O至终体积50mL。反应程序与首轮程序相同。取PCR产物各2.0 μL,1.0%琼脂糖凝胶电泳检测,自动凝胶成像系统(Gel Doc Documentation System, Bio-Rad, USA)拍照检测。
1.4.3 16S PCR产物酶切处理 采用限制性内切酶(C^CGG)和(GT^AC)对纯化后的PCR产物进行酶切[26]。反应体系:限制性内切酶(10 U)1 μL,相应缓冲液1 μL,PCR产物7 μL,超纯水补足至10 μL。反应条件:限制性内切酶在37℃条件下酶切12 h,65℃失活20 min。送生工生物工程有限公司(上海)进行T-RFLP分析。
1.4.4 T-RFLP分析 选择TRF 的原则一般是:峰高>80[27],相对误差不超过10% 。T-RFLP图谱中限制性片段(T-RF)范围细菌在35—550 bp,荧光值超过100 RFU,在平行试验的图谱中重复再现的峰纳入统计分析,并去除OTU丰度<1% 的TRFs。T-RFLP 图谱中每1个限制性片段(T-RF)为1个OTU,T-RFs 片段大小± 1 bp 被认为是同一个OTU。
1.5 Real-Time PCR测定AAOB的拷贝数
Real-Time PCR标准样品的制作。选取l份质量高的PCR产物,见1.4.2。采用DNA凝胶纯化试剂盒纯化扩增后的基因片段,将片断连接在pGEM-T Easy载体中,然后转化到.coli中,涂布到含有氨苄青霉素(Ampicillin)/IPTG/X-Gal的LB(Lufia-Beaani)培养基上,37℃下培养16—24 h。随机挑选2—3个白斑克隆子测序。利用质粒提取试剂盒提取克隆子的质粒,测定其DNA浓度,并将其以10倍为间隔系列稀释成实时荧光定量PCR测定标准品。
将样品与标准品一起进行Real-Time PCR检测,包括阴性对照在内每个样品设3个重复。引物为:Amx808f和Amx1040r[28]。反应体系:ABI Prower SybrGreen qPCR Master Mix (ABI, USA)10mL,DNA模板1mL,引物各0.5 µL(10 pmol·µL-1),加ddH2O至终体积20mL。反应程序:预变性95℃10 s,变性95℃30 s,退火60℃30 s,延伸温度72℃30 s,共进行40个循环。每个循环中荧光收集在83℃下进行,以防止由于引物二聚体的存在所引起的误差。溶解曲线程序为65—98℃,每0.2℃读数,其间停留6 s。Real-TimePCR测定控制软件ABI7500 Fast Real-Time PCR system。
1.6 数据分析
T-RFLP图谱中OTU的数目及其丰度用PCORD程序进行多样性指数计算, 包括多样性指数(Shannon diversity,)、均匀度指数(Shannon evenness,)还有丰富度指数()。土壤理化性质、T-RFLP测定结果均为3 次生物重复的平均值,误差线均为标准误。使用SPSS 20. 0软件统计软件,数据采用统计描述、方差分析(one-way ANOVA)、Duncan检验和Pearson相关分析。采用CANOCO 4.5中的冗余法(Redundancy Analysis)分析AAOB群落结构与土壤理化性质。
2 结果
2.1 土壤理化性质
不同施肥处理对石灰性紫色水稻土理化性质产生不同影响(表1)。就pH而言,与无肥(CK)(pH=7.57)比较,化肥处理(N和NPK)下的pH最低;土壤层次上,0—20 cm土层的pH最低。就土壤有机质(SOM)而言,无机肥处理下的SOM含量为9.6—38.5 g·kg-1,而NPKM处理为14.4—32.8 g·kg-1;土壤层次上,0—20 cm土层含量最高,而20—40 cm层最低。就全氮(TN)而言,各施肥处理间差异小;土壤层次上的变化与SOM相同。就硝态氮而言,NPKM处理降低土壤硝态氮含量。就铵态氮而言,NPK处理下各土层含量均最低,而N处理下最高。
2.2 qPCR数据分析
不同土壤深度AAOB的16S rRNA基因拷贝数方差分析结果如图1所示。L1层土壤是AAOB的主要分布区域,拷贝数最高。而L2层,拷贝数最低。在各个土壤层次中,NPKM和无机肥处理(N, NPK)的AAOB拷贝数基本大于CK。长期不同施肥处理间土壤的厌氧氨氧化菌的丰度存在显著差异。在所有土壤层次中,N施肥处理的AAOB的16S rRNA拷贝数均最高。而无肥处理下,AAOB的16S rRNA拷贝数均最低。运用SPSS进行AAOB的16S rRNA拷贝数与环境参数间相关性分析表明,AAOB的16S rRNA基因拷贝数与铵态氮显著正相关(= 0.78,<0.05)。

表1 不同施肥处理下各土壤层次的土壤理化性质
SOM:土壤有机质;TN:全氮;CK为对照;N为氮肥处理;NPK为氮磷钾肥配合处理;NPKM为氮磷钾肥+农家肥处理。每列数据后不同小写字母表示在<0.05水平下差异显著;L1:0—20 cm,L2:20—40 cm,L3:40—60 cm,L4:60—90 cm土层。下同
SOM:soil organic matter; TN: Total nitrogen; CK: Control treatment;N: nitrogen treatment;NPK: nitrogen; phosphorus and potassium treatment; NPKM: nitrogen; phosphorus and potassium+ manure treatment. Different letters within a column indicate significant difference between values at<0.05;L1:0—20 cm,L2:20—40 cm,L3:40—60 cm,L4:60—90 cm. The same as below

图中的小写字母表示相同土壤层次内各施肥处理间拷贝数在P<0.05下显著差异;大写字母表示不同层次间拷贝数在P<0.05下显著差异;每个值代表平均值±标准误(n=3)
2.3 AAOB细菌群落结构数据分析
2.3.1 多样性指数分析 以T-RFLP图谱为基础,各施肥处理下不同土壤层次中厌氧氨氧化细菌的多样性指数、丰富度及均匀度,见表2。
不同施肥处理下AAOB的16S rRNA基因Shannon-wiener多样性指数在L1和L2层存在显著差异(<0.05),L3和L4差异不明显(表2)。无肥和无机肥处理的AAOB群落结构多样性指数大于NPKM处理。丰富度和均匀度在L1、L2和L3间存在显著差异(<0.05)。在L1层,不同施肥处理下AAOB群落结构多样性变化明显,CK多样性指数最高,N处理最低。L2层多样性指数是4个层次中最低的,N处理下多样性指数最高,NPKM处理最低;在L3层,NPK处理AAOB多样性指数最高,NPKM处理下最低;在L4层,CK处理下AAOB多样性指数最高,NPKM处理下最低。
2.3.2 T-RFLP数据分析 采用T-RFLP技术对厌氧氨氧化细菌群落结构分析如图2所示。采用和酶切得到13种T-RF片段,取其中9个优势片段进行分析。就土壤层次而言,L3层片段种类数最少,其他层次片段数相当。就施肥处理而言,N处理下AAOB群落结构最为简单。133 bp和72 bp片段在L1层的CK、NPK和NPKM处理下的AAOB群落结构中占主导地位,但在其他层次中这两个片段的优势地位被125 bp片段代替。厌氧氨氧化菌浮霉菌目被划分为5个属:、、、、。其对应理论末端片段长度分别为125、291、351、476、91 bp。本试验中Brocadia属在土壤厌氧氨氧化菌中占主要地位,125 bp占总片段的63.3%—97.2%。属在几乎只在L2、L3、L4土层中存在。
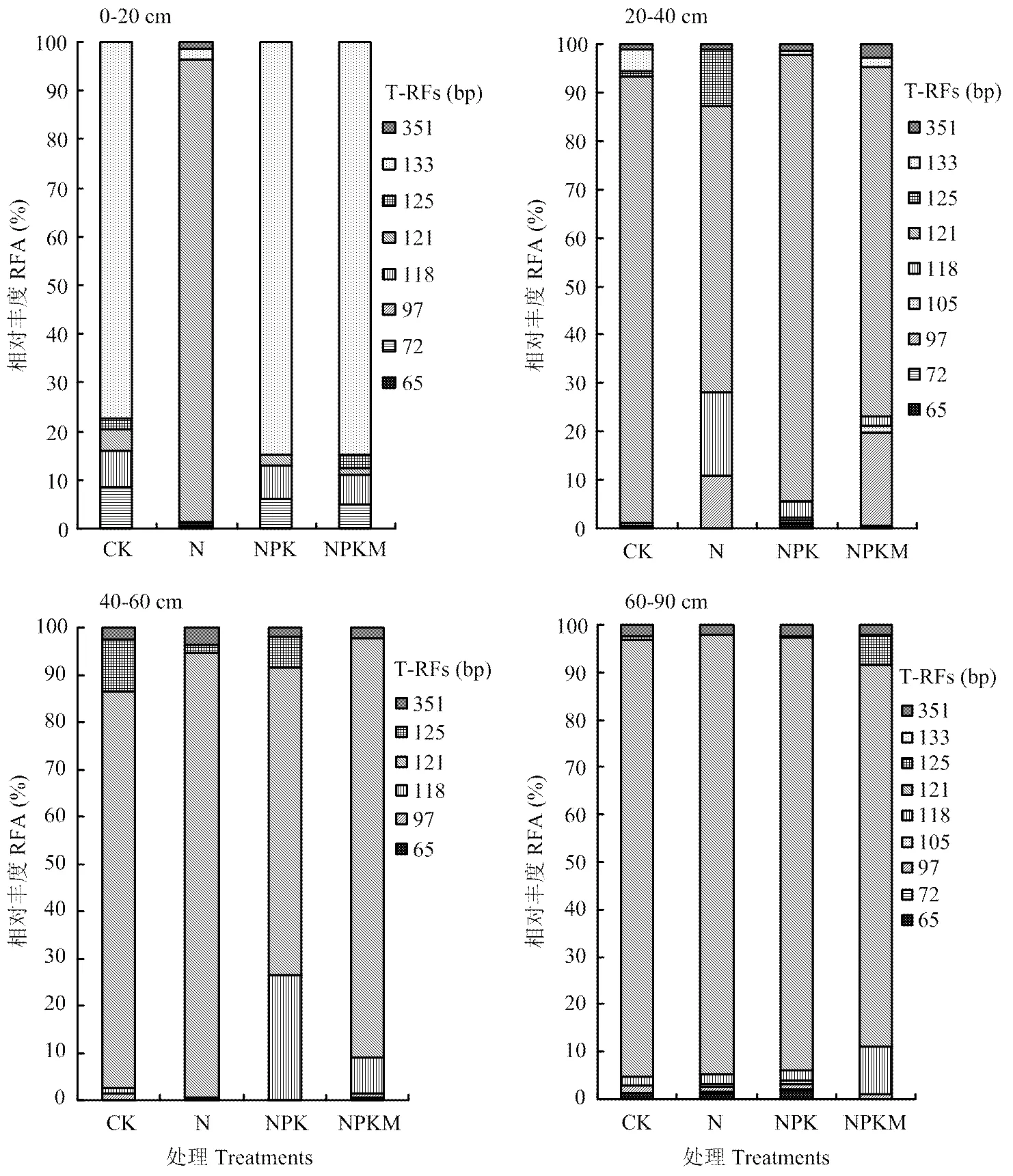
图2 不同施肥处理下不同土壤层次的AAOB群落组成

表2 不同施肥处理下AAOB的Shannon多样性指数(H),均匀度(EH)和丰富度(S)
2.4 RDA数据分析
运用RDA分析进行AAOB群落结构与环境参数的相关性分析(图3)。冗余分析图中箭头表示环境因子,箭头所处的象限表示环境因子与排序轴间的正负相关性,箭头连线长度表示该环境因子与样本分布相关程度的大小,箭头连线间的夹角代表环境因子间的相关程度。分析结果显示:第一排序轴的特征值为0.742,第二排序轴特征值为0.012。由图可知,第一排序轴与pH关系最为密切,均达到极显著水平(<0.01)。与全氮、硝态氮较为密切,均达到显著水平(<0.05)。总体而言,本试验中pH对AAOB群落结构的影响最显著(<0.05,蒙特卡罗算法)。此外,L1层的AAOB群落结构与其他层次存在明显的差异,而L2、L3和L4层的AAOB群落结构较相似。
3 讨论
3.1 不同施肥处理对AAOB群落结构及丰度的影响
与短期施肥相比,长期定位施肥在改善土壤理化性质、肥力[29]和保证农作产量[30]上有明显的优势。除此之外,与灌溉管理和季节变化相比,施肥对土壤微生物群落结构的改变更加深刻[31-32]。厌氧氨氧化是新近发现的一条与反硝化匹配的厌氧脱氮途径,由厌氧氨氧化细菌所介导调控。施肥会对AAOB群落结构形成明显影响并进而改变土壤厌氧氨氧化作用强度及土壤氮素流失量[14]。本文qPCR结果显示,施氮处理(N处理)下AAOB的16S rRNA基因的拷贝数高于其他施肥处理。虽不同施肥处理对AAOB的丰度均有促进作用,但施氮处理最为明显。与本文不同,前人亦有研究发现,无机肥配施农家肥对AAOB丰度的促进作用更明显[33]。产生上述差异的原因可能是:影响AAOB丰度的主要环境因子不同,HUI等[33]发现影响AAOB丰度的主要环境因子是pH,本文是铵态氮。T-RFLP分析和Shannon-wiener多样性分析均显示,AAOB群落结构施肥氮处理(N处理)下最为简单,而无肥处理下其最为复杂。在为数不多的研究不同施肥制度对土壤中AAOB群落结构的报道中发现,施肥处理能够促进其多样性[34-35]。然而,笔者研究显示施肥处理一定程度上都降低了AAOB的群落结构多样性,施氮肥处理最明显。因此推测产生此现象的原因是不同施肥处理使得表层土中优势AAOB群落种群减少,而随着土壤深度增加,施肥效力减弱。深层土壤中出现新的优势AAOB种群。但是表层土中减少的优势种群多,而深层增加的少。综上所述,就可得到AAOB群落多样性减少的原因。而本文2.3.2中优势T-RFs片段的变化也能支持以上推论。

SOM:有机质;TN:全氮;AK:有效钾;AP:有效磷;Nitrate:硝态氮;Ammonium:铵态氮。CK为对照;N为氮肥处理;NPK为氮磷钾肥配合处理;NPKM为氮磷钾肥+农家肥处理
3.2 AAOB群落结构及丰度在不同土壤层次上的分布
近几年AAOB研究表明,随着土壤层次的变化其群落结构和丰度都会随之发生改变。本文qPCR结果显示:AAOB丰度最高的层次是L1层土壤,最低为L2层土壤。Shen等[18]在淹水稻田里研究AAOB的群落结构发现:0—10 cm表层土中,AAOB的丰度最高;而第二层土壤(30 cm)的丰度最低。此外,ZHU等[36]研究也发现白洋淀水稻土0—20 cm深度的AAOB丰度高于20—30 cm土壤层次。以上结果均与本文的结果相似。但也有相反的结果,如BAI等[37]研究表明,深层水稻土更适宜AAOB生存和发挥功能,在表层水稻土中罕见。造成以上迥异结果的原因可能是:虽然表层水稻土溶解O2可能抑制了AAOB,但表层丰富有机质腐熟极有可能导致表层缺氧,而水稻根系处于L2层,其分泌的O2亦有可能抑制AAOB。根据T-RFLP结果显示,133 bp和72 bp片段在L1层AAOB群落结构中占主导地位,但随着土壤层次增加这两个片段的优势地位被125 bp片段代替,且125 bp所对应的是厌氧氨氧化细菌的。已有研究显示,厌氧氨氧化细菌的属广泛存在于水稻土的深层土壤[18,36]。此外,随着土壤层次增加,351 bp片段在AAOB群落中所占比例逐渐增加。其所对应的属厌氧氨氧化细菌主要存在于淡水湖泊底泥和海水深层[38-39],而在水稻土中鲜少发现。
3.3 土壤环境参数对AAOB群落结构的影响
环境因子是影响微生物群落结构变化的重要因子,对于深入认识土壤微生物在生态系统中扮演的角色和功能具有重要意义。RDA分析直接将环境变量作为约束条件考虑到排序分析中,从而解释环境因子对微生物群落结构的影响[40]。已有研究显示,农业土壤中AAOB群落结构受铵含量[16]和无机氮含量[18]的影响。而本文却得出了相异的结果,即pH和SOM是影响石灰性紫色水稻土AAOB群落结构的主要因子。造成以上差异的原因可能是:首先可能是生态系统差异造成的。因为SHEN等的研究是在种植蔬菜土壤中进行的[16],而部分研究发现水稻土中AAOB的群落结构与pH值明显相关[17, 37]。此外,HUI等还发现AAOB群落结构与土壤有机质也明显相关。其次,可能是因为不同水稻田中的各种理化性质含量的不同。
4 结论
土壤表层为厌氧氨氧化细菌(AAOB)最广泛分布的层次。石灰性紫色水稻土表层土(0—20 cm)中的优势AAOB属于Brocadia,而深层土壤中的优势AAOB属于Scalindula。长期施氮会降低石灰性紫色水稻土中厌氧氨氧化细菌的群落多样性。pH是影响石灰性紫色水稻土AAOB群落结构的主要环境因子。
References
[1] MULDER A, VAN DE GRAAF A A, Robertson L A, Kuenen J G. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor., 1995, 16(3): 177-184.
[2] Strous M, Heijnen J J, Kuenen J,Jetten M S M. The sequencing batch reactor as a powerful tool for the study of slowly growing anaerobic ammonium-oxidizing microorganisms., 1998, 50(5): 589-596.
[3] Engstrom P, Dalsgaard T, Hulth S, Aller R C. Anaerobic ammonium oxidation by nitrite (anammox): implications for N2production in coastal marine sediments., 2005, 69(8):2057-2065.
[4] Jetten M S M, Op den Camp H J M, Kuenen J G, Strous M. Description of the order Brocadiales //Krieg N R, Staley J T, Hedlund B P, Paster B J, Ward N, Ludwig W, Whitman W B.(. Heidelberg: Springer, 2010: 506-603.
[5] Strous M, Fuerst J A, Kramer E H M, Logemann S, Muyzer G, van de Pas-Schoonen K T, Webb R, Kuenen J G, Jetten M S M. Missing lithotroph identified as new planctomycete., 1999, 400(6743): 446-449.
[6] Schmid M C, Twachtmann U, Klein M, Strous M, Juretschko S, Jetten M S M, Metzger J W, Schleifer K H, Wagner M. Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation., 2000, 23(1):93-106.
[7] Schmid M C, Walsh K, Webb R I, Rijpstra W I, van de Pas-Schoonen K, Verbruggen M J, Hill T, Moffett B, Fuerst J, Schouten S, Damsté J J S, Harris J, Shaw P, Jetten M S M, Strous M.‘Scalindua brodae’, sp. nov.,‘Scalindua wagneri’, sp. nov., two new species of anaerobic ammonium oxidizing bacteria., 2003, 26(4):529 -538.
[8] Quan Z X, Rhee S K, Zuo J E, Yang Y, Bae J W, Park J R, Lee S T, Park Y H. Diversity of ammonium-oxidizing bacteria in a granular sludge anaerobic ammonium-oxidizing (anammox) reactor., 2008, 10(11):3130 -3139.
[9] Kartal B, Rattray J, van Niftrik L A, van de Vossenberg J, Schmid M C, Webb R I, Schouten S, Fuerst J A, Damsté J J S, Jetten M M S, Strous M.‘Anammoxoglobus propionicus’ a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria., 2007, 30(1):39-49.
[10] Liu S, Yang F, Gong Z,Meng F, Chen H, Xue Y, Furukawa K. Application of anaerobic ammonium-oxidizing consortium to achieve completely autotrophic ammonium and sulfate removal., 2008, 99(15): 6817-6825.
[11] Hu B L, Zheng P, Tanga C J,Chen J W, van der Biezen E, Zhang L, Ni B J, Jetten M S M, Yan J, Yu H Q, Kartal B. Identification and quantification of anammox bacteria in eight nitrogen removal reactors., 2010, 44(17): 5014-5020.
[12] Tsushimaa I, Ogasawaraa Y, Kindaichib T, Satoh H, Okabe S. Development of high-rate anaerobic ammonium-oxidizing (anammox) biofilm reactors., 2007, 41(8): 1623-1634.
[13] Kuypers M M M, SliekersA O, Lavik G, Schmid M., Jørgensen B B, Kuenen J G, Damsté J S S, Strous M, Jetten M S M. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea., 2003, 422(6932): 608-611.
[14] Zhu G B, Wang S, Wang Y, Wang C, Risgaard-Petersen N, Jetten M S M, Yin C. Anaerobic ammonia oxidation in a fertilized paddy soil., 2011, 5 (12):1905-1912.
[15] Shen L D, Liu S, Lou L P, Liu W P, Xu X Y, Zheng P, Hu B L. Broad distribution of diverse anaerobic ammonium-oxidizing bacteria in Chinese agricultural soils., 2013, 79(19): 6167-6172.
[16] Shen L D, Wu H S, Gao Z Q, Xu X H, Chen T X, Liu S, Cheng H X. Occurrence and importance of anaerobic ammonium- oxidising bacteria in vegetable soils., 2015, 99(13): 5709-5718.
[17] Yang X R, Li H, Nie S A,Su J Q, Weng B S, Zhu G B, Yao H Y, Gilbert J A, Zhu Y G. Potential contribution of anammox to nitrogen loss from paddy soils in Southern China., 2015, 81(3): 938-947.
[18] Shen L D, Liu S, Huang Q, Lian X, He Z F, Geng S, Jin R C, He Y F, Lou L P, Xu X Y, Zheng P, Hu B L. Evidence for the co-occurrence of nitrite-dependent anaerobic ammonium and methane oxidation processes in a flooded paddy field., 2014, 80(24): 7611-7619.
[19] 范改娜, 祝贵兵, 王雨, 王衫允, 王朝旭, 尹澄清. 河流湿地氮循环修复过程中的新型功能微生物. 环境科学学报2010, 30(8): 1558-1563.
Fan G N, Zhu G B, Wang Y,Wang S Y, Wang C X, Yin C Q. New functional microorganisms in nitrogen cycle restoration of river riparian ecosystems., 2010, 30(8): 1558-1563.(in Chinese)
[20] 辜运富, 张小平, 涂仕华, Kristina Lindström. 长期定位施肥对石灰性紫色水稻土古菌群落结构的影响. 生物多样性, 2011, 19(3): 369-376.
Gu Y F, Zhang X P, Tu S H, Lindström K. Effect of long-term fertilization on archaeal community structure in calcareous purplish paddy soil., 2011, 19(3): 369-376. (in Chinese)
[21] 卢圣鄂, 王蓥燕, 陈勇, 涂仕华, 张小平, 辜运富. 不同施肥制度对石灰性紫色水稻土中氨氧化古菌群落结构的影响. 生态学报, 2016, 36(21): 6919-6927.
LU S E, WANG Y Y, CHEN Y, TU S H, ZHANG X P, GU Y F. Impact of different long-term fertilization system on ammonia oxidation Archaea community structure in Calcareous Purple Paddy soil., 2016, 36(21): 6919-6927. (in Chinese)
[22] 辜运富, 云翔, 张小平, 涂仕华, 孙锡发, Kristina Lindström. 不同施肥处理对石灰性紫色土微生物数量及氨氧化细菌群落结构的影响. 中国农业科学2008, 41(12): 4119-4126.
GU Y F, YUN X, ZHANG X P, TU S H, SUN X F, Lindström K. Effect of different fertilizer treatments on soil microbes and ammonium oxidizing bacterial community in a Calcareous Purple Paddy Soil., 2008, 41(12): 4119-4126. (in Chinese)
[23] Gu Y F, Zhang X P, Tu S H, Lindström K. Soil microbial biomass, crop yields, and bacterial community structure as affected by long-term fertilizer treatments under wheat-rice cropping.2009, 45(3): 239-246.
[24] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000.
LU R K.. Beijing: China Agricultural Science and Technology Press, 2000. (in Chinese)
[25] Hamersley M R, Lavik G, Woebken D,Rattray J E, Lam P, Hopmans E C, Damsté J S S, Krüger S, Graco M, Gutiérrez D, Kuypers M. M. Anaerobic ammonium oxidation in the Peruvian oxygen minimum zone., 2007, 52(3): 923-933.
[26] 储昭瑞, 李相昆, 孟令威, 张杰. T-RFLP技术在厌氧氨氧化菌群结构分析中的应用. 哈尔滨工业大学学报, 2013, 45(2): 26-30.
CHU Z R, LI X K, MENG L W, ZHANG J. Identification of anaerobic in environmental ammonium-oxidizing bacteria samples by T-RFLP., 2013, 45(2): 26-30. (in Chinese)
[27] Blackwood C B, Marsh T L, Kim S H, Paul E A. Terminal restriction fragment length polymorphism data analysis for quantitative comparison of microbial communities., 2003, 69(2): 926-932.
[28] Dang H, Zhou H, Zhang Z,Yu Z, Hua E, Liu X, Jiao N. Molecular detection of candidatus scalindua pacifica and environmental responses of sediment Anammox bacterial community in the Bohai Sea, China., 2013, 8(4): 61330.
[29] 孙瑞莲, 赵秉强, 朱鲁生, 徐晶, 张夫道. 长期定位施肥对土壤酶活性的影响及其调控土壤肥力的作用. 植物营养与肥料学报, 2003, 9(4): 406-410.
SUN R L, ZHAO B Q, ZHU L S, XU J, ZHANG F D. Effect of long-term fertilization on soil enzyme activities and its role in adjusting-controlling soil fertility., 2003, 9(4): 406-410. (in Chinese)
[30] 林治安, 赵秉强, 袁亮, Hwat Bing-So.长期定位施肥对土壤养分与作物产量的影响. 中国农业科学2009, 42(8): 2809-2819.
LIN Z A, ZHAO B Q, YUAN L, HWAT B S. Effects of manure and fertilizers long-term located application on soil fertility and crop yield., 2009, 42(8): 2809-2819. (in Chinese)
[31] Murase J, Hida A, Ogawa K, Nonoyama T, Yoshikawa N, Imai, K. Impact of long-term fertilizer treatment on the microeukaryotic community structure of a rice field soil.2015, 80: 237-243.
[32] Zhang Q, Liang G, Myrold D D, Zhou W. Variable responses of ammonia oxidizers across soil particle-size fractions affect nitrification in a long-term fertilizer experiment.2017,105: 25-36.
[33] Hui C, Guo X, Sun P, Lin H, Zhang Q, Liang Y, Zhao Y H. Depth-specific distribution and diversity of nitrite-dependent anaerobic ammonium and methane-oxidizing bacteria in upland- cropping soil under different fertilizer treatments., 2017, 113: 117-126.
[34] Islam M R, Chauhan P S, Kim Y, Kim M, Sa T. Community level functional diversity and enzyme activities in paddy soils under different long-term fertilizer management practices.2011, 47(5): 599-604.
[35] Zhao J, Ni T, Li Y, Xiong W, Ran W, Shen B. Responses of bacterial communities in arable soils in a rice-wheat cropping system to different fertilizer regimes and sampling times.2014, 9(1): 85301.
[36] Zhu G, Wang S, Wang W,Wang Y, Zhou L, Jiang B, Op den Camp H J M, Risgaard-Petersen N, Schwark L, Peng Y Z, Hefting M M, Jetten M S M, Yin C Q. Hotspots of anaerobic ammonium oxidation at land-freshwater interfaces., 2013, 6(2): 103-107.
[37] Bai R, Chen X, He J Z,Shen J P, Zhang L M.andpredominated in anammox bacterial community in selected Chinese paddy soils., 2015, 15(9): 1977-1986.
[38] Zhao Y, Xia Y, Kana T M, Wu Y, Li X, Yan X. Seasonal variation and controlling factors of anaerobic ammonium oxidation in freshwater river sediments in the Taihu Lake region of China., 2013, 93(9): 2124-2131.
[39] Schmid M C, Risgaard‐Petersen N, Van De Vossenberg J, Kuypers M M, Lavik G, Petersen J, Hulth S, Thamdrup B, Canfield D, Dalsgaard T, Rysgaard S, Sejr M K, Strous M, Op den Camp H J M, Jetten M S M. Anaerobic ammonium-oxidizing bacteria in marine environments: widespread occurrence but low diversity., 2007, 9(6): 1476-1484.
[40] Könneke M, Bemhard A E, José R, Walker C B, Waterbury J B, Stahl D A. Isolation of an autotrophic ammonia- oxidizing marine archaeon., 2005, 437(7058): 543-546.
(责任编辑 李云霞)
Response of Anammox Bacteria Community Structure and Vertical Distribution to Different Long-term Fertilizations in Calcareous Purple Paddy Soil
WANG YingYan1, LU ShengE1, LI YueFei1, TU ShiHua2, ZHANG XiaoPing1, GU YunFu1
(1Department of Microbiology, College of Resources, Sichuan Agricultural University, Chengdu 611130;2Soil and Fertilizer Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066)
【Objective】The impacts of long-term fertilizations on the anaerobic ammonium oxidation bacteria (AAOB) community structure and vertical distribution were studied in order to deeply understand the microbial mediated mechanism of anammox reaction, develop a sound fertilization regime and provide theoretical foundations for maintaining the soil quality in this region.【Method】Chemical analysis, real-time PCR and terminal restriction fragment length polymorphism (T-RFLP) were used to analyze the soil physico-chemical properties, the 16S rRNA gene abundance and composition of AAOB community, respectively.【Result】The results showed that compared to no fertilizer application control (CK), all fertilizers decreased the soil pH and nitrate content, while increased soil organic matter (SOM), total nitrogen (TN) and ammonia content. With increasing of soil depth, soil parameters including soil pH, TN, and nitrate content were decreased, while the ammonia content was not obviously changed. The qPCR results showed: the abundance of AAOB 16S rRNA gene peaked in the 0-20 cm layer, while being the lowest in the 20-40 cm depth. Mere nitrogen treatment (N) had an evident positive effect on the abundance of AAOB. The T-RFLP results indicated that in the 0-20 cm layer, the community compositions of AAOB were the most complex, which were also supported by the highest Shannon-wiener diversity index. Compositions of AAOB community in the soil fertilized with N only were the simplest, while those in the soil amended with CK were the richest. Besides, the predominant AAOB were phylogenetically affiliated toBrocadia. Redundant gradient analysis (RDA) showed that pH was the key factor in shaping the AAOB community in calcareous purple paddy soil amended with different fertilizer treatments.【Conclusion】This study suggested that mere N fertilizer would decrease the compositions of AAOB community in calcareous purple paddy soil but increase their abundances. The topsoil (0-20 cm) was the main distribution soil depth in calcareous purple paddy soil for AAOB.
long-term fertilization; Calcareous Purple Paddy soil; T-RFLP; anammox bacteria
2017-01-03;接受日期:2017-03-29
国家自然科学基金(41201256)
王蓥燕,E-mail:398766403@qq.com。通信作者辜运富,Tel:028-86290982;E-mail:guyf@sicau.edu.cn
