QuEChERS耦合UPLC-MS/MS同时测定葡萄中9种植物生长调节剂
2017-09-03金艳红朱群英南昌市疾病预防控制中心
□ 金艳红 朱群英 南昌市疾病预防控制中心
QuEChERS耦合UPLC-MS/MS同时测定葡萄中9种植物生长调节剂
□ 金艳红 朱群英 南昌市疾病预防控制中心
目的:采用液质联用同时测定葡萄中α-萘乙酸、多效唑、2、4-D、矮壮素、吲哚-3-丁酸、6-苄基腺嘌呤、氯吡脲、缩节胺和对氯苯氧乙酸9种植物生长调节剂。方法:样品按QuEChERS方法前处理采用乙腈提取、PSA净化,以乙腈-10 mmol/L乙酸铵(0.05%氨水)溶液为流动相,梯度洗脱,Waters ACQUITY UPLCTMBEH C18(2.1 mm×100 mm,1.7 μm)不锈钢色谱柱分离,三重四级杆质谱多反应监测方式检测,外标法定量。结果:9种植物生长调节剂在线性范围内具有良好的线性关系,线性相关性r≥0.99,检出限在0.15~8.89 μg/kg,加标回收率在77.2%~112.0%,相对标准偏差在2.08%~9.12%。结论:该方法耗时短、操作简单、有机试剂使用少,灵敏度高、回收率好,适用于日常葡萄中多种植物生长调节剂检测,可缩短检测周期。
QuEChERS;液质联用;葡萄;植物生长调节剂
植物生长调节剂(Regulator)的使用已逐渐成为推动现代化农业生产发展的重要手段,它是一类具有植物激素活性的人工合成化学物质,属于农药范畴[1]。然而,与其他农药一样,植物生长调节剂具有一定的毒性。现农业植物激素使用情况增多,安全性也受到广泛关注[2]。
随着人们食品安全意识的提高,植物生长调节剂的检测方法不断更新。使用方法为气相色谱法(GC)[3-8],需要衍生化反应,前处理过程较繁琐;酶联免疫法[9-11],该方法可作为一种快速筛查方法,有特异性强、灵敏度高、易于推广等优点,但也存在很多缺陷。高效液相色谱法和液相色谱-质谱联用法是目前最常用的分析方法,液相色谱-质谱法联用法以其抗干扰能力强、灵敏度高并且能够提供化合物结构信息而应用于多组分同时分析检测[12-19]。本文以采用乙腈提取、PSA净化按QuEChERS方法前处理,液质联用法同时测定葡萄中9种植物生长调节剂。
1 实验部分
1.1 仪器与试剂
1.1.1 仪器
超高效液相色谱仪LC-30A与三重四级杆质谱仪LCMS-8040联用系统(日本岛津公司);Organomation N-EVNP24氮吹仪;IKA MS3涡旋振荡器;Milli-Q Direct8 超纯水机;Peak Scientific氮气发生器(NM32L);eppendorf 5424台式高速离心机。
1.1.2 试剂
乙腈(LCMS级);乙酸铵、氨水,为色谱纯;超纯水;标准物质:多效唑、2、4-D、矮壮素、氯吡脲,购于农业部环境保护科研监测所;缩节胺、对氯苯氧乙酸,购于上海市农药研究所有限公司,以上标准物质浓度均为100 μg/mL;α-萘乙酸、吲哚-3-丁酸、6-苄基腺嘌呤为固体,购于Dr.Ehrenstorfer GmbH。
1.2 方法
1.2.1 液相色谱条件
Waters AC QUITY UPLCTMBEH C18(2.1 mm×100 mm,1.7 μm)不锈钢色谱柱;流动相:A为乙腈,B为10 mmol/L乙酸铵(含0.05%氨水),梯度洗脱程序:0~7 min,95%~85%的B流动相;7.10~10.50 min 65%的B流动相;11.0~15.0 min,20%的B流动相;15.1 min 95%的B流动相;柱温:33 ℃;进样体积:10 μL;流速: 0.2 mL/min。
1.2.2 质谱条件
离子源:电喷雾离子源ESI,采用ESI正负模式;扫描模式:多反应监测MRM:离子源接口电压:±3.5 kV;脱溶剂管温度:240 ℃;加热模块温度:400℃;雾化气流量:氮气3.0 L/min;干燥气流量:15 L/min;碰撞气:氩气;驻留时间:100 ms;延迟时间:1 ms。
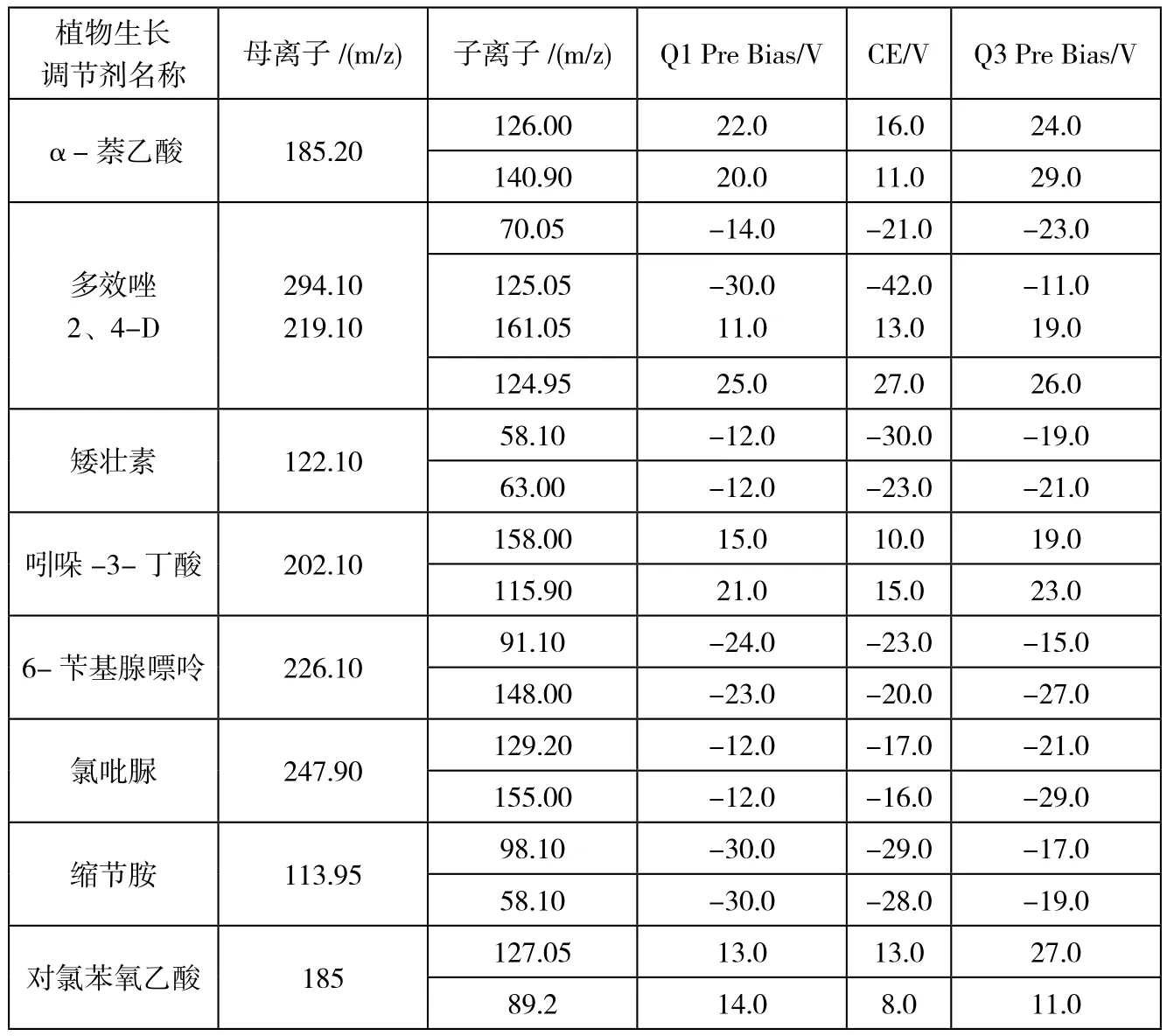
表1 9种植物生长调节剂MRM参数表
1.2.3 标准使用液的的配制
用移液器分别吸取6种标准溶液(100 μg/mL)100 μL,用乙腈-10 mmol/L乙酸铵水溶液(20∶80,V∶V)定容到10 mL,制备成6种标准物质浓度为1 μg/mL的标准使用液。称取0.01 gα-萘乙酸、吲哚-3-丁酸、6-苄基腺嘌呤用乙腈定容到100 mL成100 μg/ mL标准液,再用移液器分别吸取上述三种标准溶液(100 μg/mL)100μL,用乙腈-10 mmol/L乙酸铵水溶液(20∶80,V∶V)定容到10 mL,制备成9种标准物质浓度为1 μg/mL的标准使用液。
1.2.4 样品处理
将样品混匀,准确称取10.00 g(精确到0.01 g)样品于50 mL离心管中,加入20 mL乙腈,超声15 min,取出加入0.5 g氯化钠,2.0 g硫酸镁, 涡1 min,以5 000 r/min的转速下离心10 min,取上清液4 mL到10 mL离心管中,加250 mg PSA、0.5 mg硫酸镁, 涡1 min,以4 000 r/min的转速下离心3 min,准确吸取2 mL净化液于玻璃试管中,在50 ℃下用氮气吹干。再用乙腈-10 mmol/L乙酸铵水溶液(20∶80,V∶V)定容至1 mL。涡旋混合1 min,过0.22 μm微孔滤膜,准备上机。
2 结果与讨论
2.1 液相色谱条件的优化
2.1.1 色谱柱的选择
对常用的C18反相色谱柱考察,需要从所用的色谱柱的内径、柱分离效果等不同角度考虑,较小流量可获得较高离子化效率。实验考察两个不同型号的色谱柱1:Waters ACQUITY UPLCTMBEH C18(2.1 mm×100 mm,1.7 μm)不锈钢色谱柱,2:Shim-pack XR-ODS (3.0 mm×50 mm,2.2 μm)不锈钢色谱柱,在相同流速下柱1分离效果较好且离子化效率高,所以选择柱了1为本方法用的分离柱。
2.1.2 流动相的优化
在液相色谱-质谱联用中液相分离与质谱的离子化是一对矛盾体,为实现有效离子化,目标化合物最好在流动相中以离子形式存在,为取得良好分离,目标化合物以非离子形式存在,所以流动相的选择时要考虑分离效果,也要兼顾分离组分进入质谱前的离子化效率,以获得最佳分辨率和最高灵敏度。分别考察以乙腈-10 mmol/L乙酸铵、乙腈-10 mmol/L乙酸铵(0.5%乙酸)、乙腈-10 mmol/L乙酸铵(0.05%氨水)作为流动相,考察三者对待测化合物峰形及离子化效率的影响。结果表明,乙腈-10 mmol/L乙酸铵(0.05%氨水)、乙腈-10 mmol/L乙酸铵(0.5%乙酸)对目标物能更好分离,但乙腈-10 mmol/L乙酸铵(0.05%氨水)相对10 mmol/L乙酸铵(0.5%乙酸)能使对氯苯氧乙酸的峰形平滑。故本实验采用乙腈-10 mmol/L乙酸铵(0.05%氨水)作为流动相。
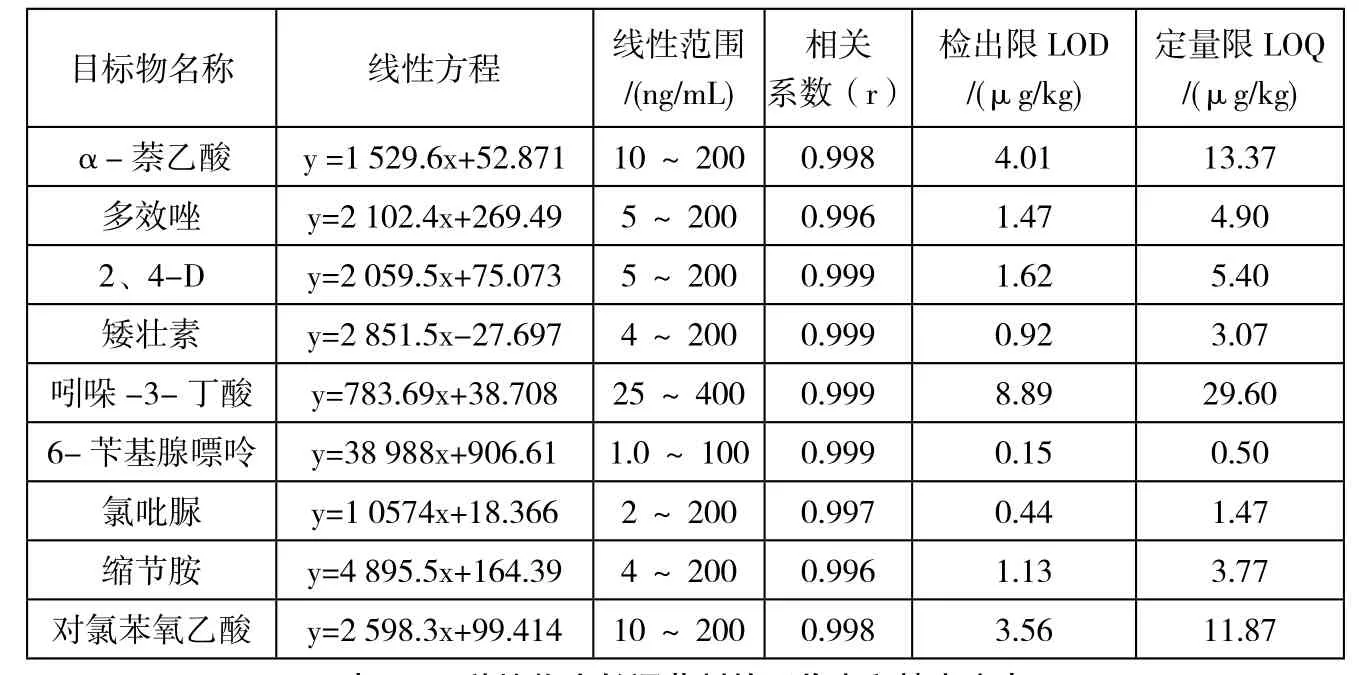
表2 9种植物生长调节剂的线性方程、线性范围、相关系数、检出限与定量下限表

表3 9种植物生长调节剂的回收率和精密度表
2.2 质谱条件的优化
2.2.1 母离子的优化
将各植物生长调节剂配成相应单标,不接分析柱下进样5 μL,分别在ESI(-)和ESI(+)模式下进行Q3 Scan,最后确定各目标物的母离子质量数。
2.2.2 碰撞能的优化以及子离子的选择
在确定好的母离子情况下,将0.5 μg/mL的植物生长调节剂单标,在不接色谱柱情况下,对子离子选择以及对相应电压和能量,优化子离子以响应值最高为定量离子,响应其次为定性离子。MRM参数见表1,其多反应监测(MRM)见图1。
2.3 样品净化条件的优化
为提高植物生长调节剂检测的灵敏度和选择性,降低样品基质对目标物离子化的影响,延长分析柱寿命,对提取液净化处理以降低色素、蛋白和脂肪等基质组分干扰。乙腈对不同极性的物质有一定溶解能力,适合多种物质同时检测,故本实验选择乙腈作为提取剂;硫酸镁和氯化钠的混合加入是为避免部分干扰物(如糖)一起提取出来。
2.4 方法学试验
2.4.1 标准曲线及方法的检出限和定量限
用乙腈-10 mmol/L乙酸铵(0.05%氨水)(20∶80,V∶V)配成不同浓度范围的植物生长调节混合标准溶液,以待测化合物标示浓度为横坐标,定量离子对峰面积为纵坐标,回归计算见表2。以3倍信噪比估算检出限,10倍信噪比对应浓度为定量限见表2。
由表2可知,目标物线性关系良好,相关系数r值均大于0.99,可克服样品提取、净化及上机测定过程造成的误差,满足不同含量的样品检测,方法检出限低。
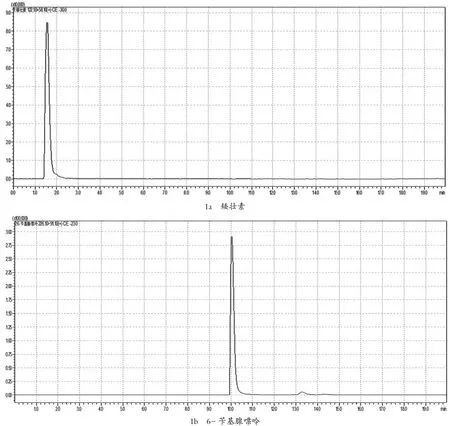
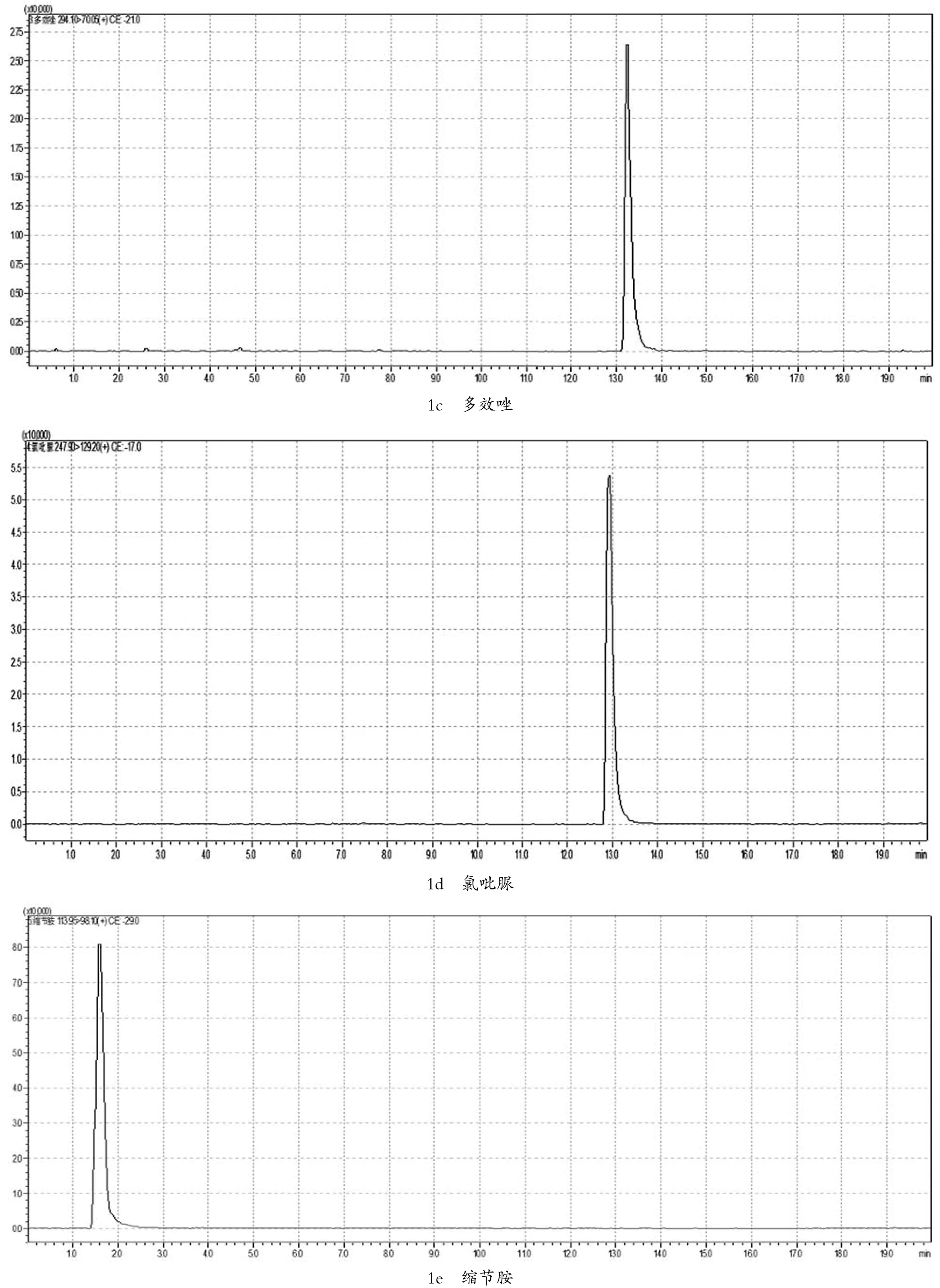
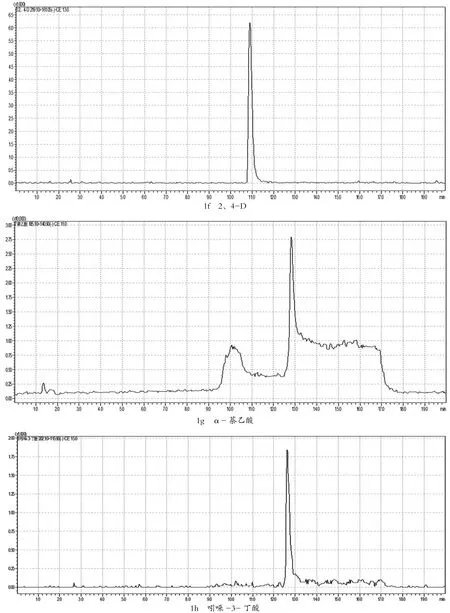

图1 9种植物生长调节剂的多反应监测(MRM)色谱图
2.4.2 方法的回收率和精密度
取葡萄空白样品,分别加入高中低3个浓度的植物生长调节剂的混合标准溶液,按1.2.4样品前处理方法处理,每个加标水平平行测定6次,计算9种植物生长调节剂的回收率和相对标准偏差,结果见表3,可知9种植物生长调节剂有较好的回收率。
2.4.3 实际样品检测
应用本方法测定本地市售的12份葡萄样品,其中在两份葡萄样品中都检测出氯吡脲(8.26 μg/kg、5.74 μg/ kg),其他植物生长调节剂均未检出。
3 结论
本文采用QuEChERS耦合液质联用法同时测定葡萄中9种植物生长调节剂。该方法采用乙腈提取、PSA净化,以乙腈-10 mmol/L乙酸铵(0.05%氨水)溶液为流动相,梯度洗脱, Waters ACQUITY UPLCTMBEH C18(2.1 mm×100 mm,1.7 μm)不锈钢色谱柱分离,三重四级杆质谱多反应监测方式检测,外标法定量。该方法耗时短、操作简单、有机试剂使用少,灵敏度高、回收率好,适用于日常葡萄中多种植物生长调节剂检测,可缩短检测周期。
[1]辛丰.植物生长调节剂种类及应用[J].农村新技术,2009(12):7-8.
[2]赵敏,邵凤赟,周淑新.植物生长调节剂对农作物和环境的安全性[J].环境与健康杂志,2007,24(5):370-372.
[3]杨挺,芦晓红,皇甫伟国.柱前衍生-气相色谱法测定柑橘中2,4-D残留量[J].中国农学通报,2006,22(10):330-333.
[4]白桦,邱月明,郝楠,等.气相色谱-质谱法测定粮谷中多效唑残留量[J].检验检疫科学,2004,14(3):54-55.
[5]Koo Y J,Yoon E,Song J T,et al.An advanced method for the determination of carboxyl methyl esterase activity using gas chromatography-chemical ionization-mass spectrometry.[J].Journal of Chromatography B,2008,863(1):80-87.
[6]李丽华,郑玲.固相微萃取-气相色谱联用技术测定芒果原浆中乙烯利的残留量[J].色谱,2001,19(3):286-288.
[7]Koo Y J,Yoon E,Song J T,et al.An advanced method for the determination of carboxyl methyl esterase activity using gas chromatography-chemical ionization-mass spectrometry.[J]. Journal of Chromatography B,2008,863(1):80-87.
[8]谢柳青,江树人,许鹏军,等.气相色谱-质谱/选择离子方法测定小白菜中己酸二乙氨基乙醇酯的残留[J].食品科学,2008,29(4):338-340.
[9]Harrison R O,Brimfield A A,Nelson J O.Development of a monoclonal antibody based enzyme immunoassay method for analysis of maleic hydrazide[J].J.agric.food Chem, 1989,37(4):958-964.
[10]Jiang X X,Shi H Y,Wu N, et al. Development of an enzymelinked immunosorbent assay for diniconazole in agricultural samples[J].Food Chemist ry,2011,125(4):1385-1389.
[11]Williams K J, James CR, Thorpe S A, et al. Two ananlytical methode for the measurement of 2,4-D in oranges: an ELISA screening procedure and a GCMS confirmatory procedure[J]. Journal of PeTICIDE Science, 1997,50(2):135-140.
[12]王金华,卢晓宇,黄梅,等.超高效液相色谱质谱法快速测定分析番茄及制品中矮壮素和缩节胺残留量[J].分析化学,2007,35(10):1509-1512.
[13]Hau J, Riediker S, Varga N, Stadler R H. Determination of the plant growth regulator chlormequant in food by liquid chromatography electrospray ionization tandem mass spectrometry[J]. J. Chromatogr. A,2000,878(1):77-86.
[14]Zhao Y, Lazou K, Schelfaut M, et al. Determination of chlormequant residues in pear concentrates by B enchtop LC-ESIMS[J]. Chromatographia,2000(51):531-535.
[15]刘靖靖,宫萍,张晓梅,等.液相色谱-四级杆时间质谱法快速测定草莓中6种植物生长调节剂的残留量[J].色谱,2012,30(10):1012-1016.
[16]陈卫军,张耀海,李云成,等.果蔬中常用植物生长调节剂分析方法研究进展[J].食品科学,2012,33(11): 283-289.
[17]唐莉娟,谭婷,万益群.超声波提取-高效液相色谱-电喷雾离子化质谱法测定白萝卜中植物生长调节剂[J].食品科学,2012,33(14):136-141.
[18]王金花,卢晓宇,黄梅,等.超高效液相色谱-质谱法快速分析番茄及其制品中矮壮素和缩节胺残留量[J].分析化学研究简报,2007,35(1):1509-1512.
[19]牟艳莉,郭德华,丁卓平,等.高效液相色谱-串联质谱法测定瓜果中11种植物生长调节剂的残留量[J].分析化学,2013,41(11):1640-1646.
南昌市指导性科技计划项目(立项文号210,编号:59)。
金艳红(1986—)女,江西吉安人,硕士,主管技师。研究方向:卫生理化检验。
