超声联合微泡对比剂在宫颈癌SiHa细胞低浓度顺铂化疗中的增敏作用
2017-09-03胡贝薛念余牧启田张盛敏牟丹许幼峰
胡贝 薛念余 牧启田 张盛敏 牟丹 许幼峰
超声联合微泡对比剂在宫颈癌SiHa细胞低浓度顺铂化疗中的增敏作用
胡贝 薛念余 牧启田 张盛敏 牟丹 许幼峰
目的 研究超声联合微泡对比剂SonoVue增强宫颈癌SiHa细胞对低浓度化疗药物顺铂敏感性的作用。 方法 将SiHa细胞培养后分为空白对照组(Control)、超声微泡空化组(MEUS)、低顺铂浓度组(顺铂IC25)、低顺铂浓度联合空化组(顺铂IC25+MEUS)。选用机械指数(MI)0.5、频率4MHz超声波联合对比剂SonoVue处理MEUS组及顺铂IC25+MEUS组的SiHa细胞。处理24h后,用CCK-8法检测细胞增殖活性,并用流式细胞仪检测细胞凋亡率。结果 Control组凋亡率为(0.855±0.427)%,MEUS组凋亡率为(1.019±0.309)%,差异无统计学意义(P>0.05);而顺铂IC25+MEUS组凋亡率为(8.453±0.265)%明显高于顺铂IC25组凋亡率(4.340±0.271)%(P<0.001)。结论 机械指数0.5、频率4MHz时,超声联合对比剂SonoVue并不会引起细胞的凋亡;但加入顺铂后,超声联合微气泡显著增强了宫颈癌SiHa细胞对顺铂的敏感性,具有化疗增敏作用。
微气泡 顺铂 宫颈癌 化疗
宫颈癌是女性三大常见恶性肿瘤之一,虽可手术根治,但仅局限于临床ⅠA~ⅡA期的患者[1]。在发展中国家,许多患者在确诊时就已达到ⅡB期或ⅡB期以上,大部分失去手术指征,预后往往不良[2]。辅助化疗技术能有效提高ⅡB期以上以及复发型宫颈癌患者的远期生存率[3],化疗后使部分患者可手术切除。宫颈癌的一线化疗药物顺铂(DDP)是一种金属铂类络合物,其毒副反应制约着临床治疗用药。因此在保证化疗效果的前提下,降低顺铂剂量具有一定临床意义。超声微泡对比剂早先用作成像显影,而后被发现微气泡能在超声波的作用下,振荡、收缩、扩大、破裂,产生“空化效应”引起周围组织细胞膜通透性一过性改变。笔者通过CCK-8、流式细胞检测等实验方法研究超声“空化效应”在低浓度顺铂处理宫颈癌SiHa细胞时所发挥的增敏作用。
1 材料和方法
1.1 材料和试剂 人子宫颈癌细胞株SiHa细胞(美国ATCC公司);DMEM、FBS、0.25%Trypsin-EDTA(美国Gibco公司);Penicillin-Streptomycin、PBS(美国GE公司);Annexin V/PI apoptosis kit(杭州联科公司);Cell counting KIT-8(日本同仁公司);SonoVue(荷兰Bracco公司);顺铂(中国齐鲁公司);超声仪器(美国PHILIPS公司IUElite);酶标仪(美国BIO-RAD公司);流式细胞仪(美国BD公司);含5%CO2、37℃饱和湿度的恒温培养箱(美国Thermo公司)。
1.2 SiHa细胞培养 SiHa细胞用含 10%FBS的DMEM培养液,于37℃、CO2体积分数为5%的培养箱中培养。根据细胞生长状况,每1~2d进行1次换液,当细胞覆盖瓶底80%~90%时,用0.25%胰酶消化进行细胞传代或收集细胞。
1.3 CCK-8实验 取处于对数生长期的SiHa细胞,用0.25%胰酶消化后轻柔吹打制成细胞悬液,计数并调整细胞终浓度浓度为1×105个/ml。接种于96孔板,每孔接种100μl细胞悬液,设4个复孔,置于CO2培养箱中培养。待细胞贴壁后,分别以不同的浓度顺铂处理,药物浓度依次为0、2、4、8、12、16、20、30、40、50μg/ml。24h后每孔加入10μl CCK-8,并置于37℃、5%CO2培养箱继续孵育1.5h。用酶标仪在450nm的波长下测定吸光度(OD)值。按下公式计算细胞抑制率:抑制率(%)=1-(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%。用GraphPad 5.0计算IC50值为后续细胞凋亡实验提供药物浓度参考。
1.4 流式细胞分析
1.4.1 实验分组与细胞处理方法 取对数生长期的Si-Ha细胞,经0.25%胰酶消化离心后轻柔吹打重悬,计数后调整细胞终浓度为1×105个/ml,接种于6孔板,每孔接种3ml,于CO2恒温培养箱培养过夜,贴壁后吸出原培养基并根据实验分组给予不同处理。处理方式分别为:空白对照(Control)组加入3ml完全培养基;超声微泡空化(MEUS)组加入完全培养基3ml,且以每3ml培养基100μl的SonoVue超声照射10min,机械指数0.5、频率4MHz;顺铂IC25组加入顺铂浓度为7.95μg/ml的完全培养基3ml;顺铂IC25+MEUS组加入顺铂浓度为7.95μg/ml的完全培养基3ml,并以每3ml培养基100μl的SonoVue超声照射10min,机械指数0.5、频率4MHz。处理完后置于37℃、5%CO2恒温培养箱培育。
1.4.2 Annexin V-FITC/PI双染色 按上述分组处理24h后,消化收集细胞,包括所有悬浮和贴壁细胞,PBS洗涤后离心后去上清液,加入500μl 1×binding buffer重悬后移入流式管中,每管加入10μlAnnexin V-FITC和 5μlPI染色,避光孵育5min。使用流式细胞仪检测各组SiHa细胞凋亡情况。重复3次实验,采用flowjo及GraphPad软件分析统计。
1.5 统计学处理 应用SPSS18.0统计软件,计量资料以表示。不同顺铂浓度抑制率的比较采用t检验,并采用概率法计算IC25。多组间比较采用单因素方差分析,两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度顺铂处理后SiHa细胞OD值及抑制率的比较 顺铂处理SiHa细胞24h后,OD值随顺铂浓度增加而减小,细胞活性抑制率则逐步增加,与0μg/ml比较差异均有统计学意义(均P<0.01),详见表1。采用GraphPad软件算出其IC50值为15.05μg/ml,概率法计算得出IC25值为7.95μg/ml。
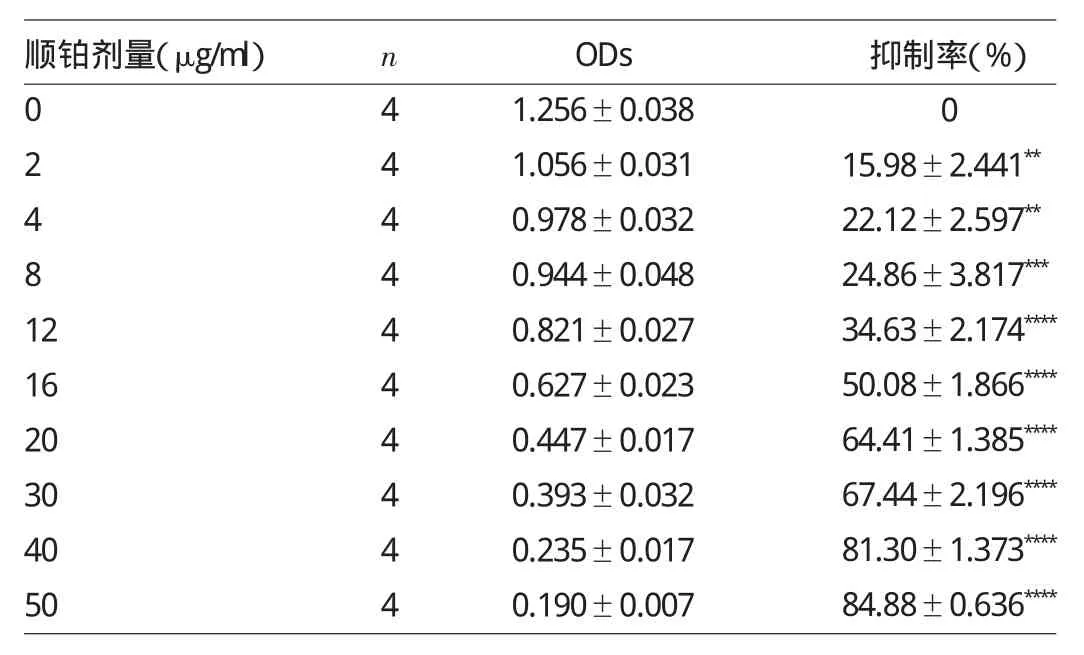
表1 不同浓度顺铂处理后S i H a细胞O D值及抑制率的比较
2.2 各组SiHa细胞凋亡情况 以横坐标为FITC染色、纵坐标为PI染色时,Q1象限代表细胞碎片,Q2象限代表中晚期凋亡,Q3象限代表早期凋亡,Q4象限代表正常活细胞,统计Q2+Q3凋亡细胞率。在没有加入顺铂的情况下,“空化效应”并不会引起细胞的凋亡,Control组凋亡率为(0.855±0.427)%,MEUS组凋亡率为(1.019±0.309)%,顺铂IC25组凋亡率为(4.340±0.271)%、顺铂 IC25+MEUS组凋亡率为(8.453±0.265)%,4组凋亡率比较差异有统计学意义(P<0.05);Control组和MEUS组凋亡率比较差异无统计学意义(P>0.05);加入顺铂处理24h后,顺铂IC25+MEUS组凋亡率明显高于顺铂IC25组,差异有统计学意义(P<0.001);顺铂IC25+MEUS组、顺铂IC25组与Control组、MEUS组比较,差异均有统计学意义(均P<0.05)(图2),可见“空化效应”增加了顺铂引起的细胞凋亡;为对比观察超声联合微泡的化疗增敏效果,加测得到用顺铂IC50药物浓度处理的细胞凋亡率为(12.450±1.501)%。
3 讨论
超声微泡对比剂最早用于血池显影、提高成像对比度,临床上已广泛应用并取得良好效果。随着超声医学与生物工程学的发展,微泡对比剂开始在治疗领域发挥其特殊作用。据文献报道,MEUS产生的“空化效应”能打开细胞膜表面孔道,利于基因或大分子药物进入细胞核,从而提高药物对细胞的作用,这一过程被称作超声“声孔效应”[4]。随后的研究表明“声孔效应”是一种瞬态的、可逆的现象,并不会影响细胞的活力,因此可将超声“声孔效应”作为一种有效的、非侵入的辅助治疗模式[5]。本实验也再次证实,机械指数0.5、频率4MHz超声联合微泡并不会引起细胞凋亡。有多项研究表明,MEUS产生的“空化效应”能增强杀肿瘤的效果[6],优化化疗药物在肿瘤组织中的聚集减少药物不良反应[7-9],甚至能逆转某些癌症的耐药性[10]。这种治疗模式可以通过增强药物对肿瘤细胞的杀伤作用来治疗癌症,例如加拿大多伦多大学的Woloschak等[6]曾将多西他赛与微泡同时经尾静脉注射进荷前列腺肿瘤的裸鼠体内,注射后立即用超声照射,24h后与多西他赛单药组对比,发现前者的肿瘤坏死面积是后者的4倍。而且对比通过超声击破载药微泡的方式给药,本研究所使用治疗模式可以不受微泡载药量的限制,适用范围更加广阔。
铂类药物是目前治疗子宫颈肿瘤的基础化疗药物,临床上宫颈癌应用最广的化疗方式,就是以顺铂为基础的联合化疗方案[2]。然而,由于顺铂具有肾毒性、耳毒性、神经毒性等毒副反应,限制了其临床应用。宫颈癌SiHa细胞的耐药机制尚不明确,可能与其细胞膜表面P-糖蛋白的过表达有关。P-糖蛋白是一种ATP结合转运蛋白,普遍存在于癌细胞膜上,能阻碍细胞摄取药物或将胞质内的药物转运出细胞外[11-12]。美国佛蒙特大学的Deng等[10]观察到在经MEUS处理的耐阿霉素MCF-7乳腺癌细胞中,P-糖蛋白的表达降低,这使细胞摄取了更多的阿霉素,且外排减少。MEUS下调癌细胞表面P-糖蛋白的机制尚不明确,推测与超声“空化效应”产生的剪切力机械移除有关[13]。本研究通过体外细胞实验,检测细胞凋亡证实MEUS能增强SiHa细胞对顺铂化疗的灵敏度。顺铂IC25组的细胞凋亡率为(4.340±0.271)%,这可能与低顺铂浓度时SiHa细胞的耐药有关,顺铂 IC25+ MEUS组的细胞凋亡率为(8.453±0.265)%,其机制可能是由于MEUS增加了顺铂的杀伤作用,或者“空化效应”下调了P-糖蛋白的表达,逆转了SiHa细胞的耐药性,尚需进一步研究证实。顺铂IC25+MEUS组的细胞凋亡率接近于中高浓度药物时顺铂 IC50处理的凋亡率为(12.450±1.501)%,可见在保证化疗效果的前提下,可以通过MEUS减少化疗药物的使用剂量,从而降低药物的毒副反应,具有一定的临床应用价值。
综上所述,MEUS联合低浓度顺铂可显著提升SiHa细胞化疗疗效,可达到较高浓度顺铂的化疗效果,因此MEUS联合低浓度顺铂有望在保证化疗效果前提下,减少顺铂用量,从而减少药物不良反应,有望临床推广试验。本研究属于体外细胞试验,还需动物、人体试验进一步研究证实。
[1] Koh WJ,Greer B E,Abu-Rustum N R,et al.CervicalCancer,Version 2.2015[J].Journal of the National Comprehensive Cancer Network Jnccn,2015,13(4):395-404.
[2] Torre LA,Bray F,SiegelR L,et al.Globalcancer statistics,2012[J]. CA:a cancer journal for clinicians,2015,65(2):87-108.doi:10. 3322/caac.21262
[3] Kumar L,Gupta S.Integrating Chemotherapy in the Management of Cervical Cancer:A Critical Appraisal[J].Oncology,2016,91 (Suppl1):8-17.doi:10.1159/000447576
[4]Wu J,Pepe J,Rincon M.Sonoporation,anti-cancer drug and antibody delivery using ultrasound[J].Ultrasonics,2006,44(Suppl1): e21-25.doi:10.1016/j.ultras.2006.06.033
[5] Tsai K C,Fang S Y,Yang S J,et al.Time dependency of ultrasound-facilitated gene transfection[J].Journal of Gene Medicine, 2009,11(8):729-736.doi:10.1002/jgm.1347
[6]Woloschak G E,Goertz D E,Todorova M,et al.Antitumor Effects of Combining Docetaxel(Taxotere)with the Antivascular Action ofUltrasound Stimulated Microbubbles[J].PLoS ONE,2012,7(12): e52307.doi:10.1371/journal.pone.0052307
[7] Yu B F,Wu J,Zhang Y,et al.Ultrasound-targeted HSVtk and Timp3 gene delivery for synergistically enhanced antitumor effects in hepatoma[J].Cancer gene therapy,2013,20(5):290-297.doi: 10.1038/cgt.2013.19
[8] Pu C,Chang S,Sun J,et al.Ultrasound-mediated destruction of LHRHa-targeted and paclitaxel-loaded lipid microbubbles for the treatment ofintraperitonealovarian cancer xenografts[J].Molecular pharmaceutics,2014,11(1):49-58.doi:10.1021/mp400523h
[9] Yan F,LiL,Deng Z,et al.Paclitaxel-liposome-microbubble complexes as ultrasound-triggered therapeutic drug delivery carriers [J].Journal of controlled release:official journal of the Controlled Release Society,2013,166(3):246-255.doi:10.1016/j.jconrel.2012. 12.025
[10] Deng Z,Yan F,Jin Q,et al.Reversalofmultidrug resistance phenotype in human breast cancer cells using doxorubicin-liposome-microbubble complexes assisted by ultrasound[J].Journalofcontrolled release:officialjournalofthe Controlled Release Society,2014,174:109-116.doi:10.1016/j.jconrel.2013.11.018
[11]Gottesman MM.Mechanisms ofCancer Drug Resistance[J].AnnualReviewofMedicine,2002,53(1):615-627.
[12] Szakacs G,Paterson J K,Ludwig J A,et al.Targeting multidrug resistance in cancer[J].Nature reviews Drug discovery,2006,5 (3):219-234.
[13] Brayman A A,Coppage M L,Vaidya S,et al.Transient poration and cell surface receptor removal from human lymphocytes in vitro by 1 MHz ultrasound[J].Ultrasound in medicine&biology, 1999,25(6):999-1008.
Ultrasound combined with microbubble contrast agent SonoVue enhances sensitivity of human cervical cancer SiHa cells to cisplatin
HU Bei,XUE Nianyu,MU Qitian,et al.Medical School of Ningbo University,Ningbo 315000,China
Microbubble Cisplatin Cervical cancer Chemotherapy
2 0 1 7-0 5-2 4)
(本文编辑:严玮雯)
d o i:1 0.1 2 0 5 6/j.i s s n.1 0 0 6-2 7 8 5.2 0 1 7.3 9.1 5.2 0 1 7-1 1 9 8
宁波市科技富民惠民项目(2 0 1 5 C 5 0 0 1 1);宁波市医学科技计划项目(2 0 1 3 A 1 0)
3 1 5 0 0 0 宁波大学医学院(胡贝、牟丹);宁波市第一医院超声科(薛念余、张盛敏、许幼峰),血液科(牧启田)
许幼峰,E-m a i l:2 3 7 1 3 3 4 4 1 3@q q.c o m
【 Abstract】 Objective To investigate the effect of ultrasound combined with microbubble contrast agent SonoVue on chemosensitivity of human cervical cancer SiHa cells to cisplatin(DDP). Methods SiHa cells were divided into 4 groups:control group (C),microbubble enhanced ultrasound group (MEUS),low cisplatin concentration group (DDP),and low cisplatin concentration combined microbubble enhanced ultrasound group(MEUS+DDP).The SiHa cells were treated with SonoVue and ultrasound (MI 0.5,4M Hz)in MEUS and MEUS+DDP group.Cell proliferation rate was examined with CCK-8 assay,and the proportion of cell apoptosis was determined with flow cytometry after cells were treated for 24 h. Results There was no significant difference in apoptotic rate between MEUS and control groups(1.019±0.309%vs.0.855±0.427%,P>0.05).The apoptotic rate of the DDP+MEUS group was significantly higher than that of DDP group(8.453±0.265%vs.0.455±0.427%, P<0.001). Conclusion The ultrasound combined with microbubbles can significantly enhance the chemosensitivity of human cervical cancer SiHa cells to cisplatin.
