藏北古露高寒草地生态系统对短期围封的响应
2017-09-01石玉祥张更新斯贵才韩丛海袁艳丽
高 凤,王 斌,石玉祥,张更新,王 建,斯贵才,韩丛海,5,袁艳丽,胡 盎
1 河北工程大学,邯郸 0560382 中国科学院青藏高原研究所,中国科学院高寒生态学与生物多样性重点实验室,北京 1001013 中国科学院水利部成都山地灾害与环境研究所,成都 6100414 中国科学院地质与地球物理研究所兰州油气资源研究中心,兰州 730000 5 中国科学院大学,北京 100049
藏北古露高寒草地生态系统对短期围封的响应
高 凤1,2,王 斌1,*,石玉祥1,张更新2,王 建3,5,斯贵才4,韩丛海2,5,袁艳丽2,胡 盎2
1 河北工程大学,邯郸 0560382 中国科学院青藏高原研究所,中国科学院高寒生态学与生物多样性重点实验室,北京 1001013 中国科学院水利部成都山地灾害与环境研究所,成都 6100414 中国科学院地质与地球物理研究所兰州油气资源研究中心,兰州 730000 5 中国科学院大学,北京 100049
过度放牧导致高寒草地生态系统退化,围封是生态保护和恢复的管理手段。以青藏高原那曲县古露镇过牧退化高寒草地为对象,系统分析了高寒草地生态系统的植被特征及土壤理化特性、土壤酶活性、土壤微生物生物量和群落结构对围封的响应。结果表明,短期围封后,(1)植被平均高度、盖度和地上生物量均有极显著增加(P<0.01),而生物多样性指数则显著降低(P<0.01);(2)土壤的水溶性有机碳含量、土壤物理结构(沙土与粉土的比例)及pH有显著变化(P<0.05);(3)土壤酶活性没有明显改善;(4)土壤微生物生物量(细菌、放线菌、真菌)均呈显著增加(P<0.05);(5)土壤中细菌的多样性有增加的趋势,其群落组成在门水平上也发生了变化;(6)Mantel test分析显示与土壤细菌群落结构的呈正相关性的环境因子主要为土壤有机碳含量(TOC)、总氮含量(TN)、碳磷比(C/P)与氮磷比(N/P)(P<0.05)。这表明围栏封育有利于藏北草地植被、土壤理化特性的恢复,还能维持土壤微生物多样性,促进高寒草地生态系统的可持续发展。
短期围封;高寒草地;生态系统;土壤酶活性;土壤微生物
青藏高原是我国主要的畜牧业基地,面积199.95×104km2,约占我国国土面积的1/5。平均海拔在4000 m以上。其中天然草地面积128.35×104km2,约占全国草地面积的1/3。丰富的天然草地资源,是发展草地畜牧业的物质基础[1]。高寒草甸是青藏高原分布最为广泛,海拔最高的草原植被类型,在维持当地生态系统稳定、生物多样性和当地经济起着重要的作用。
过度放牧一方面会影响草地生态系统地上植被的高度和盖度,另一方面还可导致土壤的理化性质发生改变,土壤微环境被破坏,土壤微生物的数量减少,致高寒草甸出现严重退化,减弱了天然草地作为生态屏障的功能[2-3]。土壤是生态系统的重要组分,其质量情况对构建稳定的生态系统具有举足轻重作用。土壤酶活性大小可表征生化反应的方向和强度,对维持土壤生态系统的稳定起着重要的作用。土壤微生物是土壤有机质的活性部分,既可作为养分的“库”,又可作为养分的“源”,在土壤形成、植物养分转化、污染物降解以及陆地生态系统物质循环和能量流动过程中具有不可替代的作用。土壤微生物参数作为草地生态系统土壤质量变化和草地发育演替的重要指标受到广泛关注,研究土壤微生物对了解土壤肥力、土壤养分有效性以及环境变化具有重要意义[4-5]。围封作为有效的修复退化草地手段,对轻度、中度放牧有一定的修复作用[6]。国内外有关围栏禁牧对土壤微生物和酶活性的影响研究表明,不同的放牧强度对微生物群落结构可产生不同的影响,围栏禁牧和轻度放牧可以有效提高土壤中各微生物群落的生物量,重度放牧明显降低微生物生物量和酶活性[5,7-8];对于草地退化和恢复过程的研究主要集中在植物群落[5]和土壤理化性质[9]方面,有关土壤微生物群落结构的报道偏少。就研究技术而言,某些微生物因培养条件要求较高而导致平板计数等目前常用的微生物数量传统研究方法具有局限性[10]。
为进一步系统探究围栏对藏北草原化生态系统的修复作用,在青藏高原那曲县古露镇过度放牧区设置围栏禁牧,研究围栏对植被与土壤理化、酶活性特征影响,同时结合磷脂脂肪酸(Phospholipid Fatty-Acid Analysis,PLFA)技术、高通量测序技术(16S rDNA High-throughput Sequencing)对土壤微生物的生物量与细菌群落结构变化进行深度解析,从而为退化的高寒草原化生态系统修复提供科学依据。
1 研究区概况与研究方法
1.1 研究区概况
研究地点古露,藏语为“黄羊聚居的山沟”之意,又名“谷露”,位于西藏那曲县,是藏北通往藏中、南的门户,以牧业为主,兼有副业。草场面积6.84万hm2,主要饲养牦牛、绵羊、山羊、马。当地草地载畜量属于严重超载,草地植被类型属于草原化草甸生态系统的范畴,土壤类型为高原草甸土,具有很强的代表性。根据当地气象观测站的气象观测数据,研究区年均温为-3℃,采样前后8月份均温7.8℃[11],年均降水量为411.6 mm。
1.2 样品采集
本试验在那曲县古露镇(30°50′54.23″N,91°37′14.14″E)开展相关研究。在2008年进行围栏禁牧试验,试验小区为3 m×3 m,共设置3个平行小区。
1.2.1 样地设置和植被调查
2011年8月,在植物生长最旺盛的季节,分别在围封样地和放牧样地(对照样地)内,随机设置3个面积为1 m×1 m的小样方,记录样方内的物种组成,然后采用样方法(有100个面积为10 cm×10 cm的网格组成),分别测量植物群落总盖度、物种分盖度、频度、高度等,调查完毕,将样方内植物齐地面剪下,装入牛皮纸袋内,密封保存。
1.2.2 土壤样品的采集
2011年采集围栏内3a的土壤样品,并且采集放牧土壤样品作为对照,每个样点用土钻通过蛇形采集0—15 cm土壤过2 mm筛后混合在一起,各3个重复。采集后至于保温箱中加生物冰袋保存,然后空运回北京实验室进行室内实验分析。
1.3 分析方法
1.3.1 地上植物生物量的测定
将牛皮纸袋内植物,在65℃烘干至恒重后称重并记录。
1.3.2 土壤理化性质的测定
将部分土壤样品风干,参照土壤农化常规分析法[12]测定基本理化性质。称取5 g土壤在105℃烘干12 h达到恒重后,测含水量;按照1∶2.5的水土比测定土壤的pH值;用粒度分析仪测量土壤粒径;土壤有机碳使用日本TOC-TN 分析仪测量;土壤总氮的测定采用凯氏定氮法;土壤总磷测定采用紫外分光光度计。
土壤水溶性物质参照Jones[13]的方法,将2.5 g湿土加入25 mL去离子水,200 r/min搅拌15 min,2500 r/min离心10 min,收集上清液。采用日本TOC-TN 分析仪测定水溶性有机碳和水溶性有机氮;采用离子色谱法测量硝酸根离子、铵根离子和硫酸根离子的含量。
1.3.3 土壤酶的测定
土壤酶活性的测定试根据关松荫[14]的方法来测定。酚氧化酶和过氧化物酶活性采用分光光度法测量:1 g湿土加入10 mL 1%浓度的焦培酸作为底物在30℃条件下混合10 min待测。β-葡萄糖苷酶活性测定:以p-Nitrophenol-β-D-Glucopyranoside(pNPG)作为底物,将1 g湿土加入4 mL 0.05 mol/L缓冲液以及1mL 5 mmol/L的pNPG在37℃条件下水浴1 h。L-天冬酰胺酶活性测定:将5 g土置于50 mL三角瓶中,用0.5 mL甲苯处理15 min后加10 mL 的3%天冬酰胺和10 mL(pH=6.7)磷酸盐缓冲液后置于37℃恒温箱中培养24 h。蔗糖酶活性测定:将1 g湿土加入15 mL的2 mol/L醋酸缓冲溶液,以及15 mL的1.2%蔗糖底物后置于50℃条件下培养3 h。脲酶活性测定:将0.5 g湿土加入2.5 mL的80 mmol/L脲素和20 mL的75 mmol/L硼酸盐缓冲溶液后置于37℃条件下反应2 h。蛋白酶活性测定:将1 g湿土加入5 mL的酪蛋白溶液和5 mL的三异丙基乙磺酰缓冲溶液后置于50℃条件下培养2 h。酸性磷酸酶活性测定:以苯基磷酸盐作为基质,以酚的释放量表示磷酸酶活性。
1.3.4 磷脂脂肪酸的提取和分离
磷脂脂肪酸抽提方法使用调整后的BD方法[15],将5 g冷冻干燥样品加入单一相的氯仿、甲醇和磷酸盐缓冲溶液的混合溶剂(1∶2∶0.8体积比,pH=7.4)抽提2 h,离心在上清液中加入等比例的水和氯仿,静置分层吸取下层有机相。重复此抽提过程两次,并两次抽提得到的有机相混合在一起,分别采用氯仿、丙酮和甲醇冲洗硅酸层析柱得到中性脂、糖脂和磷脂。得到的磷脂部分再通过37℃水浴15 min在碱性条件下水解为磷脂脂肪酸甲酯,加入C19:0作为内标,保存在-20℃条件下,待上机分析。磷脂脂肪酸图谱分析采用美国Agilent 6890 A 型气象色谱仪,包括全自动进样装置、石英毛细管柱及氢火焰检测器。鉴定采用美国MIDI公司(MIDI,Newark,Delaware,USA)开发的基于细菌细胞磷脂脂肪酸成分鉴定的SherlockMIS 4.5 系统(Sherlock Microbial Identification System)。
1.3.5 16s rDNA高通量测序
首先提取基因组DNA:取0.5 g样品,选用FastDNA® SPIN Kit for Soil提取土壤总DNA,经琼脂凝胶电泳定性检测,同时在Nanodrop 2000测定浓度及其纯度,置于-20℃冰箱保存备用。以515F(5‘-GCCAGCMGCCGCGGTAA- 3′)和806R (5‘-CCGGACTACHVGGGTWTCTAAT- 3′)作为引物(带有DNA条形码)扩增16s r RNA基因。PCR扩增条件:预变性94℃、3min,变性94℃、30 s,退火56℃、30 s,延伸温度72℃、45 s,30个循环后在72℃延伸5 min。PCR产物经切胶纯化后,使用 PicoGreen精确定量dsDNA的浓度精确定量,然后根据定量结果,等量混合样品,参照Ion PGMTMTemplate OT2 400 Kit与Ion PGMTMSequencing 400 Kit的操作说明,使用Ion OneTouchTM2、Ion PGMTM平台进行测序,从终端导出数据待分析。
1.4 统计分析
围封与放牧区的植被、理化性质、土壤酶、磷脂脂肪酸的数据整理在Excel中完成,使用SPSS 18.0做单因素方差分析,并在0.05的水平上进行显著性检验,图形绘制在OriginPro 8.5中进行。
植被调查数据整理后,分别计算平均盖度、高度、多样性指数、地上生物量等指标,计算公式如下[16]:
重要值(IV)=(相对频度+相对盖度+相对高度)/3
群落多样性指数采用Shannon-wiener指数:
式中,Pi为种i的重要值,因个体数对草本植物统计较困难,在计算中采用各物种的重要值(IV)替代个体数[17]。
16s rDNA高通量测序数据,由ION Torrent测序终端导出Q>20的数据结果,首先在Linux系统终端利用Perl脚本进行格式转换等标准化处理后,然后上传到Galaxy云端(http://zhoulab5.rccc.ou.edu:8080)进行初步分析,去除短序列、去污染、去掉嵌合体等,其中去掉嵌合体序列使用UCHIME[18],以97%的相似度使用UCLUST划分操作分类单元(Operational Taxonomic Unit,OTU),同时得到各OTU的代表序列与核糖体数据库[19](Ribosomal Database Project,RDP)数据库比对进行系统分类(Classifer)。α多样性采用Chao 1[20]指数评估,Mantel test分析在R 3.2.0(http://cran.r-project.org)中进行。
2 结果与分析
2.1 围封与放牧区植被群落的变化特征
草地植被以矮嵩草(Kobresiahumilis)为建群种,紫花针茅(Stipapurpurea)为优势种,中亚早熟禾为伴生种,兼有其他杂类草。短期(3a)围栏,围封与放牧区的优势种群没有发生变化,而高寒草地植物群落高度和盖度都出现了显著的变化,围栏内的植被平均高度、地上生物量明显高于围封外,差异极显著(P<0.001),而且植被总盖度高于围栏外,存在极显著差异(P<0.01),但围栏内植被的Shannon-wiener指数显著(P<0.01)低于围栏外(表1)。这说明围封修复的方式可以有效促进植被的生长,而放牧则直接影响群落结构。
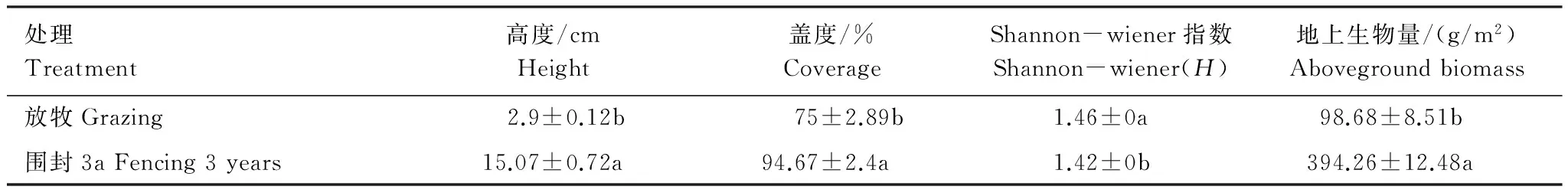
表1 围栏内外植被特征
同列不同小写字母表示不同处理间差异显著(P<0.05)
2.2 围封与放牧区土壤理化性质的变化特征
围封对土壤理化性质有显著影响,主要体现在土壤的pH、水溶性有机碳(Dissolved organic carbon,DOC)方面(表2、表3)。3年后围栏内,土壤pH由6.81显著降低至6.56,土壤水溶性有机碳含量(248.43 mg/kg)显著(P<0.05)高于自由放牧区(193.88 mg/kg);土壤含水量高于围栏外,土壤水含量达到18.69%,而自由放牧的土壤水含量为14.98%,土壤水溶性有机氮含量为14.56 mg/kg高于自由放牧区的12.1 mg/kg; 围栏内土壤总有机碳含量、全碳含量、全磷含量、碳氮含量比略低于围栏外,但均未达到显著水平。围栏内土壤中铵根离子、硝酸根离子的含量略高于围栏外;而且,围栏后土壤粒径也发生了变化,沙土/粉土含量的比值显著降低。由此看出,围封对易提高对土壤易降解有机质的含量,而难降解的有机质在一定范围内有固定作用,草原土壤有机质含量对外界变化的响应有一定的弹性[22-23],因此土壤有机质的含量没有显著变化。

表2 围栏内外土壤有机元素变化特征
同列不同小写字母表示不同处理间差异显著(P<0.05)
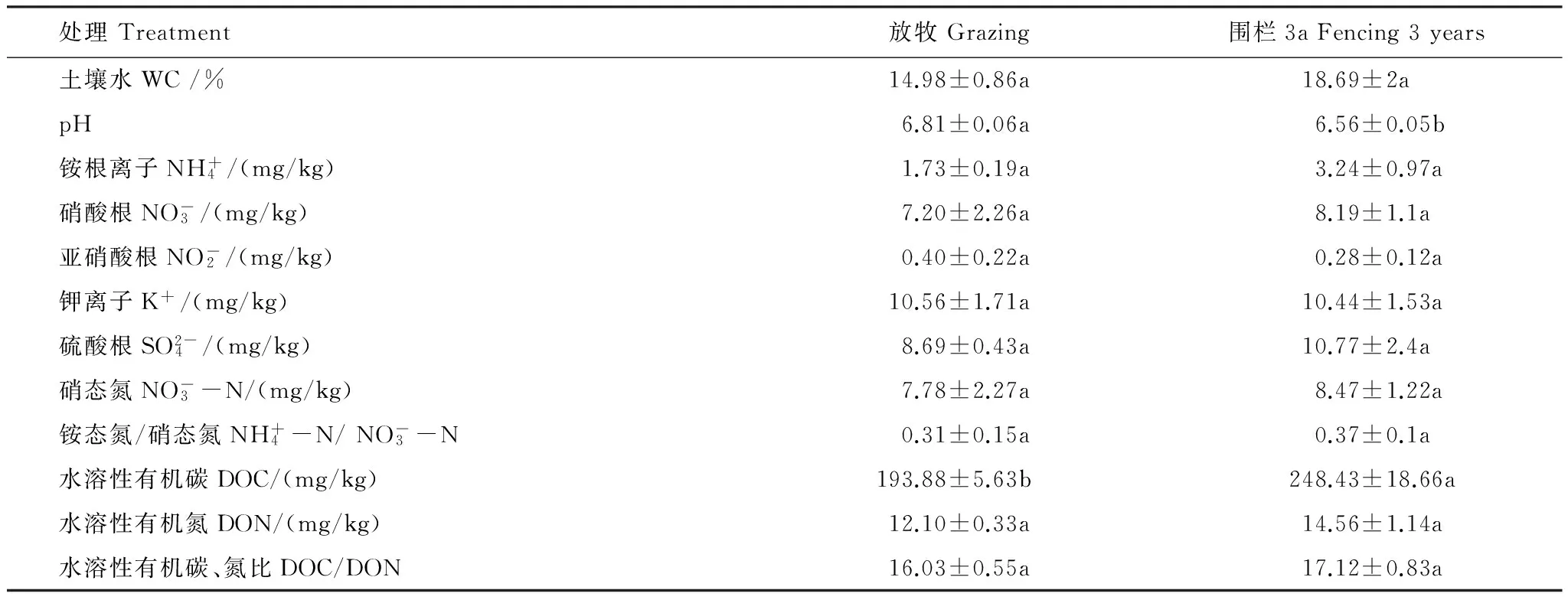
表3 围栏内外土壤水溶性物质基本理化特性
同行不同小写字母表示不同处理间差异显著(P<0.05)
2.3 围封与放牧区土壤酶活性的变化特征
从围栏内与自由放牧区的8种土壤酶活性的测定结果(表4)可以看出,土壤酶的活性均有所变化,但均未达到显著水平(P>0.05)。围栏内的蔗糖酶、葡萄糖苷酶、酚氧化酶、过氧化物酶、蛋白酶的含量均高于围栏外。反之,L-天冬氨酸酶、脲酶、碱性磷酸酯酶的含量围栏内低于围栏外。
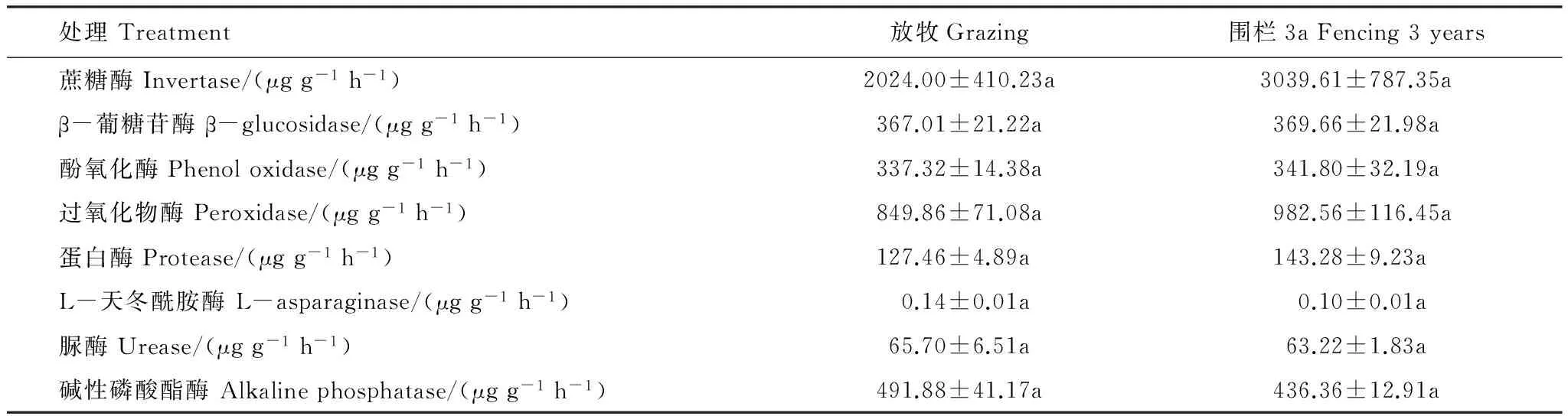
表4 围栏内外土壤酶活性变化特征
同行不同小写字母表示不同处理间差异显著(P<0.05)
2.4 围封与放牧区土壤微生物生物量的变化特征
磷脂脂肪酸分析(PLFA)技术,可以全面分析土壤微生物的生物量[24-25]。其结果(表5)表明,围栏内土壤细菌(i14:0、i15:0、a15:0、C15:1、i16:0、16:1ω5、16:1ω9、16:1ω7t、17:0、i17:0、a17:0、cy17:0、18:1ω5、18:1ω7t、i19:0、a19:0、cy19:0)生物量、放线菌(10Me16:0、Me17:0、10Mel18:0)生物量、革兰氏阳性菌(i14:0、i15:0、a15:0、i16:0、i17:0、a17:0、i19:0、10Me16:0、10Me17:0、10Me18:0)生物量和革兰氏阴性菌(cy17:0、cy19:0、15:1、16:1ω9、16:1ω7、16:1ω5、18:1ω7、19:1)生物量显著高于围栏外(P<0.05)。但真菌(18:1ω9、18:2ω6)生物量与自由放牧区均无显著差异(P>0.05)。
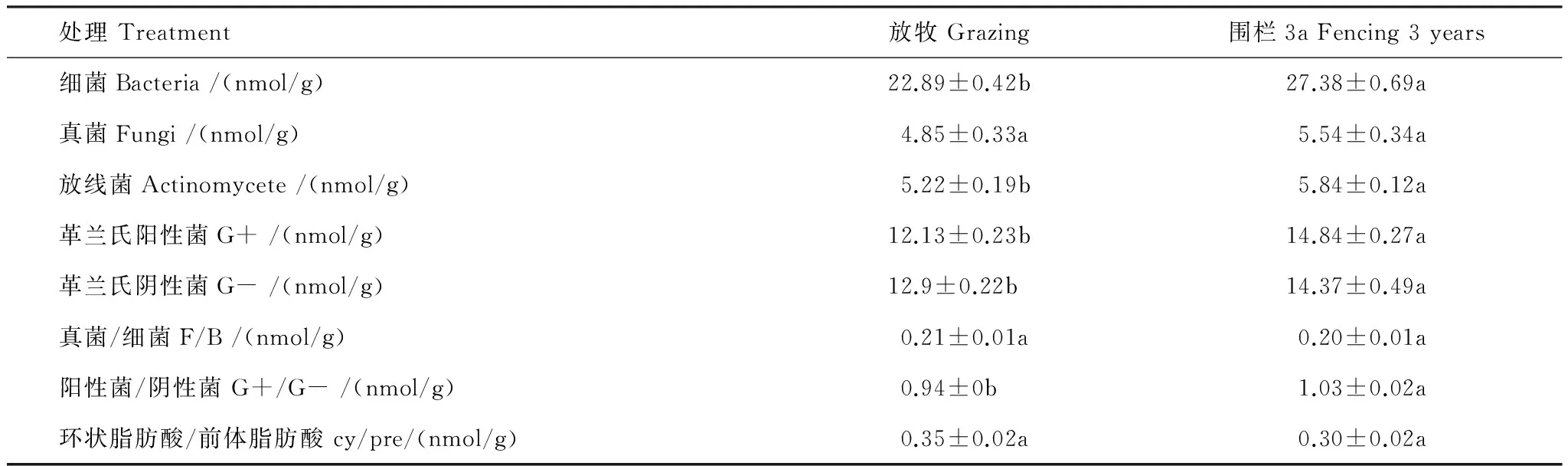
表5 围栏内外土壤微生物生物量变化特征
G+:革兰氏阳性菌Gram-positive bacteria;G-:革兰氏阴性菌Gram-negative bacteria;G+/G-:革兰氏阳性菌/革兰氏阴性菌Gram-positive bacteria /Gram-negative bacteria.;F/B:真菌/细菌 Fungi /Bacteria;cy/pre:环状脂肪酸/前体cyclopropyl/ precursors;同行不同小写字母表示不同处理间差异显著(P<0.05)
2.5 围封与放牧区土壤中细菌群落结构的变化特征
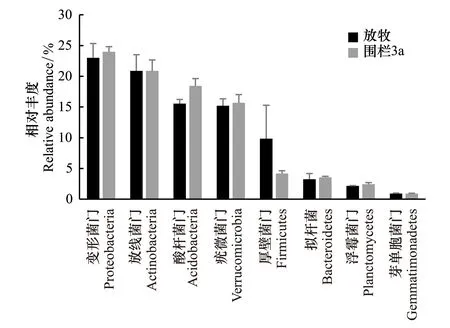
图1 围栏内外细菌在门水平上的主要群落结构特征 Fig.1 Relative abundance of the dominant bacterial phyla between grazing and fencing. Relative abundances are based on the proportional frequencies of those DNA sequences that could be classified at the phylum level
测序数据质控后共得到563617条细菌的纯净序列,从门(phylum)水平上看(图1),土壤中变形菌门、放线菌门、酸杆菌门、疣微菌门占主导位置,围栏内土壤中变形菌门、放线菌门、酸杆菌门、疣微菌门所占比例分别为24.01%、20.87%、18.43%、15.70%,围栏外土壤中变形菌门、放线菌门、酸杆菌门、疣微菌门所占比例分别为22.99%、20.88%、15.56%、15.20%。其中(图1)围栏内土壤变形菌门、放线菌门、酸杆菌门、疣微菌门、拟杆菌、浮霉菌门、芽单胞菌门所占比例均明显高于放牧区(P>0.05),而围栏外放牧区厚壁菌门所占比例高于围栏内(P>0.05)。通过Chao1值来估计物种总数[26],围栏内土壤微生物的Chao1(136311.41)高于围栏外(130616.82),由此看出,围栏内土壤细菌的多样性高于放牧区,但未达显著水平(P>0.05)。
2.6 细菌群落结构与环境因子之间的关系
通过Mantel test 分析土壤细菌群落结构与土壤理化性质之间的相关性,主要体现在土壤有机碳含量、总氮含量、碳磷比与氮磷比,呈显著正相关的关系(表6)。

表6 土壤细菌的群落结构与环境因子之间的关系
3 讨论
3.1 围封与放牧区植被群落的变化特征
围栏封育作为修复退化草地的有效手段被广泛采用,并形成良好的生态效益,主要表现在围栏封育可明显提高草地群落的地上生物量,草地植被的高度和盖度增加[27-28],有效控制草地的沙化程度、土壤的养分流失[29-30]。本研究表明,短期(3a)围栏封育后,高寒草地植被群落高度、盖度、生物量均显著增加,说明围封对植被生长有显著修复效果,对草地生产力有促进作用。然而,Shannon-Wiener指数显著降低,说明了放牧对于植物生物多样性有促进作用。有研究表明,由于受海拔、气候和植被组成等因素影响,高寒荒漠植被群落盖度和高度对围栏封育响应较快,而高寒草原和高寒草甸群落盖度和高度对围封响应相对较为缓慢,而在这3类高寒草地生态系统中地上生物量对围栏封育均响应较快[6]。长期围栏一定程度上会降低草地群落的物种多样性,而短期围栏封育对退化高寒草原植被群落多样性影响不显著,生产力显著提高,这可能是在围封前退化高寒草地处于过度放牧的状态,草地植被长期被践踏,生长发育受到抑制,降低了优势种的优势度,为非优势物种拓宽了生存空间,物种在种类数量结构上发生变化。
3.2 围封与放牧区土壤理化性质的变化特征
放牧是草地利用的主要方式之一,家畜通过采食、践踏和排泄3种主要途径影响草地的土壤健康状况[31]。放牧主要影响表层土壤物理特性及其化学元素成分,进而影响土壤养分的动态循环[9]。土壤有机质(主要指碳素)是陆地生物圈生物地球化学循环的主要成分之一,指示土壤健康,而可溶性有机质是土壤有机库中最活跃的部分,能最敏感的反映土壤有机质的变化。 本研究中围栏内土壤相对放牧来说,有机碳含量略高于围栏外,并未达到显著水平(P>0.05)、而水溶性有机碳含量高于围栏外,已经发生了显著变化(P<0.05)。这是由于在生态环境相对脆弱的半干旱地区,土壤本身有机质含量较低,放牧后打破了土壤的低缓冲性能,导致了土壤有机质降低。而围栏封育区在无牲畜干扰的情况下,得到了恢复。而土壤pH有显著变化(P<0.05),酸性增强,同时土壤物理结构(沙土与粉土比例)有显著变化(P<0.05),土壤总、氮磷含量围栏外高于围栏内,这是由于围栏外作为自由放牧区,牲畜频繁采食,导致排放的粪便输出增加,土壤全氮、全磷长时间累积导致的结果。而Yanfen W等[32]研究发现,放牧对土壤有机质没有影响,Frank等[33]研究表明围栏与适牧样地相比有一定的土壤有机质略有增加。Romulo等[34]发现放牧对全氮含量没有显著影响,长期适度放牧有利于提高氮的循环速率和可利用率。在以往的研究中放牧对土壤物理和化学性质的影响并没有单一和一致的结论,尤其体现在化学性质上,这可能是因为草原土壤系统具有滞后性和容量性 (弹性)[23],而且气候、地形、土壤性质、植物组成、放牧动物类型、放牧历史等因素对土壤化学性质有重要的影响。
3.3 围封与放牧区土壤酶的变化特征
土壤酶作为有机质分解过程的生物催化剂,主要源于土壤微生物、植物根系及动植物残体腐解过程,是评价土壤生产力与生物活性的重要生物指标。其中细菌、真菌、湿地物种的植物根系都能够合成土壤酶并释放到细胞外,土壤中的游离酶的活性非常稳定,在1a或更多时间内不失去活性。蔗糖酶、葡萄糖苷酶、酚氧化酶、过氧化物酶与碳循环密切相关,L-天冬氨酸酶、蛋白酶、脲酶与氮循环功能相关,而碱性磷酸酯酶与磷循环密切相关,土壤酶在生态系统物质循环中起着重要的作用。本试验证实,脲酶与碱性磷酸酶,L-天冬氨酸酶的活性表现为围栏外略高于高于围栏内,其原因尚不清楚需进一步研究,其他5种酶的活性均是围栏内高于围栏外,围封后,表层凋落物增多,使土壤肥力得到改善,但有些变化不明显,可能是由于围栏期限较短,表层有机质积累较少,代谢活跃性较低。
3.4 围封与放牧区土壤微生物生物量及群落结构的变化特征
在高寒草地生态系统中,土壤微生物及其生物量在土壤形成和演化过程中起介导作用,土壤微生物群落组成及其生物量等成为评价土壤健康的生物指标,以此来评价退化土壤生态系统的恢复过程已经成为国内外的热点研究对象。土壤具有比陆地上任何其他生态系统都要丰富且了解甚少的生物多样性,这是导致其群落结构和生态功能难以被预测的原因之一。磷脂脂肪酸分析(PLFA)技术常被用于研究复杂群落中微生物的多样性,磷脂是所有活细胞细胞膜的基本组成,具有多样性和生物学特异性,可用于土壤微生物群落结构的研究,结合16S rDNA高通量测序技术,对细菌的群落结构进行深入探究。PLFA试验结果表明,微生物的总生物量在围栏后显著增加。细菌与真菌的生物量围栏内显著高于围栏外(P<0.05),真菌与细菌的比值以及环状脂肪酸与前体脂肪酸的比值,围栏内略低于围栏外,没有显著变化(P>0.05)。说明在短期(3a)围栏的时间内,青藏高原该地区的环境压力较小,自由放牧区放牧量有一定的随机性,还未引起土壤微生物结构的显著改变。退化草地的修复是一个漫长的过程,在短时间内难以完全恢复。由16S rDNA测序的结果显示,围封后土壤细菌多样性(Chao1)及在门水平上的优势物种相对丰度均有所增加,但其并未达到显著水平。Mantel test结果显示,影响细菌群落结构的主要环境因子是土壤的固相有机元素含量。其中有机元素的含量相对水溶性元素变化周转较为缓慢,围封年限较短,还未发生显著变化。土壤微生物是生物地球化学循环的执行者,通过其代谢及微生物间相互作用进行着物质转化和元素循环[35]。
4 结论
过度放牧能破坏植被-土壤-微生物系统稳定性,围栏封育可以修复退化草地。本试验证实,围封后植被高度、盖度均有显著变化,土壤的理化性质(土壤水、pH、水溶性有机碳氮含量等)有所改善,土壤微生物的生物量有显著增加。进一步分析结果显示,细菌的群落结构与土壤有机元素的含量与组成(TOC、TN、C/P、N/P)呈显著正相关。这表明,围栏封育对与藏北退化草地有显著的修复效果,土壤微生物的生活环境已发生显著变化。因此,围栏封育虽对藏北退化草地生态系统有一定的修复作用,但为了保证其达到更好的平衡状态,可适当延长围栏年限,促进退化草地生态系统的完全修复。
[1] 兰玉蓉. 青藏高原高寒草甸草地退化现状及治理对策. 青海草业, 2004, 13(1): 27- 30.
[2] 林斌. 当雄高寒草甸草原土壤生物学特性对不同放牧措施的响应[D]. 合肥: 中国科学技术大学, 2013.
[3] 高英志, 韩兴国, 汪诗平. 放牧对草原土壤的影响. 生态学报, 2004, 24(4): 790- 797.
[4] Doran J W, Parkin T B, Jones A. Quantitative indicators of soil quality: a minimum data set//Doran J W, Jones A J eds. Methods for Assessing Soil Quality. Madison, Wisconsin, USA: SSSA Inc., 1996: 25- 37.
[5] 朱炜歆. 青藏高原东缘草地类型、 放牧干扰对土壤微生物的影响[D]. 兰州大学, 2012.
[6] 赵景学, 祁彪, 多吉顿珠, 尚占环. 短期围栏封育对藏北3类退化高寒草地群落特征的影响. 草业科学, 2011, 28(1): 59- 62.
[7] 赵吉. 不同放牧率对冷蒿小禾草草原土壤微生物数量和生物量的影响. 草地学报, 1999, 7(3): 223- 227.
[8] Holt J A. Grazing pressure and soil carbon, microbial biomass and enzyme activities in semi-arid northeastern Australia. Applied Soil Ecology, 1997, 5(2): 143- 149.
[9] 张成霞, 南志标. 放牧对草地土壤理化特性影响的研究进展. 草业学报, 2010, 19(4): 204- 211.
[10] 曹淑宝, 王立群. 放牧对草原土壤微生物影响研究进展. 中国农学通报, 2011, 27(29): 271- 275.
[11] 王喜明. 碳、氮添加对藏北高寒草甸土壤碳、 氮矿化及氮素转化速率的影响[D]. 兰州: 兰州大学, 2014.
[12] 鲍士旦. 土壤农化分析. 北京: 农业出版社, 1987.
[13] Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen (DON) and dissolved organic carbon (DOC) in soil. Soil Biology and Biochemistry, 2006, 38(5): 991- 999.
[14] 关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986.
[15] White D C, Davis W M, Nickels J S, King J D, Bobbie R J. Determination of the sedimentary microbial biomass by extractible lipid phosphate. Oecologia, 1979, 40(1): 51- 62.
[16] 干珠扎布, 段敏杰, 郭亚奇, 张伟娜, 梁艳, 高清竹, 旦久罗布, 白玛玉珍, 西绕卓玛. 喷灌对藏北高寒草地生产力和物种多样性的影响. 生态学报, 2015, 35(22): 7485- 7493.
[17] Peet R K. The measurement of species diversity. Annual Review of Ecology and Systematics, 1974, 5(5): 285- 307.
[18] Edgar R C, Haas B J, Clemente J C, Quince C, Knight R. UCHIME improves sensitivity and speed of chimera detection. Bioinformatics, 2011, 27(16): 2194- 2200.
[19] Wang Q, Garrity G M, Tiedje J M, Cole J R. Naïve Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Applied and Environmental Microbiology, 2007, 73(16): 5261- 5267.
[20] Hughes J B, Hellmann J J, Ricketts T H, Bohannan B J M. Counting the uncountable: statistical approaches to estimating microbial diversity. Applied and Environmental Microbiology, 2001, 67(10): 4399- 4406.
[21] Zhou J Z, Wu L Y, Deng Y, Zhi X Y, Jiang Y H, Tu Q C, Xie J P, Van Nostrand J D, He Z L, Yang Y F. Reproducibility and quantitation of amplicon sequencing-based detection. The ISME Journal, 2011, 5(8): 1303- 1313.
[22] Fox J F. Intermediate disturbance hypothesis. Science (New York, NY), 1979, 204(4399):1344- 1345.
[23] Milchunas D G, Lauenroth W K. Quantitative effects of grazing on vegetation and soils over a global range of environments. Ecological Monographs, 1993, 63(4): 327- 366.
[24] Frostegård Å, Tunlid A, Bååth E. Phospholipid fatty acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals. Applied and Environmental Microbiology, 1993, 59(11): 3605- 3617.
[25] 吴愉萍. 基于磷脂脂肪酸(PLFA)分析技术的土壤微生物群落结构多样性的研究[D]. 杭州: 浙江大学, 2009.
[26] Chao A. Nonparametric estimation of the number of classes in a population. Scandinavian Journal of Statistics, 1984, 11(4): 265- 270.
[27] 范燕敏, 孙宗玖, 武红旗, 刘秀梅. 封育对山地草地植被及土壤特性的影响. 草业科学, 2009, 26(3): 79- 82.
[28] 李媛媛, 董世魁, 李小艳, 温璐. 围栏封育对黄河源区退化高寒草地植被组成及生物量的影响. 草地学报, 2012, 20(2): 275- 279.
[29] 王蕙, 王辉, 黄蓉, 马维伟. 不同封育管理对沙质草地土壤与植被特征的影响. 草业学报, 2012, 21(6): 15- 22.
[30] 肖力宏, 宝音陶格涛, 刘海林. 草地退化的原因及退化草地改良的研究. 科学管理研究, 2004, 22(2): 27- 29.
[31] 侯扶江, 常生华, 于应文, 林慧龙. 放牧家畜的践踏作用研究评述. 生态学报, 2004, 24(4): 784- 789.
[32] Wang Y F, Chen Z H, Tieszen L T. Distribution of soil organic carbon in the major grasslands of Xilinguole, Inner Mongolia, China. Acta Phytoecologica Sinica, 1998, 22(6): 545- 551.
[33] Frank A B, Tanaka D L, Hofmann L, Follett R F. Soil carbon and nitrogen of Northern Great Plains grasslands as influenced by long-term grazing. Journal of Range Management, 1995, 48(5): 470- 474.
[34] Menezes R S C, Elliott E T, Valentine D W, Williams S A. Carbon and nitrogen dynamics in elk winter ranges. Journal of Range Management, 2001, 54(4): 400- 408.
[35] Yu Q, Chen Q S, Elser J J, He N P, Wu H H, Zhang G M, Wu J G, Bai Y F, Han X G. Linking stoichiometric homoeostasis with ecosystem structure, functioning and stability. Ecology Letters, 2010, 13(11): 1390- 1399.
The response of alpine grasslands ecosystem in the north Tibet to short-term enclosure
GAO Feng1,2, WANG Bin1,*, SHI Yuxiang1, ZHANG Gengxin2,WANG Jian3,5, SI Guicai4, HAN Conghai2,5, YUAN Yanli2, HU Ang2
1 Hebei University of Engineering, Handan 056038, China2 Key Laboratory of Alpine Ecology and Biodiversity (LAEB),Institute of Tibetan Plateau Research, Chinese Academy of Sciences, Beijing 100101, China 3 Institute of Mountain Hazards and Environment, Chinese Academy of Sciences, Chengdu 610041, China 4 Lanzhou Institute of Geology, Chinese Academy of Sciences, Lanzhou 730000, China5 University of Chinese Academy of Sciences, Beijing 100049, China
Alpine grasslands, an important terrestrial ecosystem, play an essential role in global carbon and nitrogen cycles. Recently, overgrazing in alpine grasslands, particularly on the Tibetan Plateau, a sensitive district subject to climate change, is a serious issue leading to their degradation and degeneration, Fencing to exclude grazers has become an important management practice to protect and re-establish the degraded grasslands on the TP. Previous studies on the alpine grassland ecosystem have focused on a certain aspect. However, a systematic study has largely been lacking. The current research was focused on the severely degraded alpine grassland in Gulu Town, Naqu County, located in the north of TP. In order to determine the effect of restoration, we studied the short-term (three-year) effects of fencing on the vegetation characteristics, soil physicochemical properties, soil enzyme activities, soil microbial biomass, and soil microbial communities, and compared them with areas where grazing was allowed. Soil enzyme activity was detected using an UV spectrophotometer. Microbial biomass was measured by phospholipid-derived fatty-acid analysis (PLFA) method. Furthermore, we also studied profiling of complex soil bacterial communities based on 16S ribosomal RNA gene (rDNA) sequences by means of Next Generation Sequencing (NGS) technologies at the Ion Personal Genome Machine (PGM) platform. After fencing for three years, the alpine grassland ecosystem differed noticeably between the fencing and grazing areas across the study sites. Our study showed that: (1) The total plant cover, average vegetation height, and aboveground biomass of vegetation determined during the above ground vegetation surveys were significantly higher in fenced areas than the areas where grazing was permitted (P<0.01). However, the diversity of vegetation (Shannon-Weiner index) in the fenced area was significantly lower than that in grazing sites (P<0.01). (2) Soil pH perceptibly decreased while the dissolved organic carbon in soil was increased after fencing. Soil structure, in terms of the ratio of sand to silt was also affected with fencing (P<0.05). (3) Soil enzyme activities were not influenced by fencing. (4) Soil microbial biomass (Bacteria, Actinomycetes, and Fungi) significantly increased in the fencing area(P<0.05). (5) There was an increasing tendency in the diversity of bacteria in soil, and the community composition of bacteria was changed at the phylum level, but there was no significant difference after fencing. (6) Further, the Mantel′s test suggested that the major environmental factor,soil organic matter such as total organic carbon (TOC), total nitrogen (TN), carbon to phosphorus ratio(C/P), and nitrogen to phosphorus ratio(N/P)were affecting microbial community in the fenced sites. From these results, it can be inferred that, in the grasslands ecosystem, soil sub-system was steadier than plant community sub-system. In soil sub-system, soil microbial communities were less susceptible than soil profile characteristics in fenced grasslands. In conclusions, fencing was a valid method in reconstructing aboveground biomass in the alpine grassland on TP, thereby inducing a number of changes in the soil microbial community, including the composition and diversity of microorganisms. In future, more destroyed grassland should be fenced in order to preserve the balance of the ecosystem and to resist the effects of global climate change. More studies were needed to be conducted over longer periods of fencing to further our understanding of the effects on fencing on restoration of alpine grasslands.
short-term enclosure; alpine grasslands; ecological system; soil enzyme activities; soil microorganism
国家重点基础研究发展计划(973计划)专题项目(2013CB956002);国家自然科学基金(41471055,41201236)
2016- 02- 04; 网络出版日期:2017- 02- 23
10.5846/stxb201602040259
*通讯作者Corresponding author.E-mail: hdwangbin@126.com
高凤,王斌,石玉祥,张更新,王建,斯贵才,韩丛海,袁艳丽,胡盎.藏北古露高寒草地生态系统对短期围封的响应.生态学报,2017,37(13):4366- 4374.
Gao F, Wang B, Shi Y X, Zhang G X,Wang J, Si G C, Han C H, Yuan Y L, Hu A.The response of alpine grasslands ecosystem in the north Tibet to short-term enclosure.Acta Ecologica Sinica,2017,37(13):4366- 4374.
