内生真菌对氮添加羽茅根际土壤特性和微生物群落的影响
2017-09-01李隔萍任安芝高玉葆
李隔萍, 高 远, 刘 磊, 李 夏, 任安芝, 高玉葆
南开大学生命科学学院,天津 300071
内生真菌对氮添加羽茅根际土壤特性和微生物群落的影响
李隔萍, 高 远, 刘 磊, 李 夏, 任安芝*, 高玉葆
南开大学生命科学学院,天津 300071
内生真菌不仅能改变与其共生植物的生理和生长指标,还可通过宿主植物间接对土壤的理化性质和微生物群落结构产生影响。以天然禾草——羽茅(Achnatherumsibiricum)为研究材料,探究在不同施氮水平下,内生真菌的种类对不同基因型的宿主植物根际土壤理化性质和微生物群落产生何种影响。结果表明,内生真菌侵染显著提高了羽茅根际土壤的pH值和微生物总量,但降低了土壤中真菌与细菌的比值。同时,土壤的pH值还受到了内生真菌种类的影响,其中感染Epichlo⊇sibirica的羽茅根际土壤pH显著高于感染Epichlo⊇gansuense- 1的羽茅,而感染Epichlo⊇gansuense- 2的羽茅根际土壤pH与感染E.gansuensis- 1、E.sibirica菌的羽茅相比没有显著差异。另外,内生真菌感染与否、内生真菌种类、施氮量以及宿主植物基因型对土壤总碳、总氮、微生物及碳矿化能力均无显著影响。
内生真菌;土壤pH;土壤微生物;碳矿化
内生真菌(endophytic fungi)指的是分布在活体植物组织内,不引起植物明显病害症状的拥有不同生活策略的真菌[1-2]。内生真菌的宿主范围十分广泛,涉及多种植物类群[3]。目前为止,研究者已经在包含80个属近300种禾草中观察到内生真菌的存在[4]。内生真菌感染不仅影响宿主植物的生长和抗逆性[5- 9],而且能够影响宿主植物的化学组成。已有研究表明,内生真菌感染不仅能使植物产生生物碱[10],还能影响植物体内酚类和抗氧化活性物质的含量[11],改变宿主氨基酸、水溶性碳水化合物、脂质、有机酸和绿原酸等代谢物含量[12-13]。由内生真菌导致宿主化学组成的变化不仅能影响凋落物的分解[14],并且这些物质可能通过降雨、淋溶等环境因素进入到土壤中[15],进一步对土壤理化性质及微生物群落结构产生影响。此外,内生真菌还可能通过改变宿主禾草根系分泌物(主要包括糖类、酚类、脂类、羧酸类)的组成和含量[16],改变土壤中有机物的输入,进而影响土壤碳(C)、氮(N)含量及土壤微生物群落结构和功能[17]。土壤条件的改变对后期凋落物分解、种子发芽及幼苗生长[18]具有十分重要的影响。
目前,关于内生真菌影响植物生境土壤的研究主要集中在以高羊茅(Loliumarundinaceum)和黑麦草(Loliumperenne)为材料的人工草地上。Franzluebbers等经过长达15年的研究,发现染菌(E+)高羊茅比不染菌(E-)高羊茅样地土壤具有更高的有机C和总N含量[19]。以相同的材料和方法,研究者还发现在较长时期(10a)和较短时期(3a),内生真菌侵染均显著增加了高羊茅生境中土壤有机C和总N的积累,同时还降低了土壤呼吸速率和土壤微生物生物量[20]。以黑麦草为研究对象的盆栽试验结果表明,经过一个生长季的时间,内生真菌没有改变土壤C和N的含量,但显著改变了土壤微生物群落组成和功能,主要表现在增加了土壤真菌活性[21]。
相比人工禾草,天然禾草与内生真菌的共生关系更为复杂多变。经过长期的定向选育,一种栽培禾草中通常只存在1种内生真菌,而在天然禾草中,同种宿主禾草往往感染多种内生真菌[22-24]。不同的内生真菌对宿主生物碱、氨基酸、酚类等物质的影响程度也不尽相同[11, 25]。此外,内生真菌和宿主植物之间的相互作用不仅受内生真菌种类的影响,还可能与宿主植物基因型[26]以及土壤N素的供给[27]有关。那么内生真菌感染对天然禾草土壤生境是否有影响?如果有,这种影响是否会随内生真菌种类的不同而不同呢?本文以天然禾草羽茅(Achnatherumsibiricum)为实验材料,同时考虑内生真菌种类、宿主羽茅基因型及共生体的N素供应3个因子,通过比较研究不同处理条件下羽茅生境土壤理化性质及土壤微生物群落的差异,探讨内生真菌感染对其天然禾草宿主生境的影响。
1 材料和方法
1.1 实验材料
本研究以禾本科植物——羽茅(Achnatherumsibiricum)为研究材料。羽茅为芨芨草属(Achnatherum)多年生植物,主要分布于我国东北、华北和西北等地区。不同地理种群的羽茅的内生真菌感染率接近100%[28]。实验所用羽茅种子采自中国农业科学院呼伦贝尔草原生态系统国家野外科学观测研究站(119.67°E, 49.10°N),采集间隔大于5 m。考虑到羽茅为异花授粉植物,本文将采自同一穗的种子作为一个母本植物基因型,然后对来自200个不同母本基因型的羽茅种子的内生真菌进行分离纯化,通过形态学和系统发育学分析相结合的方法,鉴定出2种Epichlo⊇属的内生真菌:Epichlo⊇sibirica(Es)和Epichlo⊇gansuense(Eg)。其中,E.gansuense存在两种不同传播方式:E.gansuensis- 1 (Eg1)在PDA培养基上生长较慢,通过种子垂直传播,E.gansuensis- 2 (Eg2)在PDA培养基上生长较快,传播方式为混合传播。
本实验选取9个不同植物母本基因型的羽茅作为实验材料:其中3个基因型的羽茅种子感染Eg1,3个基因型的羽茅种子感染Es,3个基因型的羽茅种子感染Eg2。将感染不同内生真菌的9个植物母本基因型羽茅的种子分为两份,一份置于4℃冰箱保存,另一份在60℃下高温处理30 d,以获得不染菌种子[29]。取饱满的9个母本基因型的染菌(E+)和不染菌(E-)羽茅种子,分别播种于口径为280 mm、深度为220 mm的白色塑料盆,置于南开大学网室遮雨棚下培养。待植株生长1个月后,选择大小一致且生长良好的幼苗,每盆定株到6株用于实验。实验设置2个N素施加浓度,分为低N (NL)和高N (NH) 2个处理水平。所有处理分别设置3个重复,共计108盆。实验用土为沙质土壤,总N含量为0.12 g/kg、全磷含量为0.186 g/kg、有机质含量为4.79 g/kg、pH为8.12。根据内蒙古草原羽茅自然分布区土壤N素含量的低限和高限设置施N量,使用CaCl2和KCl分别替代Hoagland营养液中的Ca(NO3)2和KNO3,通过控制添加NH4NO3的量来控制N素浓度:高N,每周浇灌1—2次Hoagland营养液,每次800 mL/盆,N素添加浓度为140 mg N/L,共施加15次;低N,每周浇灌1—2次Hoagland营养液,每次800 mL/盆,N素添加浓度为14 mg N/L,共施加15次。
实验持续时间为85 d,每2周随机调换花盆的位置,以消除位置效应,并及时清理羽茅植株上的枯叶,以排除枯落物的影响。实验收获时从每盆取植物根围土壤1 L。将各盆中所取土样混合均匀后过1 mm筛子,分为两部分,一部分放入-20℃冰冻保存,用于测土壤C矿化率和土壤微生物群落结构变化,另一部分风干,供测定土壤pH值及C、N含量。
1.2 土壤理化性质的测定
土壤C、N含量用元素分析仪(Vario EL/micro cube, Elementar, Hanau, Germany)进行测定。土壤pH值用Sartorius pH计测定(土壤∶水=1∶5)。
1.3 土壤微生物群落结构
采用磷脂脂肪酸(phospholipid fatty acid, PLFA)温和甲酯化法[30]测定土壤PLFA。样品处理如下:从-20℃冰箱取出土样置于常温下,称取6g解冻后的土壤置于5ml离心管中,向离心管中加入15 mL 0.2 mol/L醇化的KOH溶液,振荡均匀后,置于37℃下反应1 h,期间每隔10 min涡旋1次。然后加入3 mL浓度为1 mol/L的冰醋酸和10 mL正己烷。离心10 min,将上层的有机相转移到试管中,氮气下吹干,再向试管中加入480 μL 体积比为1∶1的正己烷:甲基叔丁基醚溶液。将试管中溶液倒入装有20 μL C19内标物的GC衍生瓶中,放入气质联用色谱分析仪(Agilent 7890GC 5975MSD)中分析。
磷脂脂肪酸含量计算公式为:
PLFA(nm/g土样)=(PPLFA×S×V)/(POSTD×D×R×W×M)
式中,PPLFA为样品峰面积; POSTD为内标物峰值面积;S为内标标准物质的浓度,1mg/mL;D为稀释倍数,25;R为分取倍数,1/500;V为样品的测定体积,1μL;W为土壤烘干质量(g)。
1.4 土壤C矿化的测定
土壤C矿化能力采用室内培养、碱液吸收法[31]进行测定。称取30 g(风干质量)的新鲜土样,加水调节土壤至相同含水量30%。将土壤置于250 mL广口瓶,再向瓶中放入一个盛有10 mL 0.1 mol/L NaOH溶液的小烧杯,并用保鲜膜密封好。另外设置3个不放土壤、装有NaOH溶液的空白瓶。一同放入(25±1)℃培养箱中恒温培养。分别在培养的第2、4、6、9、13、17、22、30天取出烧杯,将碱液完全倒入50 mL三角瓶中,加入过量的1 mol/L BaCl2溶液及酚酞指示剂,用0.1 mol/L HCl滴定剩余的NaOH溶液,记录所用HCl的体积。
C矿化速率的计算公式为:
当前,高职院校护理专业的信息化教学资源与医院实际护理信息系统存在脱节的情况,即护理专业学生在院校学习过程中很难接触到实际工作中需要用到的信息系统,这也就使得护理专业学生在进入医院进行护理实习时,需要进行二次培训,无形中增加了培训成本。为了避免这一问题的出现,增强护理专业学生的护理专业能力,在教育信息化背景下,要求护理专业教学加强与医院的合作,积极开设第二课堂,改变以往护理专业校内教学与医院护理岗位实习相脱离的教学现状。
C=(V0-V) ×CHCl/2×44×12/44×1/m(1-30%)t
式中,C表示培养期间土壤的C矿化速率(mg g-1d-1),V0表示空白对照所消耗的HCl体积(mL),V为样品滴定时所消耗的HCl体积(mL),CHCl为HCl浓度(mol/L),m为每个广口瓶中培养土壤的湿重(g),t为培养天数(d)。
1.5 数据分析
使用SPSS 16.0和SYSTAT 13对数据进行多因素方差(ANCOVA)分析,以探究内生真菌感染与否、N素添加及植物母本基因型对羽茅根际土壤指标的影响,其中植物母本基因型嵌套在不同的内生真菌中。采用SPSS 21.0对染菌羽茅根际的土壤数据进行多因素方差分析,以探究内生真菌种类和N素添加对土壤的影响。ANOVA分析前,数据均满足方差齐性要求,然后应用Tukey HSD检验法对各土壤指标进行多重比较,3种内生真菌处理之间的土壤pH比较除外(LSD)。数据处理和作图采用Microsoft Excel 2010进行。
2 结果
2.1 土壤的C、N含量和土壤C矿化
内生真菌感染与否、N素及植物基因型对土壤总C含量、总N含量、C/N比值以及累计C矿化量均未产生显著影响。感染Eg1、Eg2和Es的羽茅之间的根际土壤中C、N的含量、C/N比值以及累计C矿化量也无明显差异。
2.2 土壤pH
染菌和不染菌羽茅根际土壤的pH存在显著差异,表现为E+ > E-(图1)。此外,土壤pH值也受到不同内生真菌菌株的影响,即感染Es的羽茅根际土壤pH要显著高于感染Eg1的羽茅,而感染Eg2的羽茅根际土壤pH与感染Eg1、Es菌的羽茅相比没有显著差异(图1)。
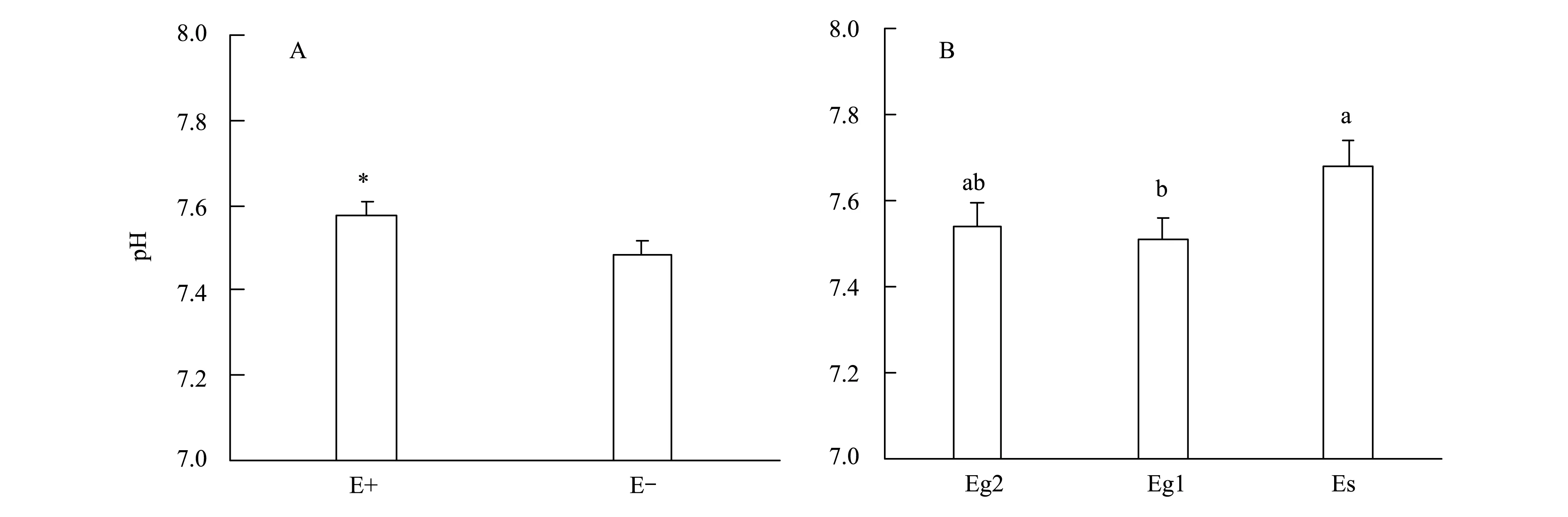
图1 内生真菌染菌状态对羽茅根围土壤pH的影响Fig.1 Soil pH with different fungal endophyte infections *代表在P<0.05水平上差异显著,不同字母代表每个处理下的差异显著(P<0.05)
从土壤中分离得到的C14-C20之间的磷脂脂肪酸含量相加得到总的微生物生物量,用15:0、16:0、17:0、16:1ω9c、cy17:0、cy19:0、18:0来表征细菌,i15:0、i16:0、a16:0、i17:0表征革兰氏阳性菌(G+),16:1ω9c、cy17:0来表征革兰氏阴性菌(G-),18:1ω9c、18:1ω9t、18:2ω9, 12c表征真菌,10Me16:0、10Me17:0、10Me18:0表征放线菌[32-35]。不同处理的所有土壤(共108个)的PLFA数据(表征细菌、G+、G-、真菌和放线菌的PLFA含量)进行NMDS分析,结果显示无论是高N处理(图2A)还是低N处理(图2B)下,从染菌不染菌(“+”代表染菌,“-”代表不染菌)、不同内生真菌以及基因型等方面来看,都没有发现各处理土壤微生物群落结构呈现明显的差异。方差分析的结果显示,内生真菌感染显著提高了羽茅根际土壤的微生物总量、显著降低了土壤中真菌和细菌的比值,但未对真菌、细菌、革兰氏阳性菌、革兰氏阴性菌、放线菌产生显著的影响(表1,图3)。内生真菌种类和宿主植物基因型没有显著影响土壤微生物(表1,表2),4种不同的染菌状态(感染3种内生真菌和不染菌)对土壤中表征各类微生物的PLFA含量也没有显著影响。
表1 内生真菌感染、氮素添加、内生真菌种类以及植物母本基因型对土壤微生物磷脂脂肪酸(PLFA)含量影响的方差分析结果
Table 1 Multiple analysis of variance for the effects of endophyte infection, nitrogen addition and maternal plant genotype on content of microbial phospholipid fatty acids (PLFAs) of rhizosphere soil ofAchnatherumsibiricum
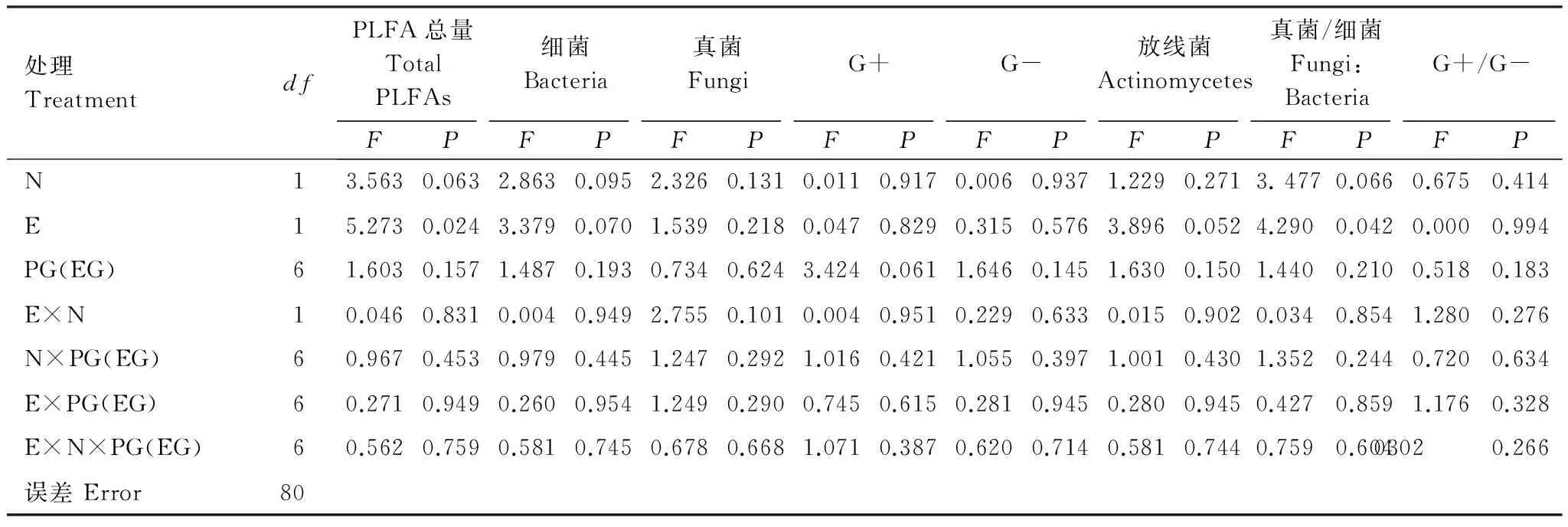
处理TreatmentdfPLFA总量TotalPLFAs细菌Bacteria真菌FungiG+G-放线菌Actinomycetes真菌/细菌Fungi:BacteriaG+/G-FPFPFPFPFPFPFPFPN13.5630.0632.8630.0952.3260.1310.0110.9170.0060.9371.2290.2713.4770.0660.6750.414E15.2730.0243.3790.0701.5390.2180.0470.8290.3150.5763.8960.0524.2900.0420.0000.994PG(EG)61.6030.1571.4870.1930.7340.6243.4240.0611.6460.1451.6300.1501.4400.2100.5180.183E×N10.0460.8310.0040.9492.7550.1010.0040.9510.2290.6330.0150.9020.0340.8541.2800.276N×PG(EG)60.9670.4530.9790.4451.2470.2921.0160.4211.0550.3971.0010.4301.3520.2440.7200.634E×PG(EG)60.2710.9490.2600.9541.2490.2900.7450.6150.2810.9450.2800.9450.4270.8591.1760.328E×N×PG(EG)60.5620.7590.5810.7450.6780.6681.0710.3870.6200.7140.5810.7440.7590.60403020.266误差Error80
N: 氮素添加nitrogen availability,E: 内生真菌感染,PG(EG) endophyte infection. PG (EG),: 植物母本基因型(嵌套于不同内生真菌)maternal plant genotype (nested within endophyte type),G+: 革兰氏阳性菌Gram-positive bacteria,G-: 革兰氏阴性菌Gram-negative bacteria;当Sig<0.05时,字体用黑色标记,表示差异显著
表2 不同内生真菌和氮素添加对羽茅根际土壤微生物磷脂脂肪酸(PLFA)含量影响的影响的方差分析
Table 2 Analysis of variance for the effects of endophyte types and nitrogen availability on content of microbial phospholipid fatty acids (PLFAs) under differentAchnatherumsibiricumrhizosphere soil

处理TreatmentdfPLFA总量TotalPLFAs细菌Bacteria真菌FungiG+G-放线菌Actinomycetes真菌/细菌Fungi:BacteriaG+/G-FPFPFPFPFPFPFPFPEG20.1430.8670.1600.8530.1480.8630.0280.9720.1380.8710.1420.8680.1020.9030.0630.939N11.4720.2311.7200.1963.8330.0561.2790.2640.17606770.8050.3741.6130.1280.0220.661N×EG20.5430.5840.5210.5970.1760.8390.4500.6400.5350.5890.5420.5850.4880.6170.8940.416误差Error48
EG: 不同内生真菌endophyte type;N: 氮素添加nitrogen availability;G+: 革兰氏阳性菌Gram-positive bacteria;G-: 革兰氏阴性菌Gram-negative bacteria;当Sig<0.05时,差异显著

图2 个不同处理土壤样品的微生物群落结构的NMDS分析(数字1—9代表不同的基因型)Fig.2 Nonmetric Multidimensional Scaling analysis of microbial community of soils in different treatments (The number 1—9 represent different genotypes)

图3 内生真菌感染对土壤微生物总量、真菌/细菌比值的影响Fig.3 Content of total PLFAs and fungi: bacteria ratio in rhizosphere soil under endophyte-infected (E+) and endophyte-free (E-) Achnatherum sibiricum
3 讨论
3.1 氮素和宿主植物基因型对羽茅-内生真菌共生体根际土壤的影响
作为植物生长必需的营养元素,N素对内生真菌—植物共生关系的影响不容忽视。一系列的研究表明,内生真菌对植物的有利影响多是在N素供给充足的条件下得到的,当N素缺乏时,这种有利影响会减弱甚至变为不利[27, 36],其原因可能是因为N素供应不足时,植物获取的可利用N被优先支配用于自身生存生长所消耗,从而限制了内生真菌有益作用的发挥。N素添加不仅会影响植物的生长,还可以影响土壤的微生物群落结构[37- 38]。研究表明,随N素添加,内蒙古典型草原土壤中细菌、放线菌和微生物总PLFA含量呈上升趋势,但对真菌含量无显著影响,并且真菌/细菌比随N含量增加而降低[39]。而本文发现,高水平的N并没有对土壤的各项测定指标产生显著的影响,可能是因为本研究所设置的高N和低N是依据羽茅自然生境中的N素含量设计的,N素更多的作用于宿主本身用于植物生物量的增加,而土壤N含量并无显著增加。本文推测,如果分别进行过饱和施N和不施N添加,可能会使内生真菌对土壤的作用更为明显。
内生真菌和宿主的相互作用除与环境条件有关外,还可能和植物的基因型相关[40]。以不同母本基因型的黑麦草为研究材料,发现植物基因型和内生真菌感染的交互作用能够影响宿主的营养生长、生物量及生殖生长等多项指标[40-42],以4个不同母本基因型的亚利桑那羊茅为研究材料,发现内生真菌感染仅增加了其中的2个母本基因型宿主的生长速率[26]。本实验室关于宿主基因型对羽茅-内生真菌共生体生长和生理特征影响的研究结果表明,宿主基因型对羽茅的生理生长指标均无影响(待发表数据),本研究进一步发现宿主植物基因型对共生体所在生境土壤理化性质和土壤微生物均无显著影响。
3.2 内生真菌感染对土壤C、N的影响
关于内生真菌通过影响植物而对土壤产生影响的相关研究较少,结论也不尽一致。Iqbal等[43]对美国东南部9个染菌率不同的高羊茅种植区的土壤进行了测定,发现在同一高羊茅样地感染内生真菌比非感染内生真菌的高羊茅种植点的有机C和总N含量分别高出6%和5%。Franzluebbers等[19]发现感染内生真菌的高羊茅可提高土壤对C、N的固定能力,进一步促进周围环境中的高羊茅的生长。与之相对照,Handayani等[44]的研究却发现内生真菌感染没有使高羊茅所在土壤的总C和N含量发生显著变化,而土壤C组分(根据土壤中团聚体的大小分组)相比总C变化更为明显。关于内生真菌对土壤C、N含量的影响机制,目前认为是:内生真菌通过改变植物的化学组成,使得感染内生真菌与非感染内生真菌的植物枯叶质量产生差异,因而以不同的分解速度进行分解,间接对土壤C、N产生一定影响[14]。本研究发现内生真菌感染对土壤总C和总N的含量没有产生显著的影响,这与本研究在植物材料培养期间及时将枯黄叶片移除,并未涉及到凋落物的分解有关。本文的结果也证实了内生真菌通过植物代谢物和根系分泌物所发挥的影响不大,因此可能主要通过凋落物分解过程影响土壤总C和N的含量。另外,基于前人的研究,推测另一个可能的原因是:植物在感染内生真菌后,排除凋落物的影响,需要一个更长的生长时期来改变土壤的养分条件[21,45],短期的研究可能检测不到土壤C、N的差异[43]。
3.3 内生真菌感染对土壤pH的影响
内生真菌可以改变宿主根系分泌物如糖类、酚类、脂类及羧酸类等的组成和含量[46],如Heck等发现染菌高羊茅根系分泌物中的碳水化合物和有机C含量显著高于不染菌高羊茅[17];Malinowski等发现染菌高羊茅的分泌物中酚类物质含量要高于不染菌植株[47]。本研究发现,感染内生真菌使羽茅根际周围土壤的pH高于不染菌羽茅。其原因可能是内生真菌感染导致羽茅的代谢活动乃至其根系分泌物成分发生改变,也可能是因为染菌植物体内的代谢物质通过浇水、淋溶等因素进入土壤中的酸性物质相对较少,因而使土壤具有较高的pH。此外,本研究对比感染3种内生真菌菌株的羽茅根际土壤的pH,发现Es显著高于Eg1菌,但两者与Eg2菌均无显著差异,说明不同内生真菌菌株对植物次生代谢物和根系分泌物的影响可能不同,从而对土壤的pH影响程度也不相同。一般情况下,微酸性和微碱性之间的土壤环境更适宜微生物的生存[48],土壤pH发生改变不仅会影响土壤微生物的生长和功能[49],影响土壤中细菌和真菌的比例[50],还可能会对土壤动物及其他植物的生长造成一定的影响,进而影响整个生态系统的结构和功能。关于内生真菌影响土壤pH的相关研究还未见报道,具体的影响机制也尚不明确,本研究未对羽茅次级代谢物、根系分泌物成分进行收集和分析对比,有待进一步研究。
3.4 内生真菌感染对土壤微生物的影响
土壤微生物是生态系统的重要组成部分,参与有机物的分解,腐殖质的形成,养分转化等生化过程,推动物质循环和能量流动,对于评价土壤肥力和土壤养分可利用性具有重要意义[51]。有研究发现感染内生真菌的禾草可以引起土壤微生物群落结构和功能的变化[52],这一影响逐渐受到国内外学者的重视。Iqbal等[43]和Handayani等[44]研究发现,感染内生真菌能刺激高羊茅根围土壤微生物生物量的增加。同时,Hecke等[17]发现内生真菌的存在显著增加了高羊茅根际土壤微生物生物量,但对微生物群落结构并无影响。黄玺等[53]以醉马草为研究对象,发现醉马草-内生真菌共生体对土壤微生物有显著影响:醉马草根际土壤中微生物的数量显著高于其伴生种根际的土壤。然而,也有学者认为内生真菌对土壤微生物群落存在其他不同的影响,如抑制土壤微生物活性[19]、降低土壤中多种细菌的含量[54]、降低革兰氏阳性细菌和丛枝菌根菌数量等[52,55]。本文研究结果发现羽茅内生真菌显著增加了其根际土壤的微生物生物量,降低了真菌与细菌的比例。很可能是由于内生真菌通过某种方式该变了羽茅根系分泌物如小分子量碳水化合物、氨基酸和有机酸等物质[56]的含量[57],根际分泌物组分的变化可能会改变土壤微生物结构,增加生物量。此外,本研究发现内生真菌还可使土壤的pH增加,高的pH可能会促进土壤中相关微生物的增长[58],降低真菌的含量,使细菌的含量增加[50]。目前,关于内生真菌对土壤微生物群落影响的相关研究还很少,且缺乏明确的机制来解释内生真菌对土壤微生物产生的影响,这就需要进行更深入的研究来探讨。
致谢:呼伦贝尔草原生态系统国家野外科学观测研究站提供支持,特此致谢。
[1] Hyde K D, Soytong K. The fungal endophyte dilemma. Fungal Diversity, 2008, 33: 163- 173.
[2] Tian Y, Amand S, Buisson D, Kunz C, Hachette F, Dupont J, Nay B, Prado S. The fungal leaf endophyteParaconiothyriumvariabilespecifically metabolizes the host-plant metabolome for its own benefit. Phytochemistry, 2014, 108: 95- 101.
[3] Zou W X, Tan R X. Biological and chemical diversity of endonhytes and their potential applications. Advances in Plant Sciences, 1999, (2): 183- 190.
[4] 任安芝, 高玉葆. 禾草类内生真菌的研究进展. 微生物学通报, 2004, 31(2): 130- 133.
[5] Burns J C, Fisher D S. Intake and digestion of ‘Jesup’ tall fescue hays with a novel fungal endophyte, without an endophyte, or with a wild-type endophyte. Crop Science, 2006, 46(1): 216- 223.
[6] Tian P, Nan Z B, Li C J, Spangenberg G. Effect of the endophyteNeotyphodiumloliion susceptibility and host physiological response of perennial ryegrass to fungal pathogens. European Journal of Plant Pathology, 2008, 122(4): 593- 602.
[7] Read J C, Camp B J. The effect of the fungal endophyte Acremonium coenophialum in tall fescue on animal performance, toxicity, and stand maintenance. Agronomy Journal, 1986, 78(5): 848- 850.
[8] Nagabhyru P, Dinkins R D, Wood C L, Bacon C W, Schardl C L. Tall fescue endophyte effects on tolerance to water-deficit stress. BMC Plant Biology, 2013, 13(1): 127- 127.
[9] Lewis G E. Effects of biotic and abiotic stress on the growth of three genotypes ofLoliumperennewith and without infection by the fungal endophyteNeotyphodiumlolii. Annals of Applied Biology, 2004, 144(1): 53- 63.
[10] Leuchtmann A, Schmidt D, Bush L P. Different levels of protective alkaloids in grasses with stroma-forming and seed-transmitted Epichlo⊇/Neotyphodium endophytes. Journal of Chemical Ecology, 2000, 26(4): 1025- 1036.
[11] Qawasmeh A, Obied H K, Raman A, Wheatley W. Influence of fungal endophyte infection on phenolic content and antioxidant activity in grasses: interaction betweenLoliumperenneand different strains ofNeotyphodiumlolii. Journal of Agricultural and Food Chemistry, 2012, 60(13): 3381- 3388.
[12] Rasmussen S, Parsons A J, Bassett S, Christensen M J, Hume D E, Johnson L J, Johnson R D, Simpson Wayne R, Stacke C, Voisey C R, Xue H, Newman J A. High Nitrogen supply and carbohydrate content reduce fungal endophyte and alkaloid concentration inLoliumperenne. New Phytologist, 2007, 173(4): 787- 797.
[13] Rasmussen S, Parsons A J, Fraser K, Xue H, Newman J. Metabolic profiles ofLoliumperenneare differentially affected by nitrogen supply, carbohydrate content, and fungal endophyte infection. Plant Physiology, 2008, 146(3): 1440- 1453.
[14] Lemons A, Clay K, Rudgers J A. Connecting plant-microbial interactions above and belowground: a fungal endophyte affects decomposition. Oecologia, 2005, 145(4): 595- 604.
[15] 李雪利, 李正, 李彦涛, 张文平, 曾宪立, 郑文冉, 刘国顺, 叶协锋. 植物化感作用研究进展. 中国农学通报, 2009, 25(23): 142- 146.
[16] Franzluebbers A J, Stuedemann J A. Particulate and non-particulate fractions of soil organic carbon under pastures in the Southern Piedmont USA. Environmental Pollution, 2002, 116(S1): S53-S62.
[17] Van Hecke M M, Treonis A M, Kaufman J R. How does the fungal endophyteNeotyphodiumcoenophialumaffect tall fescue (Festucaarundinacea) rhizodeposition and soil microorganisms?. Plant and Soil, 2005, 275(1/2): 101- 109.
[18] Loydi A, Eckstein R L, Otte A, Donath T W. Effects of litter on seedling establishment in natural and semi-natural grasslands: a meta-analysis. Journal of Ecology, 2013, 101(2): 454- 464.
[19] Franzluebbers A J, Nazih N, Stuedemann J A, Fuhrmann J J, Schomberg H H, Hartel P G. Soil carbon and nitrogen pools under low- and high-endophyte-infected tall fescue. Soil Science Society of America Journal, 1999, 63(6): 1687- 1694.
[20] Franzluebbers A J, Hill N S. Soil carbon, nitrogen, and ergot alkaloids with short- and long-term exposure to endophyte-infected and endophyte-free tall fescue. Soil Science Society of America Journal, 2005, 69(2): 404- 412.
[21] Casas C, Omacini M, Montecchia M S, Correa O S. Soil microbial community responses to the fungal endophyteNeotyphodiumin Italian ryegrass. Plant and Soil, 2011, 340(1/2): 347- 355.
[22] Leuchtmann A, Oberhofer M. TheEpichlo⊇ endophytes associated with the woodland grassHordelymuseuropaeusincluding four new taxa. Mycologia, 2013, 105(5): 1315- 1324.
[23] Li C, Nan Z, Paul V H, Dapprich P D, Liu Y. A newNeotyphodiumspecies symbiotic with drunken horse grass (Achnatheruminebrians) in China. Mycotaxon, 2004, 90(7): 141- 147.
[24] Iannone L J, Pinget A D, Nagabhyru P, Schardl C L, De Battista J P. Beneficial effects ofNeotyphodiumtembladeraeandNeotyphodiumpampeanumon a wild forage grass. Grass and Forage Science, 2012, 67(3): 382- 390.
[25] Faeth S H, Bultman T L. Endophytic fungi and interactions among host plants, herbivores, and natural enemies // Tscharntke T, Hawkins B A, eds. Multitrophic Level Interactions. Cambridge, UK: Cambridge University Press, 2002: 89- 123.
[26] Faeth S H, Bush L P, Sullivan T J. Peramine alkaloid variation inNeotyphodium-infected arizona fescue: effects of endophyte and host genotype and environment. Journal of Chemical Ecology, 2002, 28(8): 1511- 1526.
[27] Saikkonen K, Lehtonen P, Helander M, Koricheva J, Faeth S H. Model systems in ecology: dissecting the endophyte-grass literature. Trends in Plant Science, 2006, 11(9): 428- 433.
[28] 魏宇昆, 高玉葆, 李川, 许华, 任安芝. 内蒙古中东部草原羽茅内生真菌的遗传多样性. 植物生态学报, 2006, 30(4): 640- 649.
[29] 李夏, 韩荣, 任安芝, 高玉葆. 高温处理构建不感染内生真菌羽茅种群的方法探讨. 微生物学通报, 2010, 37(9): 1395- 1400.
[30] Ritchie N J, Schutter M E, Dick R P, Myrold D D. Use of length heterogeneity PCR and fatty acid methyl ester profiles to characterize microbial communities in soil. Applied and Environmental Microbiology, 2000, 66(4): 1668- 1675.
[31] He Y T, Xu X L, Kueffer C, Zhang X Z, Shi P L. Leaf litter of a dominant cushion plant shifts nitrogen mineralization to immobilization at high but not low temperature in an alpine meadow. Plant and Soil, 2014, 383(1/2): 415- 426.
[32] Wang Q K, Wang S L, He T X, Liu L, Wu J B. Response of organic carbon mineralization and microbial community to leaf litter and nutrient additions in subtropical forest soils. Soil Biology and Biochemistry, 2014, 71: 13- 20.
[33] Moore-Kucera J, Dick R P. Application of13C-labeled litter and root materials for insitudecomposition studies using phospholipid fatty acids. Soil Biology and Biochemistry, 2008, 40(10): 2485- 2493.
[34] Feng X J, Simpson M J. Temperature and substrate controls on microbial phospholipid fatty acid composition during incubation of grassland soils contrasting in organic matter quality. Soil Biology and Biochemistry, 2009, 41(4): 804- 812.
[35] Kulmatiski A, Beard K H. Long-term plant growth legacies overwhelm short-term plant growth effects on soil microbial community structure. Soil Biology and Biochemistry, 2011, 43(4): 823- 830.
[36] Ren A Z, Gao Y B, Wang W, Wang J L, Zhao N X. Influence of nitrogen fertilizer and endophyte infection on ecophysiological parameters and mineral element content of perennial ryegrass. Journal of Integrative Plant Biology, 2009, 51(1): 75- 83.
[37] 侯晓杰, 汪景宽, 李世朋. 不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响. 生态学报, 2007, 27(2): 655- 661.
[38] 齐莎, 赵小蓉, 郑海霞, 林启美. 内蒙古典型草原连续5年施用氮磷肥土壤生物多样性的变化. 生态学报, 2010, 30(20): 5518- 5526.
[39] 施瑶, 王忠强, 张心昱, 孙晓敏, 刘希玉, 何念鹏, 庾强. 氮磷添加对内蒙古温带典型草原土壤微生物群落结构的影响. 生态学报, 2014, 34(17): 4943- 4949.
[40] Cheplick G P. Effects of endophytic fungi on the phenotypic plasticity ofLoliumperenne(Poaceae). American Journal of Botany, 1997, 84(1): 34- 40.
[41] Cheplick G P. Host genotype overrides fungal endophyte infection in influencing tiller and spike production ofLoliumperenne(Poaceae) in a common garden experiment. American Journal of Botany, 2008, 95(9): 1063- 1071.
[42] Hesse U, Hahn H, Andreeva K, Förster K, Warnstorff K, Schöberlein W, Diepenbrock W. Investigations on the influence ofNeotyphodiumendophytes on plant growth and seed yield ofLoliumperennegenotypes. Crop Science, 2004, 44(5): 1689- 1695.
[43] Iqbal J, Siegrist J A, Nelson J A, McCulley R L. Fungal endophyte infection increases carbon sequestration potential of southeastern USA tall fescue stands. Soil Biology and Biochemistry, 2012, 44(1): 81- 92.
[44] Handayani I P, Coyne M S, Phillips T D. Soil organic carbon fractions differ in two contrasting tall fescue systems, Plant and Soil, 2011, 338(1/2): 43- 50.
[45] Franzluebbers A J. Short-term responses of soil C and N fractions to tall fescue endophyte infection. Plant and Soil, 2006, 282(1/2): 153- 164.
[46] Guo J Q, McCulley R L, McNear D N Jr. Tall fescue cultivar and fungal endophyte combinations influence plant growth and root exudate composition. Fronters in Plant Science, 2015, 6: 183.
[47] Malinowski D P, Belesky D P.Neotyphodiumcoenophialum-endophyte infection affects the ability of tall fescue to use sparingly available phosphorus. Journal of Plant Nutrition, 1999, 22(4/5): 835- 853.
[48] 王菲, 袁婷, 谷守宽, 王正银. 有机无机缓释复合肥对不同土壤微生物群落结构的影响. 环境科学, 2015, 36(4): 1461- 1467.
[49] Banks M L, Kennedy A C, Kremer R J, Eivazi F. Soil microbial community response to surfactants and herbicides in two soils. Applied Soil Ecology, 2014, 74: 12- 20.
[50] Rousk J, Brookes P C, Bååth E. Contrasting soil pH effects on fungal and bacterial growth suggest functional redundancy in carbon mineralization. Applied and Environmental Microbiology, 2009, 75(6): 1589- 1596.
[51] 何振立. 土壤微生物量及其在养分循环和环境质量评价中的意义. 土壤, 1997, 29(2): 61- 69.
[52] Buyer J S, Zuberer D A, Nichols K A, Franzluebbers A J. Soil microbial community function, structure, and glomalin in response to tall fescue endophyte infection. Plant and Soil, 2011, 339(1/2): 401- 412.
[53] 黄玺, 李秀璋, 柴青, 李春杰. 醉马草内生真菌共生体对土壤微生物和养分的影响. 草业科学, 2013, 30(3): 352- 356.
[54] Jenkins M B, Franzluebbers A J, Humayoun S B. Assessing short-term responses of prokaryotic communities in bulk and rhizosphere soils to tall fescue endophyte infection. Plant and Soil, 2006, 289(1/2): 309- 320.
[55] Mack K M L, Rudgers J A. Balancing multiple mutualists: asymmetric interactions among plants, arbuscular mycorrhizal fungi, and fungal endophytes. Oikos, 2008, 117(2): 310- 320.
[56] Lynch J M, Whipps J M. Substrate flow in the rhizosphere. Plant and Soil, 1990, 129(1): 1- 10.
[57] Malinowski D P, Alloush G A, Belesky D P. Leaf endophyte Neotyphodium coenophialum modifies mineral uptake in tall fescue. Plant and Soil, 2000, 227(1/2): 115- 126.
[58] Kemmitt S J, Wright D, Goulding K W T, Jones D L. pH regulation of carbon and nitrogen dynamics in two agricultural soils. Soil Biology and Biochemistry, 2006, 38(5): 898- 911.
Effects of fungal endophytes on properties and microbial community structure of the rhizosphere soil ofAchnatherumsibiricumin nitrogen addition conditions
LI Geping, GAO Yuan, LIU Lei, LI Xia, REN Anzhi*, GAO Yubao
College of Life Science, Nankai University, Tianjin 300071, China
Simultaneous infections of host plants with endophytic fungi are common in both natural and agricultural ecosystems. Endophyte-infected (E+) grasses may differ in chemical composition and root exudates from endophyte-free (E-) individuals, and these differences may indirectly affect soil properties and microbial communities in the host grass habitat. In this study, we used as plant materialAchnatherumsibiricum, a native grass, naturally infected with two species of endophytes, includingEpichlo⊇sibiricaandE.gansuensis.E.gansuensishas two morphotypes,E.gansuensis- 1 andE.gansuensis- 2,of whichE.gansuensis- 1 exhibits strict vertical transmission, whileE.gansuensis- 2 can be transmitted vertically as well as horizontally. The objective of this study was to explore the effect of endophyte infection, endophyte species, nitrogen availability, and maternal plant genotype on the physicochemical properties and microbial communities of soil in theA.sibiricumhabitat. At the end of a pot experiment, we analyzed the soil total carbon (C) and nitrogen (N), determined soil pH, and estimated the soil C mineralization. Soil microbial biomass and community composition were assayed by using the phospholipid fatty acid (PLFA) technique. In the present study, we found that the soil pH value differed significantly between the E+ and E- treatments (E+ > E-). In addition, the soil pH was influenced by endophyte species: pH in theE.sibirica-infected condition was higher than that in theE.gansuense- 1 infected condition, but the difference was not significant with theE.gansuense- 2 condition. Endophyte infection significantly improved the total amount of rhizosphere microorganisms but reduced soil bacterial:fungal ratio. Endophyte status and species, nitrogen addition, and maternal plant genotype had no significant effects on soil total carbon (C) and nitrogen (N), rhizosphere microorganisms and C mineralization ability. This study suggested that endophyte infection could alter soil pH and microbial community structure, and endophytic fungi may change soil total C and N with more available nitrogen or in the long-term. These conclusions provided some experimental basis for further understanding the complex symbiotic relationship between fungal endophytes and native grasses and its role in ecosystem C and N cycling.
fungal endophyte; soil pH; soil microbial; C mineralization
国家自然科学基金(31270463,31570433);教育部博士点基金项目(20130031110023)
2016- 01- 22; 网络出版日期:2017- 02- 23
10.5846/stxb201601220154
*通讯作者Corresponding author.E-mail: renanzhi@nankai.edu.cn
李隔萍, 高远, 刘磊, 李夏, 任安芝, 高玉葆.内生真菌对氮添加羽茅根际土壤特性和微生物群落的影响.生态学报,2017,37(13):4299- 4308.
Li G P, Gao Y, Liu L, Li X, Ren A Z, Gao Y B.Effects of fungal endophytes on properties and microbial community structure of the rhizosphere soil ofAchnatherumsibiricumin nitrogen addition conditions.Acta Ecologica Sinica,2017,37(13):4299- 4308.
