克唑替尼靶向治疗的非小细胞肺癌患者血清肿瘤标志物水平变化及意义
2017-08-31陈文武毛良平牟方红王鑫饶文明
陈文武,毛良平,牟方红,王鑫,饶文明
(1重庆开州区人民医院,重庆405400;2万州区三峡中心医院)
克唑替尼靶向治疗的非小细胞肺癌患者血清肿瘤标志物水平变化及意义
陈文武1,毛良平2,牟方红1,王鑫1,饶文明1
(1重庆开州区人民医院,重庆405400;2万州区三峡中心医院)
目的 观察非小细胞肺癌(NSCLC)患者接受间变性淋巴瘤激酶-酪氨酸激酶抑制剂(ALK-TKI)克唑替尼靶向治疗前后血清肿瘤标志物水平变化,并探讨其与疗效及临床病理参数的关系。方法 经荧光原位杂交技术检测为ALK融合基因阳性的晚期NSCLC患者82例,均给予克唑替尼靶向治疗。治疗前及治疗2、6个月分别检测患者血清肿瘤标志物水平,包括神经元特异性烯醇化酶(nNSE)、癌胚抗原(CEA)、细胞角蛋白19片段(Cyfra21-1)和人鳞状细胞癌相关抗原(SCCAg),并进行比较。分析血清肿瘤标志物水平与临床疗效及临床病理参数的关系。结果 82例晚期NSCLC患者中,克唑替尼治疗后完全缓解2例,部分缓解50例,病情稳定18例,疾病进展12例。治疗有效(完全缓解+部分缓解)率63.4%,疾病控制(部分缓解+稳定)率85.4%。治疗后2个月完全缓解患者和部分缓解患者血清肿瘤标志物水平均较治疗前降低(P均<0.05)。病情稳定患者治疗前与治疗后2个月除CEA差异有统计学意义外,其余血清标志物水平比较,P均>0.05。疾病进展患者治疗后2个月血清肿瘤标志物水平较治疗前升高(P均<0.05)。治疗6个月后,完全缓解和部分缓解患者血清肿瘤标志物水平较治疗前和治疗后2个月降低(P均<0.05);病情稳定患者的CEA水平较治疗后2个月升高(P均<0.05),但仍低于治疗前;疾病进展患者血清肿瘤标志物水平均较治疗前升高,CEA、NSE较治疗后2个月升高(P均<0.05)。血清CEA与组织学类型、TNM临床分期、外转移部位数量有关,CYFRA21-1与组织学类型有关,NSE与外转部位数量有关,SCCAg与TNM临床分期、外转移部位数量有关(P均<0.05)。结论 NSCLC患者克唑替尼靶向治疗后获得完全与部分缓解者血清肿瘤标志物CEA、CY-FRA21-1、NSE和SCCAg水平下降,其水平与组织学分型或TNM临床分期或外转移部位数量有关。
非小细胞肺癌;肿瘤标志物;间变淋巴瘤激酶-酪氨酸激酶抑制剂;克唑替尼;靶向治疗
肺癌是全球发病率最高的肺部原发性恶性肿瘤,非小细胞肺癌(NSCLC)居肺癌发病率之首,约80%以上[1]。近年肺癌靶向治疗发展迅速,尤其针对晚期NSCLC患者的靶向治疗,显著提高了患者生活质量并延长了中位生存期。2007年,研究发现染色体倒位形成棘皮动物微管相关类蛋白4基因与间变性淋巴瘤激酶(EML4-ALK)基因的重排可导致人罹患肺癌并促进其病程进展[2]。NSCLC是ALK基因阳性的主要群体,约占肺癌总量的3%~5%。由于NSCLC患者中 EML4-ALK基因重排发生率较低,对其进行筛选,并进行靶向治疗,对于患者意义重大[3]。2014年1月~2015年12月,本研究通过检测ALK-酪氨酸激酶抑制剂(TKI)靶向治疗的NSCLC患者的血清细胞角蛋白19片段 (Cyfra21-1)、神经元特异性烯醇化酶(NSE)、癌胚抗原(CEA)和人鳞状细胞癌相关抗原(SCCAg)水平变化,分析其与疗效及临床病理参数的关系。
1 资料与方法
1.1 临床资料 NSCLC患者82例,均经病理检查确诊。男53例、女29例,年龄29~73(40.5±15.7)岁,病程3~6个月。TNM分期为Ⅲ期48例,Ⅳ期34例;淋巴结转移75例,远处转移34例。纳入标准:①经组织病理学诊断,组织学分级为Ⅲ级的NSCLC患者,经荧光原位杂交(FISH)检测确认为ALK融合基因阳性的患者,在确诊前未应用其他抗肿瘤药物进行治疗;②一般情况良好,既往无烟草暴露史,评估后确定患者能够承受2个周期以上的克唑替尼方案化疗;③其他重要脏器功能正常。排除标准:①接受其他药物抗肿瘤药物治疗;②化疗同时进行其他治疗;③有神经系统转移;④未完成2个周期化疗;⑤临床信息不全面者。
1.2 治疗方法 根据NCCN指南、ESMO指南结合患者病情评估后,选择适合患者的治疗方案。克唑替尼300 mg,口服,2次/d,21 d为1个周期,共治疗2个周期。
1.3 观察指标及疗效判定方法 记录患者的临床特征(包括组织学类型、TNM分期、是否外转),记录化疗前,化疗后2、6个月患者血清CEA、CY-FRA21-1、NSE和SCCAg水平(采用电化学发光法检测)。第1、2周期化疗后对所有参加实验患者进行影像学检查,根据RESIST标准判定患者靶向治疗疗效,肿瘤组织完全消失视为完全缓解(CR);肿瘤组织体积减少30%以上视为部分缓解(PR);肿瘤体积减少未达到30%,肿瘤体积增加未达到20%者,视为稳定(SD);病灶体积增加20%以上,或增加未达到20%,但同时有新增病灶者,视为疾病进展(PD)。对不同临床疗效患者进行血清标志物水平比较,并分析血清肿瘤标志物水平与临床病理参数的关系。
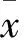
2 结果
2.1 临床疗效 82例晚期NSCLC患者中,克唑替尼治疗后CR 2例,PR 50例(PR组),SD 18例(SD组),PD 12例(PD)。PR、SD和PD比例分别为63.4%、22.0%和14.6%,治疗有效率(CR+PR所占比例)为63.4%,病情控制率(PR+SD所占比例)为85.4%。
2.2 不同时间各组患者血清肿瘤标志物水平比较 见表1。
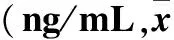
表1 不同时间各组患者血清肿瘤标志物水平比较±s)
注:与同组治疗前比较,*P<0.05;与同组治疗后2个月比较,#P<0.05。
2.3 血清肿瘤标志物水平与NSCLC患者临床病理参数的关系 见表2。
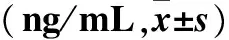
表2 血清肿瘤标志物水平与NSCLC患者临床病理参数的关系
注:分别与同组中的鳞癌、TNM分期Ⅳ期、外转移部位≥3个比较,*P<0.05。
3 讨论
早期肺癌患者大多症状不明显,大部分患者确诊时已处于晚期,导致肺癌治愈率低下,生存率及患者生活质量降低[4]。对于ALK基因阳性的肺癌患者进行靶向治疗后,可显著改善患者生存质量和预后。但在ALK融合基因阳性NSCLC患者靶向治疗疗效及病情判断方面尚缺乏特异指标。既往研究发现,肿瘤标志物在癌症的早期诊断、疗效和预后评估方面具有重要意义[5]。
既往研究表明,癌组织和胚胎组织中CEA表达水平增高,可能与细胞的增殖分化具有相关性,而CEA在多种肿瘤组织中都有表达,其判断癌症的特异性不高,在部分炎症患者中也有升高,但大量临床资料证实血清CEA水平在健康人群和良性疾病患者中表达水平较低[6]。有报道指出腺癌患者血清CEA水平较其他类型更高,目前CEA在监测肺癌治疗效果以及预测肿瘤复发和转移方面应用广泛[7]。研究报道CEA升高的NSCLC患者,肿瘤复发的危险性增加,对评估肺癌患者的预后具有重要意义[8]。本研究结果也证实,组织学类型为腺癌、TNM分期Ⅳ期和有远处转移多于3个部位的患者血清CEA水平更高,且其在疾病进展的患者中表达量更高,治疗后病情缓解的患者中水平降低,提示其在疗效评估中有重要作用。CYFRA21-1是针对NSCLC特异性肿瘤标志物。有研究报道肺癌患者CYFRA21-1水平与肿瘤大小及增殖速度相关,且其在鳞癌患者中较腺癌表达水平高[9]。本研究结果显示,CYFRA21-1在靶向治疗后病情缓解的患者中水平降低,且在鳞癌患者中高于腺癌。提示其在ALK-TKI靶向治疗NSCLC患者的疗效判断及鳞癌与腺癌的鉴别中有重要价值。
NSE在糖酵解途径中发挥重要作用,在体内主要分布在神经内分泌系统组织中[10]。研究发现,其在不同组织中活性不尽相同,在脑细胞、外周神经组织和内分泌组织、非神经组织、血清和脊髓液中的活性依次降低。因此,神经内分泌组织来源的肿瘤细胞中NSE表达量高于正常组织,此类肿瘤患者血清中检出的NSE水平高于健康人群。而在NSCLC中表达量升高并不显著。本研究发现NSE在ALK阳性的NSCLC患者中升高程度并不显著,但是在靶向治疗后患者血清NSE水平降低。提示其有利于ALK-TKI靶向治疗NSCLC患者的疗效判断。
SCCAg是原TA-4的亚型,是一种糖蛋白。人体内众多组织表达SCC,其中生殖系统、呼吸系统以及神经系统来源的鳞状上皮细胞癌组织中表达量显著增高,其中非角化细胞癌组织中表达量高于其他组织。研究表明,SCC水平升高可见于83%的宫颈癌、25%~75%的肺鳞状细胞癌、30%的Ⅰ期食道癌、89%的Ⅲ期食道癌;此外,卵巢癌、子宫癌和颈部鳞状上皮细胞癌患者的血清SCC水平升高较其他肿瘤显著。因此,SCC对以上恶性肿瘤的疗效评估、复发监测以及预后判断具有重要的应用价值。本研究发现,NSCCL患者在靶向治疗后血清SCCAg水平下降,且在TNM分期Ⅳ患者和外转移>3个部位的患者中分别高于Ⅲ期患者和外转移<3个部位的患者,说明SCCAg在评估ALK-TKI靶向治疗NSCLC患者的疗效及病情预测方面具有一定价值。
综上所述,在ALK-TKI靶向治疗的NSCLC患者中,病情缓解者治疗后血清肿瘤标志物CEA、CY-FRA21-1、NSE和SCCAg水平降低,其在评价ALK阳性NSCLC患者靶向治疗的疗效、病情及病理分型鉴别诊断方面具有一定临床意义。
[1] 张实,吴学玲.小细胞肺癌神经内分泌起源标志物的研究进展[J].中华肺部疾病杂志,2014,7(2):80-86.
[2] Eberlein CA, Stetson D, Markovets AA, et al. Acquired resistance to the mutant-selective EGFR inhibitor AZD929 is associated with increased dependence on RAS signaling in preclinical models[J]. Cancer Res, 2015,75(12):2489-2500.
[3] Wang S, Song Y, Yan F,el al. Mechanisms of resistance to third-generation EGFR tyrosine kinase inhibitors[J]. Front Med, 2016,10(4):383-388.
[4] Katayama R, Shaw AT, Khan TM, el al. Mechanisms of acquired crizotinib resistance in ALK rearranged lung cancers[J]. Sci Transl Med, 2012,4(1201):120.
[5] Kim TM, Song A, Kim DW, et al. Mechanisms of acquired resistance to AZD9291, a mutation-selective, irreversible EGFR inhibitor[J]. J Thorac Oncol, 2015,10(12):1736-1744.
[6] Ou SH, Kwak EL, Siwak-Tapp C, et al. Activity of crizotinib(PF02341066), a dual mesenchymal-epithelial transition(MET) and anaplastic iymphoma kinase(ALK) inhibitor, in a non-small cell lung cancer patient with de novo MET amplification[J]. J Thorac Oncol, 2011,6(5):942-946.
[7] Perez CA, Velez M, Raez LE, et al. Overcoming the resistance to crizotinib in patients with non-small cell lung cancer harboring EML4/ALK translocation[J]. Lung Cancer, 2014,84(2):110-115.
[8] Gandhi L, Jnne PA. Crizotinib for ALK-rearranged non-small cell lung cancer: a new targeted therapy for a new target[J]. Clin Cancer Res, 2012,18(14):3737-3742.
[9] Minca EC, Portier BP, Wang Z, et al. ALK status testing in non small cell lung carcinoma: correlation between ultrasensitive IHC and FISH[J]. J Mol Diagn, 2013,15(3):341-346.
[10] 段昕,贾春芳,段敏.CAl99、NSE、CYFRA21-1和CEA联合检测在肺癌诊断中的应用价值[J].中国实验诊断学,2014,18(2):231-233.
10.3969/j.issn.1002-266X.2017.29.021
R734.2
B
1002-266X(2017)29-0062-03
2017-04-11)
