30 209例舒血宁注射液安全性医院集中监测研究
2017-08-30姜俊杰谢雁鸣张寅黎明全赵玉斌温泽淮李学林易丹辉张一开
姜俊杰+谢雁鸣 张寅+黎明全 赵玉斌+温泽淮 李学林 易丹辉+张一开

[摘要]为获得杏雪舒血宁注射液的不良反应特征及发生率等安全性信息,采用多中心、大样本医院集中监测的设计方法,在全国27家医疗机构中,以使用舒血宁注射液的住院患者为研究对象,进行用药周期的全程监测。监测主要内容为患者的一般信息、诊断信息、用药信息、不良事件信息。结果共纳入使用舒血宁注射液的患者30 209例,发生不良反应34例,不良反应发生率0113%,属于偶见不良反应。不良反应发生特征为头痛、头晕、皮肤瘙痒、心悸、恶心等。基于以上结果,说明杏雪舒血宁注射液的安全性良好。
[关键词]舒血宁注射液; 医院集中监测; 不良反应; 安全性
Intensive hospital monitoring of Shuxuening injection in 30 209 cases
JIANG Junjie1, XIE Yanming1*, ZHANG Yin1, LI Mingquan2, ZHAO Yubin3, WEN Zehuai4,
LI Xuelin5, YI Danhui2, ZHANG Yikai6
(1 Institute of Basic Medical Sciences, Chinese Academy of Traditional Chinese Medicine, Beijing 100700, China;
2Affiliated Hospital of Changchun University of Traditional Chinese Medicine, Changchun 130618, China;
3Shijiazhuang Hospital of Traditional Chinese Medicine, Shijiazhuang 052560, China;
4Guangdong Province Traditional Chinese Medical Hospital, Guangzhou 511740, China;
5The First Affiliated Hospital of Henan University of Traditional Chinese Medicine, Zhengzhou 452486, China;
6 College of Statistics, Renmin University of China, Beijing 100872, China)
[Abstract] In order to obtain the characteristics and incidence of adverse reactions of Shuxuening injection (Xingxue), the design method of a multicenter, large sample intensive monitoring in the hospitals was adopted The hospitalized patients with use of Shuxuening injection from 27 medical institutions were enrolled as the research subjects to monitor their entire process of treatment cycle The main content of monitoring included the patients general information, diagnostic information, medication information, and adverse event information A total of 30 209 patients with Shuxuening injection were enrolled; adverse reactions occurred in 34 cases, with an incidence of 0113%, which belonged to the rare adverse reactions Adverse reactions were characterized by headache, dizziness, pruritus, palpitations, nausea, et al All the above results showed that Xingxue Shuxuening injection had high safety in clinical application
[Key words]Shuxuening injection; intensive hospital monitoring; adverse reactions; safety
杏雪舒血寧注射液(以下简称“舒血宁”)的成分是银杏叶提取物,功能是扩张血管、改善微循环,可用于缺血性心脑血管疾病,冠心病、心绞痛、脑栓塞、脑血管痉挛等。关于舒血宁注射液的安全性问题,既往诸多学者进行了安全性文献分析、回顾性分析等[12]。文献分析及不良反应被动监测数据分析,均可发现舒血宁的不良反应信号,但均有一定的局限性,来源于多个文献的数据质量参差不齐,无法获得较为准确的不良反应(adverse reaction,ADR)数据。被动监测数据分析无法计算ADR发生率,且存在低报、漏报的缺点。然而,大样本医院集中监测研究可获取舒血宁注射液全部用药患者信息及发生不良反应患者信息,可计算ADR发生率,并得出不良反应发生特征,因此,本研究基于多中心、大样本的医院集中监测设计方法,在全国27家医疗机构进行舒血宁注射液医院集中监测研究,为舒血宁注射液安全合理用药提供科学依据。endprint
1资料与方法
11监测设计本研究为多中心、大样本、医院集中监测的设计方法。
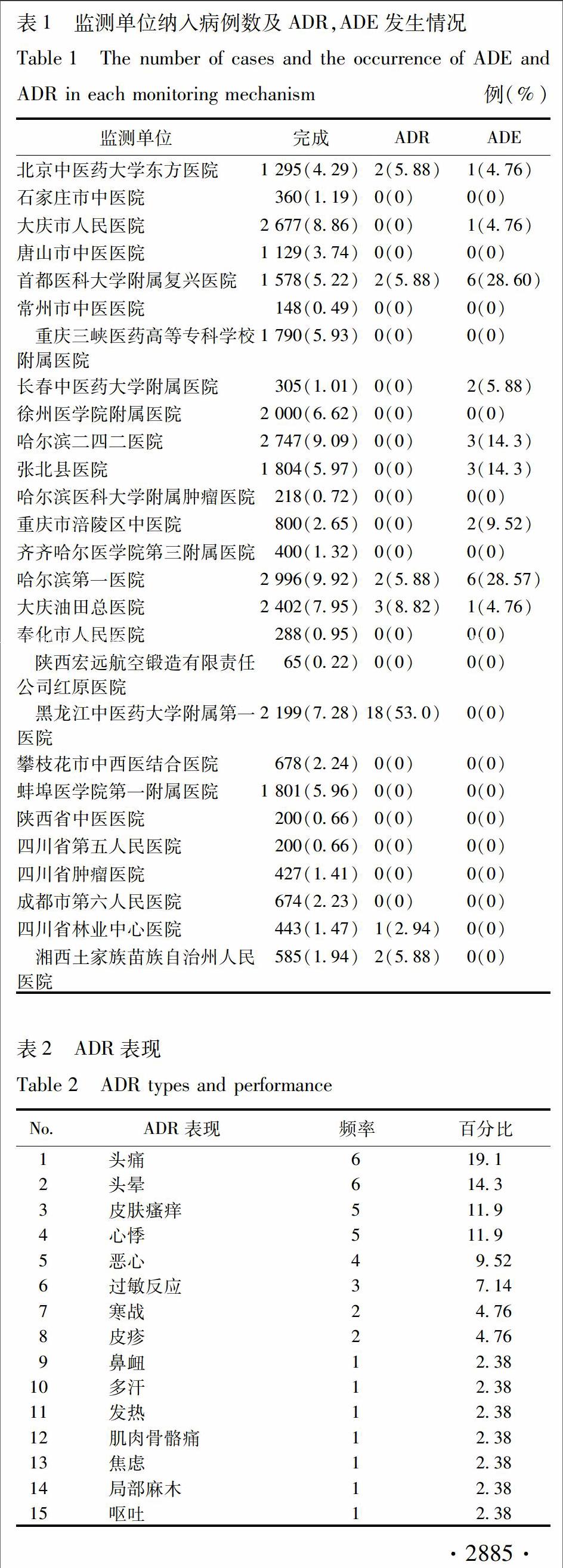
12监测机构本研究在全国共设有27家监测机构,其中,北京中医药大学东方医院为负责单位,其余26家为监测参加单位,包括石家庄市中医院、大庆市人民医院、唐山市中医医院、首都医科大學附属复兴医院、常州市中医医院、重庆三峡医药高等专科学校附属医院、长春中医药大学附属医院、徐州医学院附属医院、哈尔滨二四二医院等。
13监测对象2012年10月—2015年11月期间,在监测机构使用舒血宁注射液的住院患者。各监测医院所使用的舒血宁注射液均是由黑龙江珍宝岛药业股份有限公司生产的不同批次产品。
14样本量根据国际通用“三例原则”,监测前确定样本量是3万例。
15监测周期用药期间全程观察。
16监测形式及内容本监测的形式分为2种,一是由临床医师观察,并由临床医师填写监测表;二是由临床医师观察,继而将观察结果上报药师,由药师填写监测表。监测表分为A,B 2个表。A表包括一般信息、诊断信息、用药信息、联合用药信息,每个病例均需填写;B表是不良事件相关信息,发生不良事件的患者需要填写。A,B表具体内容是:①一般信息:包括性别、年龄、生命体征、个人过敏史、家族过敏史等;②诊断信息:包括西医诊断、中医诊断、合并疾病;③用药信息:包括舒血宁的使用方式、用药天数、药物剂量、溶媒、溶媒用量、注射室温、配液放置时间、注射持续时间、滴速;④联合用药信息:合并用药名称、注射前使用的注射剂名称、注射期间使用的注射剂名称、注射后使用的注射剂名称、注射前后是否冲管、注射前后是否更换输液器。⑤不良反应/事件信息:不良反应/事件名称、发生时间、症状、体征、临床检验;不良反应/事件结果、转归、预后;怀疑药品、溶媒、输液器、并用药品的名称、批准文号、通用名、生产厂家、批号、用法用量、室温等;关联性评价结果等。
17质量控制质量控制主要从以下7个方面实施:监测中心、监测人员、监测进度、原始文件、电子数据、档案管理、质量管理。其中,原始文件和电子数据是质量控制的重要内容。原始文件方面,主要是防止漏报病例以及监测表的填写质量检查。通过调取医院信息系统数据中研究时间范围内使用舒血宁的病例数,与实际登记例数相对照的方法,检查是否有漏报情况。原始文件质量方面,通过与原始病历对照溯源进行检查,要求具备规范性、及时性、准确性、真实性。电子数据要求与纸质监测表内容一致。
18数据管理本研究的数据采集工具是监测表,并建立了专有网络平台数据库,网址为wwwcrpcmcom。采用独立双人双份数据录入的形式,并由计算机执行差异校验功能,解决录入间的不一致。数据的现场核查主要指核对源数据(住院病历)与监测表或电子数据的一致性。在收集数据结束之后,对所有数据进行整体核查与清理,包括清除重复数据、修改错误数据和疾病名称、药物名称不标准的数据,继而,锁定数据库,用于统计分析。
19不良反应因果判断方法按照国家药品不良反应监测中心2011年公布的《药品不良反应报告和监测管理办法》(卫生部第81号令),对不良反应、不良事件、严重不良反应进行判断,并采用6级不良事件关联性评价对不良事件与舒血宁的关联性做出评价,包括肯定、很可能、可能、可能无关、待评价、无法评价。关联性评价结果为待评价、无法评价的,结合临床资料重新评价。最终,评价结果是肯定、很可能、可能的属于不良反应,评价结果是可能无关的属于不良事件。本监测采用三级不良反应判读方法,首先是一级判读,由监测者完成;其次是二级判读,由监测机构不良反应判读专家委员会完成;再次是三级判读,由行业不良反应专家委员会完成。三级判读后,确定舒血宁最终的不良反应及不良事件。
110伦理审查与国际注册本监测已通过伦理审查,审查机构是中国中医科学院中医临床基础医学研究所伦理委员会,伦理批件(201215)。并于美国临床试验注册网wwwclinicaltrialsgov通过注册,注册号是NCT01752946。
111数据标准化由于监测数据来源于多家医院,为便于分析,需要对数据库的相关信息进行标准化。参照西医《国际疾病分类标准编码》(ICD10)疾病分类[3]对西医诊断进行规范化;参照《中华人民共和国国家标准——中医病证分类与代码》(GB/T156571995)[4]对中医诊断标准化;参照2015年《中国药典》[5]对药品名称进行标准化;参照《WHO不良反应术语集》对不良反应/事件名称及所属系统进行标准化。
112统计方法对于计数资料,采用描述方法分析频数及百分比;对于计量资料,采用分段描述频数和百分比的方式,Excel辅助作图。采用SAS 93进行统计分析。
2结果
21监测完成情况及ADR发生率本监测由27家单位参加,共纳入30 209例使用舒血宁的病例,发生ADR 34例,ADE 21例,ADR发生率0113%。27家监测单位纳入病例数及ADR,ADE发生情况见表1。
22ADR及ADE表现1个ADR病例可能有多种ADR或ADE表现,因此34例ADR病例发生了40例次,分别是头痛、头晕、皮肤瘙痒、心悸、恶心等,见表2。21例病例发生ADE 25例次,21例ADE的确定是经过不良反应的三级判读,如19所述,发生原因是疾病的发展进程,或是合并用药所致,与舒血宁用药无关。ADE表现分别是心悸4例次、恶心4例次、头痛2例次、头晕2例次、死亡2例次、腹痛1例次、寒战1例次、流感样症状1例次、脑出血1例次、呕吐2例次、皮疹1例次、上呼吸道感染1例次、手臂血管发红1例次、胃功能紊乱2例次。ADR所涉及的系统包括皮肤及其附件损害、全身性损害等,见表3。
23年龄及性别34例ADR病例中,中老年人占多数,男性13例,女性21例。年龄分布见表4。endprint
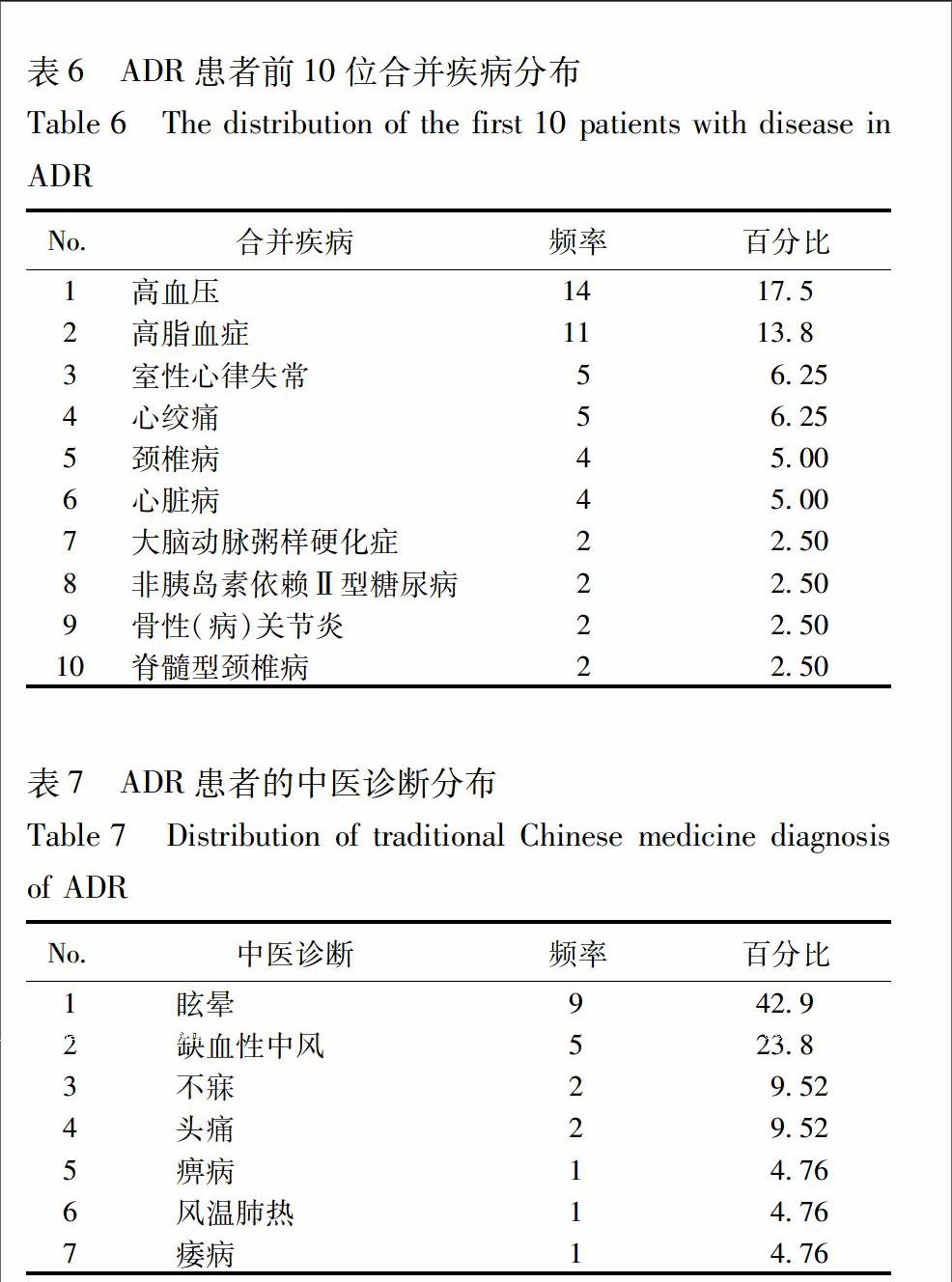
25中医诊断34例ADR患者的中医诊断是眩晕、缺血性中风、不寐、头痛等分布见表7。
26过敏史34例发生ADR的患者中,21例无过敏史,13例有过敏史,过敏原均为药物,包括青霉素类、磺胺类等西药为主。
27舒血宁用药特征34例发生ADR的患者中,使用舒血宁的用药天数方面,1~2 d的11例,3~7 d 的9例,8~14 d 8例,14 d以上的6例;用藥方式均为静脉滴注;溶媒方面,5%葡萄糖注射液20例,09%生理盐水13例,果糖注射液1例,其他溶媒1例;溶媒用量方面,250 mL的16例,150 mL的15例,100 mL的2例,20 mL的1例;单次用药剂量均为20 mL;注射室温方面,25~26 ℃的8例,20~24 ℃的23例,20 ℃以下的1例;配液放置时间方面,0~10 min的24例,11~20 min的4例,21~45 min的6例;滴速方面,30滴/min以下的1例,30~40滴/min的28例,40~60滴/min的5例;注射前冲管的18例,未冲管16例;注射前均未更换输液器;注射后冲管的18例,未冲管16例;注射后均未更换输液器。
28合并用药发生ADR的患者合并用药红花黄色素注射剂、脑蛋白水解物注射剂、天麻素注射剂等见表8。
3讨论
本监测结果表明:30 209例使用舒血宁注射液的病例中,发生ADR 34例,不良反应发生率是113‰,属于偶见不良反应,说明舒血宁注射液的安全性良好。34例ADR病例中,头痛6例,头晕6例,皮肤瘙痒5例,心悸5例,恶心4例,过敏反应3例等。引起不良反应可能的原因如下:①成分:舒血宁注射液主要成分是黄酮类化合物、白果总内酯、蛋白质、多肽、挥发油、酚酸类、色素、树脂等[6],多为大分子致敏物质,进入人体后,可能作为抗原引发过敏反应。因此,要注意用药期间的监测,发现问题及时解决。②患者机体情况:研究发现,发生ADR的患者年龄多为65~80岁的老年人。老年人由于肝肾功能减退,肾小球滤过率和肾小管分泌能力降低、肾血流量明显减少而影响体内药物的排泄,同时组织器官功能减退,靶器官对某些药物作用的敏感性增高,且老年人存在原患疾病多、用药多和营养欠佳的因素均能诱发ADR的发生,所以给老年人用药应谨慎。③合并用药:舒血宁的功能是扩张血管,改善微循环,本研究发现,发生ADR病例使用的合并用药包括红花黄色素注射剂、奥扎格雷钠注射剂、舒血宁注射剂等,以上药物与舒血宁的作用相近,分析出现不良反应的原因可能是药理作用叠加。因此,功能相近的2种注射液应避免连用,如必须联用,需根据患者的体质及疾病特点调整用药剂量,避免使用高剂量,并做好用药监护。以上影响因素的分析仅为可能的情况,若明确不良反应影响因素,仍需前瞻性的机制探讨相关试验加以验证。
既往关于舒血宁不良反应的文献报道众多,其中,杨薇等[7]针对国家药品不良反应监测中心2005年1月1日—2012年12月31日使用舒血宁后发生ADR的9 601 例报告进行的分析,采用了2种不同的统计方法进行ADR预警,报告率比例法探测到的ADR信号为头晕、心悸、静脉炎和呕吐,贝叶斯置信传播神经网络法探测到的信号为头晕和静脉炎。陈红玉等[8]对2015年10月以前的舒血宁注射液安全性文献做了系统分析,发现不良反应特征主要是头晕、头痛、恶心、腹胀、皮疹等。本研究结果与上述2种研究结果均显示:舒血宁的不良反应特征是头晕、头痛等。另外,舒血宁注射液说明书中,不良反应中也记载了头晕、头痛等神经系统症状。因此,头晕头痛等神经系统症状可能是舒血宁注射液的主要不良反应表现。但从方法角度来看,杨薇等[7]采用的是国家自发呈报系统数据分析,该研究无法提供使用舒血宁的整体患者信息,没有分母,不能计算不良反应发生率;陈红玉等[8]采用的是文献系统分析的方法,纳入文献方法学质量评价较低,可能存在选择性偏倚。而本研究为前瞻性大样本注册登记式的医院集中监测研究,可计算不良反应发生率,并且,获得的安全性信息相对来说更为准确。
本研究亦存在一定的局限性。首先,在不良反应判读方面,可能存在一定的低估问题。①漏报轻度不良反应:本监测为医生或药师主导的研究,因无法在用药期间时刻观察患者,可能会出现漏报轻度不良反应的情况;②低估实验室指标异常情况:研究涉及的实验室指标相对较少,有可能会低估实验室检查异常值方面的不良事件/反应;③无法观测远期不良反应:由于观察仅限于用药期间,并不涉及随访,因此,对于远期产生的不良反应无法观测到。其次,在偏倚控制中,本研究为非随机抽样,选取的研究医院为舒血宁用量较大的医院,可能存在一定的选择性偏倚,无法代表广泛人群;同时,由于门诊患者较难得到相应的安全性数据,所以纳入的门诊患者较少,可能会造成一定的偏倚;另外,各监测医院对ADR因果关系的判断及轻重程度的判断方面,因监测者知识结构的不同存在测量偏倚等。
综上所述,通过前瞻性、大样本、医院集中监测研究,发现舒血宁注射液的安全性良好,不良反应特征为头晕、头痛、皮肤瘙痒、心悸、恶心等,不良反应发生率是113‰,属于偶见不良反应,不良反应影响因素可能是舒血宁注射液的药物成分、患者机体情况、合并用药等。通过以上研究,获得舒血宁注射液的安全性信息,以期为临床安全合理用药起到积极的提示作用。
[参考文献]
[1]黄玮舒血宁注射液致不良反应的文献分析与评价[J]中国医院用药评价与分析,2015,15(3):407
[2]毛柳英,曹俊岭,鲁劲松,等1265例舒血宁不良反应回顾性分析[J]世界中西医结合杂志,2016,11(3):352
[3]董景五疾病和有关健康问题的国际统计分类第1卷[M].北京: 人民卫生出版社,2008
[4]陈佑邦,潘筱秦,金棣生,等中医病证分类与代码[M]北京: 中国标准出版社,1995
[5]中国药典一部[S]2015
[6]刘璐舒血宁注射液质量及化学成分研究[D]北京:北京中医药大学,2015
[7]杨薇,谢雁鸣,向永洋基于SRS数据的舒血宁注射液不良反应关联分析[J]中国中药杂志,2014,39(18):3616
[8]陈红玉,谢雁鸣,廖星,等舒血宁注射液治疗心血管疾病安全性的系统评价[J]中国中西医结合杂志,2017,37(3):283
[责任编辑张燕]endprint
