芳香化酶(P450arom)在黄鳝性腺、脑组织中的定位
2017-08-30张厚梅王琳
张厚梅+王琳

摘 要:为了揭示芳香化酶与黄鳝(Monopterus albus)性逆转之间的内在联系和作用机理,以不同性别黄鳝的性腺和腦组织为试验材料,采用免疫组化方法检测芳香化酶在不同性别黄鳝的性腺和脑组织上的定位及其变化趋势。免疫组化结果显示:在雌性黄鳝性腺中,芳香化酶主要分布在成熟卵母细胞的胞质上,卵膜、胞核和不成熟的卵母细胞呈阴性;在雌雄间性黄鳝性腺中,芳香化酶主要分布在的退化卵母细胞膜和纵隔上;在雄性黄鳝性腺中,芳香化酶主要分布在各级精母细胞上。芳香化酶在脑组织中均有分布,并且其染色程度随着黄鳝由雌性转换为雄性而趋于减弱。这意味着黄鳝性腺和脑组织中的芳香化酶可能参与黄鳝的性逆转过程,且与其性别转化密切相关。
关键词:黄鳝(Monopterus albus);芳香化酶;性逆转
中图分类号:S965.1文献标识码:A
在脊椎动物发育过程中,胚胎的早期,原始性腺是呈中性的,它具有分化为卵巢或精巢的双向潜能。在鱼类进化过程中,盐度、pH值、温度以及外源性激素等均可影响其性别分化的方向。芳香化酶能催化雄激素转化为雌激素,它是性腺分化的核心酶,芳香化酶可能调控着性别分化的方向。李广丽[1]用芳香化酶抑制剂进行腹部埋植,结果发现,血清11-酮基睾酮水平显著提高,且能诱导赤点石斑鱼(Epinephelus arkoya)由雌性转变为雄性。另外,在性别形成阶段,使用芳香化酶抑制剂可以使基因型为雌性的罗非鱼(Oreochromis niloticus)、鲑鱼(Oncorhvnchus tschawytscha)转变为功能性雄性鱼[2-3] 。到目前为止,已有斑马鱼(Barchydanio rerio)、罗非鱼等[4-5]的芳香化酶基因片段被分离和克隆,并研究了该基因与性别分化的关系。近年来,越来越多的研究结果表明,芳香化酶与鱼类性别分化密切相关。黄鳝(Monopterus albus),隶属于合鳃目、合鳃科,是我国主要淡水养殖产品之一。黄鳝从胚胎发生阶段到性成熟阶段, 都为雌性, 性成熟以后即可产生卵子, 但在产卵以后, 卵巢慢慢退化消失,逐渐转变为精巢, 随后就可以产生成熟精子,变为雄性,即具有极为罕见的性逆转生理现象。目前,关于芳香化酶在黄鳝脑组织、性腺上的细胞学分布规律仍较少研究。
本试验以黄鳝为试验动物,应用免疫组化技术系统观察芳香化酶在黄鳝脑组织、性腺上的细胞学分布规律,为进一步探讨芳香化酶如何调控动物生殖活动的机理提供参考。
1 材料与方法
1.1 试验动物和主要试剂
2016年4-12月份,从安徽省肥西县境内共采购活体野生黄鳝128尾,实验室暂养,随后分批进行解剖,收集黄鳝性腺和脑垂体,试验时,黄鳝体重为50~180 g,兔抗P450arom 抗体(A7981)购自美国 Sigma公司,PV-9000两步法免疫组化检测试剂盒购自北京中衫金桥生物技术有限公司。
1.2 试验方法
1.2.1 试验动物处理 将上述黄鳝处死,迅速分离大脑、性腺等组织,立即投入多聚甲醛(4%)溶液中进行固定,倒出固定液,用微流水冲洗组织12 h左右,使用不同浓度酒精顺序脱水,二甲苯透明、浸蜡、包埋、切片(5 μm)
1.2.2 免疫组织化学步骤
(1)切片常规脱蜡至水;(2)热修复抗原;(3)灭活内源性酶;(4)滴加一抗P450arom;(5)按照免疫组化检测试剂盒说明,滴加试剂1、2;(6)DAB 显色,蒸馏水洗涤;(7)苏木素复染,脱水,透明,封片。
1.2.3 显微镜观察 在显微镜下观察拍照,阴性对照组呈蓝色,阳性产物染色呈棕黄色。
2 结果与分析
2.1 芳香化酶(P450arom)在黄鳝性腺组织中的定位
2.1.1 芳香化酶在雌性黄鳝性腺上的定位
雌性黄鳝性腺上可观察到大小不一的卵粒,P450arom主要分布在成熟卵母细胞的胞质上(图1B),卵膜、胞核和不成熟的卵母细胞及对照组(图1A、B)呈阴性。
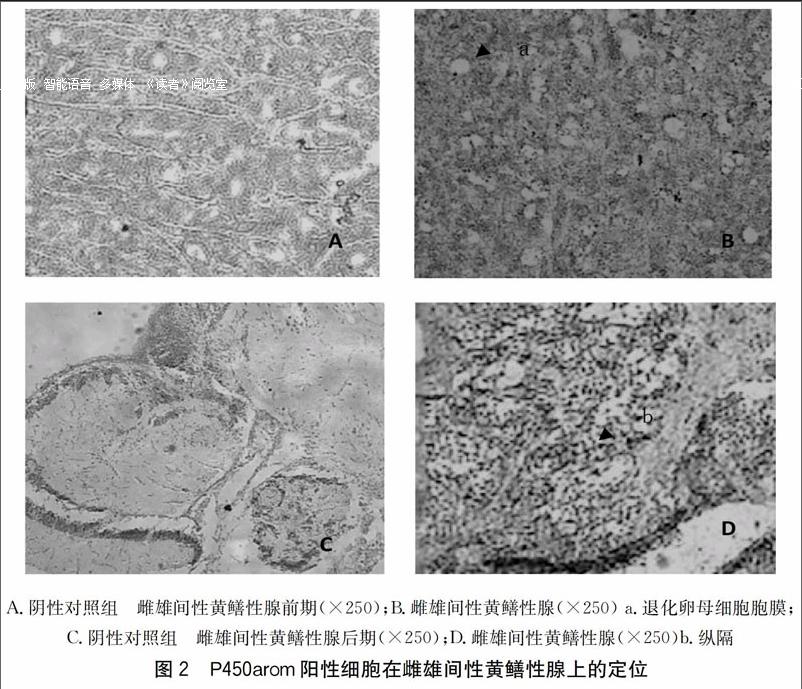
2.1.2 芳香化酶在雌雄间性黄鳝性腺上的定位
雌雄间性黄鳝性腺形态学观察结果显示,既可观察到卵母细胞,还可观察到结缔组织纵隔和在纵隔形成的管状结构的早期精细管。P450arom主要分布在退化卵母细胞膜(图2B)和纵隔(图 2D)上。
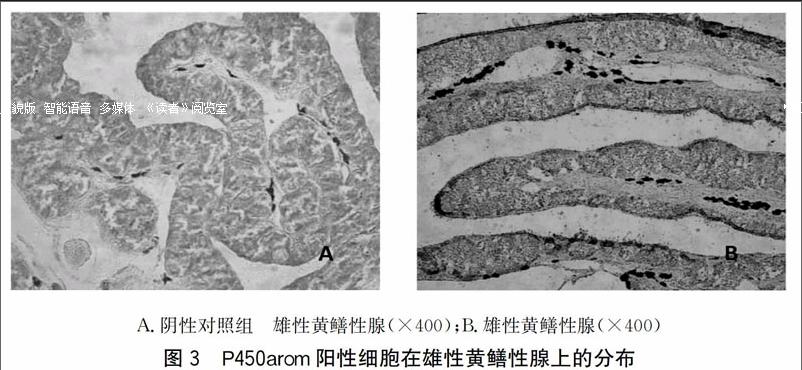
2.1.3 芳香化酶在雄性黄鳝性腺上的定位
雄性黄鳝组织切片中可观察到精母细胞,且带有黑色斑点,P450arom主要分布在各级精母细胞上,染色较浅(图3)。
2.2 芳香化酶(P450arom)在黄鳝脑组织中的定位
在黄鳝的脑组织中,芳香化酶主要分布在神经细胞的胞核内(图4 A、B、C)。对照组无阳性细胞(图4 D)。且芳香化酶在雌性(图4 A)雌雄间性(图4 B)、雄性(图4 C)黄鳝的脑组织中的染色越来越浅。
3 讨论
黄鳝属于硬骨鱼纲,黄鳝亚科,是一种具有天然单向性逆转特性的动物。雌性发育的第一个周期内黄鳝个体性腺全部表现为雌性特征,性成熟后,卵巢内卵细胞逐渐凋亡,卵巢结构趋于退化,与此同时雄性生殖细胞开始发育,通过雌雄间性发育过渡到雄性表征。
目前关于鱼类性腺分化的机理目前尚不清楚,现有的研究结果更多的是倾向于性激素比率假说和下丘脑控制学说[6],认为鱼类性腺分化与雄激素/ 雌激素比值的高低密切相关,而芳香化酶能够催化睾酮转化为雌二醇,所以芳香化酶与鱼类性腺分化可能存在潜在的联系。本实验通过免疫组化技术系统研究芳香化酶在黄鳝性腺和脑组织上的分布。
在雌性黄鳝的性腺中,可清晰地看到不同形状的卵母细胞,不少卵黄颗粒沉积在细胞内,有的卵黄颗粒充满整个卵母细胞,核也逐渐边移。同时,卵巢内存在少数一、二期的卵母细胞。免疫组化结果表明,芳香化酶主要分布在成熟卵母细胞的胞质上,不成熟的卵母细胞、卵泡膜和胞核呈阴性。由此看来,成熟卵母细胞转换雄激素为雌激素的能力大于未成熟的卵母细胞。同时,我们发现卵泡体积越大,染色越深,这意味着芳香化酶的活性随着卵泡体积的增大而增加。
在雌雄间性的黄鳝中,显微镜下可见较少的细小卵细胞,但几乎不能发育成熟,而是逐渐凋亡吸收,同时可看到曲精小管的雏形。芳香化酶主要分布在退化卵母細胞膜和纵隔上。其染色较浅,意味着活性减弱,芳香化酶活性减弱直接导致血液中雌二醇水平降低,从而加快了卵母细胞退化速度,促进雄性生殖细胞增殖。
在雄性黄鳝中,可见未成熟的精巢细长,表面有色素斑点,黑色斑点可能是卵母细胞退化凋亡的痕迹。显微镜下可见曲精小管及精子,成熟的黄鳝精巢表面有黑色细纹,并且存在大量成熟的精子。免疫组化结果显示,芳香化酶在黄鳝睾丸中的表达呈弱阳性,主要分布在睾丸间质细胞、支持细胞和生精细胞中。杜启艳等[7]采用半定量RT-PCR方法研究芳香化酶在泥鳅(Misgurnus anguillicaudatus)各组织中的表达时发现在睾丸中几乎无表达。由此可见,芳香化酶在不同鱼类睾丸中的表达并不一致。
芳香化酶在脑组织免疫组化结果表明,它主要分布在神经细胞内,这意味着它可能直接参与调节雌激素的合成,从而影响黄鳝的性别分化。芳香化酶可能在中枢神经系统上参与调节神经内分泌[8]。这和其他鱼类P450arom 在脑组织的表达研究结果不完全相同[9]。Kishida M使用Northern 杂交发现P450arom在斑马鱼的脑没有表达[10]。造成各研究结果不同可能与所研究鱼的类别、生长发育阶段有关。芳香化酶在雌性、雌雄间性、雄性黄鳝的脑组织中的染色越来越浅,这意味着芳香化酶的活性愈来愈弱,即雌激素的水平愈来愈低。
由此看来,黄鳝中芳香化酶的活性与个体发育阶段和性别密切相关,这与Anderson E[11]的结果类似。同时进一步证明了芳香化酶参与黄鳝的性逆转过程,通过生殖轴对未分化的性腺产生影响,进而影响脑和性腺的性别分化。目前,对黄鳝的性逆转发生的机制并没有彻底研究清楚,有必要对芳香化酶进行进一步研究,以阐明黄鳝脑及性腺性别决定和分化的机制。
参考文献:
[1] 李广丽.芳香化酶及其抑制剂对赤点石斑鱼性逆转的作用[D].中山:中山大学,2005:108-117
[2] Kwon J Y, Haghpanah V, Kogson Hurtodo L M,et al.Masculinization of genetic female Nile tilapia (Oreochromis niloticus) by dietary administration of an aromatase inhibitor during sexual differentiation[J].J Exp Zool, 2000(287) :46-53
[3] Pifferrer F, Zanuy S, Carrillo M, et al.Brief treatment with an aromatase inhibitor during sex differentiation causes chromosomally female salmon to develop as normal functional males[J].J Exp Zool, 1994(270):255-262
[4] Kishida M, Callard GV.Distinct cytochrome P450 aromatase isoforms in zebrafish (Danio rerio)brain and ovary are differentially programmed and estrogen regulated during early development[J].Endocrinology, 2001(142):740-750
[5] Kwon J Y, McAndrew B J,Penman D J.Cloning of brain aromatase gene and expression of brain and ovarian aromatase genes during sexual differentiation in genetic male and female Nile tilapia Oreochromis niloticus[J].Mol Reprod Dev,2001(59) :359-370
[6] Pellegrini E, Menuet A, Lethimonier C,et al.Relationships between aromatase and estrogen receptors in the brain of teleost fish[J].Gen Comp Endocrinol .2005(142) :60-66
[7] 杜启艳,南平,燕帅国,等.两种泥鳅芳香化酶基因的克隆与时空表达[J].水生生物学报,2006(3):276-283
[8] Lephart E D.A review of brain aromatase cytochrome P450[J].Brain ResReviews, 1996(22):1-26
[9] Tchoudakova A, Callard G V.Identification of multiple CYP19 genes encoding different cytochrome P450 aromatase isozymes in brain and ovary[J].Endocrinology, 1998(139) :2179 -2189
[10] Anderson E, Borg B, Lambert JGD.Aromatase activity in brain and pituitary of immature and mature Atlantic salmon(Salmo salar L.) parr[J].Gen Comp Endocrinol,1988(72):394-401.
