论阿伏伽德罗常量
2017-08-30林则东
林则东
(南昌航空大学环境与化学工程学院 江西 南昌 330063)

论阿伏伽德罗常量
林则东
(南昌航空大学环境与化学工程学院 江西 南昌 330063)
对阿伏伽德罗常量做了深入探讨.
阿伏加德罗 常量 探讨
阿伏伽德罗常量NA=6.02×1023mol-1是一个重要的物理量,频繁地出现在热力学和统计物理学的方程中.尤其是在化学学科,阿伏伽德罗常量的引入,进一步发展了分子理论,加深了人们对微观世界的理解,使得化学计算大大简化,给化学研究带来了深刻的影响.
1 阿伏伽德罗常量的提出
为了协调道尔顿的原子论[1]与盖吕萨克基于实验中提出的“在同温同压下,相同体积的不同气体含有相同数目的原子”这一假说之间的矛盾,阿伏伽德罗以其深刻的洞察力和严密的逻辑发展了道尔顿的原子理论,提出了分子假说并提出了阿伏伽德罗定律:“在同温同压下,相同体积的不同气体具有相同数目的分子.”[2]
阿伏伽德罗定律可以表示为
V=C(T,p)N
(1)
式中V代表气体的体积,N代表气体分子数,C(T,p)为比例系数.
由于气体分子数N是一个庞大的数,为了计算方便,物理学家引入了物质的量这一物理量,令

(2)
式中NA即为阿伏伽德罗常量.将式(2)代入式(1),可得
V=C(T,p)NAn=Vmn
其中Vm=C(T,p)NA即为气体摩尔体积.
根据理想气体的状态方程[3,4],我们可以得出

当T=273.15K,p=1.01×105Pa时,Vm=22.4L·mol-1.
2 阿伏伽德罗常量的确定
单从物质的量的定义出发,我们是无法确定阿伏伽德罗常量的值的.因为根据物质的量的定义式(2),NA的取值可以任意,只不过NA的取值越大,1mol分子所含的分子数越多[4].
为了使化学计算方便,化学家提出了摩尔质量的概念,规定了质量在数值上等于物质相对分子质量的物质所含的分子数目为1mol分子,即[4]
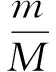
(3)
联立式(2)、式(3),可得
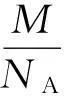

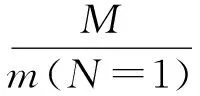
M的数值可以查元素周期表,所以想要确定阿伏伽德罗常量的数值,需要测出一个分子的质量m(N=1).分子是由原子构成的.所以分子的质量等于构成分子的原子的质量和
原子的质量主要集中在原子核上,所以只要测出构成分子的原子核质量就行.原子核的质量可以通过荷质比测量出来[3].
1 道尔顿. 化学哲学新体系.北京:北京大学出版社,2006
2 雷·斯潘根贝格,黛安娜·莫泽. 科学的旅程.北京:北京大学出版社,2014
3 陈治,陈祖刚, 刘志刚.大学物理(上).北京:清华大学出版社, 2007
4 苏汝铿.统计物理学(第2版).北京:高等教育出版社,2004
Discussion on Avogadro Constant
Lin Zedong
(College of Environment and Chemical Engineering, Nanchang Hangkong University, Nanchang, Jiangxi 330063)
In this article, the Avogadro constant is deeply discussed.
Avogadro; constant; discussion
2017-02-10)
