胆源性急性胰腺炎与高脂血症性急性胰腺炎的比较及急性胰腺炎与甘油三酯的相关性研究
2017-08-29余保平林梦娟
陈 雷,余保平,林梦娟
武汉大学人民医院消化内科,湖北 武汉 430060
胆源性急性胰腺炎与高脂血症性急性胰腺炎的比较及急性胰腺炎与甘油三酯的相关性研究
陈 雷,余保平,林梦娟
武汉大学人民医院消化内科,湖北 武汉 430060
目的 比较胆源性急性胰腺炎(biliary acute pancreatitis,BAP)与高脂血症性急性胰腺炎(hypertriglyceridemia induced acute pancreatitis,HTGAP)相关早期临床指标的差异,并探讨血清甘油三酯(triglyceride,TG)对急性胰腺炎(acute pancreatits,AP)病程进展的影响。方法 收集武汉大学人民医院2015年1月-2015年12月收治的205例AP患者,按照病因分为BAP组和HTGAP组,并比较两组间人口统计学特征及入院48 h内Ranson评分、BISAP评分和生化指标的差异,以ROC曲线分别评价血淀粉酶和血脂肪酶对以上两种胰腺炎的早期预测和诊断效能,并进行比较。以预测SAP时效能最高的TG水平为临界值,将AP患者分为两组,比较不同AP患者入院48 h内Ranson评分、BISAP评分和生化指标的差异。结果 BAP组与HTGAP组年龄、红细胞比容、血钙、载脂蛋白E(Apo E)和血糖水平比较,差异有统计学意义(P<0.05),HTGAP组急性肾损伤(acute kidney injury, AKI)的发生率为16.4%,明显高于BAP组(7.1%,P<0.05)。HTGAP组血淀粉酶水平明显低于BAP组(P<0.05),血淀粉酶早期预测和诊断HTGAP时AUC明显小于BAP组(0.336vs0.664,P<0.05),且其灵敏度和特异度均较低。与TG<3.325 mmol/L的AP患者相比,TG高于该水平的患者Ranson评分升高、住院时间明显延长,中性粒细胞比例、红细胞比容、血糖、Apo E、C反应蛋白(CRP)及高敏C反应蛋白(HS-CRP)明显升高,且SAP所占比例及AKI的发生率明显增加(P<0.05),而血淀粉酶和血钙水平明显降低(P<0.05)。结论 与BAP相比,HTGAP患者重度倾向不明显,但易发生AKI。随着血TG水平升高,AP的重度倾向越明显,AKI的发生率也越高。血淀粉酶预测和诊断HTGAP的准确度、敏感性及特异性均低于预测和诊断BAP时相应的指标。
高脂血症性急性胰腺炎;胆源性急性胰腺炎;甘油三酯
急性胰腺炎(acute pancreatitis,AP)最常见的病因包括胆石症、饮酒和高脂血症,不同国家和地区AP病因构成的比例有所不同。在我国胆石症仍然是引起AP最重要的病因[1]。近年来随着生活方式和饮食结构的改变,相关研究发现高脂血症,特别是高甘油三酯血症与AP关系密切,可引起高甘油三酯性急性胰腺炎(hypertriglyceridemia induced acute pancreatitis,HTGAP)。HTGAP的发病率也呈逐年上升趋势,20年前,HTGAP的发病率为1.3%~3.8%[2]。10余年前,台湾的研究显示该指标达12.3%[3]。Ⅰ型、Ⅴ型和Ⅳ型高脂血症是AP的主要危险因素[4]。目前认为能引起高脂血症的因素,包括脂蛋白脂酶的基因多态性和载脂蛋白C-Ⅱ缺陷,均能导致AP[5]。高甘油三酯血症诱发AP无明确的临界值,当血浆TG的浓度>11.3 mmol/L时,即可自发导致AP。当前高甘油三酯血症引起AP的相关机制还未被完全阐明。血TG降解产生的游离脂肪酸引起的炎症反应及毛细血管损伤在发病过程中可能起到重要作用,此外血液的黏滞度增加及其所致的胰腺微循环障碍也是其主要的发病机制。其次高脂血症的严重程度与AP严重程度之间的关系一直未得到证实,观点大致分为两类。血TG浓度越高,AP病情就越严重;也有研究认为AP的发展进程和预后不受促发因素的影响,与血脂浓度无关[6]。本研究将比较胆源性急性胰腺炎(biliary acute pancreatitis,BAP)和HTGAP患者临床指标差异,旨在探索促发因素对AP病程的影响,并进一步比较不同TG水平时AP病情的严重程度,旨在探讨TG水平对AP进程的影响。
1 资料与方法
1.1 一般资料 将2015年1月-2015年12月武汉大学人民医院收治的符合急性胰腺炎诊断标准[7]的205例AP患者,根据以下标准对其进行病因学分类。BAP的诊断依据为:(1)符合AP的诊断标准;(2)既往有胆石症和(或)胆绞痛发作史;(3)存在肝功能异常,转氨酶和(或)胆红素升高;(4)影像学检查、ERCP或手术探查证实胆道结石合并AP。HTGAP的诊断依据为:符合AP的诊断标准,血TG>11.3 mmol/L;或虽然TG为5.56~11.3 mmol/L,但血液呈乳糜状,需排除BAP、酒精性AP及其他原因所致的AP。
2013年新版亚特兰大急性胰腺炎分类标准[8]推荐将AP的严重程度划分为以下三类:(1)MAP:不伴器官功能衰竭及局部或全身并发症,通常在1~2周内恢复,具有自限性;Ranson评分<3分,BISAP评分<3分;(2)MSAP:伴有一过性的器官功能衰竭(48 h内可自行恢复),或伴有局部或全身并发症;Ranson评分≥3分,BISAP评分≥3分;(3)SAP:伴有持续性器官功能衰竭(即持续48 h以上,不能自行恢复的呼吸系统、心血管系统或肾脏功能衰竭,可累及一个或多个器官)。
1.2 数据采集 设计专用表格采集研究对象的人口统计学资料、烟酒嗜好、起病到就诊的入院前时间、入院后生命体征和48 h内血生化指标、住院期间病情变化、住院天数、转归等信息,根据相关临床参数行Ranson[9]和BISAP[10]评分。
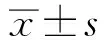
2 结果
2.1 临床资料的比较 205例AP患者中,BAP患者占41.5%(85例),HTGAP 占29.8%(61例),酒精性AP占13.2%(27例),ERCP术后占0.98%(2例),其他原因(包括外伤性、Oddi括约肌功能紊乱、药物性、胰腺分裂、特发性等)占14.6%(30例)。比较BAP和HTGAP患者临床资料的差异,以评价不同AP促发因素对病情的影响(见表1)。HTGAP组的发病年龄明显小于BAP组(P<0.05),且男性患者所占比例较高(P<0.05)。此外,HTGAP患者的吸烟与饮酒率明显高于BAP患者(P<0.05)。SAP所占比例、Ranson评分、BISAP评分和住院时间在两组间的差异均无统计学意义(P>0.05)。HTGAP组的红细胞比容、CRP、Apo E及血糖水平明显高于BAP组(P<0.05),血钙水平较之明显下降(P<0.05),而中性粒细胞比例、血肌酐和血尿素氮未见明显差异(P>0.05)。反应肝功能的指标,如ALT、AST在BAP组明显升高,差异有统计学意义(P<0.05)。BAP组血淀粉酶水平明显高于HTGAP组(P<0.05),但血脂肪酶水平差异无统计学意义(P>0.05)。PCT、D-二聚体在BAP组有所升高,但两组比较,差异无统计学意义(P>0.05)。HTGAP患者的AKI发生率明显高于BAP患者(P<0.05,见表1)。
2.2 胰酶对BAP及HTGAP患者的预测价值 以ROC曲线评价血淀粉酶和血脂肪酶对HTGAP的预测和诊断效能,并与BAP作比较(见表2)。结果显示,血淀粉酶预测HTGAP时其AUC仅为0.336,明显小于BAP组,表明血淀粉酶预测HTGAP时准确性明显小于预测BAP时的准确性。此外,血淀粉酶预测HTGAP时的最佳临界值为270.5 U/L,小于预测BAP时的临界值,且相应的灵敏度和特异度均较低。此外,血脂肪酶预测BAP和HTGAP时AUC均较小,分别为0.592和0.408,表明血脂肪酶预测与诊断AP时准确性较血淀粉酶低。
表1 BAP组与HTGAP组各临床指标的比较
Tab 1 Comparison of clinical indicators between BAP group and HTGAP group

临床资料BAP组(n=85)HTGAP组(n=61)P值年龄(x±s,岁)59.91±16.8243.33±11.640.000男性[n(%)]30(35.3)33(54.1)0.024吸烟[n(%)]8(9.4)13(21.3)0.044饮酒[n(%)]8(9.4)17(27.9)0.004SAP[n(%)]15(17.7)15(24.6)0.785Ranson评分(x±s)2.78±1.653.00±1.890.449BISAP评分(x±s)1.49±1.081.28±0.970.216住院时间(x±s,d)11.87±5.14 12.28±4.76 0.741中性粒细胞比例(x±s,%)82.64±11.6783.69±7.59 0.519红细胞比容(x±s)0.382±0.0530.412±0.04800.001ALT(x±s,U/L)252.77±244.1734.17±27.160.000AST(x±s,U/L)240.85±238.5947.07±61.980.000血尿素氮(x±s,mmol/L)5.93±3.866.43±4.400.475血肌酐(x±s,μmol/L)75.91±93.0583.26±66.630.605血钙(x±s,mmol/L)2.06±0.281.93±0.400.028血糖(x±s,mmol/L)7.54±3.349.80±6.300.012ApoE(x±s,mg/L)42.70±15.2997.45±53.170.000TG(x±s,mmol/L)1.50±1.2913.21±10.920.000血淀粉酶(x±s,U/L)1329.13±1316.66759.88±1167.530.008血脂肪酶(x±s,U/L)6160.15±6989.543814.58±6455.250.058HS-CRP(x±s,mg/L)72.77±81.94109.89±80.23 0.146CRP(x±s,mg/L)93.00±80.21128.50±77.47 0.038PCT(x±s,ng/ml)8.57±18.994.33±11.590.421D-二聚体(x±s,mg/L)2.98±2.622.73±2.980.629AKI[n(%)]6(7.1)10(16.4)0.013
表2 血淀粉酶、血脂肪酶对BAP和HTGAP患者的预测效能
Tab 2 The discriminatory power of amylase and lipase for BAP and HTGAP patients

组别临界值(μ/L)P值AUC95%CI灵敏度(%)特异度(%)阳性似然比阴性似然比Youden指数淀粉酶 BAP510.00.0010.6640.572~0.75572.360.31.8210.4590.326 HTGAP270.50.0010.3360.245~0.42863.822.90.8271.581-0.133脂肪酶 BAP1804.50.0720.5920.494~0.69062.255.21.3880.6850.174 HTGAP469.00.0720.4080.310~0.50693.121.61.1880.3190.147
2.3 不同TG水平患者的临床资料比较 205例研究对象中,共有182例患者早期检测了血TG,统计结果显示TG水平随着AP严重程度增加有上升趋势,分别为MAP:(4.11±6.25)mmol/L、MSAP:(5.00±6.36)mmol/L、SAP: (8.79±13.21)mmol/L,TG与SAP关联性的Logistic回归分析所得TG最佳临界值为3.325 mmol/L,关联系数为1.261(OR=3.529,95%CI:1.587~7.851)。将该部分患者以3.325 mmol/L为临界值,分为两组,A组患者的血TG<3.325 mmol/L,共118例;B组患者血TG>3.325 mmol/L,共64例。比较两组间各指标的差异(见表3)。比较发现,B组患者的年龄明显小于A组(P<0.05)。两组间性别构成无明显差异。B组中SAP所占比例和AKI的发生率分别为29.7%(19/64)和18.8%(10/64),明显高于A组(P<0.05),且Ranson评分和住院时间较之明显延长(P<0.05),但两组的BISAP评分未见明显差异(P>0.05)。此外,B组的中性粒细胞比例、红细胞比容、血糖、Apo E、CRP和HS-CRP水平明显升高(P<0.05),而血钙和血淀粉酶水平明显下降(P<0.05)。PCT、D-二聚体、血肌酐、尿素氮、血脂肪酶在两组间未见明显差异。
表3 不同TG水平患者各临床指标的比较
Tab 3 Comparison of clinical indicators between two groups
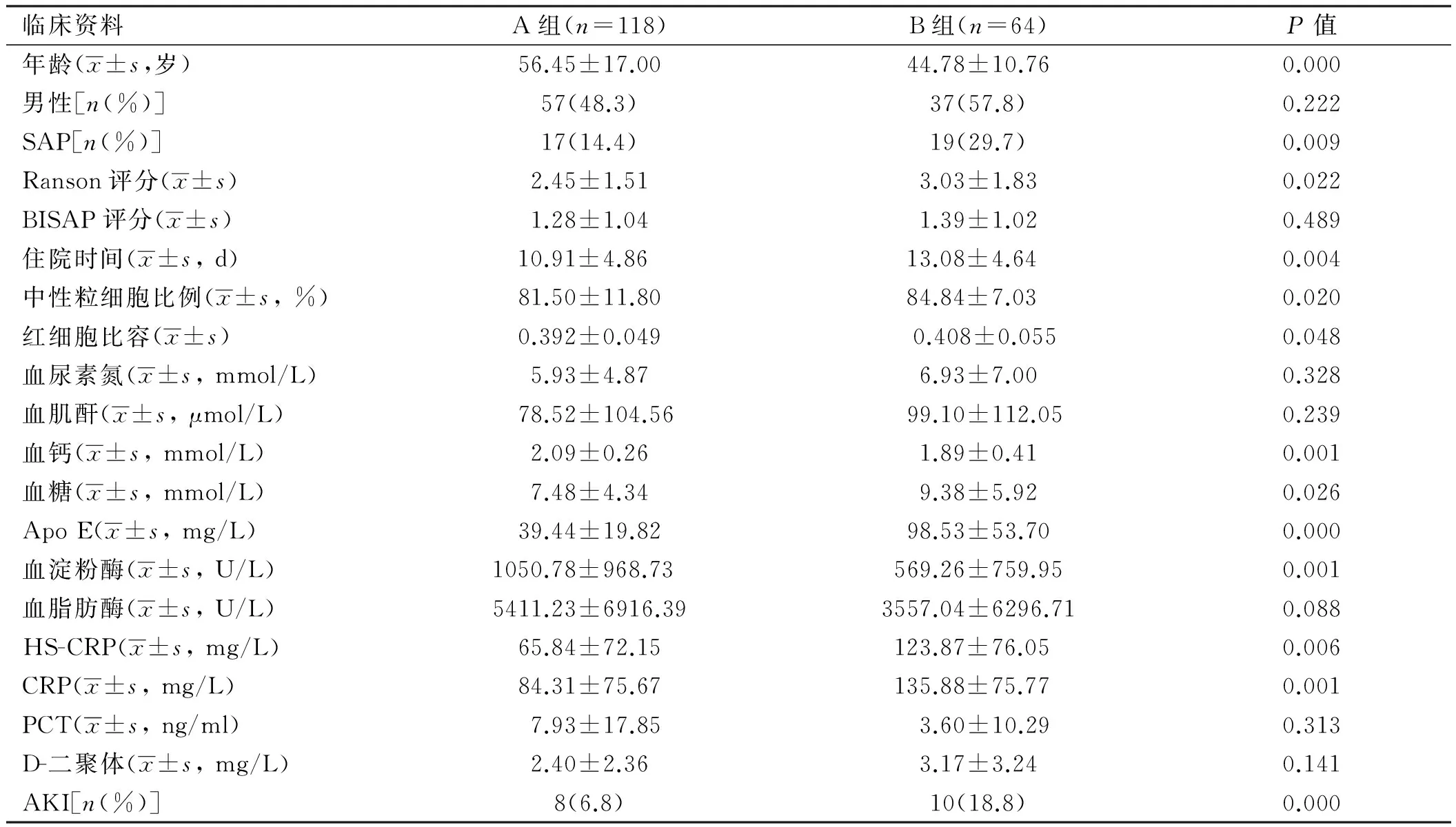
临床资料A组(n=118)B组(n=64)P值年龄(x±s,岁)56.45±17.0044.78±10.760.000男性[n(%)]57(48.3)37(57.8)0.222SAP[n(%)]17(14.4)19(29.7)0.009Ranson评分(x±s)2.45±1.513.03±1.830.022BISAP评分(x±s)1.28±1.041.39±1.020.489住院时间(x±s,d)10.91±4.86 13.08±4.64 0.004中性粒细胞比例(x±s,%)81.50±11.8084.84±7.03 0.020红细胞比容(x±s)0.392±0.0490.408±0.0550.048血尿素氮(x±s,mmol/L)5.93±4.876.93±7.000.328血肌酐(x±s,μmol/L)78.52±104.5699.10±112.050.239血钙(x±s,mmol/L)2.09±0.261.89±0.410.001血糖(x±s,mmol/L)7.48±4.349.38±5.920.026ApoE(x±s,mg/L)39.44±19.8298.53±53.700.000血淀粉酶(x±s,U/L)1050.78±968.73 569.26±759.950.001血脂肪酶(x±s,U/L)5411.23±6916.393557.04±6296.710.088HS-CRP(x±s,mg/L)65.84±72.15123.87±76.05 0.006CRP(x±s,mg/L)84.31±75.67135.88±75.77 0.001PCT(x±s,ng/ml)7.93±17.853.60±10.290.313D-二聚体(x±s,mg/L)2.40±2.363.17±3.240.141AKI[n(%)]8(6.8)10(18.8)0.000
3 讨论
本研究显示HTGAP患者较BAP患者年龄偏小、男性所占比例偏高,与Ivanova等[11]研究结果一致。本研究发现HTGAP患者的血Apo E水平明显高于BAP患者,且血TG越高,Apo E就越高。Apo E属于载脂蛋白的一种,编码基因位于19号染色体上,其可携带富含TG的颗粒,可与LDL受体及LDL相关受体结合,目前认为其可能与阿尔茨海默病及神经损伤相关。近年来研究发现,HTGAP患者Apo E基因e4的等位基因出现更加频繁,存在基因突变[11]。因此该研究认为HTGAP的发生与Apo E基因突变相关。也有研究认为Apo E基因型的改变也与HTGAP的复发密切相关[12]。
该研究显示与严重程度相关的指标,如SAP所占比例、Ranson评分、BISAP评分及住院时间在BAP和HTGAP患者间均无明显差异,但HTGAP患者的AKI发生率却明显高于BAP。表明与BAP相比,HTGAP患者重度倾向不明显,但易发生AKI。目前不少研究认为HTGAP患者病情更为严重,重度倾向更明显,相关并发症发生率和死亡率更高,预后更差[13]。法国的一项队列研究显示SAP患者的比例在HTGAP组高达71.5%,明显高于BAP组和酒精性AP组[14]。
本研究发现HTGAP患者的CRP水平明显高于BAP患者,该差异表明使用CRP评价HTGAP患者的严重程度、AKI的发生风险或预测和诊断胰腺坏死时,CRP的最佳临界值可能不同于BAP患者。因此,使用相同的临界值评价不同种类的AP具有一定的弊端。
本研究发现血淀粉酶预测HTGAP时其AUC仅为0.336,明显小于BAP(0.664),血淀粉酶处于其最佳临界值270.5 U/L时,相应的灵敏度和特异度均较低。表明血淀粉酶用于预测和诊断HTGAP时准确度、灵敏度及特异度均低于预测和诊断BAP时相应的指标,且用于预测两种不同病因的AP时其临界值不同,HTGAP患者的临界值明显小于BAP。其可能的原因为HTGAP时含有TG浓度较高的脂血血清能干扰胰酶的准确测定,从而影响其对AP的诊断效能。本研究还发现血脂肪酶预测和诊断HTGAP和BAP的准确性均较低。Navarro等[15]研究显示血清淀粉酶和脂肪酶诊断HTGAP的准确性分别为26%和58%,明显小于诊断BAP时的准确性,分别为58%和79%。因此可以发现,胰酶对HTGAP的诊断价值低于对BAP的诊断价值。
本研究显示,血TG水平越高,AP的重度倾向越明显,AKI的发生率也越高。其可能的机制为血TG在胰腺脂肪酶的作用下可产生具有促炎作用的游离脂肪酸,从而进一步加重对胰腺腺泡的损伤[16],并参与AKI的发生和发展过程[17],在此过程中血TG浓度越高,相关的损伤就越严重。由此可见血TG水平可影响AP的发生及发展过程,但其常于发病的48 h内迅速下降,因此对于AP患者应当早期检测血TG,如果延迟检测可能会出现假阴性结果[18]。
综上所述,HTGAP患者Apo E水平明显高于BAP患者,Apo E基因改变可能与HTGAP的发生和复发相关。与BAP相比,HTGAP患者重度倾向不明显,但易发生AKI。血TG水平越高,AP的重度倾向越明显,AKI的发生率也越高。血淀粉酶用于预测和诊断HTGAP时准确度、灵敏度及特异度均低于预测和诊断BAP时相应的指标。
[1]Moreau JA, Zinsmeister AR, Melton LJ 3rd, et al. Gallstone pancreatitis and the effect of cholecystectomy: a population-based cohort study [J]. Mayo Clin Proc, 1988, 63(5): 466-473.
[2]Fortson MR, Freedman SN, Webster PD 3rd. Clinical assessment of hyperlipidemic pancreatitis [J]. Am J Gastroenterol, 1995, 90(12): 2134-2139.
[3]Chang MC, Su CH, Sun MS, et al. Etiology of acute pancreatitis-a multi-center study in Taiwan [J]. Hepatogastroenterology, 2003, 50(53): 1655-1657.
[4]Dickson AP, O’Neill J, Imrie CW. Hyperlipidaemia, alcohol abuse and acute pancreatitis [J]. Br J Surg, 1984, 71(9): 685-688.
[5]Santamarina-Fojo S, Brewer HB Jr. The familial hyperchylomicronemia syndrome. New insights into underlying genetic defects [J]. JAMA, 1991, 265(7): 904-908.
[6]Uhl W, Isenmann R, Curti G, et al. Influence of etiology on the course and outcome of acute pancreatitis [J]. Pancreas, 1996, 13(4): 335-343.
[7]Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis-2012: revision of the Atlanta classification and definitions by international consensus [J]. Gut, 2013, 62(1): 102-111.
[8]Banks PA, Bollen TL, Dervenis C, et al. Classification of acute pancreatitis--2012: revision of the Atlanta classification and definitions by international consensus [J]. Gut, 2013, 62(1): 102-111.
[9]Ranson JH, Pasternack BS. Statistical methods for quantifying the severity of clinical acute pancreatitis [J]. J Surg Res, 1977, 22(2): 79-91.
[10]Singh VK, Wu BU, Bollen TL, et al. A prospective evaluation of the bedside index for severity in acute pancreatitis score in assessing mortality and intermediate markers of severity in acute pancreatitis [J]. Am J Gastroenterol, 2009, 104(4): 966-971.
[11]Ivanova R, Puerta S, Garrido A, et al. Triglyceride levels and apolipoprotein E polymorphism in patients with acute pancreatitis [J]. Hepatobiliary Pancreat Dis Int, 2012, 11(1): 96-101.
[12]Wen T, Liu L, Nie S. The relationship between apolipoprotein E genotypean hypertriglyceridemia-associated recurrent acute pancreatitis[J]. Zhonghua Wai Ke Za Zhi, 2008, 46(20): 1579-1582.
[13]Deng LH, Xue P, Xia Q, et al. Effect of admission hypertriglyceridemia on the episodes of severe acute pancreatitis [J]. World J Gastroenterol, 2008, 14(28): 4558-4561.
[14]Lloret Linares C, Pelletier AL, Czernichow S, et al. Acute pancreatitis in a cohort of 129 patients referred for severe hypertriglyceridemia [J]. Pancreas, 2008, 37(1): 13-20.
[15]Navarro S, Cubiella J, Feu F, et al. Hypertriglyceridemic acute pancreatitis. Is its clinical course different from lithiasic acute pancreatitis[J]. Med Clin (Barc), 2004, 123(15): 567-570.
[16]Nagayama D, Shirai K. Hypertriglyceridemia-induced pancreatitis [J]. Nihon Rinsho, 2013, 71(9): 1602-1605.
[17]Sztefko K, Panek J. Serum free fatty acid concentration in patients with acute pancreatitis [J]. Pancreatology, 2001, 1(3): 230-236.
[18]Dominguez-Muoz JE, Malfertheiner P, Ditschuneit HH, et al. Hyperlipidemia in acute pancreatitis. Relationship with etiology, onset, and severity of the disease [J]. Int J Pancreatol, 1991, 10(3-4): 261-267.
(责任编辑:李 健)
The comparison between biliary acute pancreatitis and hypertriglyceridemia induced acute pancreatitis, and the relation between triglyceride and acute pancreatitis
CHEN Lei, YU Baoping, LIN Mengjuan
Department of Gastroenterology, Renmin Hospital of Wuhan University, Wuhan 430060, China
Objective To compare the differences of early related clinical indicators between biliary acute pancreatitis (BAP) and hypertriglyceridemia induced acute pancreatitis (HTGAP). And to investigate the influence of serum triglyceride (TG) level on the progression of acute pancreatitis (AP).Methods A retrospective analysis of 205 patients with AP from Jan. 2015 to Dec. 2015 in Renmin Hospital of Wuhan University was performed. AP patients were divided into BAP group and HTGAP group according to etiology, the differences in demographic characteristics, the indicators within 48 hours after admission such as Ranson score, BISAP score and biochemical indexes were compared. The early predictive and diagnostic performance of serum amylase and lipase in predicting BAP and HTGAP were evaluated byROCcurve and the differences were compared. The patients were divided into two groups according to the serum TG level at which the accuracy was optimum when used to predict SAP. Differences of the clinical indicators within 48 hours after admission such as Ranson score, BISAP score and biochemical indexes between two groups were compared.Results There were significant differences in age, hematocrit, serum calcium, apolipoprotein E (Apo E) and blood glucose between BAP group and HTGAP group (P<0.05). The incidence of acute kidney injury (AKI) in HTGAP group was 16.4%, significantly higher than that in BAP group (7.1%,P<0.05). The serum amylase levels in HTGAP group were significantly lower than the BAP group (P<0.05). TheAUCof serum amylase byROCcurve in predicting HTGAP was 0.336, significantly less than that in BAP (0.664,P<0.05), and the sensitivity and specificity were relatively lower. Ranson score, length of stay, the percentage of the neutrophils, hematocrit, blood glucose, Apo E,CRP and HS-CRP were significantly increased in the group whose TG was higher than 3.325 mmol/L. Furthermore, the proportion of SAP and the incidence of AKI were significantly higher than that in patients with TG below 3.325 mmol/L (P<0.05). The serum amylaze and serum calcium were significantly lower (P<0.05).Conclusion The severe tendency of HTGAP patients is not obvious, but they are more vulnerable to AKI compared with patients with BAP. The higher of TG is the more likely to aggravate the state of AP, and the incidence of AKI is higher. The accuracy, sensitivity and specificity of serum amylase when used to predict and diagnose HTGAP are lower than these of BAP.
Hypertriglyceridemia induced acute pancreatitis; Biliary acute pancreatitis; Triglyceride
陈雷,在读硕士研究生。E-mail:1603009736@qq.com
余保平,博士,主任医师,研究方向:胃肠道动力、内脏痛。E-mail:yubp62@163.com
10.3969/j.issn.1006-5709.2017.07.009
R576
A
1006-5709(2017)07-0749-05
2016-12-17
