盐酸川芎嗪通过干预GABAR和FOXP2的表达保护低压低氧大鼠学习记忆
2017-08-29李晓娜汪晓筠朱艳媚曹成珠杨春燕严云飞赵延礼李生花
李晓娜,汪晓筠,朱艳媚,曹成珠,杨春燕,严云飞,赵延礼,李生花
(青海大学医学院基础医学部生理学教研室,青海 西宁 810016)
盐酸川芎嗪通过干预GABAR和FOXP2的表达保护低压低氧大鼠学习记忆
李晓娜,汪晓筠,朱艳媚,曹成珠,杨春燕,严云飞,赵延礼,李生花
(青海大学医学院基础医学部生理学教研室,青海 西宁 810016)
目的探讨盐酸川芎嗪对低压低氧大鼠学习记忆功能的影响及其作用机制。方法将120只SD大鼠随机分为2组,低氧对照组(5 500 m)、低氧药物组(5 500 m),按时间段不同又分为1 d、3 d、7 d、15 d、30 d组,每组12只;对照组和药物组在模拟海拔5500 m的低压氧仓造模,对照组腹腔注射生理盐水,药物组用同样的方法注射盐酸川芎嗪进行干预。用Morris水迷宫实验检测大鼠行为学变化;Western blot检测大鼠海马GABAAα1R、GABAB1R、FOXP2表达情况。结果① 通过计算对照组和药物组定位航行实验中的总路程和穿越平台次数可以得出,两组1 d结果差异无统计学意义(P>0.05),从3 d组开始,药物组总路程较对照组逐渐缩短(P<0.01),而穿越中心平台次数较对照组逐渐增多(P<0.01);② Western blot检测海马GABAAα1R受体,不同时间段对照组与药物组海马中该受体表达差异无统计学意义(P>0.05);GABAB1R受体和FOXP2蛋白,1 d对照组药物组表达没有差异,从3 d组开始,对照组该受体和蛋白表达量均低于药物组(P<0.05);③ 对照组海马中GABAB1R与水迷宫总路程呈负相关(r=-0.738,P<0.05);对照组海马中FOXP2蛋白与水迷宫总路程呈负相关(r=-0.693,P<0.05);对照组海马中GABAB1R、FOXP2蛋白表达呈正相关(r=0.834,P<0.05)。结论盐酸川芎嗪对低压低氧大脑学习记忆能力起到一定的保护作用,其机制可能与增加大鼠脑内递质GABAB1R和蛋白FOXP2表达量有关。
盐酸川芎嗪;低压低氧;海马;水迷宫;学习记忆;GABAR;FOXP2
随着高原地区资源的开发和旅游业的发展,长期或短期进入高原地区的人群与日俱增,由于对高原高寒、低压、低氧等环境的不适应,将造成机体急性供氧不足,氧的利用受阻,就会产生急、慢性缺氧反应,其中脑是最易受到影响的器官之一,特别是大脑的认知功能[1-2]。Morris水迷宫(Morris water mase, MWM)是英国心理学家 Morris于20世纪80年代初设计,近年来在神经行为学研究中得到广泛应用[3],通过对该方法中得到的数据进行分析以后,可以对影响行为神经效果的相关药物做出评价。近年来,随着脑科学计划的提出,低压低氧条件对学习记忆能力影响的研究颇受关注。川芎嗪(tetramethylpyrazine,TMP)是从伞形科藁本属植物川芎中分离提纯的生物碱单体,主要用于脑供血不全、脑栓塞等疾病,它具有改善循环、保护大脑的作用,还可以用于治疗由于缺血缺氧引起的脑部疾病[4]。γ-氨基丁酸(gamma aminobutyric acid, GABA)是中枢神经系统中的一种抑制性神经递质,在大脑海马、皮质等部位都有分布,主要通过与其相应的受体结合而产生作用。GABA受体具有3种亚型,分别为离子型受体GABAR-A、GABAR-C,代谢型受体GABAR-B。其中,GABAR-A、GABAR-B主要分布在海马、皮质等部位,与大脑的认知功能相关[5]。它们又包含不同的亚基,其中GABAA受体α1亚单位在各脑组织表达强度依次是:海马、大脑皮质等,而GABAB受体存在2种亚型B1和B2,研究发现B1在大脑认知过程中发挥着很重要的作用。叉头框蛋白P2(forkhead box P2,FOXP2)是一种与口面部协调、学习记忆功能有密切联系的转录因子[6]。本文就低压低氧大鼠经过TMP干预后,通过用水迷宫行为学中的定位航行实验,研究其对低压低氧大鼠学习记忆功能的影响,应用Western blot方法检测GABAAα1R、GABAB1R受体和FOXP2表达情况,为临床治疗缺血缺氧性脑疾病提供理论依据。
1 材料与方法
1.1仪器与试剂低氧实验组选择在青海大学医学院高原医学研究中心低压氧舱(中航风雷,DXY-3000)进行模拟;Morris水迷宫采用中国医学科学院药物研究所DMS-2。RIPA、PMSF、转膜液、电泳液,均购自Solarbio;蛋白酶抑制剂,购自罗氏;BCA蛋白定量试剂盒、Marker,购自Thermo;PVDF膜购自Millipore;GABAAα1R(ab33299)、GABAB1R(ab131417)、FOXP2(ab16046)、β-actin(ab8227)的抗体,均购自Abcam;电泳仪、电泳槽、ECL发光液等,购自Bio-Rad。
1.2实验动物及分组实验中所用动物为SPF级健康♂ Sprague Dawley大鼠[SCXK(陕)2012-003,购自西安交通大学医学实验动物中心]120只,10~12周龄,体质量(210±40)g,随机分为2组:低氧对照组和低氧药物组(模拟海拔5 500 m),并且将低氧组又按照时间不同,分为1 d、3 d、7 d、15 d、30 d组,每组12只。
1.3模拟低压低氧条件将用于模拟低压低氧条件的大鼠置于低压氧舱内,以2 m·s-1的速度升至模拟海拔5 500 m,舱内温度(22±2)℃,湿度50%~60%,采用慢性低压低氧来模拟高原低氧环境,大鼠自由取食水。
1.4药物及给药方法盐酸川穹嗪(批号:H20054485),上海现代哈森(商丘)药业有限公司产品。根据体质量(5 mL·kg-1),1 d和3 d低氧对照组和药物组大鼠提前5 d开始腹腔注射盐酸川穹嗪和生理盐水;从7 d组开始,15 d和30 d低氧对照组和药物组大鼠,每隔1 d按照上述方法给予TMP和同剂量生理盐水进行干预。
1.5Morris水迷宫实验不锈钢喷塑圆柱形水池、圆柱形平台和图像采集系统(摄像机、录像机、显示器、分析软件等)三部分组成。不锈钢圆柱形水池为黑色,高50 cm、直径120 cm。圆柱形平台高15 cm、直径10 cm。实验开始前,先制备水,要求为超过平台1~2 cm深,为了不使大鼠产生应激,水温保持在在(22±2)℃;然后,随意将水池分为4个象限(NE、SE、SW、NW),平台置于任意一象限,在每两个象限中央处,分别贴上空间标记物,不同形状的白色几何图形(菱形、长方形、正方形、三角形),以此来引导大鼠找到平台;最后,图像采集系统置于水迷宫上方2~4 cm处,自动采集大鼠游泳轨迹记录相关信息,将其输入计算机系统,用于相应指标的提取和分析。
1.6水迷宫定位航行实验大鼠学习记忆能力采用经典的定位航行实验进行训练,按照组别先分别进空间探索实验,将大鼠每天训练5次,每次从不同的象限将大鼠头朝水迷宫贴壁处放入,直到其找到平台,间隔时间为60 s,期间用毛巾将大鼠擦干,以免影响游泳效果。如果大鼠在规定时间内找不到中心平台,则需要人为引导其找到平台,并在平台上停留10 s左右,等到将其训练完以后,d 5时,将训练过的大鼠,撤去平台,记录其在120 s内在水迷宫内的总路程和穿越平台的次数,以观察大鼠的学习记忆能力。
1.7Westernblot实验将大鼠用10%乌来糖(3.5 mL·kg-1)腹腔注射麻醉后,在冰上分离海马,将其冻存在液氮中,随后放入-80℃超低温冰箱保存。在提取蛋白时,按比例加入蛋白裂解液(RIPA ∶PMSF ∶蛋白酶抑制剂=100 ∶1 ∶1),提取蛋白,匀浆后分装;分别配备10%分离胶和5%的浓缩胶,用80 V、130 min电泳,转膜2 h,3%脱脂奶粉封闭1 h,之后分别加入GABAAα1R(1 ∶500)、GABAB1R、(1 ∶2 000)、FOXP2(1 ∶1 000)一抗,4℃过夜,洗膜,加入二抗2 h,洗膜,最后用ECL发光液曝光。

2 结果
2.1Morris水迷宫行为学结果Fig 1结果显示,在定位航行实验中,对照组和药物组大鼠1 d总路程和穿越平台次数比较差异均无显著性(P>0.05);从3 d组开始,药物组大鼠在水迷宫120 s内总路程明显少于对照组,差异有统计学意义(P<0.01,Fig 1A);并且,从3 d组开始,药物组大鼠在水迷宫120 s内穿越中心平台次数明显多于对照组,差异有统计学意义(P<0.01,Fig 1B)。
2.2各组大鼠海马中GABAAα1R、GABAB1R和FOXP2蛋白表达结果Fig 2结果显示,不同时间段内,GABAAα1R蛋白表达对照组与药物组差异无统计学意义(P>0.05);GABAB1R表达,从3 d组开始,药物组明显多于对照组(P<0.05);FOXP2蛋白表达,从3 d组开始,药物组明显多于对照组(P<0.05)。

Fig 1 The summary of the change total diatance(A) and the changing trendency of the frequency of crossing platform(B) in Morris water mase of rats(±s, n=12)
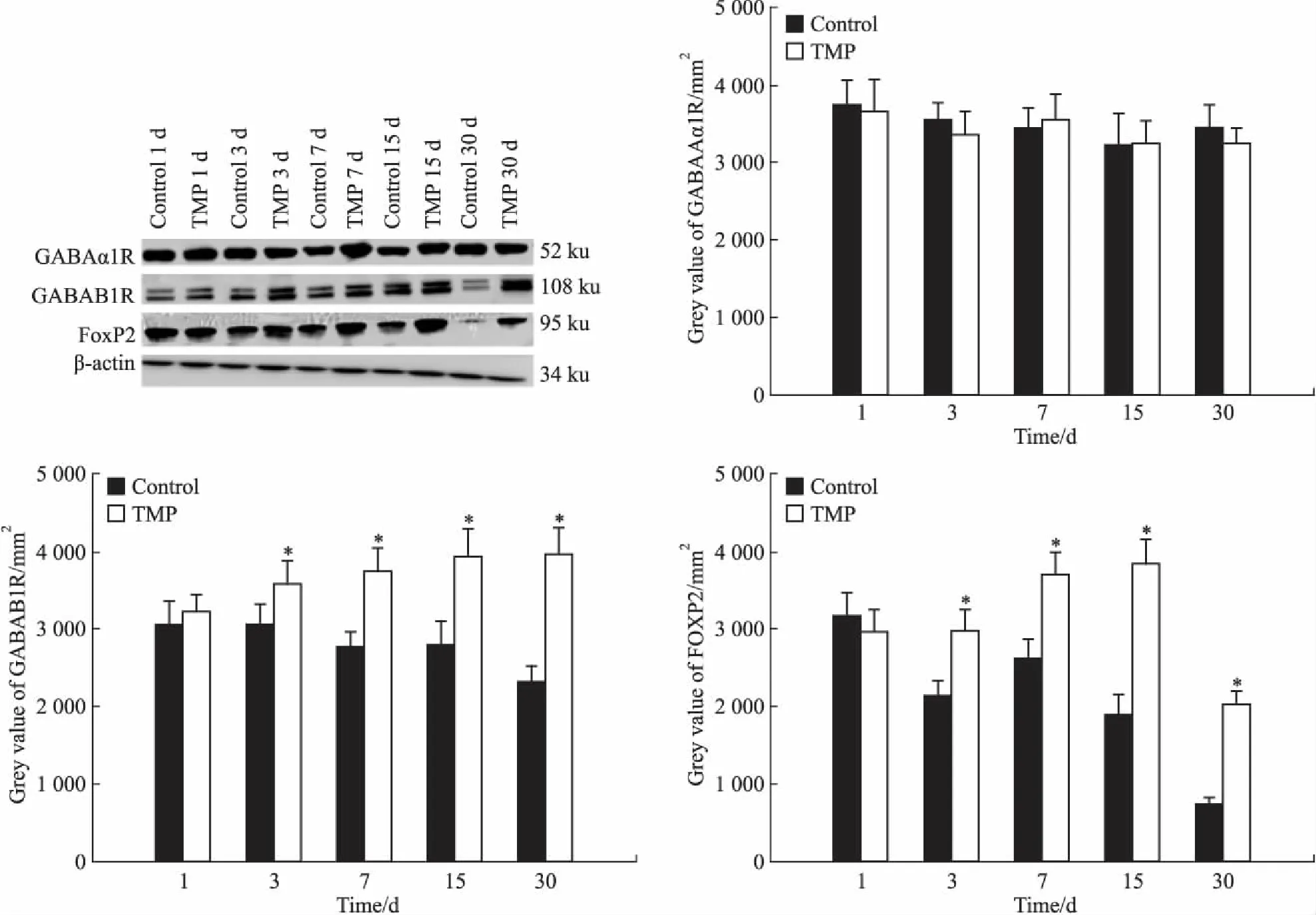
Fig 2 The expression of GABAAα1 and GABAB1 receptor and FOXP2 in hippocampus of rats for each group(±s,n=12)
2.3相关性分析结果Fig 3结果显示,对照组海马中GABAB1R表达与水迷宫总路程呈负相关(r=-0.738,P<0.05,Fig 3A),对照组海马中FOXP2蛋白表达与水迷宫总路程呈负相关(r=-0.693,P<0.05,Fig 3B)。由Fig 4可见,对照组海马中GABAB1R与FOXP2蛋白表达呈正相关(r=0.834,P<0.05)。
3 讨论
当机体短期或长期处于缺血缺氧环境时,会使脑血管通透性增高,神经细胞出现代谢障碍,ATP生成减少,导致脑血管性和脑细胞毒性水肿的发生,颅内压升高,后者又进一步加重脑缺血缺氧症状和一些神经退行性疾病,最终使得大脑的学习记忆能力受到损伤[7]。TMP是传统中药川芎的主要有效成分,很早就被发现它可以抑制细胞凋亡和维持大脑氧化抗氧化系统平衡,主要用于脑血管性疾病[8-9]。近年来也有文献报道,TMP可以通过调节脑内递质谷氨酸(glutamic acid, Glu)和GABA含量,对神经元兴奋性进行调节[10];TMP也可以升高大脑多巴胺(dopamine,DA)、五羟色胺(5-hydroxytryptamine,5-HT)以及降低去甲肾上腺素(norepinephrine,NE)的含量,保护大脑认知功能;TMP还可通过下调大鼠海马区细胞周期蛋白E(cycline E)和上调p21蛋白表达量,抑制细胞凋亡,最终提高大脑学习记忆力[11]。

Fig 3 The correlation analysis of GABAAB1receptor(A), FOXP2 protein(B) and total distancein hippocampus of rats for control group(±s,n=12)

Fig 4 The correlation analysis of GABAB1 receptor and FOXP2 protein in hippocampus of rats for control group(±s,n=12)
本研究中,通过Morris水迷宫行为学实验结果,计算定位航行实验中的大鼠在水迷宫的游泳总路程和穿越中心平台次数可以得出,从3 d组开始,对照组大鼠的水迷宫总路程呈现不断增长的趋势,而穿越中心平台次数却减少,说明低压低氧环境会使大脑学习记忆能力下降,与Cha等[2]研究结果相一致。大脑作为人体的核心器官,其氧耗量大,约占人体总氧耗量的23%,低压低氧条件使大脑的抗氧化应激、能量代谢、信号通路、神经递质等正常代谢和功能都受到影响,最终损伤大脑的学习记忆能力。而经过TMP干预后,从3 d组开始,药物组游泳总路程明显短于对照组,而穿越中心平台次数明显多于对照组,说明TMP对这种低压低氧导致学习记忆功能障碍有着一定的保护作用,这与Liu等[8]的研究结果一致。
GABA是一种抑制性神经递质,当与其相应受体结合后,在海马、小脑等部位起作用。其中,GABAB1R主要分布在海马,研究表明它们对大脑的学习记忆功能有着很重要的作用,并且持续低压低氧会使得大脑内的GABA含量明显减少,这与本项目随着大鼠暴露低氧时间的延长,海马组织中的GABAB1R表达量逐渐减少的研究结果是一致的。有研究报道[12],GABABR激动剂能够拮抗神经元损伤,其机制可能是因为GABAR可以干预Glu受体下游信号转导通路,抑制Glu受体的神经毒性,对大脑学习、记忆起到保护作用。我们的研究也发现,经过TMP干预后,GABAB1R表达量均明显比同一暴露低氧时间的对照组高(P<0.05),并具有时间依赖性,说明TMP能够提高GABAB1R表达量,从而对海马学习记忆起到保护作用,这与孙正启等[12-13]研究结果相符合。其机制可能是在低压低氧条件下,磷酸化的Glu受体和N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDA)表达量均明显升高,Glu是一种广泛存在于大脑的兴奋性氨基酸,在大脑学习记忆功能中有着重要的意义。NMDA受体又是Glu的一种离子型受体,是参与形成大脑的长时程抑制(LTP)的主要受体,低压低氧下产生过量的Glu,使得Glu与NMDA受体更多地结合,使Ca2+通道处于持续开放的状态,对大脑产生兴奋毒性作用,造成神经细胞凋亡,最终影响大脑的学习记忆功能[14]。而在本实验中,GABAAα1R蛋白表达量在对照组和药物组差异无统计学意义,说明TMP并不是通过调节该受体对大脑学习记忆进行干预。
FOXP2是一种与学习记忆、语言等功能相关的蛋白,它主要在大脑的海马表达。Ma等[6]研究发现,该蛋白的高表达与高原鼢鼠学习记忆能力有关。韦娜[15]研究发现,通过增加靶基因FOXP2的表达量,保护海马神经环路突触可塑性,进而逆转学习和记忆功能障碍。本实验研究发现,持续低氧干预后,随着大鼠暴露低氧的天数增加,FOXP2出现逐渐减少的趋势(P<0.05),而经过TMP干预后,其表达量明显高于对照组,表明TMP能够上调FOXP2蛋白,这种变化趋势是否与GABAB1R以及游泳总路程等学习记忆功能有关?我们通过分析发现,FOXP2蛋白灰度值与水迷宫总路程具有较高的负相关性(r=-0.693,P<0.05),表明FOXP2蛋白参与了大鼠在水迷宫实验中的学习记忆过程,即FOXP2蛋白表达越高,总路程时间越短,学习记忆能力越强。另外,GABAB1R灰度值与水迷宫总路程也存在较高的负相关(r=-0.738,P<0.05),表明该受体也参与大鼠在水迷宫中的学习记忆过程。而GABAB1R与FOXP2蛋白相关性分析表明,两者间存在高度正相关性(r=0.834,P<0.05),说明在低氧对海马组织损伤以及TMP调节干预中,GABAB1R与 FOXP2均发生了同步性变化。换言之,两者之间存在一种协同作用,至于是GABAB1R改变影响了FOXP2,还是由于FOXP2改变影响了GABAB1R,两者之间存在怎样的信号通路对学习记忆起调节作用,尚不清楚,有待于进一步研究证实。
综上所述,本研究结果表明,低压低氧环境会减弱大鼠大脑的学习记忆能力,但是通过TMP对GABAB1R与FOXP2蛋白表达量的调节,可以增强脑的学习记忆能力,对低氧脑损伤具有一定的防治作用,这将为后续医学研究和高原地区临床工作提供一定的参考价值。
(致谢:本实验在青海大学高原医学研究中心和青海大学医学院基础医学研究中心完成,非常感谢研究中心各位老师和同学在实验技术上的无私帮助。)
[1] Shao G, Wang Y, Guan S, et al. Proteomic analysis of mouse cortex postsynaptic density following neonatal brain hypoxia-ischemia[J].DevNeurosci, 2017,39: 1-16.
[2] Cha J, Zea-Hernandez J A, Sin S, et al. The effects of obstructive sleep apnea syndrome on the dentate gyrus and learning and memory in children[J].JNeurosci, 2017,37(16):4280-8.
[3] Kus K, Ratajczak P, Czaja N, et al. Effect of combined administration of aripiprazole and fluoxetine on cognitive functions in female rats exposed to ethyl alcohol[J].ActaNeurobiolExp(Wars),2017,77(1):86-93.
[4] 喻 斌,蒋宝平,阮 鸣. 川芎嗪和不同剂量冰片配伍对全脑缺血/再灌注大鼠脑区特异性保护作用研究[J].中国药理学通报,2017,33(4):589-91.
[4] Yu B, Jiang B P, Ruan M. protective effects of tetramethylpyrazine phosphate combining with different doses of borneol on region-specificity in global cerebal ischemia/reperfusion rats[J].ChinPharmacolBull,2017,33(4):589-91.
[5] 李翠限,王 莹,周 春,沈晓燕. GABAA受体转运及其在神经性疾病中的作用[J].中国药理学通报,2011,27(7):889-92.
[5] Li C X, Wang Y, Zhou C, et al. GABAA receptor transport and its role in neurological diseases[J].ChinPharmacolBull,2011,27(7):889-92.
[6] 马本园, 魏 莲, 孙生祯, 等. 高原鼢鼠的学习记忆能力与其脑组织中foxP2基因的高表达有关[J].生理学报,2014,66(2):135-44.
[6] Ma B Y, Wei L, Sun S Z, et al. The plateau zokors’ learning and memory ability is related to the high expression levels of foxP2 in the brain[J].ActaPhysiolSin, 2014,66(2):135-44.
[7] Yuan L, Wu J, Liu J, et al. Intermittent hypoxia-induced parvalbumin-immunoreactive interneurons loss and neurobehavioral impairment is mediated by NADPH-oxidase-2[J].NeurochemRes,2015,40(6):1232-42.
[8] Liu H, Wei X, Chen L, et al. Tetramethylpyrazine analogue CXC195 protects against cerebral ischemia/reperfusion injury in the rat by an antioxidant action via inhibition of NADPH oxidase and iNOS expression[J].Pharmacology, 2013,92(3-4):198-206.
[9] 梁跃霞,曹国琼,张文生.阿尔茨海默症炎症反应及中药干预研究进展[J].中国药理学通报,2017,33(5):597-602.
[9] Liang Y X, Cao G Q, Zhang W S. Research progress on inflammatory response of Alzheimer′s disease and traditional Chinese medicine intervention[J].ChinPharmacolBull,2017,33(5):597-602.
[10]Han J, Wan H T, Yang J H, et al. Effect of ligustrazine on levels of amino acid neurotransmitters in rat striatum after cerebral ischemia-reperfusion injury[J].JAsianNatProdRes,2014,16(11):1060-7.
[11]尹淑杰,张 涛,荣光影,等.川芎嗪对阿尔茨海默病大鼠学习记忆能力和细胞周期蛋白E、P21表达的影响[J].中国老年学杂志,2016,36(20):4961-2.
[11]Yin S J, Zhang T, Rong G Y,et al. Effect of Ligustrazine on learning-memory ability and the expression of cyclin E and P21 in rats with Alzheimer′s disease[J].ChinJGerontol,2016,36(20):4961-2.
[12]Li G, Jing L, Wang J, et al. GABAB, receptors in the hippocampal dentate gyrus are involved in spatial learning and memory impairment in a rat model of vascular dementia[J].BrainResBull,2016,124:190-7.
[13]孙正启,王唯析,康龙丽,等. 模拟高原低压低氧对大鼠学习记忆行为和海马GABA表达的影响[J]. 现代预防医学,2009,36(21):4133-5.
[13]Sun Z Q,Wang W X, Kang L L, et al. The influence of simulated high-altitude hypobaric hypoxia on learning and memory behaviors and expression of GABA neurons in hippocampus of rats[J].ModPrevMed, 2009,36(21):4133-5.
[14]López-Pérez S J, Morales-Villagrán A, Ventura-Valenzuela J, et al. Short- and long-term changes in extracellular glutamate and acetylcholine concentrations in the rat hippocampus following hypoxia[J].NeurochemInt,2012,61(2):258-65.
[15]韦 娜. 兴奋性神经元特异性表达Kir2.1通道通过上调miR-9抑制FoxP2翻译而损伤学习和记忆[D]. 武汉:华中科技大学,2015.
[15]Wei N. Overexpression of Kir2.1 in Excitatory neurons impairs learning and memory via aberrant regulation of miR-9 and FoxP2 translation[D].Wuhan:Huazhong University of Science and Technology,2015.
TetramethylpyrazineprotectslearningmemoryofhypoxichypoxiaratsthroughinterferingexpressionofGABAreceptorandFOXP2
LI Xiao-na,WANG Xiao-jun, ZHU Yan-mei,CAO Cheng-zhu, YANG Chun-yan,YAN Yun-fei, ZHAO Yan-li, LI Sheng-hua
(DeptofPhysiology,FacultyofBasicMedicine,QinghaiUniversityMedicalCollege,Xining810016,China)
AimTo examine the influence of tetramethylpyrazine on learning and memory function of hypoxic hypoxia rats, and the expression of gamma aminobutyric acid(GABA) receptor and forkhead box P2(FOXP2) in hippocampus of rats.MethodsA total of 120 Sprague Dawley rats were randomly divided into low hypoxic hypoxia and high hypoxic hypoxia groups, then according to different time points every group was divided into 1 d, 3 d, 7 d 15 d, 30 d group, with 12 rats per each group. Experiment group and the control group were treated with tetramethylpyrazine and 0.9% normal saline, respectively. The hypoxic hypoxia environment was achieved by putting the rats in a hypobaric chamber at a simulated altitude of 5 500 meters for different days. The capabilities of learning and memory of rats were detected by Morris water maze test. The expression of GABA receptor and FOXP2 protein in hippocampus of rat was determined by Western blot.Results① Morris water maze test showed that the total distance of rats in the simulated hypobaric hypoxia control group was longer than that in the tetramethylpyrazine group(P<0.01) and the number of crossing the bestride platform increased compared with that in the hypobaric hypoxia control group(P<0.01) from the third day;② Western blot results showed that the expression of GABAAα1 receptor have no statistical significance(P>0.05);however,GABAB1 receptor and FOXP2 protein rose from the third day(P<0.05). The expression of GABAAα1 receptor and FOXP2 protein expression were correlated to total distance of Morris water maze in the control group(r=-0.738,P<0.05;r=-0.693,P<0.05), and the expression of GABAB1 receptor was correlated with FOXP2 protein level(r=0.834,P<0.05).ConclusionThe simulated high-altitude hypobaric hypoxia can decrease the learning and memory abilities of rats, which may be ameliorated by tetramethylpyrazine intervention, and this effect might be related to the increase of GABAB1R receptor and FOXP2 expression in hippocampus of rats.
tetramethylpyrazine; hypobaric hypoxia; hippocampus; Morris water maze test; learning and memory; GABA receptor; FOXP2
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.038.html
2017-05-18,
2017-06-30
青海大学医学院中青年科研基金资助项目(No 2015-KT-5)
李晓娜(1991-),女,硕士生,研究方向:低氧神经生理学,E-mail:863996552@qq.com; 李生花(1966-),女,硕士,教授,硕士生导师,研究方向:高原低氧神经与心血管生理学,通讯作者,E-mail:lshls@126.com
10.3969/j.issn.1001-1978.2017.09.019
A
:1001-1978(2017)09-1285-06
R-332;R284.1;R322.81;R338.64;R392.11;R442.9;R845.22
