1-磷酸鞘氨醇及受体对自身免疫性疾病血管新生的影响
2017-08-29张峥嵘王文宇
张峥嵘,吴 虹,戴 丽,王文宇,邓 然,李 锋,傅 俊
(安徽中医药大学药学院,新安医学教育部重点实验室,安徽 合肥 230012)
1-磷酸鞘氨醇及受体对自身免疫性疾病血管新生的影响
张峥嵘,吴 虹,戴 丽,王文宇,邓 然,李 锋,傅 俊
(安徽中医药大学药学院,新安医学教育部重点实验室,安徽 合肥 230012)
1-磷酸鞘氨醇 (sphingosine-1-phosphate, S1P) 是细胞膜鞘磷脂代谢过程产生的一类信号分子,在免疫系统中,与细胞膜表面的G蛋白偶联受体S1P 受体 (S1P receptors, S1PRs) 结合,通过相关炎症信号通路,影响新生血管的形成。该文简述S1P及其受体通过细胞内信号转导对类风湿关节炎、多发性硬化症、结肠炎、系统性红斑狼疮等自身免疫性疾病微血管生成的影响,提出了S1P及其受体可能是治疗自身免疫性疾病血管炎症新的靶点。
1-磷酸鞘氨醇;1-磷酸鞘氨醇受体;G蛋白偶联受体;自身免疫性疾病;血管生成;炎症
1-磷酸鞘氨醇 (sphingosine-1-phosphate, S1P) 是一种具有广泛生物学活性的溶血磷脂。作为细胞内信号转导的第二信使,可通过调节脂质细胞表面特定的受体而发挥多种生物学功能,包括哺乳动物细胞的生长、增殖、迁移、淋巴细胞侵袭、血管完整性、炎症细胞因子浸润等,在自身免疫性疾病、心血管系统、癌症和移植排斥中均具有重要作用[1]。近年来,S1P及其受体在自身免疫性疾病,如类风湿性关节炎 (rheumatoid arthritis, RA)、多发性硬化症 (multiple sclerosis, MS)、结肠炎 (colitis) 、系统性红斑狼疮 (systemic lupus erythematosus, SLE) 的血管新生、血管通透性和炎症方面的作用成为研究热点,本文就此作一综述。
1 S1P合成与代谢
鞘氨醇激酶 (sphingosine kinases, SphKs) 是从大鼠肾脏提取纯化的一种供细胞膜鞘磷脂分解代谢的限速酶。SphKs基因由高度同源性的SphK1和 SphK2合成。在蛋白水平, SphK2比SphK1表达要多。SphK1具有促进细胞存活及抑制细胞凋亡的作用,而SphK2促进细胞凋亡、抑制细胞存活。SphK1或SphK2基因缺失小鼠SphKs功能并未受到影响;但SphK1和SphK2基因同时敲除对小鼠胚胎有致死性,且S1P在小鼠体内不表达,表明在机体内S1P仅由SphKs产生[2]。在自身免疫性疾病病理状态下,机体产生大量炎症因子,如血小板衍生生长因子(platelet-derived growth factor, PDGF)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、转化生长因子-β(transforming growth factor-β, TGF-β)、血管内皮生长因子(vascular endothelial growth factor, VEGF)等,炎症因子可激活胞内SphKs,进而催化磷酸化鞘氨醇产生S1P。
S1P的分解代谢调节作用包括:一方面,S1P在磷酸酶的作用下,去磷酸基生成鞘氨醇,然后在内质网胞质面的神经酰胺酶的作用下,通过酰胺键与脂酸结合,直接合成神经酰胺,并对抗S1P 的作用。另一方面,S1P裂解酶对胞内和胞外S1P的水平均有调控作用。S1P在裂解酶的作用下,降解为软脂醛和磷酸胆碱。因此,S1P与神经酰胺的平衡在某一状态下与细胞的存活密切相关[3]。
2 S1P及其受体的分类与功能
S1P受体(S1P receptors, S1PRs) 目前主要作为胞外溶血磷脂配体,属于G蛋白偶联受体(G protein coupled receptors, GPCRs)家族成员之一。因这些受体早期被称为内皮分化基因(endothelial differentiation gene, EDG)和非内皮分化基因(non-EDG)编码的克隆蛋白,故将其命名为EDG,后来根据国际药剂师协会正式更名为S1PRs。目前为止,S1PRs由S1PR 1~5五个亚型组成,均能与S1P产生高度亲和作用,并激活各自细胞内信号途径,与G蛋白α亚型(Gαi、Gαq、Gα12/13)偶联而发挥作用[4]。S1PR1-S1PR3在不同类型的细胞中广泛表达。S1PR1最初来源于S1P+/Lac-Z小鼠的肝、肺、心内皮血管,在内皮细胞、平滑肌细胞、心肌细胞以及树突细胞中广泛表达,也是T淋巴细胞和B淋巴细胞从淋巴组织迁移的必要通道,在血管重建、免疫细胞迁移和内皮细胞屏障功能等方面发挥重要作用[5]。S1PR2在成年大鼠的心、肺、脑、肝、肾、脾以及人的血管内皮细胞、平滑肌细胞、树突细胞和巨噬细胞等免疫细胞中分布广泛。敲除S1PR2基因可影响神经细胞的兴奋性引起耳聋,同时也影响心肌细胞存活率以及血管张力、调节力等功能。S1PR3主要分布于内皮细胞、平滑肌细胞、心肌细胞以及T淋巴细胞等免疫细胞中,具有调节心肌缺血/再灌注损伤和心率的作用[6]。S1PR4和S1PR5虽然参与S1P的生物学效应,但表达相对较少,S1PR4仅限于免疫系统的淋巴及造血组织中,而S1PR5发现存在于脾脏细胞、淋巴结细胞、骨髓细胞以及中枢神经系统的少突胶质细胞[7]。
S1P与细胞表面的S1PR1、S1PR2、S1PR3结合,可活化Gi和Gq蛋白,并触发磷脂酰肌醇3激酶(phosphatidylinositol-3 kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)以及细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路的级联反应,加速细胞扩散,进而调节细胞的增殖、迁移等作用。S1P在转染S1PR2的CHO细胞中,通过Rac激活c-Jun氨基末端激酶(c-Jun N-terminal kinases, JNK)/p38 MAPK信号通路,调节细胞的凋亡。炎症因子通过ERK1/2信号通路,影响胶原性关节炎大鼠肠系膜淋巴细胞的增生[8]。活化S1PR1能有效抑制MS淋巴细胞的迁移,控制血液中淋巴细胞的数量,减轻炎症病理症状。另外,S1PR1需要Rho蛋白和钙调蛋白参与SLE中淋巴细胞的重新分布。有研究通过构建pmirGLO-S1PR1-3′-UTR载体,证实了miR-155通过负向调控S1PR1影响SLE的发病进程[9]。这些信号通路不仅与S1P结合发挥生物活性,而且对RA、MS以及SLE炎症免疫反应软调节的影响至关重要[10]。
3 S1P对血管生成的影响
血管生成是一个极其复杂的过程,起始于中胚层内皮细胞的增殖、迁移、黏附等过程,之后由萌芽到形成毛细血管,最终形成毛细血管网。另外,血管的形成和成熟需要血管生成素 (angiogenin, Ang)、表皮生长因子、PDGF、TGF-β等。多种细胞因子通过复杂的信号途径,调控内皮细胞的增殖和迁移,然后覆盖于平滑肌细胞,从而诱导血管的发生[11]。血管生成在自身免疫性疾病、肿瘤细胞生长、组织修复、视网膜病等病理情况下起到重要作用。
S1P、S1PRs直接在血管内皮细胞上发挥作用,对血管生成可进行双向调节。最初在基底膜植入小鼠体内发现,S1P通过Gi蛋白信号通路诱导内皮细胞的增殖和迁移而刺激血管生成[12]。S1P被认为是一种脂类促血管生长因子,也可通过S1PR1-Gi-Rac和S1PR3-G12/13-Rho信号通路,与VEGF和碱性成纤维生长因子(basic fibroblast growth factor, bFGF) 相结合,促进黏附连接作用,进而加速毛细血管网的形成。RA患者滑膜组织中VEGF的水平与正常人相比要高很多,可诱导滑膜细胞的增殖和迁移,同时促进间质胶原酶的分泌,降解细胞基质,有利于血管的形成和分化并形成血管翳,从而导致骨、软骨以及关节的破坏,造成不可逆的关节功能损伤[13]。另外,S1PRs也能抑制VEGF依赖的萌芽样血管发生,对血管过度增生发挥负性调节作用。在人脐静脉血管内皮细胞 (human umbilical vein endothelial cells,HUVEC) 模型中,S1PR2通过Rhoc通路抑制血管生成。
体内S1P主要来源于造血细胞和血管内皮细胞,S1P在造血细胞中的释放主要通过ABC转运蛋白家族,而血管内皮细胞中S1P的释放则是通过Spinster 2(Spns2)。Spns2作为一种新型的S1P外排转运体,在胸腺和肾的血管内皮细胞较多[14]。Spns2的缺失会降低循环中S1P的水平,诱发淋巴细胞减少,缓解胶原性关节炎,同时还可减轻实验性自身免疫性脑炎小鼠的损伤。
4 S1P对血管通透性的影响
血管通透性异常一般出现在自身免疫性疾病、炎症反应、肿瘤等多种临床疾病中,引起血浆溢出、组织水肿等一系列并发症。伴随着血小板数目的降低,而导致血管的脆性和通透性增加,使得炎性细胞因子和蛋白外渗形成水肿。S1P在血浆中具有较高的水平(2×10-7~1×10-6mol·L-1),主要来源于造血系统,如血小板、红细胞、单核细胞等。血浆中S1P与高密度脂蛋白、血清蛋白、脂蛋白结合,可介导多种细胞反应。S1P与紧密连接蛋白(tight junctions, TJs) 相作用,影响细胞的渗透功能。另外,S1P也通过血管内皮钙黏蛋白(vascular endothelial cells cadherin, VE-cadherin) 与细胞内多种传递信号连接和沟通,调节细胞骨架的稳定性。PDGF是一种重要的脂类促血管生成因子,有研究证实,S1P对血小板活化因子 (platelet activating factor, PAF) 引起的大鼠肠系膜微血管通透性具有较好的抑制作用。
S1P作为一种趋化因子,多种S1PRs作用在血管内皮细胞和血管平滑肌细胞上,调节血管紧张度。当内皮细胞受某种外源性信号途径干扰时,一些重要的肌动蛋白结合蛋白发生异位,细胞与基底膜结构改变,血管通透性增加,而S1P有助于维护血管屏障的完整性[15]。S1PR1和S1PR2受体通常聚集在内皮细胞,S1P与S1PR1结合后,通过PI3K/Akt 激活Rac信号通路,促进NO合酶的磷酸化,NO扩散进入平滑肌细胞,舒张血管、抑制炎症反应,增强内皮细胞的屏障功能,并降低微血管通透性。S1PR3通过促进血管内皮细胞特异表达的VE-cadherin在细胞周边的分布,加强细胞间连接,保护内皮细胞功能障碍,降低血管通透性。在氧化应激状态下,内皮细胞屏障功能衰退、通透性增加,大量炎症细胞浸润到组织器官。因而灌注H2O2模拟氧化应激状态后发现,S1P对黏附连接有抑制作用,加强内皮细胞屏障功能,降低血管通透性[16]。
免疫细胞的迁移是免疫细胞向成熟免疫器官转移与宿主共同对外来病原微生物产生免疫应答的重要环节。细胞运动主要通过细胞骨架微管肌动蛋白(actin)的聚合和解聚完成,S1P通过细胞表面的受体参与介导细胞迁移运动,稳定细胞与细胞间以及细胞与基质间作用,从而增强内皮细胞的屏障保护功能,降低血管通透性[17]。然而,S1P及其受体下游的细胞信号通路,在炎症细胞、肿瘤细胞和中性粒细胞的激活、趋化中具体的作用机制,还需要进一步深入的研究。
5 S1P对炎症的影响
炎症反应中,中性粒细胞激活、趋化以及浸润是血管炎的特征性病变之一,S1P可作为固有免疫的调节剂。S1PRs促使淋巴细胞归巢和次级淋巴组织的重新分布而发挥免疫调节作用。被激活的SphKs随着循环的中性粒细胞通过黏附分子到达血管内皮细胞,然后迁移经过内皮细胞,使炎症因子募集到损伤部位,同时释放毒性产物,如活性氧自由基 (active oxygen radicals, AOR)、各种能破坏感染及其周围正常组织的活性酶,故SphKs在炎症细胞的激活与趋化中起着关键作用[18]。在免疫系统中,辅助性T淋巴细胞(helper T lymphocyte,Th) 的平衡由鞘氨醇及磷脂调控。Th1主要分泌促炎因子IFN-γ和IL-2,诱导细胞免疫;Th2主要分泌抗炎因子IL-4和IL-5等,介导体液免疫并参与免疫抑制;S1PRs在胸腺和淋巴结的微环境中对淋巴细胞的迁移有重要影响。通常情况下,成熟树突细胞(mature dendritic cells, mDCs)促使初始T细胞分化产生IFN-γ的Th1类细胞;当有S1P存在时,mDCs引起Th1细胞向Th2细胞转化,T细胞分泌IL-4增加,IFN-γ减少,这可能与S1P影响DC分泌细胞因子的微环境有关。
在RA、MS及SLE等自身免疫性疾病中,所有的S1PRs都与免疫细胞的迁移和分化有关,并引起免疫损伤。芬戈莫德(fingolimod, FTY-720)是冬虫夏草中提取的有效成分——多球壳菌素通过结构改造而合成的一种新型免疫抑制剂。它主要作用于细胞表面的S1PRs,发挥免疫抑制和免疫调控作用,不影响淋巴细胞的活化和增殖[19]。SLE中滤泡辅助型T(follicular helper T cell, Tfh)细胞比例失调,通过血清学、细胞学和病理学诊断结果表明,FTY-720可激活S1PRs,加速Tfh淋巴细胞的重新分布,抑制炎症反应。在RA患者中,TNF-α是一类重要的细胞内信号转导因子[20]。S1P可增加RA患者体内的炎症趋化因子和细胞因子,尤其是TNF-α的产生,并且促进NF-κB活化因子在MH7A和CD4+T细胞的表达,导致炎症细胞的大量浸润,进一步促进疾病产生。另外,在氯化钴诱导的化学缺氧实验中显示,S1P在激活滑膜细胞的细胞因子和趋化因子的自分泌过程中具有重要作用[21]。S1P通过与S1PRs结合,调节血管内皮细胞和星形胶质细胞来影响血脑屏障(blood brain barrier, BBB)。S1PR1可选择性地减少MS的小鼠实验性自身免疫性脑脊髓炎(experiment autoimmune encephalomyelitis, EAE) 模型中星形胶质细胞的增殖,并缓解EAE的症状,为治疗MS提供了可靠依据[22]。抑制S1PRs可减少IL-1、IL-6等炎症因子渗入到靶器官,缓解SLE中靶器官多胞质和核抗原自身抗体的产生。
S1P与未成熟的记忆T细胞和B细胞膜上的S1PRs相互作用,然后从胸腺和淋巴结流出,调节淋巴细胞的发育和组织归巢[23]。S1PR1-4在树突细胞中均有表达,胞外低水平的S1P会上调S1PR1受体的表达,S1PR1和S1PR3在B细胞中表达,刺激淋巴细胞的迁移,S1PR2受体对其产生拮抗作用;S1PR4表达对维持DC细胞功能发挥重要作用。经SphK1处理过的siRNA对关节炎症和关节破坏具有很好的抑制作用,能明显降低疾病的炎症程度,同时降低血清中IL-6、TNF-α的水平。激活SphKs的活性可调控TNF-α和fMLP(N-甲酰-L-甲硫氨酰-L-白氨酰-L苯丙氨酸),刺激中性粒细胞生成超氧化物。抑制SphKs可能影响血管细胞黏附分子-1(vascular cell adhesion molecule, VCAM-1)和E-选择素的表达,而VCAM-1表达增高被认为是炎症反应的第一步。此外,前列腺素E2(prostaglandin E2, PGE2)能促进RA中VEGF的表达,环孢菌素通过抑制激活因子与VEGF的结合,可对抗滑膜细胞血管生成的作用,而S1P/S1PR1信号通路可增强COX-2对PEG2的诱导作用。
6 结语与展望
S1PRs是S1P发挥生物学作用的主要途径,干预S1PRs是探讨S1P 作用机制和开发药物的重要靶点。FTY-720作为新型免疫抑制剂,在体内SphKs磷酸化作用下生成p-FTY-720,通过激活S1PR1引发外周淋巴细胞的归巢作用,从而产生免疫抑制作用。目前FTY-720主要用于通过降低相关炎症因子的分泌水平、减少血液中淋巴细胞的数量、抑制炎症细胞的浸润,从而抑制 RA、MS、SLE、Colitis等自身免疫疾病的发生。但FTY-720具有专一性不强、引起心动过缓等特征,因此,在FTY-720的基础上进行结构修饰,得到了新的S1PR1选择性激动剂,如氨基醇类(KRP-203)、中性分子类(SEW-2871)以及氨基羧酸类和吡唑类,目前已进入临床试验阶段,期待其在发挥免疫调节方面具有很好的发展潜力[24]。本课题组在中医药理论指导下,探讨S1P信号通路对RA滑膜血管翳的作用,是否可以减轻患者的关节损伤症状(Fig 1)。
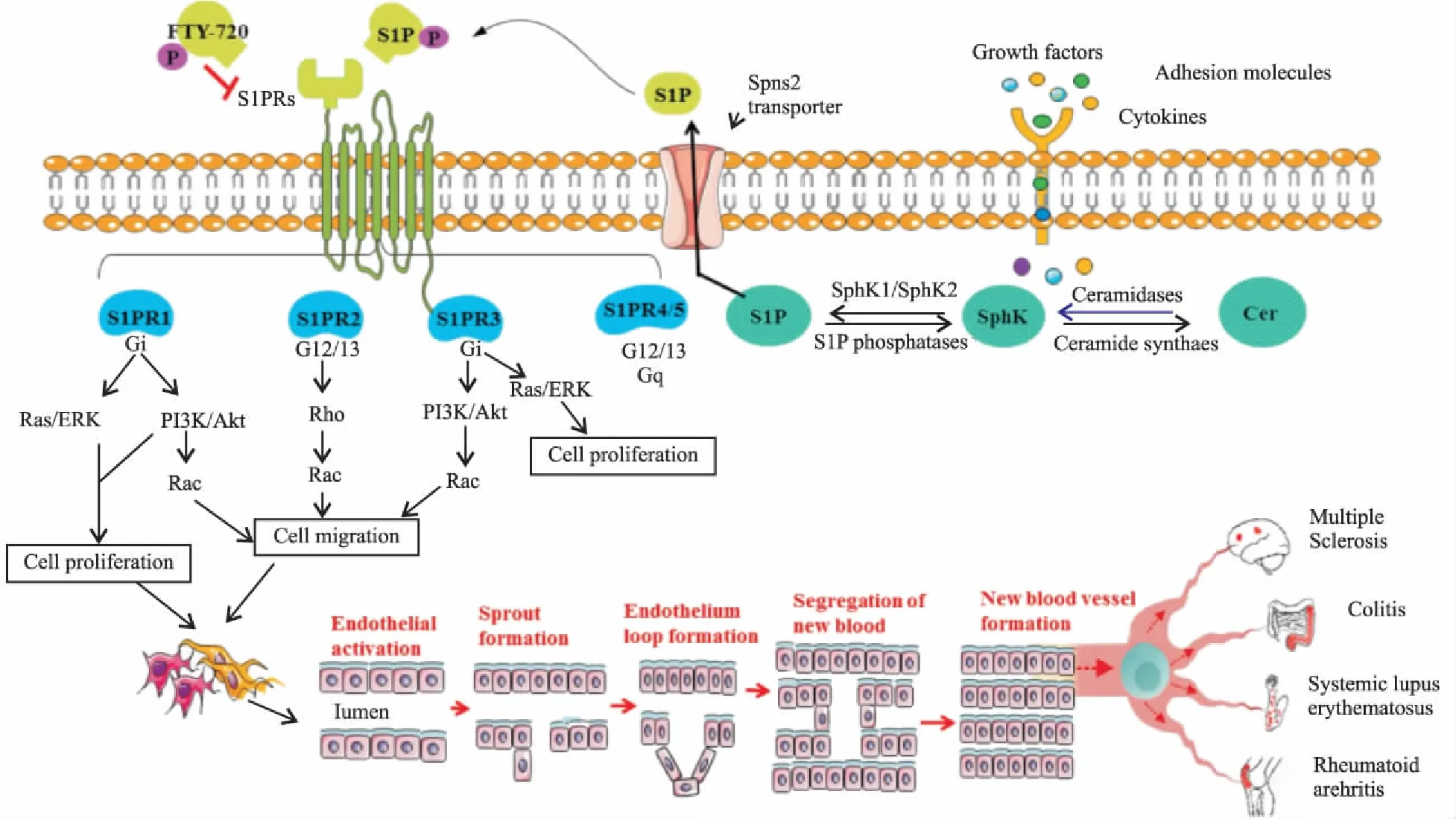
Fig 1 Mechanism of sphingosine-1-phosphate(S1P) and its receptors on angiogenesis and inflammation in autoimmune diseases
S1P is synthesized via phosphorylation of the precursor sphingosine mediated by sphingosine kinases(SphKs). Ceramide(Cer) is deacylated by ceramidase to yield sphingosine, which is then phosphorylated by SphK1/2 to generate S1P. S1P is exported through a plasma membrane S1P transporters, leading to activation of G-protein coupled S1P receptor subtypes(S1P1-S1PR5). Upon coupling with S1P, these receports can activate downstream signaling pathways leading to cell proliferation and migration. These are several steps involved in angiogenesis, which consist of endothelial cell migration, endothelial cell proliferation into vascular tubules and separation of the newly formed blood vessels that mature and become interconnected to the circulatoy system in auto-immune diseases
综上所述,S1P及其受体是具有血管保护作用的生物活性化合物。S1P通过与S1PRs结合,在细胞周边形成稳定的激动蛋白环,增强内皮细胞的屏障保护功能,降低血管通透性,抑制血管新生,参与炎症因子的表达。S1P及S1PRs对RA、MS、SLE、Colitis等自身免疫性疾病及慢性血管炎症的防治具有重要意义,但确切的作用机制还有待进一步研究,为何同一受体对不同病理状态下的相同细胞产生相反的作用?而且S1P/S1PRs对下游信号通路所调控的基因序列尚不明确。随着S1P及S1PRs在机体生理和病理过程的不断深入研究,S1P可能成为自身免疫性疾病治疗新的作用靶点。
[1] Proia R L, Hla T. Emerging biology of sphingosine-1-phosphate:its role in pathogenesis and therapy[J].JClinInvest, 2015,125(4): 1379-87.
[2] Chen W, Lu H, Yang J, et al. Sphingosine 1-phosphate in metabolic syndrome(Review)[J].IntJMolMed, 2016,38(4): 1030-8.
[3] 杜春阳, 肖 夏, 王鑫贵, 等. 鞘氨醇激酶1在肾间质纤维化中的作用及机制研究[J]. 中国药理学通报, 2017,33(2): 212-8.
[3] Du C Y, Xiao X, Wang X G, et al. Role of SphK1 in renal tubulointerstitial fibrosis and its mechanism[J].ChinPharmacolBull, 2017,33(2): 212-8.
[4] Machida T, Matamura R, Iizuka K, et al. Cellular function and signaling pathways of vascular smooth muscle cells modulated by sphingosine 1-phosphate[J].JPharmacolSci, 2016,132(4): 211-7.
[5] Pyne N J, Pyne S. Sphingosine 1-phosphate receptor 1 signaling in mammalian cells[J].Molecules, 2017,22(3): 2-18.
[6] Bajwa A, Huang L, Kurmaeva E, et al. Sphingosine 1-phosphate receptor 3-deficient dendritic cells modulate splenic responses to ischemia-reperfusion injury[J].JAmSocNephrol, 2016,27(4): 1076-90.
[7] 谷振阳, 赵小利, 杨 楠, 等. S1PR5缺陷对小鼠体内淋巴细胞分布的影响[J]. 中国实验血液学杂志, 2016,24(4): 1168-72.
[7] Gu Z Y, Zhao X L, Yan N, et al. Influence of S1PR5 defect on the lymphocyte distribution in mice[J].JExpHematol, 2016,24(4): 1168-72.
[8] Wang R, Wu H, Chen J, et al. Antiinflammation effects and mechanisms study of geniposide on rats with collagen-induced arthritis[J].PhytotherRes, 2017,31(4): 631-7.
[9] Xin Q, Li J, Dang J, et al. miR-155 deficiency ameliorates autoimmune inflammation of systemic lupus erythematosus by targeting S1pr1 in Faslpr/lpr mice[J].JImmunol, 2015,194(11): 5437-45.
[10]魏 伟. 炎症免疫反应软调节[J]. 中国药理学通报, 2016,32(3): 297-303.
[10]Wei W. Soft regulation of inflammatory immune responses[J].ChinPharmacolBull, 2016,32(3): 297-303.
[11]Ridiandries A, Tan J T, Bursill C A, et al. The role of CC-chemokines in the regulation of angiogenesis[J].IntJMolSci, 2016,17(11): 2-16.
[12]Shao X, Liu K, Fan Y, et al. Gαs relays sphingosine-1-phosphate receptor 1 signaling to stabilize vascular endothelial-cadherin at endothelial junctions to control mouse embryonic vascular integrity[J].JGenetGenomics, 2015,42(11): 613-24.
[13]Jiang S, Li Y, Lin T, et al. IL-35 inhibits angiogenesis through VEGF/Ang2/Tie2 pathway in rheumatoid arthritis[J].CellPhysiolBiochem, 2016,40(5): 1105-16.
[14]Donoviel M S, Hait N C, Ramachandran S, et al. Spinster 2, asphingosine-1-phosphate transporter, plays a critical role in inflammatory and autoimmune diseases[J].FASEBJ, 2015,29(12): 5018-28.
[15]Williams P A, Stilhano R S, To V P, et al. Hypoxia augments outgrowth endothelial cell (OEC) sprouting and directed migration in response to sphingosine-1-phosphate(S1P)[J].PLoSOne, 2015,10(4): e0123437.
[16]Fu P, Usatyuk P V, Jacobson J, et al. Role played by paxillin and paxillin tyrosine phosphorylation in hepatocyte growth factor/sphingosine-1-phosphate-mediated reactive oxygen species generation, lamellipodia formation, and endothelial barrier function[J].PulmCirc, 2015,5(4): 619-30.
[17]刘艺璇, 戴 岚, 狄 文, 等. 鞘氨醇-1-磷酸与血管生成的研究进展[J]. 国际妇产科学杂志, 2015,42(5): 555-9.
[17]Liu Y X,Dai L,Di W, et al. Advances of sphingosine-1-phosphate in angiogenesis[J].JIntObstetGynecol, 2015,42(5): 555-9.
[18]Chen W, Lu H, Yang J, et al. Sphingosine 1-phosphate in metabolic syndrome[J].IntJMolMed, 2016,38(4): 1030-8.
[19]Park S J, Im D S. Sphingosine 1-phosphate receptor modulators and drug discovery[J].BiomolTher(Seoul), 2017,25(1): 80-90.
[20]李 影, 陈镜宇, 张玲玲, 等. 肿瘤坏死因子受体相关因子参与炎症免疫调节的研究进展[J]. 中国药理学通报, 2015,31(9): 1206-10.
[20]Li Y, Chen J Y, Zhang L L, et al. Research advance of tumor necrosis factor receport-assocoated factors in inflammatory immune regulation[J].ChinPharmacolBull, 2015,31(9): 1206-10.
[21]Guerrero M, Urbano M, Roberts E. Sphingosine 1-phosphate receptor 1 agonists: a patent review(2013~2015)[J].ExpertOpinTherPat, 2016, 26(4): 455-70.
[22]Yanagida K, Liu C H, Faraco G, et al. Size-selective opening of the blood-brain barrier by targeting endothelial sphingosine 1-phosphate receptor 1[J].ProcNatlAcadSciUSA, 2017,114(17): 4531-6.
[23]Delgado A , Martínez-Cartro M. Therapeutic potential of the modulation of sphingosine-1-phosphate receptors[J].CurrMedChem, 2016,23(3): 242-64.
[24]Mao-Draayer Y,Sarazin J,Fox D,Schiopu E. The sphingosine-1-phosphate receptor: a novel therapeutic target for multiple sclerosis and other autoimmune diseases[J].ClinImmunol, 2017,2(175): 10-5.
Effectsofsphingosine-1-phosphateanditsreceptorsonangiogenesisinautoimmunediseases
ZHANG Zheng-rong, WU Hong, DAI Li, WANG Wen-yu, DENG Ran,LI Feng, FU Jun
(SchoolofPharmacy,AnhuiUniversityofChineseMedicine;KeyLabofXin′anMedicine,MinistryofEducation,Hefei230012,China)
Sphingosine-1-phosphate(S1P) is an important bioactive lipid produced from cell membrane sphingomyelin metabolism process. S1P and cell membrane surface S1P receptors(S1PR1-5) are G protein coupled receptors(GPCRs), which influence the formation of new blood vessels in the immune system via combining the related inflammatory signaling pathway. This review describes briefly the effects of S1P and S1PRs on autoimmune disease angiogenesis through intracellular signal transduction, such as rheumatoid arthritis, multiple sclerosis, colitis, systemic lupus erythematosus. Further research will be a new therapeutic target on vascular inflammation of autoimmune diseases.
sphingosine-1-phosphate; sphingosine-1-phosphate receptors; G protein coupled receptors; autoimmune diseases; angiogenesis; inflammation
时间:2017-8-20 16:47 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170820.1647.004.html
2017-06-13,修回稿日期:2017-07-19
国家自然科学基金资助项目(No 81473400);安徽中医药大学探索性研究性项目(No 2016ts072)
张峥嵘 (1993-),女,硕士生,研究方向:药物作用有效性与活性成分相关性,E-mail:zhangzhengrong311@126.com; 吴 虹(1967-),女,博士,教授,博士生导师,研究方向:药物作用有效性与活性成分相关性,通讯作者,E-mail:hongw@aliyun.com
10.3969/j.issn.1001-1978.2017.09.002
A
:1001-1978(2017)09-1190-05
R-05;R364.3;R364.5;R392.11;R593.2;R977.3;R977.6
