UPLC/TOF MS用于头孢美唑钠系统适用性对照品的结构解析*
2017-08-28刘云飞周浩于佳王凌波张士博王润德金金杨利红
刘云飞,周浩,于佳,王凌波,张士博,王润德,金金,杨利红*
(1.正大天晴药业集团股份有限公司,江苏南京210023;黑龙江省食品药品检验检测所,黑龙江哈尔滨150088)
UPLC/TOF MS用于头孢美唑钠系统适用性对照品的结构解析*
刘云飞1,周浩1,于佳2,王凌波1,张士博1,王润德1,金金1,杨利红2*
(1.正大天晴药业集团股份有限公司,江苏南京210023;黑龙江省食品药品检验检测所,黑龙江哈尔滨150088)
鉴定头孢美唑钠系统适用性对照品。方法:以0.1%甲酸溶液-乙腈为流动相,结合正离子和负离子两种模式下检测的母离子及子离子谱,参考文献推测杂质的结构。结果:在液相条件下,检测到分离良好的8个明显的杂质,对其杂质进行结构解析。结论:建立的液质条件有效地分离了头孢美唑钠系统适用性对照品中各有关物质,为其质量控制提供参考。
头孢美唑钠;系统适用性对照品;结构解析
由于头孢菌素类抗生素的工艺及化学结构特性,在生产和储存过程中易产生杂质[1]。药物中的杂质是引起不良反应的主要原因之一[2-4]。为全面有效地控制杂质,中国药典2010年版二部首次将混合杂质对照品应用于抗生素品种(阿莫西林)有关物质检查中[5]。头孢美唑钠为第二代头孢菌素类半合成抗生素,临床应用广泛,对多种β内酰胺酶稳定,且不良反应少,本研究制备了系统适用性对照品,并采用UPLC-TOF-MS对其杂质进行结构推测,为头孢美唑钠的质量控制提供参考。
1 实验部分
1.1 仪器材料
Waters xevo G2 QTOF质谱仪。
头孢美唑钠原料(哈药集团制药总厂);乙腈(色谱纯,fisher);甲酸(色谱纯,sigma);去离子水(明澈-D超纯水仪制)。
2 方法
2.1 UPLC-MS条件
色谱柱:watersBEH-C18(2.1mm×50mm,1.7μm);流动相:0.1%甲酸溶液-乙腈(80:20);流速:0.2mL·min-1;柱温:30℃;进样量:2.0μL;检测波长:272nm;喷雾电压:3kV;样品锥孔电压:20V;离子源温度:120℃,干燥气温度:300℃,雾化气:10L·min-1,检测模式:ESI正负离子检测;扫描范围(m/z):60~1000。
1.2.2 混合杂质对照品的制备
称取本品200g平铺在托盘中。样品置110℃烘箱中破坏100min,取出后将样品研磨成细粉。
2 结果
2.1 正负离子模式表征有关物质
按“1.2.1”项下条件,得到LC-MS图谱。结果表明,在头孢美唑钠的系统适用性对照品图谱中检测到8个明显的有关物质峰,根据正负离子比对及其离子碎片,推测其可能的结构。

图1 系统适用性对照品图谱Fig.1Spectrum of system suitability reference substance
2.2 有关物质的结构解析
在流动相中头孢美唑钠以头孢美唑酸的形式存在,ESI+-MS测得头孢美唑酸的一级质谱图中m/z 472.0212和m/z 943.0840为[M+H]+和[2M+H]+峰,ESI--MS测得m/z 470.0318和m/z 941.0710为[M-H]-和[2M-H]-峰。

图2 头孢美唑酸的质谱图Fig.2Mass spectrum of cefmetazole acid
2.2.1 杂质1的结构解析ESI--MS的m/z为115.0067,是[M-H]-峰,其相对分子质量为116,在色谱柱上保留较弱,极性较大,结合参考文献和工艺特点[4-6],推断为5-巯基-1-甲基四氮唑。

图3 杂质1的结构和质谱图Fig.3Structure and mass spectrum of impurity 1
2.2.2 杂质2的结构解析ESI+-MS的m/z为356.0071和711.1063,是[M+H]+和[2M+H]+峰,ESI-MS的m/z为354.0175,是[M-H]-峰,推断其相对分子质量为355。ESI+-MS模式下其主要有m/z 324、296、211、183和156的碎片峰。推断为5-巯基-1-甲基四氮唑断裂后形成的头孢美唑内酯。
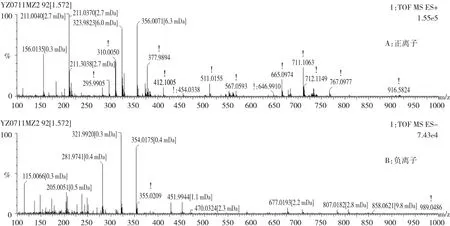
图4 杂质2的质谱图Fig.4Mass spectrum of impurity 2
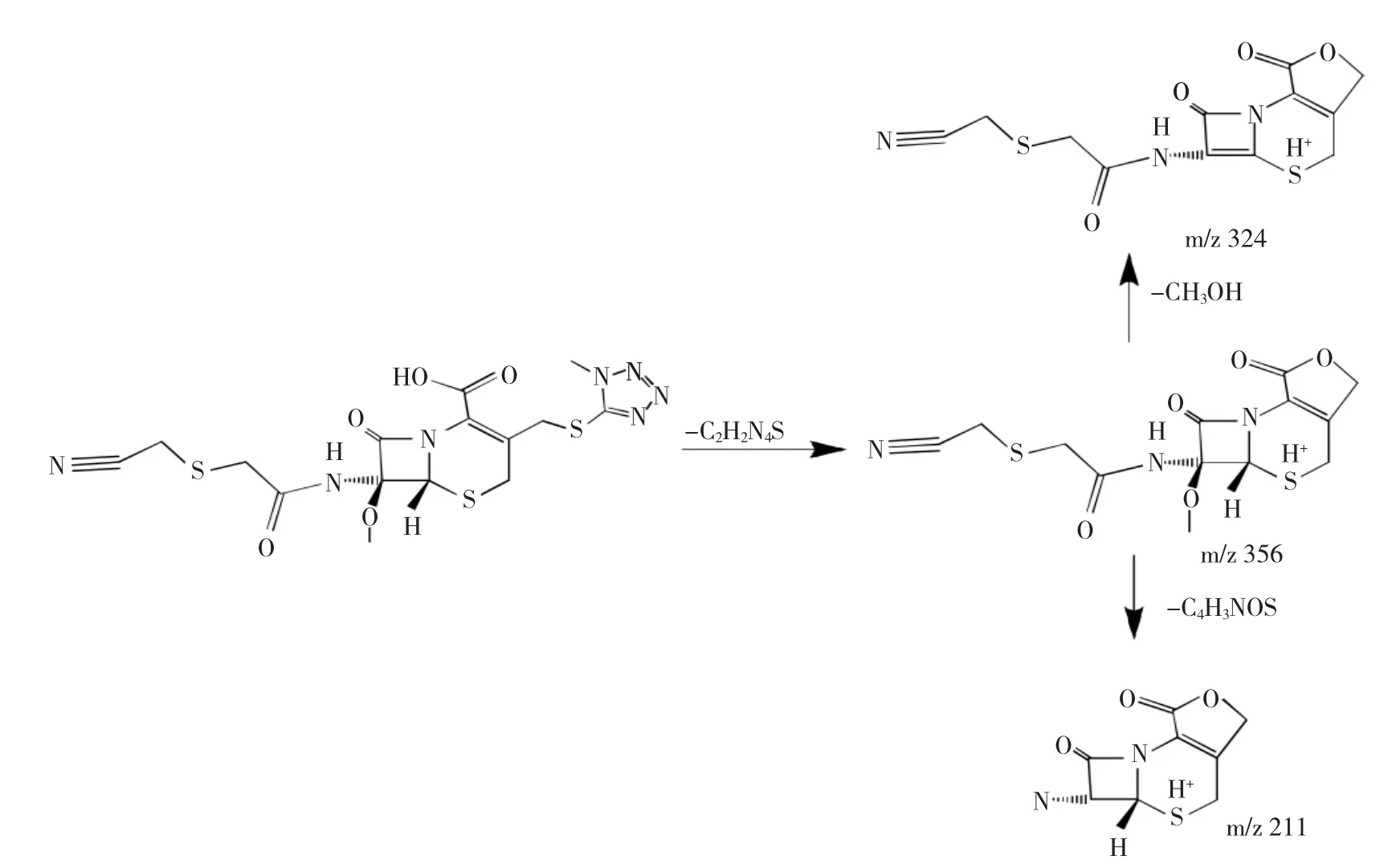
图5 杂质2裂解规律图Fig.5Mass spectrometric pattern of impurity 2
2.2.3 杂质3的结构解析ESI+-MS的m/z为490. 0341和979.1721,是[M+H]+和[2M+H]+峰,ESI--MS的m/z为488.0426,是[M-H]-峰,推断其相对分子质量为489。

图6 杂质3的质谱图Fig.6Mass spectrum of impurity 3
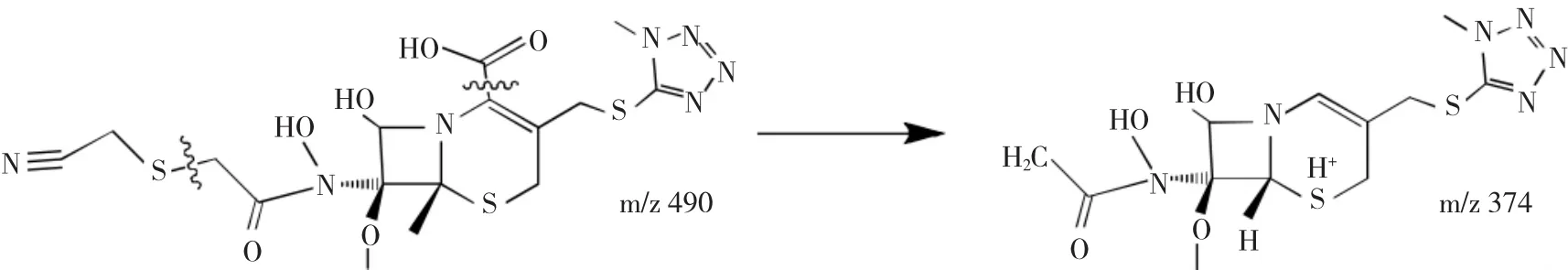
图7 正离子模式下m/z374离子碎片裂解过程Fig.7Fragmentation process of m/z374ion in positive mode
2.2.4 杂质4和杂质6的结构解析杂质4和杂质6 ESI+-MS的m/z均为472.02,是[M+H]+峰,ESI--MS的m/z均为470.03,是[M-H]-峰,推断其相对分子质量为471,与头孢美唑酸相同,推测为头孢美唑酸的同分异构体。
2.2.5 杂质5的结构解析杂质5:ESI+-MS的m/z为488.0018和975.0819,是[M+H]+和[2M+H]+峰,ESI--MS的m/z为486.0133和973.0266,是[M-H]-和[2M-H]-峰,推断其相对分子质量为487。其相对分子质量比头孢美唑酸相对分子质量多16,在正离子扫描下其主要包含一个m/z372的杂质碎片结合其碎片峰和文献报道推测其可能为头孢美唑酸5位硫氧化产物[7]。

图8 杂质5的质谱图Fig.8Mass spectrum of impurity 5

图9 正离子模式下m/z372杂质碎片裂解过程Fig.9 Fragmentation process of m/z372 ion in positive mode
2.2.6 杂质7的结构解析杂质7:ESI+-MS的m/z为430.0366,是[M+H]+峰,ESI--MS的m/z为427.9966,是[M-H]-峰,推断其相对分子质量为429。

图10 杂质7的质谱图Fig.10Mass spectrum of impurity 7
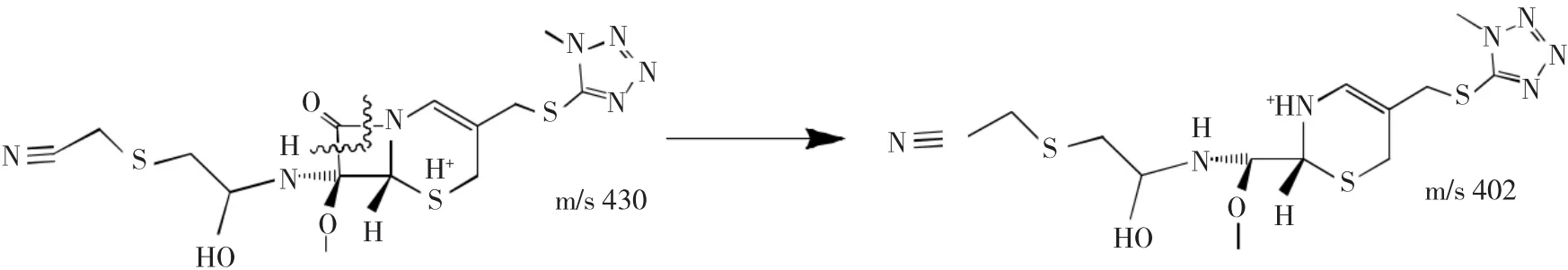
图11 正离子模式下m/z 402离子裂解过程Fig.11Fragmentation process of m/z 402 ion in positive mode
3.2.7 杂质8的结构解析ESI+-MS的m/z为486.0376和971.1964,是[M+H]+和[2M+H]+峰,ESI--MS的m/z为484.0468和969.0949,是[M-H]-峰和[2M-H]-,推断其相对分子质量为485。

图12 杂质8的质谱图Fig.12Mass spectrum of impurity 7
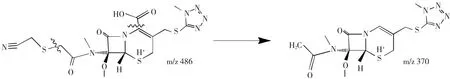
图13 正离子模式下m/z 370离子裂解过程Fig.13Fragmentation process of m/z 370 ion in positive mode
3 结论
系统适用性混合杂质对照品中信息丰富有利于样品的质控,分别取样品在酸、碱、氧化、高温、沸水和光照等条件下破坏,测定条件参考单页标准(YBH04552007)。比较各破坏结果的色谱图,结果表明采用高温破坏可以得到杂质信息量更多的混合杂质对照品。
头孢美唑钠在中国药典中未收载,在现行标准(YBH04552007)和美国药典的液相条件中均为磷酸盐溶液,不适用于质谱分析。经过优化色谱条件,选择0.1%甲酸溶液-乙腈(80-20)为流动相,各杂质分离较好,可用于质谱分析。
[1]王莹莹,龚莉,王成港,等.头孢美唑钠的体外降解稳定性[J].中国新药杂志,2012,(12):1410-1417.
[2]王玉红,李桂军.静脉注射头孢美唑发生不良反应的原因分析[J].中国实用内科杂志,2015,(s1):21-23.
[3]龙敏,王颖,龙秀英.头孢美唑致不良反应18例文献分析[J].中国药房,2011,(24):2262-2263.
[4]邓晶晶,张春然,唐克慧,等.反相高效液相色谱法测定头孢美唑钠中的有关物质[J].中国新药杂志,2011,(9):828-832.
[5]国家药典委员会.中国药典(2010年版二部)[M].北京,中国医药科技出版社,2010.401-402.
[6]孔兴欣,沈文斌,王丽云,等.LC MS/MS法研究头孢美唑钠中有关物质[J].中国药科大学学报,2012,43(2):170-176.
[7]KV Rao,A Rani,AV Reddy,CH Bharathi,R Dandala.Isolation, structural elucidation and characterization of impurities in Cefdinir[J].Journal of Pharmaceutical&Biomedical Analysis,2007,43(4): 1476-1482.
Structural analysis of system suitability reference substance of cefmetazole sodium by UPLC/TOF MS*
LIU Yun-fei1,ZHOU Hao1,YU Jia2,WANG Ling-bo1,ZHANG Shi-bo1,WANG Run-de1,JIN Jin1,YANG Li-hong2*
(1.Chiatai Tianqing Pharmaceutical Group Limited by Shares,Nanjing,210023,China;2.Heilongjiang Institute for Food and Drug Control,Harbin 150088,China)
The system suitability reference substance of cefmetazole sodium was elucidated.Methods:HPLC separation was carried out by a mobile phase consisting of 0.1%formic acid aqueous solution and pure acetonitrile. The parent ions and product ions were detected both in positive mode and negative mode.The structures of impurities were assigned combined with literatures.Results:Eight impurities were detected under HPLC conditions and well-separated.Their structures were identified.Conclusions:Impurities in system suitability were effectively separated by LC-MS method.The results were useful for quality control.
cefmetozole sodium;system suitability reference substance;structural analysis.
10.16247/j.cnki.23-1171/tq.20170874
2017-03-23
哈尔滨市应用技术研究与开发项目-科技创新人才(No.20 15RQQYJ002);黑龙江省自然科学基金项目(No.H201452)
刘云飞(1985-),男,主管药师,2012年毕业于中国药科大学,中药学专业,硕士研究方向:药物分析和药品质量控制。
杨利红(1968-),女,博士,主任药师,研究方向:药物分析和药品质量控制。
R917
A
