不同黏度骨水泥治疗骨质疏松性椎体压缩骨折的疗效对比
2017-08-24曾希银王永强
曾希银,王 璨,王永强
·临床医学·
·短篇论著·
不同黏度骨水泥治疗骨质疏松性椎体压缩骨折的疗效对比
曾希银,王 璨,王永强
骨质疏松性椎体压缩骨折;经皮椎体成形术;高黏度骨水泥;低黏度骨水泥
骨质疏松症(osteoporosis, OP)是一种最常见的代谢性骨病,主要表现为骨量减少、骨强度减弱、骨脆性增加以及骨组织显微结构退化。骨质疏松症最严重的并发症是骨质疏松性骨折,而脊柱所含松质骨比较丰富,极易因轻微暴力导致骨质疏松性椎体压缩骨折(osteoporotic vertebral compression fracture, OVCF)。OVCF病情严重时可导致脊柱畸形且患者自觉持续疼痛,严重影响老年患者的生活质量。目前经皮椎体成形术(percutaneous vertebroplasty, PVP)以其侵入性小、止痛疗效显著的优势在临床上广泛推广[1-3]。
随着脊柱微创技术的发展,PVP在国内外已普遍应用于治疗OVCF。但骨水泥渗漏、邻近椎体激发骨折等并发症也常出现。不断地手术实践中发现掌握骨水泥注入时机和控制骨水泥黏度正日益成为避免骨水泥渗漏的重要因素[4]。低黏度骨水泥黏稠度小、流动性大,易导致骨水泥渗漏;高黏度骨水泥黏稠度大、流动性小,能够在压力泵的推注下实现良好的填充效果。尽管有研究表明高黏度骨水泥也存在较少的渗漏现象[5],但其长期临床疗效是否优于低黏度骨水泥尚缺乏有效的临床资料支持。本研究通过对比高黏度骨水泥与低黏度骨水泥行PVP治疗骨质疏松性椎体压缩骨折的临床疗效,比较其疗效及骨水泥渗漏情况。
1 资料与方法
1.1 一般资料 选取2011年6月至2013年6月我院收治的OVCF患者78例作为研究对象,其中男37例,女41例;年龄58~82岁,平均年龄(71.47±10.12)岁。按治疗方法将研究对象分为高黏度组与低黏度组,每组各39例。高黏度骨水泥组中男18例,女21例,年龄59~82岁,平均(72.04±9.73)岁;低黏度骨水泥组中男19例,女20例,年龄58~80岁,平均(70.06±10.81)岁。所有患者胸椎或腰椎棘突处压痛或叩击痛明显,高黏度骨水泥组有42节伤椎:T102节,T115节,L125节,L24节,L36节;低黏度骨水泥组有47节伤椎:T103节,T117节,L122节,L25节,L34节,L41节。2组均行PVP术,且所有手术为同一组医师完成。纳入标准:(1)经双能X线骨密度测定,确诊为骨质疏松症;(2)无神经压迫表现,影像学证实为单椎体新鲜骨质疏松性压缩骨折;(3)明确胸腰背部疼痛为OVCF导致;(4)均采用保守治疗无效;(5)患者均签署入组知情同意书。排除标准:(1)陈旧性骨折患者;(2)椎管内有游离骨片患者;(3)椎体存在结核、化脓等感染性病变患者;(4)脊柱局部或全部感染患者;(5)存在任何其他手术禁忌的患者。
1.2 方法 (1)手术方法:患者取俯卧位并调整腰桥,用C型臂X线机透视明确伤椎椎弓根体表具体位置并标记。常规消毒术区皮肤,铺无菌洞巾,局部麻醉。于C型臂X线机透视下,采用高黏度骨水泥或低黏度骨水泥椎体成形术专用穿刺针经伤椎椎弓根从后外侧进入伤椎椎体前中部(前中1/3处)。对于椎弓根影不清楚患者可采用椎弓根旁入路或单侧入路,双向透视确认到达伤椎椎体1/3处。使用专用的骨水泥搅拌器调配骨水泥黏度,将骨水泥调配至拉丝状态,一般高黏度骨水泥从开始混合到注射的时间为30 s,低黏度骨水泥为4~8 min,时间主要依手术室环境温度而定。采用特制液压推进泵及专用骨水泥注射器于侧位C型臂X线机透视下注入低黏度骨水泥,待其固化后,移除穿刺针;高黏度骨水泥于注射结束后即可移除穿刺针,注射过程未出现骨水泥凝固现象。手术结术后穿刺点均予小敷贴包扎。(2)术后治疗:术后给予常规抗骨质疏松治疗,口服阿法骨化醇搭配钙尔奇D(阿法骨化醇0.5 μg/次,1次/d;钙尔奇D 600 mg/次,1次/d),同时口服唑来膦酸 70 mg/次,1次/周。术后第2天即可在腰围保护下下地做负重训练。
1.3 评估指标 (1)影像学评估。分别于术前、术后3 d、术后6个月及术后3年在正、侧位X线片上观察:①伤椎椎体高度:伤椎椎体前缘或中部高度占正常椎体前缘或中部高度的百分比;②伤椎后凸角度:侧位X线片上测得椎体上终板与下终板垂线的交角;③新发骨折情况:通过MRI判断随访期间新发骨折情况。术后3年评估骨水泥渗漏,X线片结合三维CT判定以骨水泥超出椎体边界为骨水泥渗漏。(2)手术疗效评定。分别于术前、术后3 d、术后6个月及术后3年评价。具体评价:①腰背部疼痛:疼痛视觉模拟评分(visual analogue scale, VAS);②腰背部功能:Oswestry功能障碍指数(oswestry disability index, ODI)。
1.5 统计学处理 采用SPSS 19.0统计软件,计量资料用均数±标准差(x±s)表示,比较采用t检验;计数资料用百分比表示,比较采用χ2检验。以P<0. 05 为差异有统计学意义。
2 结果
2.1 2组患者手术资料比较 2组患者手术时间、骨水泥注入量比较差异无统计学意义(P>0.05)。见表1。

表1 2组患者手术资料比较(x±s)
2.2 2组患者手术前后椎体高度、伤椎后凸角度及骨水泥渗漏情况比较 2组患者术后的椎体前部高度、椎体中部高度、伤椎后凸角度与同组术前相比差异有统计学意义(P<0.05)。2组患者同期(术前或术后不同时间点)的椎体前部高度、椎体中部高度、伤椎后凸角度比较差异无统计学意义(P>0.05)。术后2组的骨水泥渗漏比较差异有统计学意义(P<0.01)。见表2。
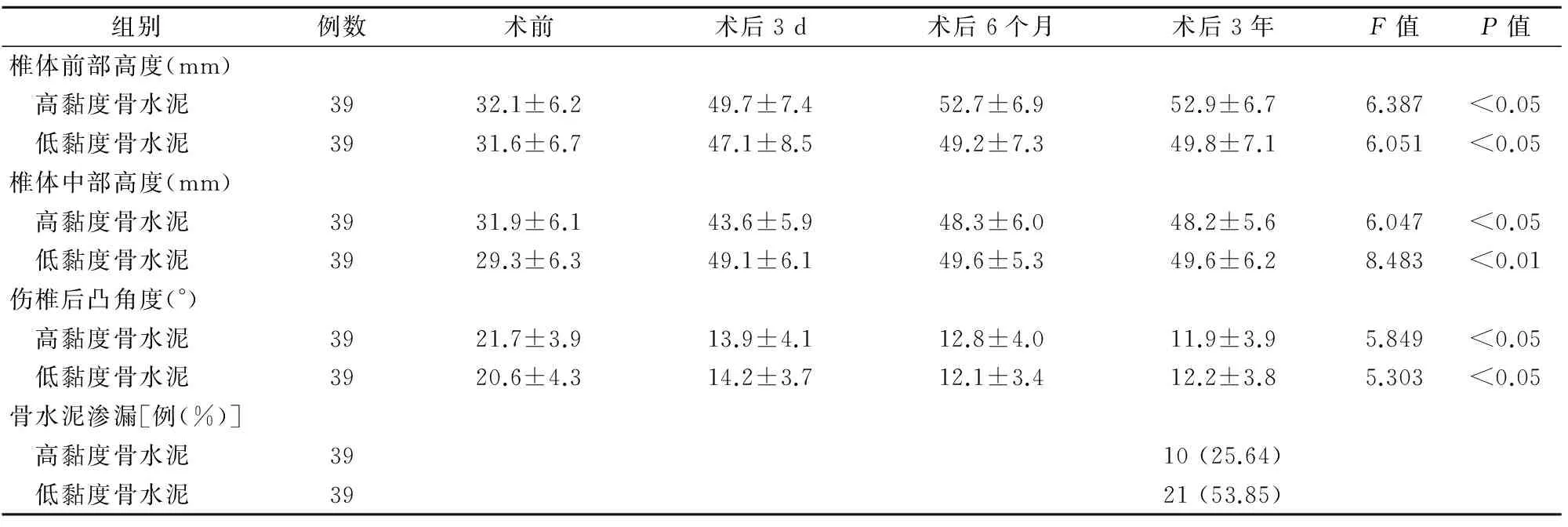
表2 2组手术前后椎体高度、伤椎后凸角度及骨水泥渗漏情况比较(x±s)

表3 2组各时间点VAS和ODI评分比较(x±s,各组n=39)
注:与术前比较aP<0.01;VAS:疼痛视觉模拟评分,ODI:Oswestry功能障碍指数
2.3 2组患者手术前后VAS和ODI评分比较 2组患者的VAS评分和ODI评分术后各时间点与本组术前相比差异有统计学意义(P<0.01)。2组同期(术前或术后各时间点)的VAS评分和ODI评分比较差异无统计学意义(P>0.05)。此外随访至术后3年,均未发现原发骨折邻近节段的新发骨折。见表3。
3 讨论
骨质疏松椎体压缩性骨折的患病群体一般是老年患者,老年患者身体机能减弱、活动锻炼减少、营养吸收差、肺功能减弱而容易导致术后并发症多,其发病率和死亡率较高[6]。目前作为微创脊柱外科领域技术的PVP因其创伤小、手术时间短、术后并发症少而得到医师和患者的青睐,其疼痛缓解率可达70%~95%[7]。随着该手术技术的日趋成熟,骨水泥的黏度特性成为导致术后并发症的重要因素。多项研究表明骨水泥渗漏与骨水泥的黏度有很大关系[8]。Georgy等[9]研究发现相较于低黏度骨水泥,高黏度骨水泥具有更低的术后渗漏率。后来也有研究证实高黏度骨水泥PVP降低了骨水泥渗漏率,增加了手术安全性[10-11]。本研究中发现高黏度骨水泥渗漏率明显低于低黏度骨水泥(P<0.01),表明高黏度骨水泥行PVP手术有效降低了骨水泥渗漏率,这与前人的研究结果一致。但是本研究中高黏度骨水泥PVP的术后渗漏率为25.64%,明显低于之前的研究[12]。这可能是由于本研究中使用了X线片结合三维CT成像共同判断骨水泥渗漏而使得判断的准确性大大提高,其优于单独使用X线片或三维CT成像的观察判断。因此X线片联合三维CT成像判断骨水泥渗漏情况值得在临床上推广应用。
除了骨水泥的黏度,骨水泥的注入量也是一个备受争议的问题。有研究认为骨水泥渗漏率与骨水泥用量密切相关[13]。骨水泥注射量增加,相应的渗漏风险也随之增加。目前对于骨水泥的最佳注射量还没有足够的临床证据,本研究中高黏度骨水泥组平均注入量为(4.2±0.9)ml,明显低于之前研究中的用量[14]。但是长期来看,高黏度骨水泥的渗漏率(25.64%)在临床上处在一个较低的水平,且长期观察疗效更佳。笔者试图找到一个骨水泥注射量的临界值,既能保持较低的骨水泥渗漏率、较好的临床疗效,同时又能缩短手术时间,减轻患者的痛苦。鉴于高黏度骨水泥行PVP手术的渗漏率更低、手术时间更短,且考虑到OVCF的患病群体主要是老年患者,耐受性差。因此寻找骨水泥注射量的临界值这一设想的摸索可以集中在高黏度骨水泥行PVP手术中进行。
本研究结果发现,应用高黏度骨水泥和低黏度骨水泥行PVP手术都可以明显缓解患者疼痛,有着相似的临床疗效。但高黏度骨水泥的渗漏率更低,可有效提高术后的安全性,且手术时间短。因此建议对于年龄大的OVCF患者,高黏度骨水泥行PVP手术可作为首选治疗方式。
[1] Papanastassiou I D, Phillips F M, Meirhaeghe J, et al. Comparing effects of kyphoplasty, vertebroplasty, and non-surgical management in a systematic review of randomized and non-randomized controlled studies[J]. European Spine Journal, 2012, 21(9): 1826-1843. DOI:10.1007/s00586-012-2314-z.
[2] Folman Y, Shabat S. A comparison of two new technologies for percutaneous vertebral augmentation: confidence vertebroplasty vs. sky kyphoplasty[J]. Isr Med Assoc J, 2011, 13(7): 394-397.
[3] Ender S A, Eschler A, Ender M, et al. Fracture care using percutaneously applied titanium mesh cages (OsseoFix®) for unstable osteoporotic thoracolumbar burst fractures is able to reduce cement-associated complications-results after 12 months[J]. Journal of Orthopaedic Surgery and Research, 2015, 10(1). DOI:10.1186/s13018-015-0322-5.
[4] 张贺庆, 刘洪涛, 吕宏琳, 等. 两种骨水泥治疗老年骨质疏松性椎体压缩骨折的比较[J]. 实用骨科杂志, 2016, 22(4): 343-346.
[5] 张亮, 王静成, 冯新民, 等. 不同黏度骨水泥椎体成形术治疗重度骨质疏松性骨折的疗效研究[J]. 实用骨科杂志, 2016, 22(7): 577-581.
[6] Kim K W, Cho K J, Kim S W, et al. A Nation-Wide, outpatient-based survey on the pain, disability, and satisfaction of patients with osteoporotic vertebral compression fractures[J]. Asian Spine Journal, 2013, 7(4): 301. DOI:10.4184/asj.2013.7.4.301.
[7] Muto M, Muto E, Izzo R, et al. Vertebroplasty in the treatment of back pain[J]. Radiol Med, 2005, 109(3): 208-219.
[8] Nieuwenhuijse MJ, Van Erkel AR, Dijkstra PD. Cement leakage in percutaneous vertebroplasty for osteoporotic vertebral compression fractures: identification of risk factors[J]. Spine J, 2011, 11(9): 839-848. DOI:10.1016/j.spinee.2011.07.027.
[9] Georgy BA. Clinical experience with high-viscosity cements for percutaneous vertebral body augmentation: occurrence, degree, and location of cement leakage compared with kyphoplasty[J]. AJNR Am J Neuroradiol, 2010, 31(3): 504-508. DOI:10.3174/ajnr.A1861.
[10] Eichler K, Zangos S, Mack MG, et al. Outcome of long-axis percutaneous sacroplasty for the treatment of sacral insufficiency fractures with a radiofrequency-induced, high-viscosity bone cement[J]. Skeletal Radiol, 2014, 43(4): 493-498. DOI:10.1007/s00256-013-1811-4.
[11] Wang CH, Ma JZ, Zhang CC, et al. Comparison of high-viscosity cement vertebroplasty and balloon kyphoplasty for the treatment of osteoporotic vertebral compression fractures[J]. Pain Physician, 2015, 18(2): E187-E194. DOI:10.1016/j.clineuro.2014.11.018.
[12] Venmans A, Klazen CA, Lohle PN, et al. Percutaneous vertebroplasty and pulmonary cement embolism: results from VERTOS II[J]. AJNR Am J Neuroradiol, 2010, 31(8): 1451-1453. DOI:10.3174/ajnr.A2127.
[13] Boonen S, Van Meirhaeghe J, Bastian L, et al. Balloon kyphoplasty for the treatment of acute vertebral compression fractures: 2-year results from a randomized trial[J]. J Bone Miner Res, 2011, 26(7): 1627-1637. DOI:10.1002/jbmr.364.
[14] Young C, Munk PL, Heran MK, et al. Treatment of severe vertebral body compression fractures with percutaneous vertebroplasty[J]. Skeletal Radiol, 2011, 40(12): 1531-1536. DOI:10.1007/s00256-011-1138-y.
(本文编辑:甘辉亮、边冬冬)
629000 四川 遂宁,四川省遂宁市第一人民医院骨科
R683.2
A
10.3969/j.issn.1009-0754.2017.04.026
2017-01-06)
