罗汉果内生菌及其周边土壤中产α-淀粉酶菌株的筛选
2017-08-23赵丰丽张昌志范彩琴宋云飞杨文国
赵丰丽, 吴 奔, 张昌志, 范彩琴, 宋云飞, 杨文国, 陈 静
(1.广西师范大学 生命科学学院, 广西 桂林 541004; 2.珍稀濒危动植物生态与环境保护教育部重点实验室,广西 桂林 541004; 3.桂林莱茵生物科技股份有限公司, 广西 桂林 541199)
罗汉果内生菌及其周边土壤中产α-淀粉酶菌株的筛选
赵丰丽1,2, 吴 奔1, 张昌志1, 范彩琴1, 宋云飞3, 杨文国3, 陈 静1
(1.广西师范大学 生命科学学院, 广西 桂林 541004; 2.珍稀濒危动植物生态与环境保护教育部重点实验室,广西 桂林 541004; 3.桂林莱茵生物科技股份有限公司, 广西 桂林 541199)
对罗汉果内生菌及其种植区土壤中的微生物进行分离,筛选淀粉酶产生菌,并研究其发酵条件,结果得到15株内生菌和8株微生物,从中筛选到2株产淀粉酶高的菌株2 -1(土壤)和R - 4(根部内生菌)。经初步鉴定,菌株2 -1为球菌,菌株R - 4为芽孢杆菌,均为革兰氏阳性菌。研究显示,菌株2 -1产酶条件为1.0%氯化铵、0.5%酵母粉、1.0%可溶性淀粉、0.4%氯化钠,发酵温度为40 ℃,发酵3 d,其产酶量为127.65 U/mL;R - 4菌株产酶条件为0.5%酵母粉、1.0%氯化铵、0.05%氯化钠、2.0%可溶性淀粉,发酵温度为40 ℃,发酵3 d,其产酶量为197.21 U/mL。
罗汉果; 内生真菌; α -淀粉酶; 发酵条件
罗汉果(Siraitiagrosvenorii)为葫芦科罗汉果属的多年生藤本植物的果实,是我国特有植物[1],生长于广西、广东、江西、湖南及贵州等地,广西桂林市永福县是罗汉果发源地和主产地。罗汉果果实富含多种人体必需氨基酸、微量元素及维生素等,此外,含有黄酮、多糖、甜甙和多酚等活性成分。罗汉果具有多种药理作用,具有良好的保健价值[2]。罗汉果中含有比蔗糖甜300倍的强甜物质——罗汉果甜甙V。罗汉果甜甙V占总甜甙量的30%~40%[3],是一种低热量、不吸湿、不引发龋齿的纯天然甜味剂。
甜甙Ⅴ随罗汉果成熟度的增加而逐步增多,这是受体内诸多水解酶参与转化形成的结果,是低糖苷与葡萄糖逐渐结合转化而来的[4]。罗汉果甜甙含量的多少受其体内水解酶的影响较大,与葡萄糖有关联。作为主要的水解酶之一的淀粉酶有可能参与了这一过程,而这些酶与微生物的关系如何,其研究有重要的意义。罗汉果中含有丰富的内生菌,它们是否参与了罗汉果甙类物质转化等代谢过程,这些微生物和次级代谢产物的产生是否有关,十分值得研究。经查阅中外文献,目前尚未见有从罗汉果中分离微生物、内生菌以及内生菌产淀粉酶等的研究报道。本研究以罗汉果根、茎、果实以及罗汉果种植地土壤为材料,采用微生物纯种分离技术对其内生菌以及其他微生物进行分离,并以淀粉水解圈为指标,筛选罗汉果产淀粉酶的内生菌和其他微生物,对筛选到的菌株进行初步鉴定,研究其发酵条件,以期为罗汉果内生菌相关研究奠定基础。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料
罗汉果的根、茎、果实以及罗汉果根部土壤及其周边土壤于2015年10月采集于广西桂林市临桂县。
1.1.2 主要培养基
马铃薯葡萄糖琼脂培养基(PDA培养基):马铃薯200 g切块,用水煮沸30 min,4层纱布过滤,滤液加葡萄糖20 g、琼脂20 g、自来水补足1 000 mL,pH值自然。
改良PDA培养基:在其中加入2%的可溶性淀粉,用于产淀粉酶菌株的筛选。
种子培养基[5]:牛肉膏3 g、蛋白胨10 g、NaCl 5 g、pH值为7.4~7.6、自来水1 000 mL。
基础发酵培养基[6]:可溶性淀粉20 g、蛋白胨10 g、酵母粉5 g、K2HPO41 g、NaCl 1 g、pH值7.4、自来水1 000 mL。
以上培养基灭菌条件为121 ℃,20 min。
1.1.3 仪器与设备
SY100型显微镜,Nikon公司;BXM- 30R型立式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;HZ200LB型恒温摇床、HP400S型生化培养箱,武汉瑞华仪器设备有限责任公司;UV mini- 1240型紫外分光光度计,日本岛津公司。
1.2 实验方法
1.2.1 材料预处理
1)根、茎、果表面的消毒及预处理。实验前,用自来水将罗汉果的根、茎、果冲洗干净,放入超净工作台;先用75%的酒精浸泡3 min,用无菌水清洗一次;用3%(3%~5%)的NaClO浸泡10 min,再用无菌水清洗一次;最后用75%的酒精浸泡30 s,用无菌水清洗5次,每次5 min。将第5次清洗的水保留下来作为对照。对已消毒的罗汉果根、茎、果进行剪切,取大小约为0.5 cm×0.5 cm×0.2 cm的组织进行接种。
2)土壤样品的预处理。分别取20 g罗汉果根部土壤和周边土壤,加入100 mL无菌水,振荡30 min,取上清液稀释后备用。
1.2.2 对照实验的设置
分别取0.5 mL根、茎、果的第5次清洗的水涂布于PDA培养基平板上,设置3个平行实验,静置5 min后,倒置于26 ℃培养箱中培养,24 h后观察是否长菌,未长菌说明表面消毒彻底,有菌生长说明消毒不彻底,需对材料表面重新消毒。
1.2.3 菌株的分离
将待接种的根、茎、果、土壤稀释液分别涂布于PDA培养基平板上,每种做3个平行,26 ℃恒温倒置培养3~5 d,当样品周围菌落长到一定程度,进行菌种分离纯化。
1.2.4 菌株的纯化
罗汉果内生菌及土壤微生物菌落长出后,挑取形态不同菌落分别接种于PDA培养基平板上,做3个平行实验,26 ℃恒温倒置培养3~5 d,观察菌落生长情况,分离纯化1~3次,经镜检确定无杂菌,可确定为纯培养菌,供筛选。
1.2.5 产淀粉酶菌株的筛选
1)初筛。将分离到的菌株进行稀释,取0.2 mL涂布于改良后的PDA分离筛选平板上,28 ℃培养箱中培养1~3 d[7]。每天观察菌落生长情况,在菌落周围滴加稀碘液,如菌落周围出现透明水解圈,表明菌株所产生的产物具有分解淀粉的能力。测定菌落及水解圈直径,计算其比值,测量D/d(水解圈直径/菌落直径)值,挑选D/d较大的菌株进行复筛。
2)复筛。在装有50 mL发酵培养基的250 mL三角瓶中接入初筛菌株,32 ℃,120 r/min 摇瓶培养48 h[8]。取发酵液离心,收集上清液进行酶活测定。选取酶活高的菌株,备用。
1.2.6 菌株的初步鉴定
将产酶菌株接种在平板上,观察菌落特征,进行革兰氏染色,在显微镜下观察菌株形态[9],对产酶菌株进行初步鉴定。
1.2.7 淀粉酶活力的测定
粗酶液的制备。取2 mL产酶菌株的种子液接种于50 mL发酵培养基中(250 mL三角瓶),32 ℃、120 r/min 摇床培养72 h,4 000 r/min离心20 min,取上清液[6],参照参考文献[10]、[11]进行酶活测定。
1.2.8 菌株产酶条件优化
1.2.8.1 产酶条件优化单因素实验
由于培养基成分和培养条件可直接影响菌株的生长情况,从而影响酶产量。其中碳源、氮源、氯化钠浓度、淀粉含量和温度是影响菌株生长的重要因素[5,8,12]。对复筛得到的产酶菌株通过单因素实验初步筛选菌株产酶的培养基和培养条件,为正交试验的因素水平设计提供依据。按表1进行单因素实验。

表1 单因素实验因素水平
基本发酵条件:250 mL三角瓶中装50 mL基础发酵培养基,接入种子液2 mL,32 ℃,120 r/min 培养3 d,离心取上清液,按1.2.7方法测酶活。
1.2.8.2 菌株产酶条件的正交试验
根据单因素实验结果,选择对实验结果影响大的因素进行正交试验,研究优化产酶条件。
2 结果与分析
2.1 菌株分离纯化的结果
罗汉果根、茎、果实等样品经过处理后接种于PDA培养基上,一周之内未发现杂菌污染,并且对照组培养基中没有长出菌落,表明样品材料表面消毒符合菌种分离要求。经分离培养,从罗汉果
根部样品中分离到6株菌株,编号为R1、R2、R3、R4、R5、R6;从茎部样品中得到5株菌株,编号为D1、D2、D3、D4、D5;从果实样品中得到4株菌株,编号为F1、F2、F3、F4;从罗汉果根部土壤中得到5株菌株,编号为1 -1、1 -2、1 -3、1 - 4、1 -5;从罗汉果周边土壤中得到3株菌株,编号为2 -1、2 -2、2 -3。
2.2 产淀粉酶菌株筛选结果
将分离纯化所得菌株的培养液经梯度稀释后涂布在初筛平板培养基上进行培养,共获得4株淀粉水解圈相对值较大的菌株(如图1),编号分别为:1 -5、2 -1、F -1、R - 4。将4株菌进一步划线分离后,接到斜面培养基上,低温保存。将初筛得到的4株菌按1.2.5中2)方法进行复筛,结果见表2。
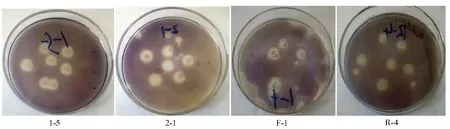
图1 菌株平板培养基筛选结果Fig.1 Screening results of plate culture medium
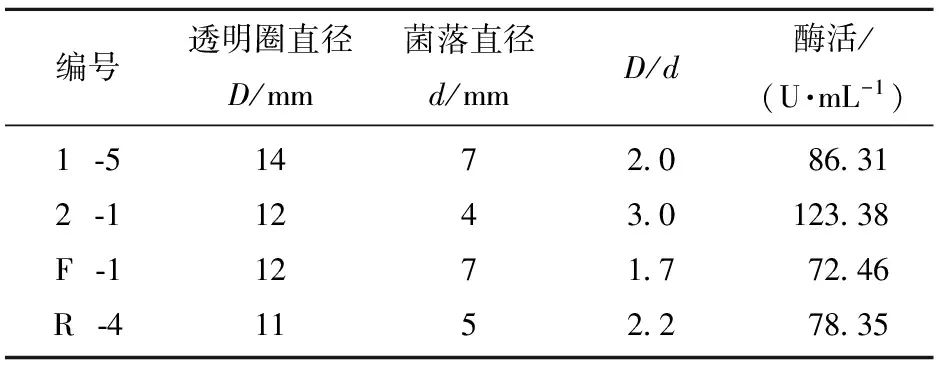
编号透明圈直径D/mm菌落直径d/mmD/d酶活/(U·mL-1)1⁃52⁃1F⁃1R⁃41412121174752030172286311233872467835
从表2可以看出,在分离于土壤的2株菌株中,菌株2 -1酶活最高,分离于罗汉果的内生菌中活性最高的为R - 4菌株,最终选定2 -1和R - 4两株菌株进行发酵条件优化。
2.3 菌株鉴定结果分析
对筛选出的产酶较高的2 -1菌株和R - 4菌株采用1.2.6方法进行初步鉴定,其结果见表3和图2。
2.4 菌株产酶条件分析
为获得菌株产酶的条件,对筛选出的2株产酶菌株按表1进行单因素实验,菌株2 -1的产酶条件单因素实验结果如图3,菌株R - 4的结果如图4。

表3 菌株初步鉴定结果
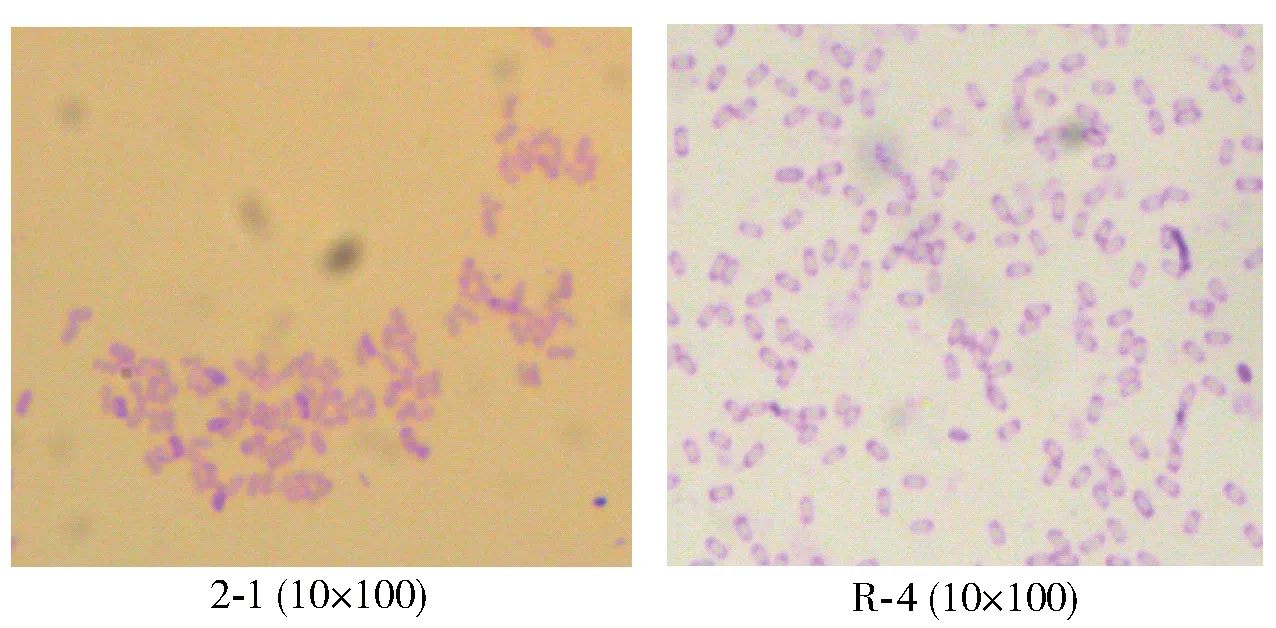
图2 菌株个体形态特征Fig.2 Morphological characteristics of strains

图3 菌株2 -1产酶条件分析Fig.3 Single factor experiment results for strain 2 -1
菌株2 -1发酵培养基的碳源为0.5%酵母粉、氮源为1.0%氯化铵、0.4%氯化钠、1.0%可溶性淀粉,当发酵温度为40 ℃时酶活性最大,被确定为菌株2 -1的较佳培养条件。其最大酶活为127.65 U/mL。

图4 菌株R - 4产酶条件分析Fig.4 Single factor experiment results for strain R - 4
菌株R - 4发酵培养基的碳源为0.5%酵母粉、氮源为1.0%氯化铵、0.1%氯化钠以及1.5%可溶性淀粉,当发酵温度为40 ℃时酶活性最大,被确定为菌株R - 4的较佳培养条件。其最大酶活为183.19 U/mL。
由图3、图4可以看出,培养基和环境条件对来自于土壤的菌株2 -1和来自于罗汉果的内生菌R - 4的产淀粉酶的活性有较大影响。在单因素实验条件下,罗汉果的内生菌R - 4产酶活性最大为183.19U/mL,来自于土壤的菌株2 -1的产酶活性最大为127.65 U/mL。因此,选择内生菌R - 4进行产酶优化条件选择的正交试验。
2.5 R - 4菌株产酶条件正交试验结果分析
为了获得内生菌R - 4产酶更好的条件,根据图4单因素实验结果,固定碳源和氮源,选择对产酶影响大的因素氯化钠、可溶性淀粉和发酵温度进行正交试验。结果见表4。
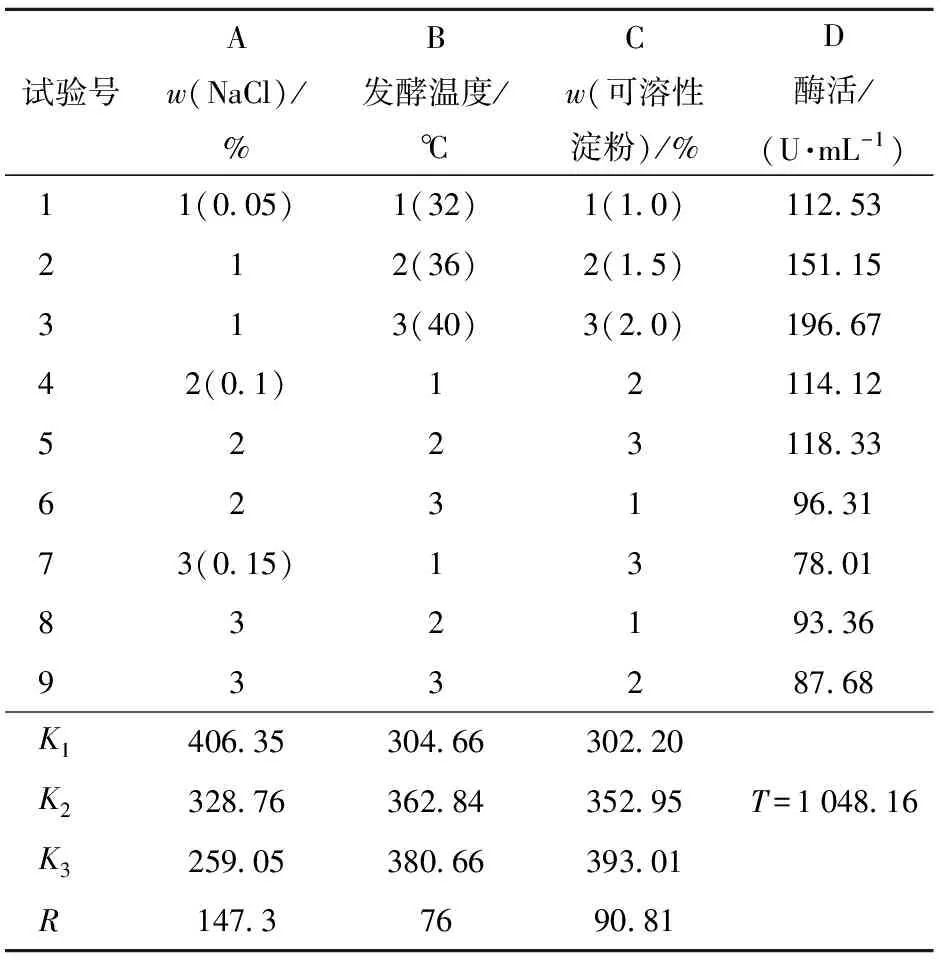
表4 正交试验结果与分析
表4结果显示,各因素影响的顺序为:ACB,即培养基中氯化钠的含量对菌株产酶的影响最大,其次为可溶性淀粉的含量,最后是发酵温度。极差分析优化条件为A1B3C3,与表4中实验号为3的条件一致。即优化培养条件为氯化钠0.05%、可溶性淀粉2.0%、发酵温度40 ℃。
2.6 优化培养条件验证实验结果
将内生菌R - 4的菌悬液2 mL接种于装液量为50 mL的最适发酵培养基中,即0.5%酵母粉、1.0%氯化铵、0.05%氯化钠、2.0%可溶性淀粉, 40 ℃,120 r/min摇床发酵3 d,进行3次重复试验,测定上清液中酶活为197.21 U/mL,显示正交试验结果的稳定性良好。
3 结 论
本研究采用微生物纯种分离技术,从罗汉果的根、茎、果实以及植株附近的土壤中分别分离到6株、5株、4株、8株微生物菌株。采用淀粉酶筛选培养基,从中分离筛选出产酶活性较高的两株菌株,一株为来自于罗汉果根部的内生菌R - 4;一株为来自于土壤的菌株2 -1。经初步鉴定,菌株2 -1为球菌,菌株R - 4为芽孢杆菌,均为革兰氏阳性菌。经单因素实验和正交试验,获得罗汉果的内生菌R - 4产酶发酵的优化培养基条件为0.5%酵母粉、1.0%氯化铵、0.05%氯化钠、2.0%可溶性淀粉,在发酵温度为40 ℃条件下、120 r/min摇床发酵3d,发酵液中α -淀粉酶的酶活为197.21 U/mL。来自于土壤的菌株2 -1优化的产酶培养基条件为:1.0%氯化铵、0.5%酵母粉、1.0%可溶性淀粉、0.4%氯化钠,在40 ℃条件下,120 r/min摇床发酵3d,其发酵液中α -淀粉酶的酶活为127.65 U/mL。研究结果初步表明,罗汉果内生菌中含有产淀粉酶的菌株,且产酶能力强于来自周围土壤中的产酶菌株,但该菌株是否有其他作用,是否参与了罗汉果甜甙的代谢等尚需进一步的研究,R - 4内生菌也需采用分子生物学手段进一步深入研究,鉴定其为何种细菌。
[1] 何超文,姚美村,朱晓韵,等.鲜罗汉果皂苷提取工艺及其成分分析[J].广西轻工业,2011,157(12):1-2. HE C W, YAO M C, ZHU X Y, et al. Process and composition analysis of extracted from freshMomordicagrosvenori[J]. Light Industry in Guangxi, 2011, 157(12): 1-2.
[2] CHEN Q B, ZHU J, TAN H W. Identification of flavone aglycones inMomordicagrosvenoriflower[J]. Medicinal Plant,2010(11): 59-61.
[3] TAN H S, CHEN Q B. Pilot production and product index of flavonoids from the leaves ofMomordicagrosvenoriswingle[J]. Medicinal Plant,2011(8): 56-57.
[4] 莫长明,王海英,马小军,等.罗汉果甜苷V合成生理规律的研究[J].华南农业大学学报,2014,35(1):93-99. MO C M, WANG H Y, MA X J, et al. Study on synthesis of mogroside V physiological law[J]. Journal of South China Agricultural University, 2014, 35(1): 93-99.
[5] 王海涛,王昌禄,李贞景,等.可降解蓖麻饼粕的蛋白酶产生菌筛选及产酶条件优化[J].食品科学技术学报,2015,33(1):43-48. WANG H T, WANG C L, LI Z J, et al. Screening of protease producing bacteria for degradable castor meal and its optimization of fermentation conditions[J]. Journal of Food Science and Technology, 2015,33(1): 43-48.
[6] 尹伊,屈建航,李海峰,等. 耐酸耐高温α -淀粉酶及其菌种选育研究进展[J].粮油食品科技,2015,23(5):101-105. YIN Y, QU J H, LI H F, et al. Progress of high tempera -ture alpha amylase and acid resistant breeding research[J]. Grain and Oil Food Science and Technology, 2015, 23 (5) : 101-105.
[7] 楼超,刘铁帅,贾博深,等.高产淀粉酶菌株的筛选及产酶条件优化的探究[J].中国卫生检验杂志,2010,20(11):2817-2820. LOU C, LIU T S, JIA B S, et al. Screening of high yield amylase producing strains and optimization of enzyme production conditions[J]. Chinese Journal of Health Laboratory Technology, 2010, 20(11): 2817-2820.
[8] 腾军伟,杨贞耐.解淀粉芽孢杆菌GSBa- 1产凝乳酶培养基组成的优化[J].食品科学技术学报,2016,34(4):31-38. TENG J W, YANG Z N. Optimization ofBacillusamyloliquefaciensGSBa- 1 chymosin producing medium composition[J]. Journal of Food Science and Techno -logy, 2016, 34(4):31-38.
[9] 东秀珠 ,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:1-398.
[10] 李翠香,胡元森,潘涛,等.一株耐酸性α -淀粉酶产生菌的分离鉴定及发酵条件研究[J].河南工业大学学报(自然科学版),2009,30(2):51-54. LI C X, HU Y S, PAN T, et al. Isolation and identification of a strain of acid resistant alpha amylase producing strain and its fermentation conditions[J]. Journal of Henan University of Technology (Natural Science Edition), 2009, 30(2): 51-54.
[11] 雷晓燕.土壤中淀粉酶产生菌的筛选及产酶条件优化[J].沈阳化工大学学报,2010,24(3):203-208. LEI X Y. Screening of amylase producing strains and optimization of enzyme production conditions in soils[J]. Journal of Shenyang University of Chemical Engineering, 2010, 24(3): 203-208.
[12] 崔海洋,程仕伟,黄田红,等.产纤维素酶的解淀粉芽孢杆菌分离鉴定及酶学性质研究[J].食品科学技术学报,2014,32(3):43-47. CUI H Y, CHENG S W, HUANG T H, et al. Isolation and identification of aBacillusstrain producing cellulase and study on its enzymatic properties[J]. Journal of Food Science and Technology, 2014, 32(3): 43-47.
(责任编辑:叶红波)
Screening ofα-Amylase Producing Strains from Endophytic Bacteria inSiraitiagrosvenoriiand Its Surrounding Soil
ZHAO Fengli1,2, WU Ben1, ZHANG Changzhi1, FAN Caiqin1, SONG Yunfei3, YANG Wenguo3, CHEN Jing1
(1.CollegeofLifeScience,GuangxiNormalUniversity,Guilin541004,China; 2.KeyLaboratoryofEcologyofRareandEndangeredSpeciesandEnvironmentalProtection,MinistryofEducation,Guilin541004,China; 3.GuilinLaynNaturalIngredientsCorp.,Guilin541199,China)
In this study, the screening of α -amylase producing strains from endophytic bacteria inSiraitiagrosvenoriiand surrounding soil were preformed, and the optimum fermentation conditions for α -amylase producing strains were performed. Our results showed that 15 strains were isolated from theSiraitiagrosvenoriand 8 strains from surrounding soil. High amylase producing strains 2 -1 (surrounding soil) and R - 4 (root endophytic bacteria) were isolated. The identification results showed that 2 -1 strain was staphylococcus and R - 4 strain was bacillus, which were gram positive bacteria. The appropriate condition of enzyme production for strains 2 -1 and R - 4 were determined. For strain 2 -1, the appropriate conditions were 1.0% ammonium chloride, 0.5% yeast powder, 1.0% soluble starch, 0.4% sodium chloride, fermentation temperature 40 ℃, and fermentation time 3 days and the enzyme production was 127.65 U/mL under these conditions. For strain R - 4, the appropriate conditions were 0.5% yeast powder, 1.0% ammonium chloride, 0.05% sodium chloride, 2.0% soluble starch, fermentation temperature 40 ℃, and fermentation time 3 days, and the enzyme production was 197.21 U/mL under these conditions.
Siraitiagrosvenorii; endophytic bacteria; α -amylase; fermentation condition
10.3969/j.issn.2095 -6002.2017.03.009
2095 -6002(2017)03 -0061 -05

赵丰丽,吴奔,张昌志,等. 罗汉果内生菌及其周边土壤中产α -淀粉酶菌株的筛选[J]. 食品科学技术学报,2017,35(3):61-65.
ZHAO Fengli, WU Ben, ZHANG Changzhi, et al. Screening of α -amylase producing strains from endophytic bacteria inSiraitiagrosvenoriiand its surrounding soil[J]. Journal of Food Science and Technology, 2017,35(3):61-65.
2016 -06 -29
桂林莱茵生物科技股份有限公司与广西师范大学合作项目;广西科学研究与技术开发计划项目(桂科重14121001 - 4 -3)。
赵丰丽,女,教授,主要从事功能性食品、发酵食品及生物活性成分等研究与开发工作。
TS201.3
A
