艾普拉唑肠溶片在中国健康人体中药代动力学及绝对生物利用度研究
2017-08-22张天南张宏文
张天南,欧 宁,张宏文
·论 著·
艾普拉唑肠溶片在中国健康人体中药代动力学及绝对生物利用度研究
张天南1,欧 宁2,张宏文2
目的 采用液相色谱串联质谱(UPLC-MS/MS)分析方法研究艾普拉唑肠溶片在中国健康人体中的吸收特性。 方法 采用随机交叉自身对照试验设计,16名健康受试者随机等分成4组,先后口服艾普拉唑肠溶片或静脉注射艾普拉唑钠,采用UPLC-MS/MS测定血浆药物浓度。利用WinNonlin(V6.1)软件标准非房室模型方法进行药代动力学参数的计算。 结果 注射用艾普拉唑钠(10 mg)的主要药代动力学参数:最大血药浓度(Cmax)为(834.3±101.2)ng/mL,消除半衰期(t1/2)为(3.4±0.9)h,表观分布容积(Vz)为(14.0±2.2)L, 0到t时间药时曲线下面积(AUC0_t)为(3 520.9±915.3)ng·h/mL,血浆清除率(CL)为(3.0±0.9)L/h。艾普拉唑肠溶片(10 mg)的主要药代动力学参数:Cmax为(347.9±176.3)ng/mL,t1/2为(3.5±0.8)h,Vz为(29.1±12.2)L,AUC0_t为(1970.2±834.7)ng·h/mL,CL为(5.9±2.5)L/h。与静脉给药相比,口服艾普拉唑肠溶片的绝对生物利用度为(55.2±13.9)%。 结论 艾普拉唑肠溶片生物利用度良好,适于开发。
艾普拉唑;药代动力学;绝对生物利用度;液相色谱串联质谱
艾普拉唑(ilaprazole,IY-81149)由韩国的一洋制药公司与丽珠医药集团股份有限公司在中国合作研发的新一代质子泵抑制剂(PPI),并且首次在小鼠、大鼠、犬和猪动物模型上进行体外研究[1-3]。艾普拉唑是一种新型的离子泵抑制剂,属于苯并咪唑类,与奥美拉唑和兰索拉唑化学结构相似,但在苯并咪唑上用吡咯环取代了氢,在吡啶环上用氢取代了甲基。它可以有效并长久地抑制胃酸分泌[4-5],并可高效、安全地治疗十二指肠溃疡及胃酸相关的一些疾病,如应激性胃溃疡等[6-7]。艾普拉唑在治疗十二指肠溃疡时特别是在较低剂量(10/5 mg/d艾普拉唑vs20 mg/d奥美拉唑)下与奥美拉唑一样可耐受,安全和有效[8-9]。注射用艾普拉唑钠是艾普拉唑钠的冻干粉针剂,是丽珠集团研发的化学药品2类新药。2013年1月,该药获中华人民共和国国家食品药品监督管理总局(SFDA)批准进行临床试验(药物临床试验批件号:2013L00143),丽珠集团委托南京医科大学第一附属医院和中国医学科学院北京协和医院进行I期临床研究。本研究用于评价艾普拉唑静脉注射与口服片剂生物利用度,为推荐Ⅱ期临床试验方案提供依据。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 艾普拉唑、奥美拉唑-d2标准品均由丽珠集团医药研究所提供,纯度分别为99.7%和98.3%。注射用艾普拉唑钠,规格:10 mg(以艾普拉唑计)/瓶,批号:130401;艾普拉唑肠溶片,规格:5 mg(以艾普拉唑计)/片,批号:20120822。均由丽珠集团丽珠制药厂提供;乙腈和甲酸为HPLC级,分别为Burdick&Jackson及Sigma-Aldrich产品。乙酸乙酯和异丙醇为HPLC级,均为Thermo-Fisher产品。氨水和乙酸铵为分析纯,分别由北京化学试剂公司和国药集团试剂公司提供。
1.1.2 仪器 使用液相色谱串联质谱(UPLC-MS/MS)系统进行测定,LC-20A超高效液相色谱仪、Xevo TQS质谱仪来自美国Waters公司。离心机(Megaguge 1.0R,德国Heraeus产品)。分析天平(AX105DR,瑞士METTLER TOLEDO产品)。氮吹仪(DB-3D,TECHNE产品)。Milli-Q超纯水机(Millipore Inc. USA)。
1.1.3 色谱及质谱条件 美国Waters Acquity BEH C18色谱柱(2.1 × 50 mm,1.7 μm);流动相为乙腈-含0.08%氨水的10 mM乙酸铵水溶液(55∶45,V/V,pH=9.0),流速为0.4 mL/min,柱温为室温。进样体积为3 μL,每个样品的分析时间为2.0 min。串联质谱条件:采用电喷雾离子源(ESI),用正离子方式检测,选用多反应监测(MRM)的质谱扫描方式测定,用于定量的离子反应分别为m/z 367.10→m/z 183.97(艾普拉唑)和m/z 348.16→m/z 198.00(奥美拉唑-d2)。脱溶剂气温度为450 ℃;雾化气设置(氮气)参数为7.0;毛细管电压为2.5 kV;碰撞气设置(氩气)参数为15 unit。
1.2 临床试验
1.2.1 对象 本试验使用的临床试验方案和受试者书面知情同意书,及其修订均在试验开始前获得了南京医科大学第一附属医院临床试验伦理委员会的书面批准(批准号:2013-MD-039)。本研究严格遵守赫尔辛基宣言人体医学研究的伦理准则,SFDA颁布的药物临床试验质量管理规范,ICH/GCP以及国家法规部门的相应要求。入选标准:受试者试验前签署知情同意书,并对试验内容、过程及可能出现的不良反应充分了解,入选健康受试者16名(男女各半),年龄18~45 岁(包括边界值),体重指数(BMI)在正常19~25 kg/m2范围内;且同一批受试者体重不宜悬殊过大,无心、肝、肾、消化道、神经系统、精神异常及代谢异常等病史,体格检查显示血压、心率、心电图、呼吸状况、肝、肾功能和血象无异常,试验前2 周内未服任何药物,非过敏体质,无已知的药物过敏史,以往无重要脏器疾病史者,无影响药物代谢的其他因素,无吸烟、饮酒、吸毒史。排除标准:躯体残疾者,最近3个月献血者或参加其他临床试验采血者,妊娠期妇女或可能妊娠的妇女,研究者认为不能入组的其他情况(如体弱、依从性不可控等)。退出标准:受试者依从性差,研究者认为不能完成临床试验者,受试者不愿意继续进行临床试验,向研究者提出退出者,使用了影响试验结果的药物。终止试验标准:半数受试者出现中度不良反应,达到最大剂量,申办者要求全面终止试验,SFDA或伦理会要求停止。
1.2.2 实验方案 受试者于给药前1周进行体格检查和实验室检查,筛查合格后,于给药前1天入住Ⅰ期病房。晚餐后开始禁食,22:00后开始禁水。第2天早上8:00开始给药。采用随机、开放、四周期交叉的试验设计。16 名志愿者随机分成4 组,每组4名,男、女各半。在不同周期内,受试者分别口服艾普拉唑肠溶片10 mg 或静脉注射艾普拉唑钠10 mg。经过1周的洗脱期,交叉后再分别给药。口服给药采血时间点为给药前及给药后1.5、2、2.5、3、3.5、4、5、6、8、10、12、24、34、48 h;注射给药采血时间点为给药前及给药后15、30、45、50、60 min及1.5、2、3、4、5、8、12、24 h。每次取血3 mL,肝素抗凝。将采集后的血样尽快在避光条件下冰浴冷却,并在4℃条件下高速离心分离。血浆样品分3份碱化并置于有合适标记的试管中,在≤-40 ℃冰箱中保存待测。血浆碱化方法为600 μL的血浆加入10 μL NaOH溶液(1 mol/L)碱化溶液,混匀后存放于在≤-40 ℃冰箱中。
1.2.3 血浆样品的处理 取50 μL血浆样本置于1.5 mL EP管中,依次加入10 μL内标溶液(1.0 μg/mL)和400 μL乙酸乙酯(含5%异丙醇),涡旋振荡2 min,13000 rpm离心10 min。取上清液400 μL至于洁净玻璃管中,室温下以N2吹干,以体积为200 μL的乙腈-含0.08%氨水的10 mM乙酸铵水溶液(55∶45,V/V)的溶液复溶后,取3 μL进样。
1.2.4 标准溶液配制 分2次精密称取艾普拉唑标准品10.03 mg,然后转移至10 mL容量瓶中,用乙腈:10 mM乙酸铵水溶液(55∶45,V/V,pH=10.0)的溶液定容至刻度。上述储备液分别用与配制标准曲线和质控样品,储存于-80 ℃冰箱备用。标准曲线工作液STD1(100 μg/mL):取1 mg/mL标准储备液1.0 mL,转移至10 mL容量瓶中,用乙腈:10 mM乙酸铵水溶液(55∶45,V/V,pH=10.0)的溶液定容至刻度。此工作液用于配制血浆标准曲线,储存于-80 ℃冰箱备用。质控工作液QTD1(100 μg/mL):取1 mg/mL质控储备液1.0 mL,转移至10 mL容量瓶中,用乙腈:10 mM乙酸铵水溶液(55∶45,V/V,pH=10.0)的溶液定容至刻度。此工作液用于配制血浆质控样品,储存于-80 ℃冰箱备用。精密称取内标10.04 mg,然后转移至1 mL容量瓶中,加入适量乙腈:10 mM乙酸铵水溶液(55∶45,V/V,pH=10.0)的溶液溶解后定容至刻度,得到1 mg/mL储备液,储存于-80 ℃冰箱备用。浓度为100 μg/mL内标工作液的配制:取1 mg/mL内标储备液1.0 mL,转移至10 mL容量瓶中,用乙腈∶10 mM乙酸铵水溶液(55∶45,V/V,pH=10.0)的溶液定容至刻度,储存于-80 ℃冰箱备用。浓度为1 μg/mL内标工作液的配制:取100 μg/mL内标储备液1.0 mL,转移至10 mL容量瓶中,用乙腈∶10 mM乙酸铵水溶液(55∶45,V/V,pH=10.0)的溶液定容至刻度,储存于-80 ℃冰箱备用。
1.3 观察指标 观察主要药代动力学参数为:消除半衰期(t1/2)、最大血药浓度(Cmax)、表观分布容积(Vz)、0到t时间药时曲线下面积(AUC0_t)、0到∞时间药时曲线下面积(AUC0_∞)、血浆清除率(CL)。药代动力学参数的计算根据样本的实际采样时间,采用药代动力学专业统计分析软件Phoenix WinNonlin(V 6.1,美国pharsight公司),通过非房室模型方法对艾普拉唑血浆浓度数据进行药代动力学参数的计算,分别获得了静脉和口服给药后的药时曲线下面积,通过以下公式计算艾普拉唑的绝对生物利用度:
绝对生物利用度=口服药时曲线下面积·注射剂量/注射药时曲线下面积·口服剂量×100%
2 结 果
2.1 方法学 按选定的LC-MS/MS条件,艾普拉唑及内标的保留时间分别为0.43 min及0.38 min,并且附近没有明显的内源性物质干扰,此方法专属性强。血浆中艾普拉唑在室温放置2 h、反复冻融3次(-80 ℃至25 ℃)、自动进样器(4 ℃)放置24 h、-80 ℃放置180 d仍然稳定。其储备液在-80 ℃放置346 d稳定性良好。本研究标准曲线的范围为1~1000 ng/mL,分别为1、2、10、50、100、250、500、1000 ng/mL。在1~1000 ng/mL的范围内,艾普拉唑与内标峰面积比值与药物浓度具有良好的线性关系。标准线性方程为:Y=0.005X+0.0007(r=0.999)。精密度实验批内和批间的变异系数<15%。该方法萃取回收率为70.3%~75.9%。结果表明所建立的艾普拉唑在人血浆内LC-MS/MS分析方法符合生物样品分析的要求。
2.2 药代动力学 单次给药试验中入组16名受试者,有1名男性受试者在试验第1周期结束后退出试验(凝血功能中凝血酶原时间值升高较高,结合试验前后心电图检查时,与电极接触部分皮肤均出现异常无法短期恢复的红斑,且受试者皮肤有疾病史,为保证受试者安全,由研究者决定其退出试验)。15名受试者(男7名、女8名)完成所有临床试验。15名受试者单剂量口服或静脉注射给予10 mg艾普拉唑后的平均血浆药物浓度-时间曲线见图1。口服及静脉注射艾普拉唑试验的主要药代动力学参数见表1,单次静脉注射10 mg艾普拉唑药物后,Cmax和AUC与剂量呈现明显比例关系, t1/2、CL和Vz与给药剂量无关。非房室模型方法对艾普拉唑血浆浓度数据进行药代动力学参数的计算,分别获得了静脉和口服给药后的药时曲线下面积,计算艾普拉唑的绝对生物利用度为(55.2±13.9)%。

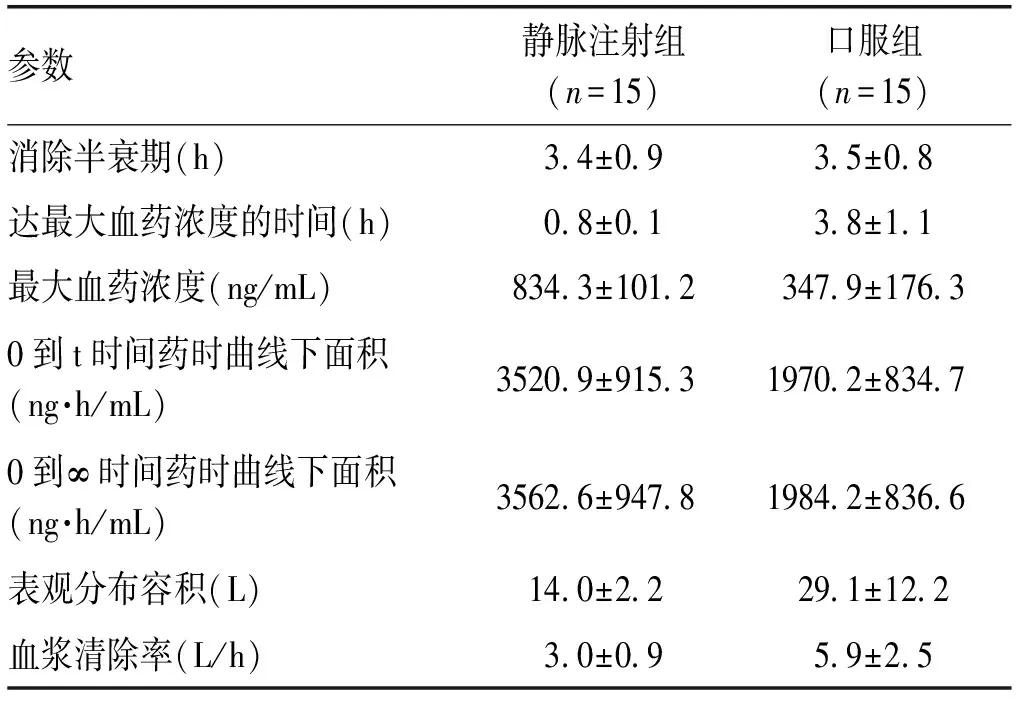
参数静脉注射组(n=15)口服组(n=15)消除半衰期(h)3 4±0 93 5±0 8达最大血药浓度的时间(h)0 8±0 13 8±1 1最大血药浓度(ng/mL)834 3±101 2347 9±176 30到t时间药时曲线下面积(ng·h/mL)3520 9±915 31970 2±834 70到∞时间药时曲线下面积(ng·h/mL)3562 6±947 81984 2±836 6表观分布容积(L)14 0±2 229 1±12 2血浆清除率(L/h)3 0±0 95 9±2 5
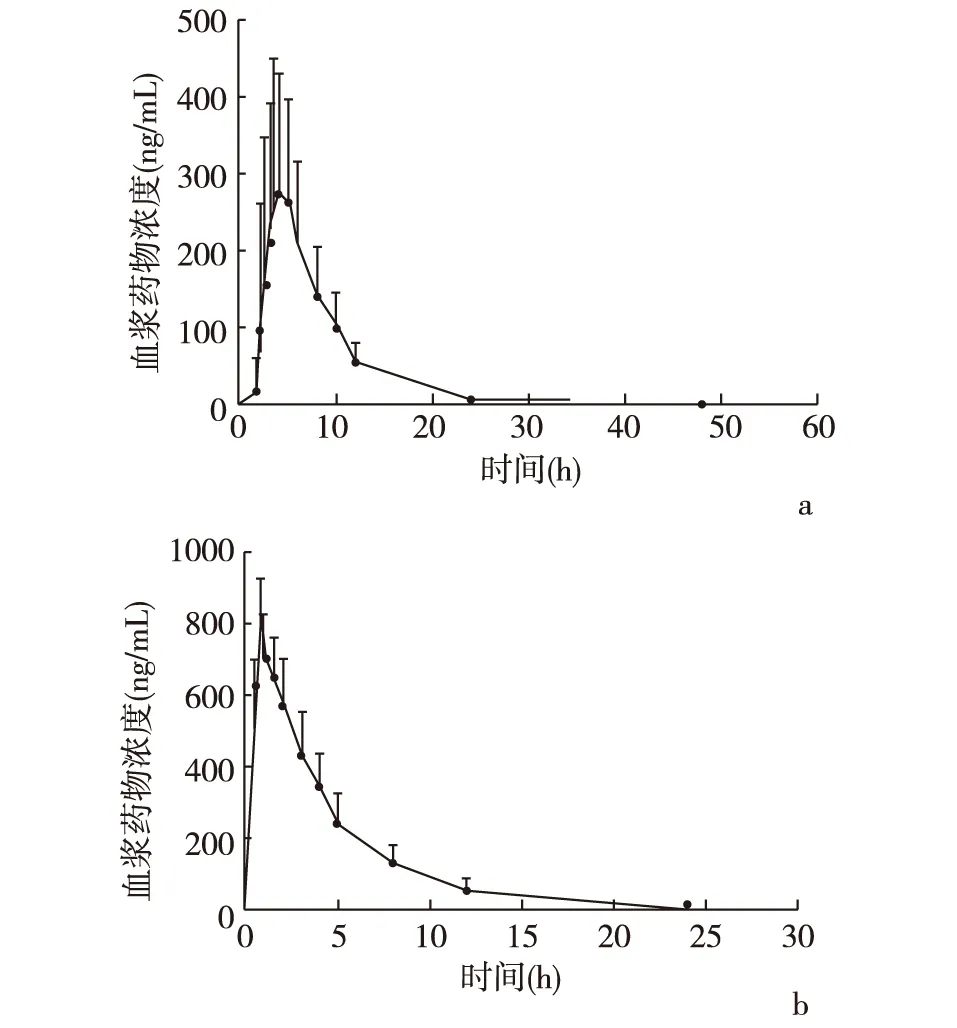
a:口服10 mg艾普拉唑肠溶片;b:静脉注射10 mg艾普拉唑钠
图1 受试者口服和静脉注射艾普拉唑钠的平均血药浓度-时间曲线
3 讨 论
艾普拉唑至2009年已在27个国家申请专利[10]。2007年12月,艾普拉唑作为治疗十二指肠溃疡的药物被批准上市。2009年,在韩国开始用于治疗十二指肠溃疡和胃溃疡,并于2012年用于治疗糜烂性食管炎[11]。丽珠集团研发的艾普拉唑原料及肠溶片于2007年12月在我国获批,首次在全球上市,为国家Ⅰ类新药,至今研究资料较少[12-13]。其他拉唑类药物,如雷贝拉唑和埃索美拉唑为进口合资的质子泵抑剂,由于价格高临床使用受限[14]。艾普拉唑肠溶片每日晨服10 mg治疗十二指肠球部溃疡,疗效较好。本试验单次口服10 mg,单剂量静脉注射5 mg、10 mg、20 mg注射用艾普拉唑钠(批号130401)药物后, 16名受试者共发生了11人次轻度不良事件,其中有7人次,以凝血功能中活化部分凝血活酶时间(APTT)和凝血酶原时间(PT)的升高为表现,每个剂量组中都有出现。结合试验过程中出现的受试者凝血测定值部分异常,怀疑与处方中乙二胺四乙酸钠(EDTA-Na)有关,将注射用艾普拉唑钠处方中EDTA-Na的含量由2 mg/10 mg调整为1 mg/10 mg,使用新处方继续进行试验。单次给药试验剂量研究过程中无重度或严重不良事件发生。 本试验结果显示,艾普拉唑在人体内的过程符合线性动力学特征。通过非房室模型方法对艾普拉唑血浆浓度数据进行药代动力学参数的计算,分别获得了静脉和口服给药后的药时曲线下面积,计算艾普拉唑的绝对生物利用度。结果显示,口服艾普拉唑肠溶片的绝对生物利用度是(55.2±13.9)%。艾普拉唑肠溶片生物利用度良好,因此适于开发。
[1] Kil BJ, Kim IW, Shin CY,etal. Comparison of IY81149 with omeprazole in rat reflux oesophagitis[J]. J Auton Pharmacol,2000, 20(5-6):291-296.
[2] Kwon D, Chae JB, Park CW,etal. Effects of IY-81149, a newly developed proton pump inhibitor, on gastric acid secretion in vitro and in vivo[J]. Arzneimittelforschung, 2001, 51(3):204-213.
[3] Kim EJ, Lee RK, Lee SM,etal. General pharmacology of IY-81149, a new proton pump inhibitor[J]. Arzneimittelforschung, 2001, 51(1):51-59.
[4] 周丽雅, 林三仁, 杨云生,等. 艾普拉唑对十二指肠溃疡患者胃内pH值的影响[J]. 中华内科杂志, 2010, 49(4):290-292.
[5] Wang H, Lang L, Ning O,etal. Pharmacokinetics, pharmacodynamics and safety of multiple-Infusion ilaprazole in healthy Chinese subjects[J]. Clin Drug Invest, 2016, 36(6):463-470.
[6] Ji XQ, Du JF, Chen G,etal. Efficacy of ilaprazole in the treatment of duodenal ulcers:a meta-analysis[J]. World J Gastroenterol, 2014, 20(17):5119-5123.
[7] 李志坤, 王福文. 药物治疗应激性胃溃疡的研究进展[J]. 医学研究生学报, 2015,28(1):110-112.
[8] Wang L, Zhou L, Lin S,etal. A new PPI, ilaprazole compared with omeprazole in the treatment of duodenal ulcer: a randomized double-blind multicenter trial[J]. J Clin Gastroenterol, 2011, 45(4):322-329.
[9] Ho KY, Kuan A, Zao F,etal. Randomized, parallel, double-blind comparison of the ulcer-healing effects of ilaprazole and omeprazole in the treatment of gastric and duodenal ulcers[J]. J Gastroenterol, 2009, 44(7):697-707.
[10] 刘 腾, 常艳璐, 韩 容. 艾普拉唑的作用机制与临床评价[J]. 中国医院用药评价与分析, 2009, 9(10):724-725.
[11] Shin JS, Lee JY, Cho KH,etal. The pharmacokinetics, pharmacodynamics and safety of oral doses of ilaprazole 10, 20 and 40 mg and esomeprazole 40 mg in healthy subjects: a randomised, open-label crossover study[J]. Aliment Pharmacol Ther, 2014, 40(5):548-561.
[12] 艾普拉唑临床协作组. 艾普拉唑肠溶片治疗十二指肠溃疡的多中心、随机、双盲、阳性平行对照临床研究[J]. 中华消化杂志, 2009, 29(8):542-546.
[13] 梁嘉碧, 冯文周, 边 壮,等. 液相色谱-串联质谱法测定人血浆中艾普拉唑的浓度[J]. 药物分析杂志, 2013,33(6):935-940.
[14] 吴 骏, 陈集志, 徐小燕,等. 2011-2013年我院口服抗消化性溃疡药物的用药分析[J]. 东南国防医药, 2014,16(5):502-504.
(本文编辑:叶华珍; 英文编辑:王建东)
Pharmacokinetics and absolute bioavailability of ilaprazole enteric-coated tablet in Chinese healthy volunteers
ZHANG Tian-nan1, OU Ning2, ZHANG Hong-wen2
(1.DepartmentofPharmacy,JiangsuProvinceHospitalofTraditionalChineseMedicine,Nanjing210029,Jiangsu,China;2.PhaseIClinicalTrialLaboratory,theFirstAffiliatedHospitalofNanjingMedicalUniversity,JiangsuProvinceHospital,Nanjing210029,Jiangsu,China)
Objective To study the absorption of ilaprazole enteric-coated tablet in Chinese healthy volunteer using UPLC-MS/MS. Methods A randomized crossover self-controlled trial was designed, in which sixteen subjects were randomly divided into 4 groups. Then ilaprazole enteric-coated table or ilaprazole sodium were given to each group by oral or intravenous injection. The drug concentrations were determined by UPLC-MS/MS and pharmacokinetic parameters were calculated using WinNonlin (V6.1) software with non-compartmental model. Results The pharmacokinetic parameters of ilaprazole sodium (10 mg) for injection were as follows: Cmaxwas (834.3±101.2) ng/mL t1/2was (3.4±0.9) h. Vz was (14.0±2.2) L. AUC0_twas (3520.9±915.3) ng·h/mL. CL was (3.0±0.9) L/h. The pharmacokinetic parameters of ilaprazole enteric-coated table (10 mg) were as follows: Cmax was (347.9±176.3) ng/mL. t1/2was (3.5±0.8) h. Vz was (29.1±12.2) L. AUC0_twas (1970.2±834.7) ng·h/mL. CL was (5.9±2.5) L/h. Compared with ilaprazole sodium, the mean absolute bioavailability of ilaprazole enteric-coated table was (55.2±13.9)%. Conclusion Ilaprazole enteric-coated tablet has good bioavailability and is suitable for development.
Ilaprazole; Pharmacokinetic; Absolute bioavailability; LC-MS/MS
1. 210029南京,江苏省中医院药学部;2. 210029南京,南京医科大学第一附属医院/江苏省人民医院I期临床试验研究室
张天南,欧 宁,张宏文.艾普拉唑肠溶片在中国健康人体中药代动力学及绝对生物利用度研究[J].东南国防医药,2017,19(4):372-375.
R969.1
A
1672-271X(2017)04-0372-04
10.3969/j.issn.1672-271X.2017.04.010
2017-03-15;
2017-06-01)
