海参胶原低聚肽对糖尿病小鼠术后伤口愈合的促进作用
2017-08-22任金威陈启贺
李 林,李 迪,徐 腾,刘 睿,任金威,陈启贺,李 勇
(北京大学公共卫生学院,北京 100191)
海参胶原低聚肽对糖尿病小鼠术后伤口愈合的促进作用
李 林,李 迪,徐 腾,刘 睿,任金威,陈启贺,李 勇
(北京大学公共卫生学院,北京 100191)
目的:观察海参胶原低聚肽是否具有促进db/db 2型糖尿病小鼠术后伤口愈合的作用。 方法:取90只10w龄的db/db小鼠分为5组,包括模型对照组乳清蛋白组和3个海参胶原肽组(从低到高分别为0.25、0.50、1.00 g/kg·BW),每组18只。另设一组同周龄、性别的db/m小鼠18只作为正常对照组。模型对照组和正常对照组使用溶剂(蒸馏水)灌胃。进行背部切口手术后开始干预,分别于术后第4、7、14d分批处死动物,每组每次处死6只。术后观察不同时期伤口愈合情况,测定血清生化指标、皮肤切口抗张力强度以及进行皮肤组织HE染色。结果:与模型对照组相比,海参胶原肽剂量组小鼠血清IL-8水平降低,IL-10水平升高,NO水平升高,伤口抗张力强度提升,伤口愈合较好。结论:海参胶原低聚肽能够改善糖尿病小鼠术后营养状况,促进伤口愈合。
海参胶原低聚肽;糖尿病;伤口愈合
糖尿病人伤口愈合缓慢是糖尿病的一种常见并发症[1]。在临床中,糖尿病患者由于伤口愈合困难,从而使其发生溃疡、感染甚至坏疽和截肢[2]。寻找促进糖尿病人伤口愈合的方法对于改善术后糖尿病人的生活质量,减少并发症的发生有着重要的作用。海参肽具有多种生物活性功能[3]。有研究发现,海参胶原肽能够促进正常大鼠伤口胶原蛋白合成从而促进伤口愈合[4]。本研究拟建立糖尿病小鼠伤口模型,观察海参胶原低聚肽对糖尿病小鼠术后伤口愈合的影响。
1 材料和方法
1.1 材料
海参胶原低聚肽:淡黄色粉末,利用生物酶解技术从海参中提取、制备的小分子生物活性肽。经高效液相色谱纯化后,用质谱仪对其分子质量分布进行分析可知,其相对分子质量小于1 000的占89.44%,游离氨基酸含量占7.496%,其中精氨酸、亮氨酸、酪氨酸、苯丙氨酸、赖氨酸、谷氨酸含量较多。实验样品由吉林肽谷生物工程有限责任公司提供。
1.2 实验动物
SPF级雄性db/db型糖尿病小鼠以及与之周龄、性别匹配的同窝出生的非糖尿病健康db/m小鼠,10w龄,由常州卡文斯实验动物公司提供。
清洁级动物房饲养,环境温度21~23℃,相对湿度50%~60%,动物分笼饲养,自由进食饮水。
1.3 主要仪器和试剂
高速冷冻离心机(德国Eppendorf 公司);PCLAB-UE生物医学信号采集处理系统(北京微信斯达科技发展有限责任公司);力换能器(北京新航兴业科贸有限公司);CK40-SL倒置显微镜(日本Olympus公司);小鼠IL-8、IL-10(ELISA)检测试剂盒、小鼠NO检测试剂盒(北京泰格诺克科技有限公司)。
1.4 实验方法
1.4.1 实验动物创伤模型的建立 小鼠经过4%水合氯醛麻醉后,进行背部脱毛。常规皮肤消毒,于背部两侧分别切一个长1.5cm的纵向切口。切口切开肌肉,深达腹腔。然后模拟临床手术过程逐层缝合肌肉与皮肤。术后涂抹2%碘伏消毒,并注射青霉素G钠(1 000 IU/g·BW)防止感染。术后禁食6h,保持正常饮水。手术当天记为第0d。
1.4.2 实验动物分组 db/db小鼠90只,每组18只,随机分为5组。包括模型对照组、乳清蛋白组(0.50 g/kg·BW)和海参胶原低聚肽剂量组(从低到高分别为0.25、0.50、1.00 g/kg·BW)。同时设立1组正常对照组,为18只同窝出生的非糖尿病db/m小鼠。正常对照组和模型对照组用等体积溶剂(蒸馏水)进行灌胃。于手术当天开始灌胃进行干预,海参肽3个剂量组每天灌胃给予海参肽水溶液,乳清蛋白组给予乳清蛋白水溶液,正常对照组和模型对照组每天灌胃给予同体积的蒸馏水。灌胃量为0.1 mL/10g,每日1次。乳清蛋白水溶液和海参肽水溶液均用蒸馏水配置。分别于术后第4、7、14d分批处死小鼠,每组每次处死6只。
1.4.3 伤口愈合的评价
伤口愈合的组织病理学观察:各组小鼠于第4、7、14d处死时取左侧全层皮肤组织,组织切口距伤口边缘0.5 cm,用甲醛固定用于做石蜡切片进行HE染色。
伤口的抗涨强度测试:各组小鼠于第4、7、14d处死时取右侧伤口皮肤,以伤口处为中线,宽0.5 cm,距伤口两侧各0.5 cm为长的长方形皮肤,去除皮下脂肪组织。将皮肤短边的一头连接到张力感受器,另一端连接到可以通过旋钮微调距离的装置上。缓慢调动旋钮拉伸皮肤,通过多功能生物信号采集系统记录皮肤断开时的张力大小。通过测微尺测量皮肤的厚度计算横截面积,张力除以横截面积即为皮肤的抗张强度。
血清生化指标检测:小鼠摘眼球采血后静置30min,于4℃ 3 000r/min的条件下离心20min,取上层血清保存待用。用试剂盒测定血清中IL-8、IL-10、NO的水平,按照试剂盒说明书操作。
1.5 数据处理和统计方法
2 结果与分析
2.1 术后小鼠伤口愈合组织病理学观察结果
由图1可见,术后第7d,正常对照组伤口表面完整性较好,创面毛细血管密集,成纤维细胞较多。模型对照组伤口表面完整性较差,瘢痕组织较多,炎性细胞浸润明显,毛细血管形成较少。乳清蛋白组伤口创面毛细血管较少且有大量炎性细胞浸润。海参肽干预后可见毛细血管形成增多,瘢痕组织明显减少,成纤维细胞聚集,且炎性细胞明显低于模型对照组。
由图2可见,术后第14d,正常对照组伤口表面愈合较好,表面平整,瘢痕组织小,少见炎性细胞浸润,毛细血管密集,成纤维细胞较多。模型对照组伤口仍有大量瘢痕组织,伴随大量炎性细胞浸润,毛细血管和成纤维细胞均较少。乳清蛋白组瘢痕组织较多,毛细血管少。海参肽干预组瘢痕组织明显减少,皮肤表面完整性较好,毛细血管较多,炎性细胞浸润明显较少且伴有较多的成纤维细胞。

图1 术后第7d小鼠伤口愈合组织学观察情况(40×)A:正常对照组 B:模型对照组 C:乳清蛋白组 D:海参肽低剂量组 E:海参肽中剂量组 F:海参肽高剂量组

图2 术后第14d小鼠伤口愈合组织学观察情况(40×)A:正常对照组 B:模型对照组 C:乳清蛋白组 D:海参肽低剂量组 E:海参肽中剂量组 F:海参肽高剂量组
2.2 术后各组小鼠伤口张力强度
如表1所示,术后第7d,与正常对照组相比,模型对照组、乳清蛋白组、海参肽3个剂量组伤口张力强度均明显较低,差异有统计学意义;与模型对照组相比,乳清蛋白组伤口张力强度无显著升高,海参肽3个剂量组伤口张力强度均明显较高,其中海参肽中、高剂量组伤口张力强度增高更为显著;与乳清蛋白组相比,海参肽3个剂量组伤口张力强度均明显较高,其中海参肽中、高剂量组伤口张力强度增高更为显著。术后第14d,与正常对照组相比,模型对照组、乳清蛋白组、海参肽3个剂量组伤口张力强度均明显较低,差异有统计学意义;与模型对照组相比,乳清蛋白组伤口张力强度无显著升高,海参肽中、高剂量组伤口张力强度均明显较高,其中海参肽中剂量组伤口张力强度增高更为显著;与乳清蛋白组相比,海参肽中、高剂量组伤口张力强度均明显较高。
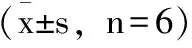
表1 术后第7、14d各组小鼠伤口张力强度
注:*与正常对照组相比P<0.05、**与正常对照组相比P<0.01;#与模型对照组相比P<0.05、##与模型对照组相比P<0.01;△与乳清蛋白组相比P<0.05;△△与乳清蛋白组相比P<0.01。
2.3 小鼠血清中白细胞介素8、10水平
由表2、表3发现,在同一时期里,各剂量组IL-8含量与模型对照组相比均有降低且差异具有统计学意义。同样在同一时期里,各个剂量组IL-10含量与模型对照组相比均有显著升高,差异具有统计学意义。
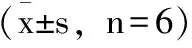
表2 术后第4、7、14d各组小鼠血清白细胞介素8水平

表3 术后第4、7、14d各组小鼠血清白细胞介素10水平
注:*与正常对照组相比P<0.05、**与正常对照组相比P<0.01;#与模型对照组相比P<0.05、##与模型对照组相比P<0.01;△与乳清蛋白组相比P<0.05、△△与乳清蛋白组相比P<0.01。
2.4 小鼠血清中一氧化氮(NO)检测结果
术后第14d,与正常对照组相比,模型对照组、乳清蛋白组、海参肽3个剂量组小鼠血清NO浓度均明显较低(P<0.01);与模型对照组相比,海参肽3个剂量组小鼠血清NO浓度均明显较高血清NO浓度均明显较高(P<0.05);与乳清蛋白组相比,海参肽低、中剂量组小鼠血清NO浓度均明显较高(P<0.01)(图3)。
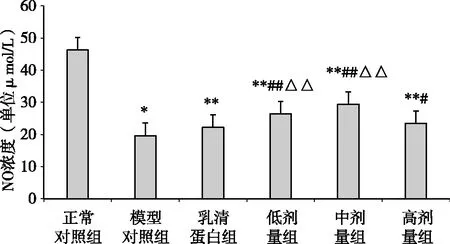
图3 术后第14d各组小鼠血清NO水平 注:*与正常对照组相比P<0.05、**与正常对照组相比P<0.01;#与模型对照组相比P<0.05、##与模型对照组相比P<0.01;△与乳清蛋白组相比P<0.05、△△与乳清蛋白组相比P<0.01。
3 讨论与结论
db/db小鼠是自发性糖尿病模型小鼠,属2型糖尿病模型。小鼠在1个月时开始贪食及发胖,继而发生严重的糖尿病症状[5]。相比于手动诱发糖尿病的小鼠,该模型鼠不存在人为诱导因素的干扰,糖尿病的产生与临床患者更为相似[6],因此实验结果更为可靠。由于db/db小鼠纯合子不育,需要用杂合子来交配繁殖,故引入m基因来保持小鼠的糖尿病表型[7]。纯合子的db/db小鼠保持糖尿病表型,而杂合子的db/m小鼠为非糖尿病。本实验采用db/m小鼠作为正常对照,以对比正常的非糖尿病小鼠与糖尿病小鼠之间的差异。对照组中另设一组乳清蛋白组,意为提供与中剂量组同浓度蛋白质,排除额外摄入营养物质带来的影响,说明干预效果是由海参胶原低聚肽产生。
伤口愈合包括凝血期、炎症期、增殖期与塑性期,这四个时期之间没有明显的界限[8]。在正常伤口愈合的过程中,炎症反应迅速发生并持续3d左右,然而在糖尿病患者的伤口愈合过程中,炎症反应的持续时间明显延长并影响伤口的正常愈合[9]。本实验对各组小鼠皮肤切口进行病理观察,与模型对照组相比,各剂量组明显可见炎性细胞浸润的减少,提示海参胶原低聚肽对于糖尿病小鼠伤口愈合过程中的炎症反应具有一定的抑制作用。有研究表明,炎性相关因子IL-8增加可能延长炎症期引起糖尿病伤口愈合障碍[10]。同时,对于抗炎因子IL-10,也有报道其调节成纤维细胞再生,促进组织修复[11]。本实验对小鼠IL-8和IL-10进行了检测,结果相对于模型对照组,显示各剂量组IL-8水平降低而IL-10水平升高。说明海参胶原低聚肽的干预,避免了慢性伤口愈合过程的炎症反应过度延长,从而对糖尿病伤口的愈合有着一定的促进作用。创伤修复过程中毛细血管的再生能够为创伤部位组织提供必需的营养物质,促进肉芽组织的形成。本研究通过对db/db 2型糖尿病小鼠伤口皮肤组织进行HE染色发现,3个海参肽剂量组的小鼠伤口处微血管的形成相对于模型对照组显著增加。
伤口重塑以及瘢痕的形成主要受胶原的影响[12-13]。本实验病理检测显示,3个剂量组小鼠伤口处成纤维细胞明显多于模型对照组。通过伤口抗张强度测试也发现中剂量和高剂量组小鼠伤口抗张力强度显著高于模型对照组,说明海参肽中、高剂量组小鼠伤口愈合程度显著优于模型对照组。除了分泌胶原酶以外,成纤维细胞还会分泌血管内皮生长因子(VEGF)[14-15]。VEGF可以影响血管的新生和血管通透性的增加,刺激内皮细胞迁移通过细胞外基质,从而改善伤口愈合过程中的血管形成[16]。有研究发现,对db/db小鼠进行VEGF的局部治疗可以通过促进局部血管生成改善伤口处的新生血管生成情况[17]。由此可以推测VEGF或者刺激其产生的药物可用于促进慢性伤口愈合的组织修复。目前已经证明NO可以增加VEGF的表达从而刺激新生血管的形成[18],并且NO是促进VEGF表达的最为有效的因子[19]。本实验各个剂量组NO水平均显著高于模型对照组,因此,可以推测海参胶原低聚肽可能促进糖尿病小鼠NO水平升高,从而促进新生血管的形成,进而改善慢性伤口的愈合。
本研究通过建立db/db 2型糖尿病小鼠术后伤口模型,设立蒸馏水以及乳清蛋白干预作为对照组,探讨海参胶原低聚肽对于糖尿病小鼠术后伤口愈合的促进作用,结果提示,海参胶原低聚肽能够促进糖尿病小鼠手术后伤口的NO生成和新生血管形成,减少炎症反应并且增强伤口抗张力强度,说明海参胶原低聚肽能够促进糖尿病人伤口愈合。◇
[1]SALAZAR J J,ENNIS W J,KOH T J.Diabetes medications:Impact on inflammation and wound healing[J].Diabetes Complications,2016,30(4):746-752
[2]Greenhalgh DG.Wound healing and diabetes mellitus[J].Clin.Plast.Surg,2003,30(1):37-45.
[3]赵芹.海参胶原蛋白多肽抗氧化活性的研究[D]. 中国海洋大学,2008.
[4]梁锐,张召锋,赵明,等.海洋胶原肽对剖宫产大鼠伤口愈合促进作用[J].中国公共卫生,2010,26(9):1144-1145.
[5]吴静,王华旻,李晶,等.db/db小鼠的实验室应用[J].生理科学进展,2013,44(1):12-18.
[6]刘芳,杨华,周文江,等.诱发性2型糖尿病小鼠模型与自发性db/db 小鼠特性的比较[J].中国实验动物学报,2014,10(6):54-59.
[7]唐慧青,陈立新,梁磊,等.型糖尿病模型-小鼠的生物学特性研究[J].实验动物与比较医学,2011,31(1):62-65.
[8]铁璐等.糖尿病伤口愈合的分子机制[J].生理科学进展,2010,41(6):407-412.
[9]Zhang,Z,et al..Oral administration of skin gelatin isolated from Chum salmon (Oncorhynchus keta)enhances wound healing in diabetic rats.[J].Marine Drugs,2011,9(5):696-711.
[10]SINGH K,et al.Increased expression of TLR9 associated with pro-inflammatory S100A8 and IL-8 in diabetic wounds could lead to unresolved inflammation in type 2 diabetes mellitus (T2DM)cases with impaired wound healing[J].Journal of Diabetes and its Complications,2016,30(1):99-108.
[11]BALAJI S,WANG X,KING A,et al.Interleukin-10-mediated regenerative postnatal tissue repair is dependent on regulation of hyaluronan metabolismvia fibroblast-specific STAT3 signaling[J].The FASEB Journal,2017,31(3):868-881.
[12]王益民,韦福康,刘敏.成纤维细胞与创伤修复的研究进展[J].中国修复重建外科杂志,2000,14(2):126-128.
[13]LI J,CHEN J,KIRSNER R.Pathophysiology of acute wound healing[J].Clinics in Dermatology,2007,25(1):9-18.
[14]BITTO A,et al.Simvastatin enhances VEGF production and ameliorates impaired wound healing in experimental diabetes[J].Pharmacol Res,2008,57(2):159-169.
[15]CHA J,KWAK T,BUTMARC J,et al.Fibroblasts from non-healing human chronic wounds show decreased expression of beta ig-h3,a TGF-beta inducible protein[J].J Dermatol Sci,2008,50(1):15-23.
[16]Santos S C,et al.VEGF and VEGFR-2 (KDR)internalization is required for endothelial recovery during wound healing[J].Exp Cell Res,2007,313(8):1561-1574.
[17]RD Galiano,OM Tepper,CR Pelo,et al..Topical vascular endothelial growth factor accelerates diabetic wound healing through increased angiogenesis and by mobilizing and recruiting bone marrow-derived cells[J].American Journal of Pathology,2004,164(6):1935-1947.
[18]B Romanasouza,AP Nascimento,A Montealtocosta.Propranolol improves cutaneous wound healing in streptozotocin-induced diabetic rats[J].European Journal of Pharmacology,2009,611(1):77-84.
[19]MB Witte,T Kiyama,A Barbul.Nitric oxide enhances experimental wound healing in diabetes[J].British Journal of Surgery,2002,89(12):1594-1601.
(责任编辑 李婷婷)
Effect of Sea Cucumber Collagen Oligopeptide in Diabetic Wound Healing
LI Lin,LI Di,XU Teng,LIU Rui,REN Jin-wei,CHEN Qi-he,LI Yong
(School of Public Health,Peking University,Beijing 100191,China)

sea cucumber oligopeptide;diabetes mellitus;wound healing
国家自然科学基金(项目编号:81573138)。
李林(1991— ),男,硕士,研究方向:肽营养学。
李勇(1957— ),男,教授,研究方向:肽营养学。
