奈达铂联合多西他赛治疗晚期宫颈癌的临床观察
2017-08-22齐彦宇蒋莎莎成都市第三人民医院肿瘤科成都610031
张 军,齐彦宇,蒋莎莎,樊 佳(成都市第三人民医院肿瘤科,成都 610031)
奈达铂联合多西他赛治疗晚期宫颈癌的临床观察
张 军*,齐彦宇,蒋莎莎,樊 佳(成都市第三人民医院肿瘤科,成都 610031)
目的:探讨奈达铂联合多西他赛对晚期宫颈癌患者的临床疗效及安全性。方法:回顾性选取2014年4月-2016年4月于我院就诊的晚期宫颈癌患者53例,根据化疗方案分为观察组(31例)和对照组(22例)。对照组患者给予多西他赛注射液60 mg/m2,ivgtt,qw;观察组患者在对照组基础上给予注射用奈达铂35 mg/m2+0.9%氯化钠注射液稀释至500 mL,ivgtt( 60 min),qw。两组患者均以21 d为1个化疗周期,行2个周期化疗。两组患者治疗结束2周后评价临床疗效,检测治疗前及治疗结束2周后增殖细胞核抗原(PCNA)积分,并记录不良反应发生情况。结果:观察组患者的总有效率(77.42%)明显高于对照组(63.64%),差异有统计学意义(P<0.05)。治疗前,两组患者PCNA积分比较,差异无统计学意义(P>0.05);治疗后,两组患者PCNA积分均明显降低,且观察组明显低于对照组,差异有统计学意义(P<0.05)。两组患者各项不良反应均集中在I度,且不良反应发生率比较,差异均无统计学意义(P>0.05)。结论:奈达铂联合多西他赛可明显提高晚期宫颈癌患者的临床疗效,与多西他赛单独使用相比,并不会增加不良反应的发生。
多西他赛;奈达铂;晚期宫颈癌;增殖细胞核抗原;疗效;安全性
宫颈癌是发生在宫颈阴道部及移行带的鳞状上皮细胞和宫颈管内膜的柱状上皮细胞交界处的恶性肿瘤,发病原因为人乳头瘤病毒(HPV)感染,好发于25~55岁女性[1]。宫颈癌已成为全球女性中仅次于乳腺癌的第二大癌症,其病死率居首位[2]。仅2012年全球就有近52.8万新发宫颈癌患者,其中26.6万患者死亡,且80%的宫颈癌患者为发展中国家居民[3]。据世界卫生组织统计,全球每1.13 min即新发1例宫颈癌,每2.6 min有1例宫颈癌患者死亡;我国每3.75 min新发1例[4]。晚期宫颈癌患者临床治疗常采取放疗。多西他赛为紫杉烷类药物,可通过促进微管双聚体装配成微管干扰去多聚化过程,阻滞细胞于G2和M期,抑制癌细胞的有丝分裂和增殖[5]。奈达铂为新型第二代铂类抗肿瘤药物,与多西他赛联用于多种癌症的治疗中临床疗效较好[6]。鉴于此,本研究探讨了奈达铂联合多西他赛治疗晚期宫颈癌患者的临床效果及安全性,现报道如下。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)符合《宫颈癌及癌前病变规范化诊疗指南(试行)》中诊断标准[7]者;(2)经病理多点活检证实为宫颈癌;(3)按照宫颈癌国际妇产科联盟(FIGO)分期为Ⅱb期或以上。
排除标准:(1)存在放疗或化疗史者;(2)合并高血压、脑血管疾病、肝肾功能障碍、凝血功能障碍或精神疾病者;(3)妊娠或哺乳期妇女。
1.2 研究对象
本研究为回顾性研究。选取2014年4月-2016年4月于我院就诊的晚期宫颈癌患者53例作为研究对象,根据化疗方案分为观察组(31例)和对照组(22例)。其中,观察组患者平均年龄(49.3±4.2)岁;平均病程(6.3± 2.2)年;肿瘤直径(4.02±0.37)cm;FIGO分期Ⅲa期14例,Ⅲb期17例。对照组患者平均年龄(49.3±4.2)岁;平均病程(6.3±2.2)年;平均肿瘤直径(4.13±0.58)cm;FIGO分期Ⅲa期10例,Ⅲb期12例。两组患者的年龄、病程、肿瘤直径和FIGO分期等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究方案经医院医学伦理委员会审核通过,患者或其家属均知情同意并签署知情同意书。
1.3 治疗方法
两组患者化疗前均给予麻黄碱苯海拉明片25 mg,po,注射用地塞米松磷酸钠10 mg+西咪替丁氯化钠注射液400 mg+盐酸昂丹司琼氯化钠注射液8 mg,ivgtt。对照组患者给予多西他赛注射液(江苏恒瑞医药股份有限公司,批准文号:国药准字H20080366,规格:1.5 mL∶60 mg)60 mg/m2,ivgtt,qw,每21 d为1个化疗周期。观察组患者在对照组基础上给予注射用奈达铂(齐鲁制药有限公司,批准文号:国药准字H20050563,规格:10 mg)35 mg/m2+0.9%氯化钠注射液稀释至500 mL,ivgtt(60 min),qw,每21 d为1个化疗周期。两组患者均行2个周期化疗,期间严密监测各项指标,若白细胞计数
3×109L-1、血小板计数 80×109L-1时予以集落刺激因子治疗;中性粒细胞 1×109L-1、血小板计数 50×109L-1、肌酐清除率 40 mL/min或转氨酶升高至正常上限值2倍及以上则停止化疗。
1.4 观察指标及疗效评价标准
(1)观察两组患者治疗结束2周后的临床疗效。依据《实体瘤治疗疗效评价标准(RECIST)》[8]进行疗效判定——完全缓解(CR):可见病灶完全消失,X光片或骨显像显示肿瘤完全消失;部分缓解(PR):肿瘤缩小50%及以上;疾病稳定(SD):肿瘤缩小<50%或增大不超过25%,X光片或骨显像无明显变化;疾病进展(PD):肿瘤增大超过25%或出现新病灶,X光片或骨显像提示有肿瘤增加或出现新转移灶。总有效=CR+PR。(2)检测两组患者治疗前及治疗结束2周后增殖细胞核抗原(PCNA)积分。采用免疫组化(SP)法检测病灶组织,每例切片随机观察10个高倍视野,以1 000个癌细胞中PCNA阳性细胞的占比进行评分, 25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分;着色强度呈浅棕褐色计1分,深棕褐色计2分;上述两分相加即为PCNA积分。(3)根据《抗癌药物急性及亚急性毒性反应分度标准》[9]记录两组患者不良反应发生情况。
1.5 统计学方法
采用SPSS 17.0软件对数据进行统计分析。计量资料以±s表示,采用t检验;计数资料和等级资料以例数或率表示,前者采用χ2检验,后者采用秩和检验。P< 0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
观察组患者的总有效率(77.42%)明显高于对照组(63.64%),差异有统计学意义(P<0.05),详见表1。

表1 两组患者临床疗效比较[例(%%)]Tab 1 Comparison of clinical efficacies between 2 groups[case(%%)]
2.2 两组患者治疗前后PCNA积分比较
治疗前,两组患者PCNA积分比较,差异无统计学意义(P>0.05)。治疗后,两组患者PCNA积分均明显降低,且观察组明显低于对照组,差异有统计学意义(P<0.05),详见表2。
表2 两组患者治疗前后PCNA积分比较(±s)Tab 2 Comparison of PCNA integral between 2 groups before and after treatment(±s)

表2 两组患者治疗前后PCNA积分比较(±s)Tab 2 Comparison of PCNA integral between 2 groups before and after treatment(±s)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05Note:vs.before treatment,*P<0.05;vs.control group,#P<0.05
3.17±0.24*#4.21±0.28*观察组对照组31 22 5.22±0.31 5.16±0.28
2.3 不良反应
两组患者的各项不良反应均集中在Ⅰ度,均无患者出现严重的Ⅳ度不良反应,且两组患者各项不良反应发生率比较,差异均无统计学意义(P>0.05),详见表3。
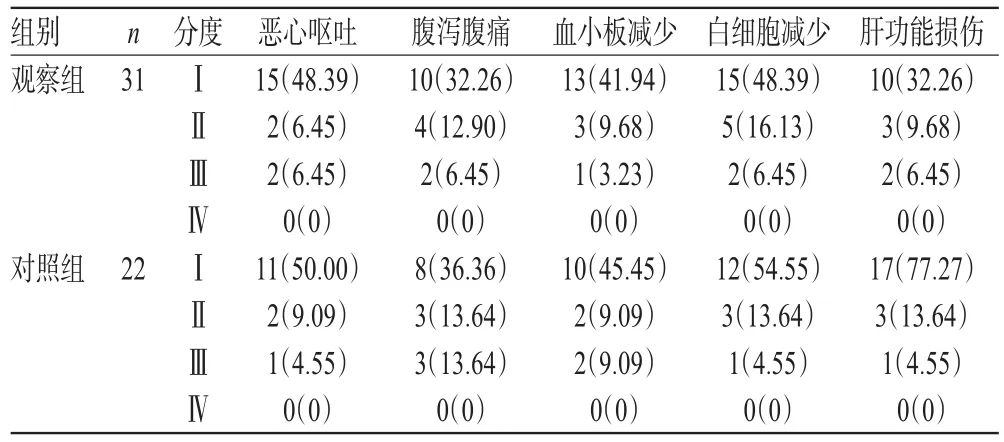
表3 两组患者不良反应发生情况比较[例(%%)]Tab 3 Comparison of occurrence of ADR between 2 groups[case(%%)]
3 讨论
宫颈癌是常见的妇科恶性肿瘤,其首要病因为HPV感染,过早性生活、多个性伴侣、多次妊娠、吸烟、社会经济地位低下和营养不良等原因均是其高危因素,其发病年龄逐渐出现年轻化的趋势[10]。宫颈癌可通过直接蔓延侵袭临近器官组织,并发生淋巴转移和血行转移,病死率极高[11-12]。宫颈癌的临床治疗原则为Ⅱb以上的中晚期宫颈癌患者可给予化疗或配合放疗,使局部肿块缩小达到能进行手术或缩小手术范围,并消除可能存在的微小转移灶,减少血行转移。临床常用的治疗药物有顺铂、卡铂和紫杉醇等[13-16]。多西他赛是紫杉醇衍生物,以半合成方式生产,对肿瘤的作用机制与紫杉醇相似。多西他赛的取代基团空间位阻小,极性基团亲水性强,与微管蛋白的亲和力为紫杉醇的2倍,体外细胞毒性是紫杉醇的1.3~10.0倍,且对紫杉醇耐药的细胞株并不会自发产生对多西他赛的交叉耐药[17]。因此,多西他赛与紫杉醇相比,具有结构合理、高效、低毒、与紫杉醇无交叉耐药和广泛的临床适应证等优点,临床多用于宫颈癌的治疗[18]。顺铂具有较好的临床疗效,但其肾毒性和胃肠道毒性限制了临床应用。奈达铂为第二代顺铂类似物,具有较低的肾毒性和胃肠道毒性,有2个氨合配位体,与核苷形成核苷铂络合物,类似于顺铂。奈达铂摄取至细胞后,其乙醇酸部分被水解切断,可抑制DNA复制[19-20]。本研究结果显示,给予奈达铂联合多西他赛的观察组患者的总有效率较单用多西他赛的对照组显示出明显的优势。
PCNA在系统性红斑狼疮患者的血清中首次被发现,因其只存在于正常增殖细胞和肿瘤细胞内而得名,与细胞DNA合成关系密切,在细胞增殖的启动上起重要作用,是反映细胞增殖状态的有效指标[14]。肿瘤细胞具有旺盛的增殖活性,因此PCNA可作为肿瘤独立的预后指标[14]。本研究结果显示,两组患者PCNA积分均明显降低,且观察组明显低于对照组,可见奈达铂联合多西他赛较单纯使用多西他赛可更好地控制肿瘤细胞的增殖。同时,两组患者治疗过程中恶心呕吐、腹泻腹痛、血小板减少、白细胞减少和肝功能损伤等不良反应的发生率比较,差异均无统计学意义(P>0.05),可见增加奈达铂的治疗方案并未增加患者发生不良反应的风险,具有较好的安全性。
综上所述,奈达铂联合多西他赛可明显提高晚期宫颈癌患者的临床疗效,且安全性较高。但本研究样本量较小、观察时间较短,尚需大样本、多中心研究来进一步证实该结论。
[1] 胡尚英,郑荣寿,赵方辉,等.1989-2008年中国女性子宫颈癌发病和死亡趋势分析[J].中国医学科学院学报,2014,36(2):119-125.
[2] Luciani S.Cervical and female breast cancers in the Americas:current situation and opportunities for action[J].Bull World Health Organ,2013,91(9):640-649.
[3] Kato S,Ohno T,Thephamongkhol K,et al.Long-term follow-up results of a multi-institutional phase 2 study of concurrent chemoradiation therapy for locally advanced cervical cancer in east and southeast Asia[J].Int J Radiat Oncol Biol Phys,2013,87(1):100-105.
[4] Al Asiri M,Tunio M,Al Hadab A,et al.Five-year outcome of concurrent radiotherapy and chemotherapy in Saudi women with locally advanced cervical cancer:single-institution experience[J].Ann Saudi Med,2013,33(4):327-333.
[5] 陆建华.优化护理对宫颈癌术后常见并发症及生活质量的影响[J].贵州医药,2016,40(9):1005-1006.
[6] Au-Yeung G,Mileshkin L,Bernshaw DM,et al.Radiation with cisplatin or carboplatin for locally advanced cervix cancer:the experience of a tertiary cancer centre[J].J Med Imaging Radiat Oncol,2013,57(1):97-104.
[7] 国家卫生和计划生育委员会.宫颈癌及癌前病变规范化诊疗指南:试行[J].慢性病学杂志,2013,14(6):401-410.
[8] 杨学宁,吴一龙.实体瘤治疗疗效评价标准:RECIST[J].循证医学,2004,4(2):85-90.
[9] 世界卫生组织.抗癌药物急性及亚急性毒性反应分度标准[J].癌症,1992,11(3):32.
[10] Nam EJ,Lee M,Yim GM,et al.Comparison of carboplatin-and cisplatin-based concurrent chemoradiotherapy in locally advanced cervical cancer patients with morbidity risks[J].Oncologist,2013,18(7):843-849.
[11] Qiu B,Ji M,Song X,et al.Co-delivery of docetaxel and endostatin by a biodegradable nanoparticle for the synergistic treatment of cervical cancer[J].Nanoscale Res Lett,2012,7(1):38-41.
[12] 李亚林,廖鸿纯.宫颈癌组织中细胞周期相关激酶的表达功能与化疗药物敏感性的关系[J].贵州医药,2016,40(8):801-803.
[13] 冷玲,高晨光,陈虹,等.鬼臼毒素衍生物QW-83对人宫颈癌HeLa细胞凋亡的影响及其机制研究[J].中国药房,2016,27(7):892-895.
[14] Kelly RJ,Draper D,Chen CC,et al.A pharmacodynamic study of docetaxel in combination with the P-glycoprotein antagonist tariquidar(XR9576)in patients with lung,ovarian,and cervical cancer[J].Clin Cancer Res,2011,17(3):569-580.
[15] 郝颂华,宋颖,杨玲竹.局部晚期宫颈癌53例新辅助化疗的疗效观察[J].肿瘤基础与临床,2012,25(6):501-503.
[16] Huang X,Lan C,Huang H,et al.Neoadjuvant docetaxel combined with cisplatin and followed by radical surgery for the treatment of locally advanced(stageⅠb2-Ⅱb)cervical cancer:preliminary results of a single-institution experience[J].Expert Opin Pharmacother,2011,12(2):165-173.
[17] 高岭,李宁,高鑫,等.奈达铂联合放疗治疗局部晚期宫颈癌临床观察[J].肿瘤基础与临床,2015,28(1):21-22.
[18] Kato S,Ohno T,Thephamongkhol K,et al.Longterm follow-up results of a multi-institutional phase 2 study of concurrent chemoradiation therapy for locally advanced cervical cancer in east and southeast Asia[J].Int J Radiat Oncol Biol Phys,2013,87(1):100-105.
[19] Forrest J,Presutti J,Davidson M,et al.A dosimetric planning study comparing intensity-modulated radiotherapy with four-field conformal pelvic radiotherapy for the definitive treatment of cervical carcinoma[J].Clin Oncol:R Coll Radiol,2012,24(4):63-70.
[20] Yin M,Zhang H,Li H,et al.The toxicity and long-term efficacy of nedaplatin and paclitaxel treatment as neoadjuvant chemotherapy for locally advanced cervical cancer [J].J Surg Oncol,2012,105(2):206-211.
(编辑:陶婷婷)
Clinical Observation of Nedaplatin Combined with Docetaxel in the Treatment of Advanced Cervical Cancer
ZHANG Jun,QI Yanyu,JIANG Shasha,FAN Jia(Dept.of Oncology,Chengdu Third People’s Hospital,Chengdu 610031,China)
OBJECTIVE:To explore the clinical efficacy and safety of nedaplatin combined with docetaxel in the treatment of advanced cervical cancer.METHODS:A total of 53 patients with advanced cervical cancer selected from our hospital during Apr. 2014-Apr.2016 were divided into observation group(31 cases)and control group(22 cases)according to chemotherapy plan.Control group was given Docetaxel injection 60 mg/m2,ivgtt,qw.Observation group was additionally given Nedaplatin for injection 35 mg/m2+0.9%Sodium chloride injection diluted into 500 mL,ivgtt( 60 min),qw.A chemotherapy cycle lased for 21 d,and both groups
2 cycles of chemotherapy.Clinical efficacies of 2 groups were evaluated 2 weeks after treatment,and the level of PCNA integal was detected before and 2 weeks after treatment.The occurrence of ADR was recorded.RESULTS:The total response rate of observation group(77.42%)was significantly higher than that of control group(63.64%),with statistical significance(P<0.05).Before treatment,there was no statistical significance in PCNA integval between 2 groups(P>0.05).After treatment,PCNA integval of 2 groups were decreased significantly,and the observation group was significantly lower than the control group,with statistical significance(P<0.05).ADR were concentrated in grade I,and there was no statistical significance in the incidence of ADR between 2 groups(P>0.05).CONCLUSIONS:Docetaxel combined with nedaplatin can significantly improve the clinical efficacy of patients with advanced cervical cancer,and does not increase the adverse reactions compared to docetaxel alone.
Docetaxel;Nedaplatin;Advanced cervical cancer;PCNA;Therapeutic efficacy;Safety
R737
A
1001-0408(2017)20-2820-04
2016-11-02
2017-01-20)
*副主任医师,硕士。研究方向:肿瘤内科。电话:028-61318724。E-mail:zhangxiaoguop@163.com
DOI10.6039/j.issn.1001-0408.2017.20.24
