超声造影联合血清学指标评估失代偿期肝硬化患者门静脉高压的临床价值
2017-08-21陈世耀
张 庆 李 玲 丁 红 陈世耀△
(1徐汇区中心医院消化科 上海 200031; 2 复旦大学附属中山医院消化科, 3 超声诊断科 上海 200032)
超声造影联合血清学指标评估失代偿期肝硬化患者门静脉高压的临床价值
张 庆1李 玲2丁 红3陈世耀2△
(1徐汇区中心医院消化科 上海 200031;2复旦大学附属中山医院消化科,3超声诊断科 上海 200032)
目的 探讨超声造影联合常规血清学标志物评估失代偿期肝硬化患者门静脉高压的可行性。方法根据肝静脉压力梯度(hepatic venous pressure gradient,HVPG)将54例失代偿期肝硬化门静脉高压患者分为HVPG<12 mmHg (1 mmHg=0.133 kPa)和HVPG≥12 mmHg两组。对血常规、肝功能、出凝血功能、Child-pugh评分(Child-pugh score,CPS)及肝脏超声造影定量参数,包括肝动脉到达时间(hepatic artery arrival time,HAAT)、肝静脉到达时间(hepatic vein arrival time,HVAT)、门静脉到达时间(portal vein arrival time,PVAT)、肝动脉-肝静脉渡越时间(hepatic artery to hepatic vein arrive transmit time,HA-HVTT)、门静脉-肝静脉渡越时间(portal vein to hepatic vein arrive transmit time,PV-HVTT),进行单因素分析和Logistic回归分析,筛选出可以诊断门静脉高压的无创指标,并在此基础上构建诊断模型。通过ROC曲线评价模型的诊断价值并确定界值。结果 建立诊断模型Y=-0.217×PV-HVTT+1.526×CPS-7.097。当模型的预测概率值≥0.631时,其判断HVPG≥12 mmHg的敏感性为87.5%,特异性为78.6%,ROC曲线下面积为0.857。结论 由PV-HVTT和CPS建立的无创诊断模型对评估门静脉高压有一定的临床价值。
肝硬化; 门静脉高压; 肝静脉压力梯度; 超声造影; 无创性
门静脉高压是失代偿期肝硬化的主要表现之一,可导致腹水、脾亢、食管胃静脉曲张等一系列并发症。准确评估肝硬化患者的门静脉压力可判断疾病转归,预测食管静脉曲张破裂出血的风险,评估降门静脉高压药物的疗效,从而指导临床医师为患者选择更恰当的治疗方案[1-2]。目前肝静脉压力梯度(hepatic vein pressure gradient,HVPG)为评估门静脉压力的“金标准”[3],然而这一方法为有创检查,技术要求高,价格昂贵,尚未能在临床广泛展开。因此,寻找一种无创性检查方法成为当下研究的热点。本研究回顾性分析54例失代偿期肝硬化患者的资料,尝试利用无创指标建立一个诊断门静脉高压的模型,以探索无创诊断新方法。
资 料 和 方 法
研究对象 选择2013年2月至2015年6月复旦大学附属中山医院消化科收住的54例肝硬化食管胃静脉曲张拟行内镜治疗的患者,其中男性35例,女性19例,年龄25~78岁,平均年龄(55.28±11.59)岁,乙肝肝硬化29例,丙肝肝硬化1例,酒精性肝硬化8例,原发性胆汁性肝硬化7例,自身免疫性肝炎肝硬化2例,其他类型肝硬化共7例。排除标准:(1)肝性脑病、肝肾综合征、肝恶性肿瘤、门脉血栓或严重心肺功能不全的患者;(2)既往行脾切、脾动脉栓塞、断流术、分流术、TIPS及2个月内行内镜治疗的患者;(3)长期规律口服非选择性β受体阻滞治疗的患者;(4)活动性消化道出血的患者。
一般资料收集 记录患者年龄、性别、病因、有无腹水、血常规、肝功能和出凝血功能。
超声造影检查
仪器与对比剂 超声诊断仪(Acuson Sequoia 512,德国西门子公司),4V1-S探头,造影时探头频率1.5~2.5 MHz。第二代超声对比剂声诺维(SonoVue,意大利Bracco公司),即注射用六氟化硫微泡。
超声造影方法 患者检查前均禁食至少6 h,在超声造影过程中尽量屏气或平静匀速呼吸。超声选择同时能显示肝动脉、门静脉和肝右静脉的切面作为感兴趣区(region of interest,ROI)。启动造影程序,造影时保持增益、焦点、深度补偿等预设置始终一致,机械指数固定为0.19~0.21。对比剂使用前充分振摇,造影时每次用20 G套管针抽取0.6 mL微泡混悬液经肘静脉快速注入,再推注5 mL生理盐水。启动系统计时器开始计时,实时超声造影图像显示对比剂最先通过肝动脉,然后经门静脉,最后通过肝静脉。采集至少1 min的动态造影数据。
超声造影参数分析 通过拟合时间-强度曲线(time-intensity curve,TIC)来获取超声造影的定量参数:显影时间 (arrival time,AT)和达峰时间(time to peak,TTP); 根据不同血管内对比剂到达时间差计算肝内渡越时间。AT:从注射对比剂开始到ROI内对比剂强度增加10%的时间。记录肝动脉到达时间(hepatic artery arrival time,HAAT)、肝静脉到达时间(hepatic vein arrival time,HVAT)、门静脉到达时间(portal vein arrival time,PVAT)肝动脉-肝静脉渡越时间(hepatic artery to hepatic vein arrive transmit time,HA-HVTT)及门静脉-肝静脉渡越时间(portal vein to hepatic vein arrive transmit time,PV-HVTT)。
肝静脉压力梯度测定 患者于术前完成实验室及超声造影检查,向其及家属解释此项检查的必要性,告知注意事项及可能发生的风险并签署知情同意书。HVPG的测定由我院介入科2位医师共同完成,患者测压前禁食4~6 h。测压时取右侧颈静脉为穿刺点,以微穿刺系统穿脉插管引入Fogaty球囊接压传感器,导管进入肝静脉测量肝静脉游离压(free hepatic vein pressure,FHVP),扩张Fogaty随机选择一支肝静脉球囊阻塞肝静脉近端测量肝静脉楔压(wedged hepatic vein pressure,WHVP),两者相减即为HVPG,单位为mmHg (1 mmHg=0.133 kPa,下同)。再注射泛影葡胺对比剂,观察是否存在肝静脉侧枝循环、肝动脉-门静脉瘘、门体分流等情况。再次复测HVPG,记录数据,拔管加压包扎。
统计学分析 采用SPSS 21.0进行统计学分析。定性资料以构成比表示,定量资料以均数±标准差或中位数及四分位间距表示。定量资料两组样本的比较采用独立样本t检验或Mann-WhitneyU检验,构成比的比较采用χ2检验,P<0.05为差异有统计学意义。通过计算各参数ROC曲线分析评价其诊断效能。
结 果
一般情况 根据HVPG测定结果将54例患者分为2组:HVPG<12 mmHg组(14例)和HVPG≥12 mmHg组(40例)。两组患者各指标比较见表1、表2。

表1 两组研究对象基线资料的比较
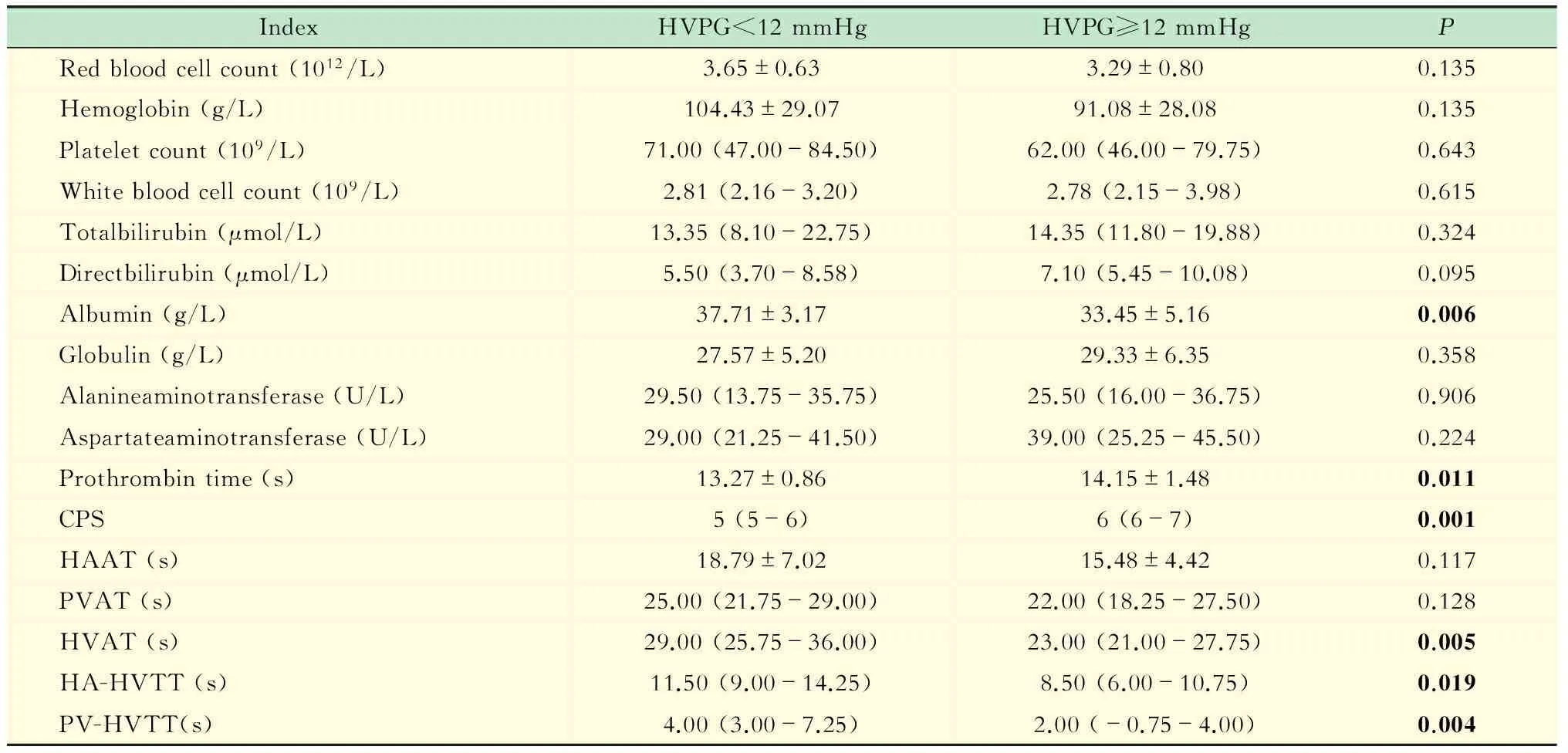
表2 两组研究对象血清学及超声造影指标的比较
CPS:Child-pugh score;HAAT:Hepatic artery arrival time;HVAT:Hepatic vein arrival time;PVAT:Portal vein arrival time;HA-HVTT:Hepatic artery to hepatic vein arrive transmit time;PV-HVTT:Portal vein to hepatic vein arrive transmit time.
模型构建 对上述组间差异有统计学意义的凝血酶原时间(prothrombin time,PT)、APTT、Alb、CPS、HVAT、HA-HVTT和PV-HVTT做多因素二元Logistic回归分析,有统计学意义的指标为PV-HVTT和CPS,回归系数分别为-0.217 (P=0.041)和1.526 (P=0.008),据此可建立诊断模型的回归方程Y=-0.217×PV-HVTT+1.526×CPS-7.097。
评估各血清学指标、超声造影参数及模型的诊断效能 对上述差异有统计学意义的各项指标及诊断模型进行ROC分析,当模型的切点≥0.631时,其判断HVPG≥12 mmHg的敏感性为87.5%,特异性为78.6%,ROC曲线下面积(area under ROC,AUROC)为0.857。该模型的诊断效能优于其他指标(图1,表3)。
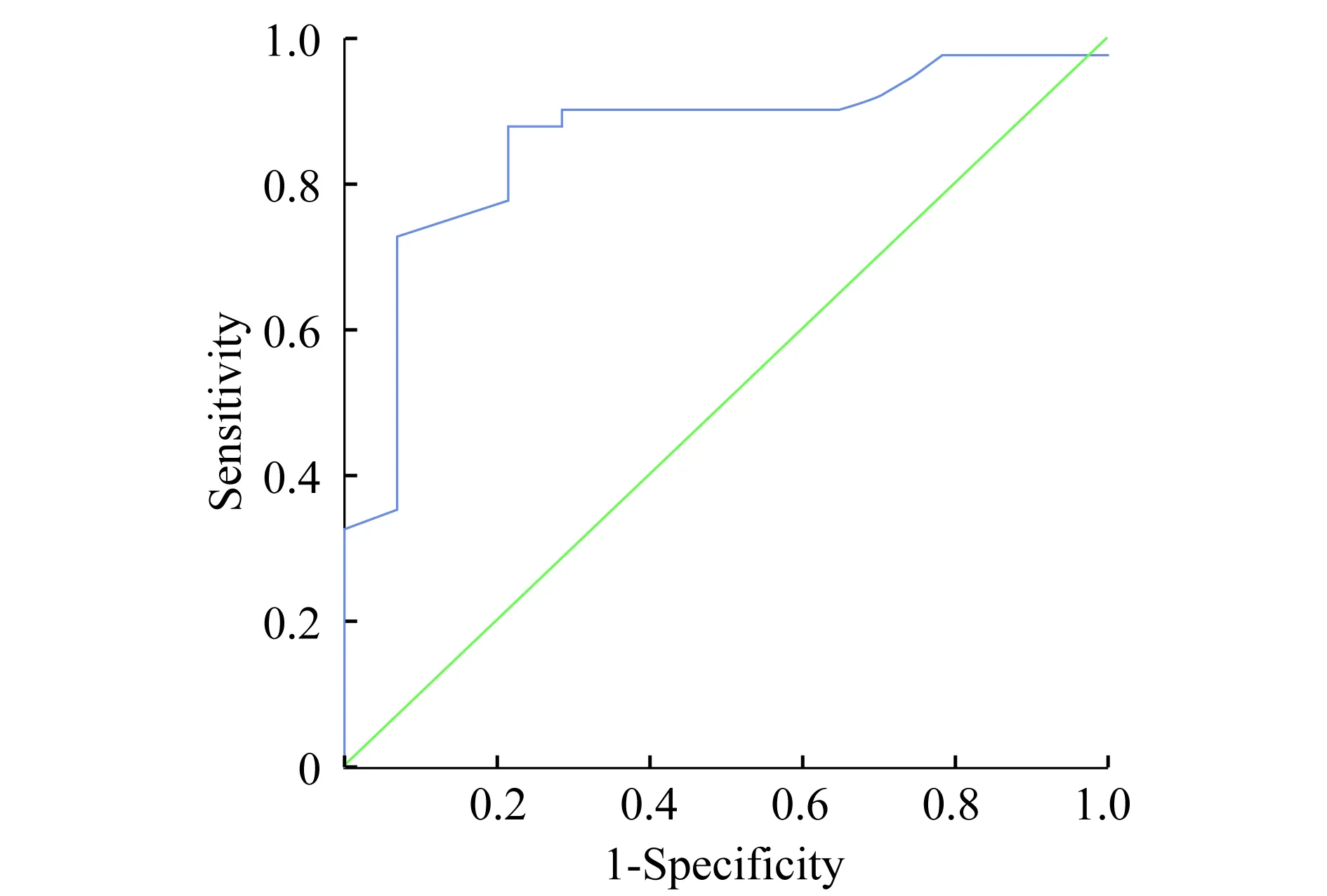
图1 HVPG≥12 mmHg模型的ROC曲线图
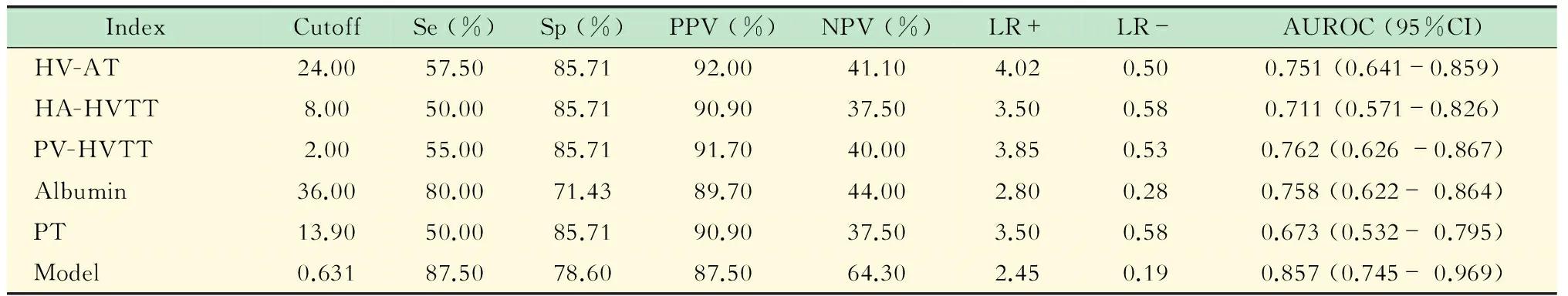
表3 比较两组间各指标的诊断价值
Se:Sensitivity;Sp:Specifivity;PPV:Positive predictive value;NPV:Negative predictive value;LR+:Positive likelihood ratio;LR-:Negative likelihood ratio.
讨 论
肝硬化门静脉高压导致的食管胃静脉曲张破裂出血是临床常见的危重症,准确的评估门静脉高压可以预测食管胃静脉曲张破裂出血的风险,指导治疗方案的选择,故2015年我国《肝硬化门静脉高压食管胃静脉曲张出血防治指南》和《Baveno Ⅵ共识:门静脉高压的危险分层及个体化治疗》中特别强调HVPG测定的重要性,认为其是进行门静脉高压分层和风险评估最可靠的指标[4-5]。尽管HVPG的测定对指导临床工作有重要作用,但目前球囊导管法测压为侵入性检查,价格昂贵、操作复杂且随访困难,从而限制了其在临床的广泛应用。因此,寻找一种安全、便捷、经济、准确的无创性诊断门静脉高压的方法值得积极探索。本研究探讨了常规实验室指标和超声造影技术无创评估失代偿期肝硬化患者门静脉高压的临床价值。
肝硬化失代偿期,患者肝脏储备功能下降,既往已有研究表明白蛋白和INR可以用于评估门静脉高压[6]。本研究显示当白蛋白≤36 g/L时,判断HVPG≥12 mmHg的AUROC为0.758,当PT≥13.9 s时,判断HVPG≥12 mmHg的AUROC为0.673,再次验证了白蛋白和PT (INR)在诊断门静脉高压方面的作用。
超声造影技术是一项在常规超声基础上加用对比剂的新技术,利用对比剂微泡信号强度与其血液中浓度成线性相关的原理,通过拟合TIC曲线获得相应定量参数可以较普通超声检查更好地反映组织灌注情况。目前使用的超声对比剂声诺维为六氟化硫微泡,平均直径2.5 μm,稳定性好,在肝脏内不会被Kupffer细胞吞噬,在血管内的行为和红细胞相似,不会穿透血管壁渗出到组织间隙,是一种理想的血池型示踪剂[7]。
肝硬化时肝脏弥漫纤维化,再生结节及假小叶形成。这些病理变化推动着门静脉高压的发生,从而使肝动脉、门静脉和肝静脉失去了正常联系,使得肝动脉、门静脉和肝静脉彼此间出现短路分流[8],如肝动脉-肝静脉分流,门静脉-肝静脉分流等。通过这些短路分流,肝动脉及门静脉的血液绕过肝血窦直接进入肝静脉系统,导致肝内循环时间缩短。肝硬化时肝内血流动力学变化是超声造影技术评估门静脉高压的研究基础。
本研究发现HVAT、HA-HVTT和PV-HVTT随着HVPG的升高而缩短。当HA-HV TT<8 s时,判断HVPG≥12 mmHg的AUROC为0.711,当PV-HVTT<2 s时,判断HVPG≥12 mmHg的AUROC为0.762,这和国内的一些研究结果相近[9-11];当HVAT<24 s时,判断HVPG≥12 mmHg的AUROC为0.751,Kim等[12]的研究结果则是:当HVAT<14 s时,判断HVPG≥10 mmHg的AUROC为0.973,这一差异可能与研究人群不同有关,Kim的研究对象为代偿期肝硬化患者。当肝硬化进展到失代偿期时,随着门静脉血流量及门静脉压力的进一步升高,门静脉-肝静脉分流增加,导致肝动静脉分流相对减少,使得通过肝动静脉短路维持的HVAT相对推迟[11]。
本研究通过Logistic回归分析筛选出差异有统计学意义的多因素变量为PV-HVTT和CPS,建立回归方程Y=-0.217×PV-HVTT+1.526×CPS-7.097。通过ROC曲线来评价其诊断效能,当该模型切点值≥0.780时,其判断HVPG≥12 mmHg的敏感性为87.5%,特异性为78.6%,AUROC为0.857优于任一单因素指标。
目前研究诊断肝硬化门静脉高压的无创指标较多,各研究结果尚未统一。本研究利用多个无创指标建立一种诊断模型,具有一定的临床应用价值。然而本研究为一项回顾性的单中心研究,样本量少,模型建立后缺少验证集来验证,有待在今后的工作中进一步完善。
[1] 曾健,梅浙川.肝静脉压力梯度临床应用进展[J].山东医药,2016(23):103-106.
[2] DE FRANCHIS R.Updating consensus in portal hypertension:report of the Baveno Ⅲ Consensus Workshop on definitions,methodology and therapeutic strategies in portal hypertension[J].JHepatol,2000,33(5):846-852.
[3] SUK KT.Hepatic venous pressure gradient:clinical use in chronic liver disease[J].ClinMolHepatol,2014,20(1):6-14.
[4] 丁惠国,徐小元,令狐恩强,等.《肝硬化门静脉高压食管胃静脉曲张出血的防治指南》解读[J].临床肝胆病杂志,2016,32(2):220-222.
[5] DE FRANCHIS R.Expanding consensus in portal hypertension:Report of the Baveno Ⅵ Consensus Workshop:Stratifying risk and individualizing care for portal hypertension[J].JHepatol,2015,63(3):743-752.
[6] BERZIGOTTI A,GILABERT R,ABRALDES JG,etal.Noninvasive prediction of clinically significant portal hypertension and esophageal varices in patients with compensated liver cirrhosis[J].AmJGastroenterol,2008,103(5):1159-1167.
[7] 李娜.超声造影定量评估肝纤维化程度的可行性研究及参数筛选[D].复旦大学,2010.
[8] 韩磊,李莘,沈亚梅,等.超声造影在肝硬化定量分析中临床应用研究[J].陕西医学杂志,2015,44(3):331-333.
[9] 张超学,王玲,郑慧,等.超声造影及多普勒参数与乙肝患者门静脉压力相关性研究[J].中国超声医学杂志,2011,27(11):1012-1015.
[10] 张海英,孟繁坤.门静脉压力有创及无创检测方式的相关性研究[J].陕西医学杂志,2013,42( 4):433-436.
[11] 庄园,丁红,韩红,等.超声造影评价失代偿期肝硬化患者门静脉高压的临床价值[J].中华肝脏病杂志,2016,24(4):270-274.
[12] KIM MY,SUK KT,BAIK SK,etal.Hepatic vein arrival time as assessed by contrast-enhanced ultrasonography is useful for the assessment of portal hypertension in compensated cirrhosis[J].Hepatology,2012,56(3):1053-1062.
Clinical value of contrast-enhanced ultrasonography and serum markers in assessing portal hypertension in patients with decompensated liver cirrhosis
ZHANG Qing1, LI Ling2, DING Hong3, CHEN Shi-yao2△
(1DepartmentofGastroenterology,XuhuiCenterHospital,Shanghai200031,China;2DepartmentofGastroenterology,3DepartmentofUltrasound,ZhongshanHospital,FudanUniversity,Shanghai200032,China)
Objective To analyze the possibility of assessing portal hypertension in patients with decompensated liver cirrhosis via contrast-enhanced ultrasonography and common serum markers. Methods Fifty-four patients with decompensated liver cirrhosis were divided into two groups according to hepatic venous pressure gradient (HVPG):HVPG<12 mmHg (1 mmHg=0.133 kPa) and HVPG≥12 mmHg.The non-invasive index of routine blood test,liver function,coagulation function,Child-pugh score (CPS) and the results of contrast-enhanced ultrasound such as hepatic artery arrival time (HAAT),hepatic vein arrival time (HVAT)、portal vein arrival time (PVAT),hepatic artery to hepatic vein arrive transmit time (HA-HVTT) and portal vein to hepatic vein arrive transmit time (PV-HVTT) were assessed by univariate analysis and multivariate Logistic regression analysis,and then were used to generate a diagnostic model.The receiver operating characteristic curve was also used for analysis. Results The non-invasive model is Y=-0.217×PV-HVTT+1.526×CPS-7.097.When the area under ROC curve (AUROC) was ≥0.857 and the best cutoff value was ≥0.631,and the sensitivity and specificity in judging HVPG≥12 mmHg were 87.5% and 78.6%,respectively.Conclusions The model composed of PV-HVTT and CPS could be used to assess portal hypertension.
liver cirrhosis; portal hypertension; hepatic venous pressure gradient; contrast-enhanced ultrasonography; non-invasion
R657.3+1
A
10.3969/j.issn.1672-8467.2017.04.012
2016-10-31;编辑:王蔚)
上海市科学技术委员会科研计划项目(15411950501)
△Corresponding author E-mail:chen.shiyao@zs-hospital.sh.cn
*This work was supported by the Scientific Research Project of Science and Technology Commission of Shanghai Municipality (15411950501).
