体外诊断试剂研发及市场发展概况
2017-08-16袁银池赵晓勤陈大明张春芳
袁银池,赵晓勤,陈大明,张春芳
1.中国科学院上海生命科学信息中心,上海 200031
2.上海图书馆(上海科学技术情报研究所),上海 200031
3.中银消费金融有限公司,上海 200002
体外诊断试剂研发及市场发展概况
袁银池1,赵晓勤2,陈大明1,张春芳3
1.中国科学院上海生命科学信息中心,上海 200031
2.上海图书馆(上海科学技术情报研究所),上海 200031
3.中银消费金融有限公司,上海 200002
基因组学、分子生物学等基础学科的发展,促进了体外诊断试剂的开发应用和更新换代,使其在疾病诊治中发挥越来越重要的作用。2016年全球体外诊断试剂市场容量约680亿美元,未来全球增速预计达7%~8%,其中中国是全球增速最快的市场。主要就体外诊断试剂的研发及市场发展情况进行阐释。
体外诊断试剂;技术研发;市场发展
目前,全球医疗决策中约有三分之二是依据诊断做出,其中体外诊断(in vitro diagnostics,IVD)已是预防诊断和治疗疾病过程中的重要环节。体外诊断从人体样本中获取临床检测信息,达到诊断的目的。体外诊断市场可以细分为体外诊断试剂和体外诊断仪器两个部分。就国内体外诊断市场而言,体外诊断试剂占据大部分的体外诊断市场。
国家食品药品监督管理总局(CFDA)2014公布的《体外诊断试剂注册管理办法》中指出,体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂(盒)、校准品、质控品等产品。CFDA 2017年通过的《体外诊断试剂注册管理办法修正案》,表明体外诊断试剂全链条动态质量管理是提升产业格局、优化产品结构的监管方向。
1 体外诊断试剂领域的技术研发
1.1 发展历程
体外诊断试剂行业在我国开展较晚,20世纪70年代才刚刚拉开帷幕[1]。1970年初,我国小规模引进西方国家的技术设备,诊断试剂产业的雏形初现;1980年,开始大量引入海外先进技术,出现一批体外诊断试剂的生产企业,诸如生化类诊断试剂的北京中生、深圳迈瑞等生产企业,免疫类诊断试剂的上海科华、郑州安图等生产企业;20世纪90年代初期,生化类诊断试剂已有100多家的生产企业,免疫类诊断试剂的生产企业约300家,但大多数缺少合法资质,此时诊断试剂行业竞争白热化;90年代后期,CFDA着手对血源筛查类、免疫类诊断试剂开展市场清查,取缔违规不合格生产厂家;2010年之前,我国体外诊断试剂生产企业集中于较低端的生化与免疫诊断市场,缺乏创新性;2010年之后,体外诊断技术得到快速发展,尤其是分子生物学技术在临床检验领域应用带来的新一轮医疗革命。
近些年,我国先后出台了一系列规范性法规,包括《体外诊断试剂临床试验技术指导原则》以及《体外诊断试剂质量评估和综合治理方案》,推进了体外诊断领域的基础研究,研究成果呈直线式增长,并有望在总量上赶超美国。
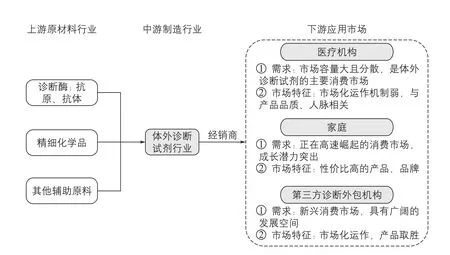
图1 体外诊断试剂行业产业链
1.2 行业产业链
体外诊断试剂行业产业链是由上游原材料、中游体外诊断试剂、下游服务和需求共同组成(图1)。产业链的上游为原材料生产,当前我国诊断试剂领先企业均已加大原料研发力度。产业链的中游为试剂生产,且产业链所涉及的企业主要为位于中游的试剂厂商。目前我国体外诊断试剂中高端市场基本为国外大牌所垄断,国内生产企业数量众多但市场相对分散,产品同质化较为严重,逐渐进入到价格战阶段。此时,中游的体外诊断试剂厂商的渠道能力是竞争重点。产业链的下游业务拓展一般是通过经销商或由厂商直接销往医院、体检中心、临检中心、血站、防疫站及血液制品厂家等终端用户。目前各级医院是体外诊断产品最主要的终端用户。
从整个产业链来看,我国上市公司多集中在上游试剂原料提供、中游诊断产品生产和下游数据分析服务提供,部分核心原材料需要进口。我国新材料与上游试剂原料行业在近几年已经逐渐做大做强,根据美国分子诊断行业发展历程来看,我国体外诊断试剂行业已经进入到了行业整合提速阶段。
1.3 技术发展路径
按检测方法或原理划分,体外诊断试剂包括生化诊断、免疫诊断、分子诊断、即时诊断(POCT)、凝血类诊断和血液学等试剂。我国诊断试剂主要的四大类产品信息详见表1。
从20世纪初第一台生化分析仪诞生,到免疫分析和分子诊断的兴起,体外诊断行业得到快速发展。体外诊断试剂先后经历了生化诊断、免疫诊断、分子诊断与POCT 4个发展阶段。其中,前3个阶段于实验室完成,最后1个阶段可在家中进行。另外,国内分子试剂占体外诊断试剂比约为5%,而世界范围内此比例高达11%,因此,代表了未来研发方向的分子诊断和POCT等细分领域在我国还处于早期发展阶段。
1.3.1 生化诊断
生化诊断(clinical biochemistry)产品在我国发展较早,为医院常规诊断检测项目。其检测系统大部分是开放式。国产试剂历经以往的发展,质优价廉,品种丰富。试剂基本完成进口替代,国产品牌市场占有率超过60%,国内生产性企业200多家。
1.3.2 免疫诊断
免疫诊断(immunodiagnostics)运用免疫学理论、技术与方法诊断各种疾病和测定免疫状态。免疫诊断试剂在诊断试剂盒中品种最多,主要用于肝炎检测、性病检测、肿瘤检测、孕检等。
免疫诊断技术包括化学发光免疫分析技术(CLIA)、时间分辨荧光免疫分析技术(TRFIA)、电化学发光免疫分析(ECLA)和流式荧光发光法等(表2)。区别在于标记抗原、抗体,最终定量检测反应信号所涉及的方法不同。

表1 体外诊断试剂分类
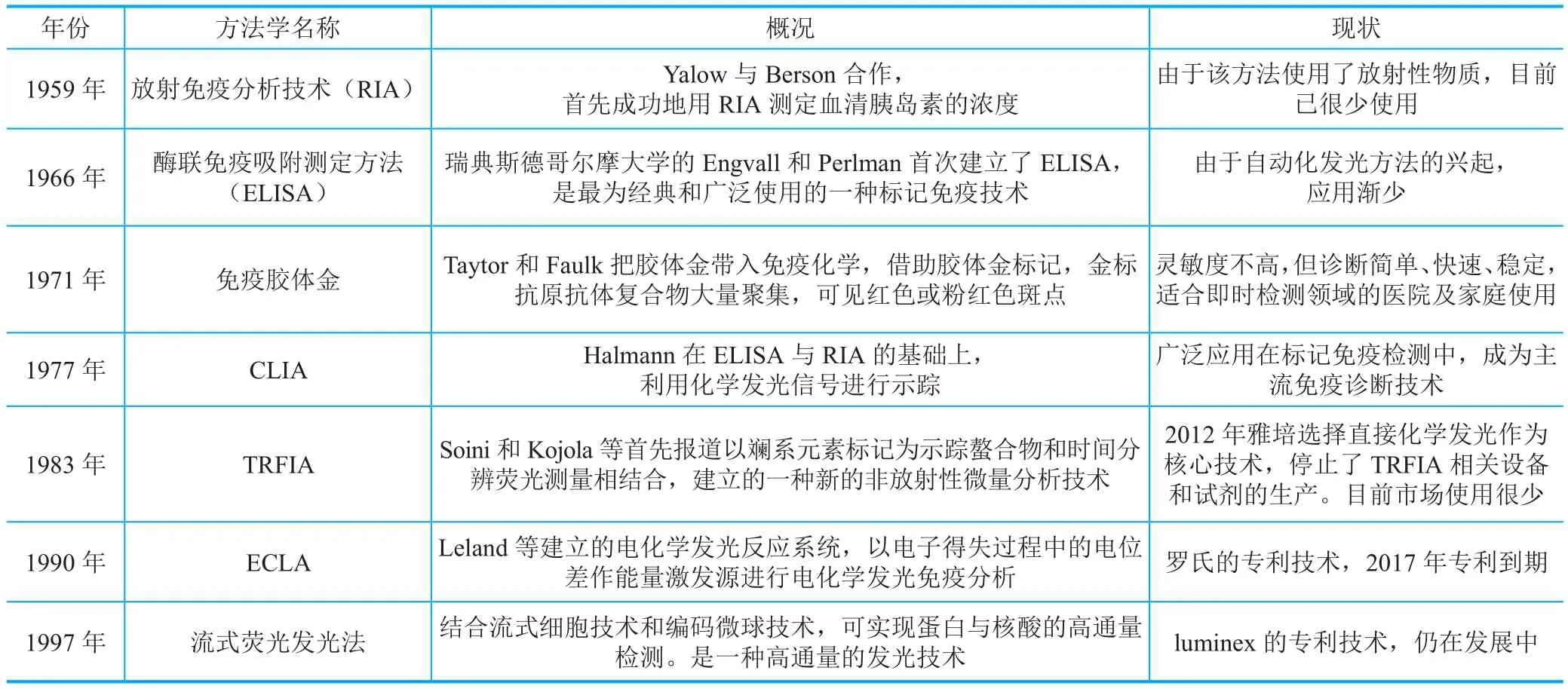
表2 免疫诊断技术发展简史
化学发光试剂在短短20年内快速发展,市面上已有4代试剂。第一代试剂主要以异鲁米诺为发光标记物,采用CLIA方法,代表有索林的Liaison;第二代试剂采用竞争性抑制酶免疫测定(CIEIA),代表为强生的Ortho Vitros ECi & Vitros 3600,采用辣根酶标记鲁米诺为发光物;市面上主流的试剂主要为第三代试剂,包括采用CLIA用吖啶酯为标记物的试剂,代表为雅培的Architect i系列和西门子的Centaur系列,还有以碱性磷酸酶标记AMPPD为发光物的试剂,如Beckman的BCI ACCESS2 & Dx I800、西门子的Immulite系列和奥林巴斯的AU3000i;电化学发光试剂,罗氏宣称其为第四代化学发光试剂,于1996年推出,其专利已经在2016年过期,国内已有企业在电化学发光领域进行了紧密布局。
1.3.3 分子诊断
分子诊断(molecular diagnostics,MDx)是一门运用分子生物学方法、技术,以获得人体生物大分子及其体系的存在结构或表达调控的变化,为疾病的防治、预测、诊断、治疗和预后判断提供信息和决策依据的新兴学科。分子诊断检测的是遗传物质的状态变化,遗传物质的编码决定表达成什么样的蛋白,表达成什么样的蛋白又决定了具体的个体是怎么样的表型,具体的表型又可能影响面对不同的病原体时的症状、进展等。
人体遗传物质(核酸)的状态和变化情况检测是分子诊断的核心。核酸检测的应用可大致分为3类:临床感染性疾病病原体核酸检测、血液筛查核酸检测、人体基因核酸检测。分子诊断的主要技术有核酸分子杂交(FISH)、PCR和生物芯片技术。
分子诊断的发展(图2)可分为3个阶段:1978年简悦威等应用液相DNA分子杂交成功地进行了镰形细胞贫血症的基因诊断,标志着分子诊断的诞生,此阶段分子诊断仅应用于检测遗传病以及产前诊断;由Kary Mullis于1985年发明的PCR,经过不断发展,已成为分子生物学实验室的必备技术;1992年美国Affymetrix公司制造出第一张基因芯片标志着分子诊断进入生物芯片阶段,分子诊断应用进一步扩展。
1.3.4 即时诊断
即时诊断(point-of-care testing,POCT),又称即时检测、即时检验、现场快速检测或者床边检测,通常不一定需要临床检验师来进行,在采样现场即时开展分析。POCT类产品具有使用方便、高效(出结果时间快,判读时间多在15min内)以及准确度高等特点,对于疾病预防、确定病因和预后效果、提高治疗有效性和减少医疗成本有重大意义,能满足各级各类医疗机构的临床检测需要。1995年美国临床实验室标准化委员会发布AST2—P文件,决定对POCT进行标准化管理。
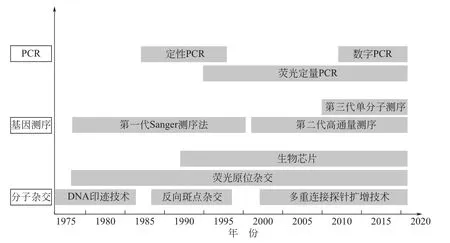
图2 分子诊断的发展阶段
POCT概念及技术在2004年首次引入我国,自2006年举办了多届POCT高峰论坛,我国POCT得到快速发展。2013年10月国家标准化管理委员会发布了《GB/ T 29790—2013即时检测质量和能力的要求》国家标准,将POCT命名为“及时检测”,同时对POCT产品的质量保证能力提出了明确要求,该标准于2014年2月1日正式实施。
POCT技术经过多年发展,目前主要可分为干化学技术、胶体金技术、传感器技术、生物芯片技术、未来有望代表技术主流的微流控技术及红外和远红外分光光度技术。技术的创新升级使得POCT的检验范围、精度等方面都得到了极大地发展。
2 体外诊断试剂行业的市场现状
2.1 体外诊断试剂行业市场规模
2.1.1 全球体外诊断试剂行业市场规模
图3显示,全球体外诊断试剂行业保持稳定增长的态势。2014~2016年,全球诊断试剂行业的市场规模分别为590亿美元、632亿美元及680亿美元,同比增速分别为6.50%、7.12%及7.59%。预计到2018年市场规模将达到793亿美元,其2013~2018年的年均复合增速为6.16%。
根据Kalorama的调查报告显示,欧美占据全球四分之三以上的体外诊断试剂行业的市场份额,美国仍是世界体外诊断创新中心和最大的需求市场,仍保持年均3%~5%的增长,欧洲2015~2016年的体外诊断市场份额有所下滑。新兴市场占据的市场份额虽小,但增速最快,以中国、拉美及印度为代表的新兴经济体市场正处于快速增长期。
由图4可以看出,免疫诊断和生化诊断为全球体外诊断市场中占比较高的细分领域。产业信息网发布的《2015~2022年中国分子诊断市场评估分析及投资战略研究报告》显示,广泛的应用领域促进了分子诊断行业的快速发展,目前全球分子诊断市场规模不断增大,增速高于同期体外诊断其他项目。分子诊断行业集中度高,罗氏、诺华等排名前八位的公司市场占比高达88%。据美国MarketsandMarkets预测(图5),2013~2018年全球POCT市场年均复合增速约为8%,分子诊断市场年均复合增速达到9.3%,分子诊断的市场份额将大幅提升。预计2018年生化诊断市场占比将降至10%,而免疫诊断市场将保持在20%~25%。
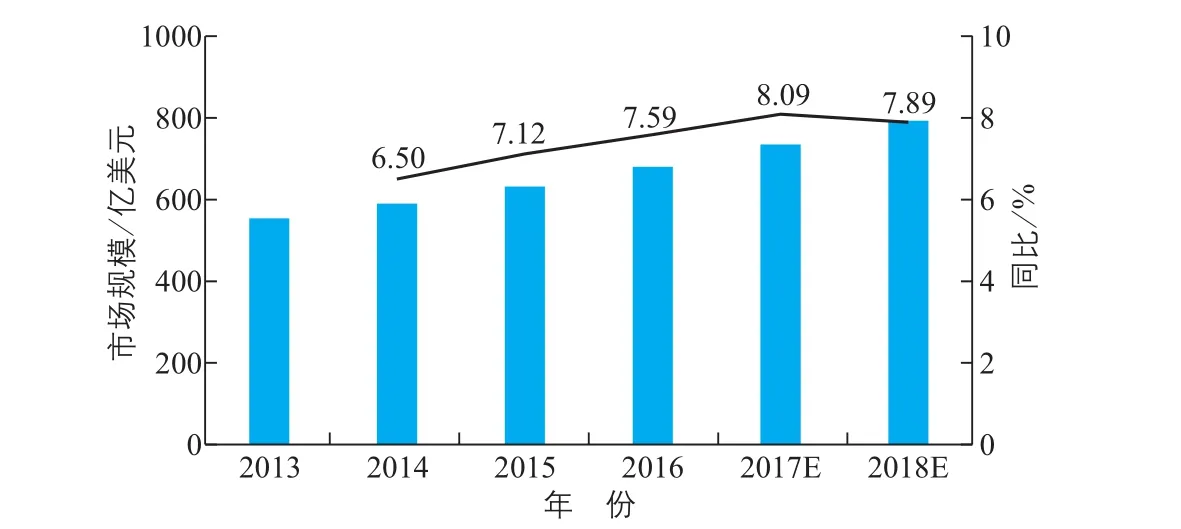
图3 全球体外诊断试剂行业市场规模及增长趋势
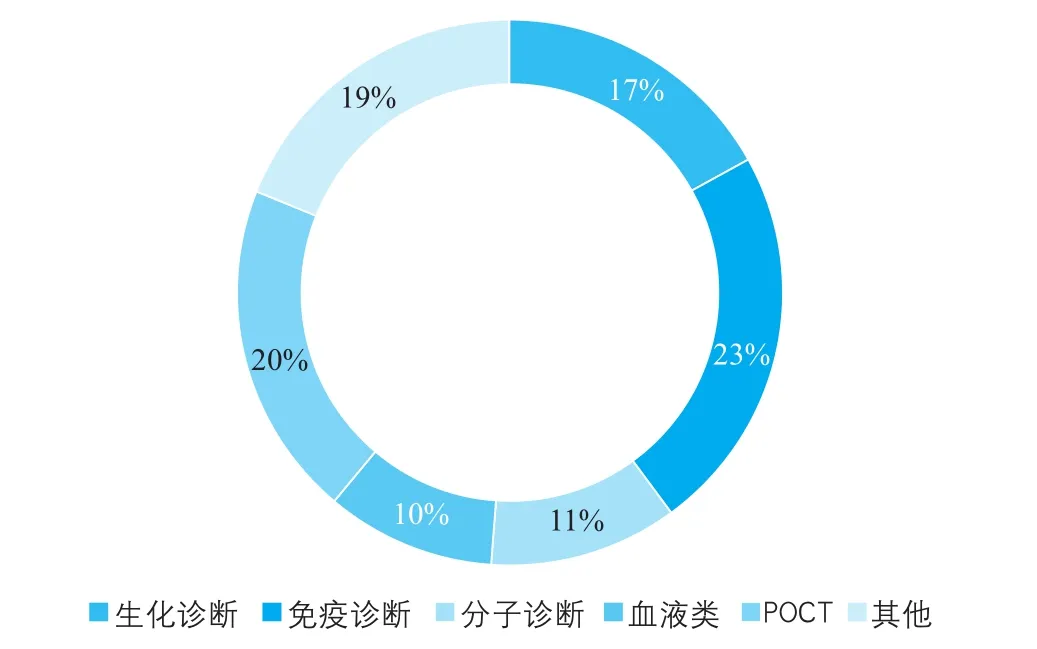
图4 2016年全球体外诊断子行业分布情况
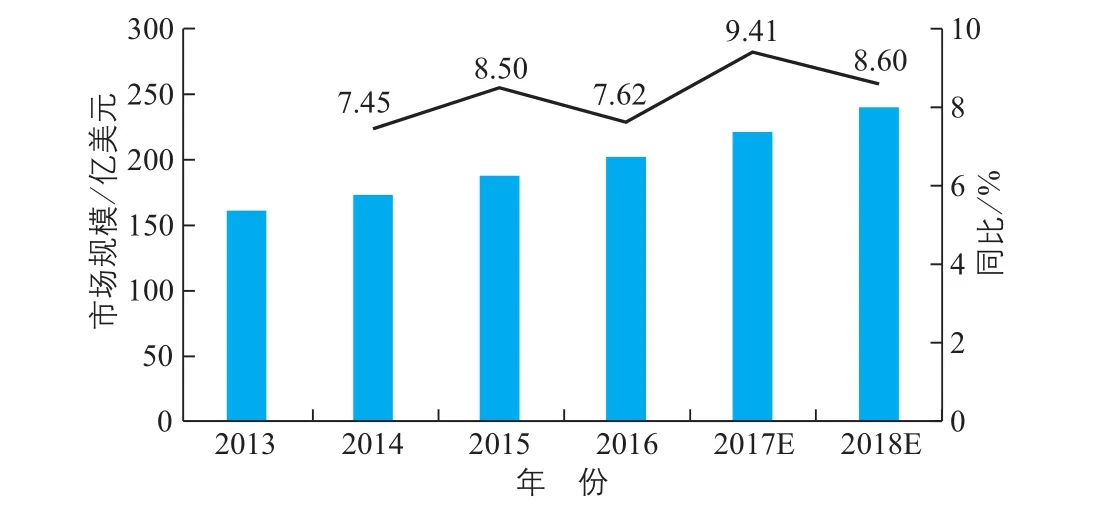
图5 全球POCT行业市场规模及增速
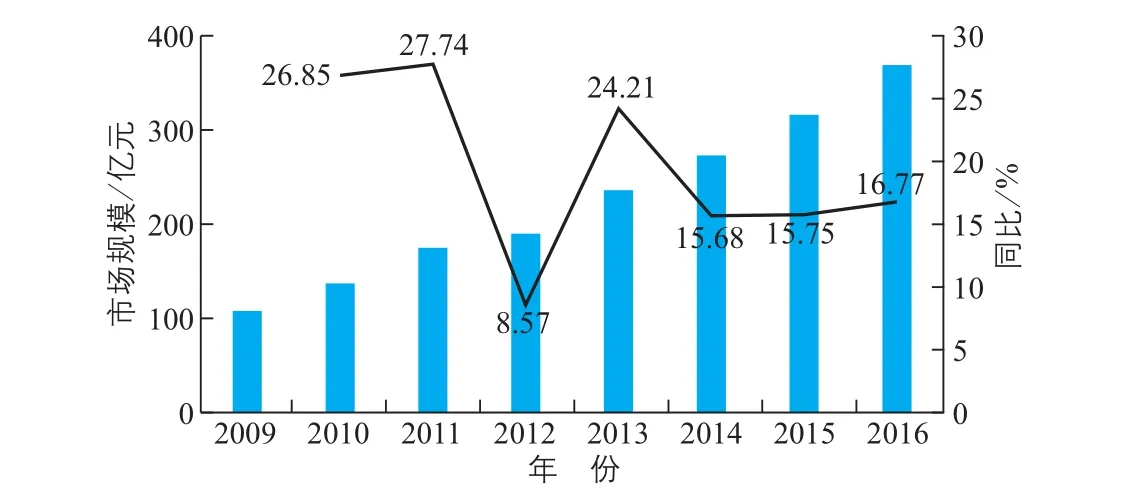
图6 我国体外诊断试剂行业市场规模及增长趋势
2.1.2 我国体外诊断试剂行业市场规模
由图6可以看出,我国体外诊断试剂行业处于快速发展阶段。2013~2015年,我国体外诊断试剂行业的市场规模分别为236亿元、273亿元、316亿元,同比增速分别为24.21%、15.68%、15.75%;2016年市场规 模 达369亿元,其2009~2016年的年均复合增速为16.60%。如果按照诊断试剂原料市场规模约占体外诊断试剂市场规模10%左右计算,2016年我国体外诊断试剂原料市场规模约为37亿元。
与发达国家体外诊断产品约30美元的人均年消费金额相比,我国仅为2美元左右。Marketresearchreports.biz调查报告《中国体外诊断(IVD)市场——2021年前的机遇评估、竞争格局和市场预测》显示,2021年我国体外诊断市场规模将超百亿美元。其中,体外诊断试剂占据80%左右的体外诊断市场份额。而我国体外诊断市场中,进口占比超50%。伴随医院模块占体外诊断总需求超90%,未来我国体外诊断产业规模将以16%~18%的速度扩增。中国医药工业信息中心发布的《中国医药健康蓝皮书(2015版)》预计2019年我国体外诊断行业规模将超过700亿元。
由图7可以看出,生化诊断和免疫诊断占据我国体外诊断行业的主要市场。免疫诊断是我国体外诊断市场占比最高的细分领域,酶联免疫是主流产品,化学发光诊断试剂的国产化率较低,免疫诊断市场2016年增速约18%。由于生化试剂检测系统多为开放式,国产的试剂具备明显价格优势,因此约占我国生化试剂行业三分之二的市场份额,同时产品同质化也使得市场竞争较为激烈。目前我国分子诊断市场中,PCR的主导技术为荧光定量qPCR技术,且在中高端的荧光PCR领域已实现试剂的国产化。分子诊断行业初步形成了“2(达安基因和华大基因)+X(其他国内相关企业)”的市场格局。而基因芯片产品仅有国外几家企业进行生产,尚处于早期研发阶段,技术壁垒高。预计未来我国分子诊断市场年增速为15%~30%,是全球增长最快区域。目前国内POCT行业发展处于起步阶段(图8),医院渗透不高,其中血糖类占据主要市场,心血管类增速最快[2]。
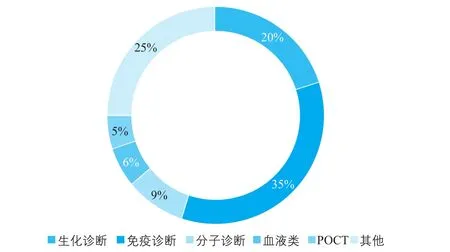
图7 2016年我国体外诊断子行业分布情况
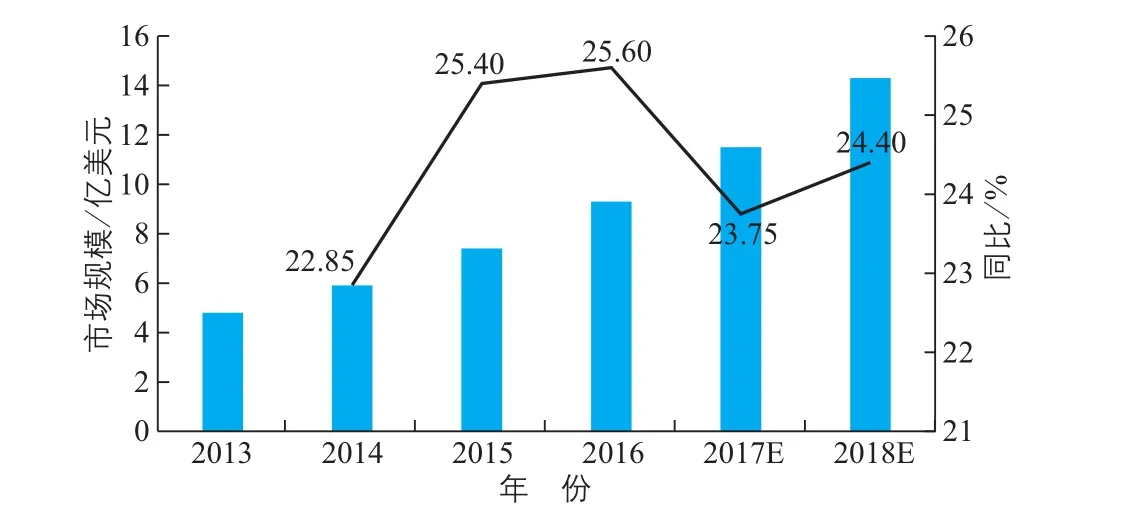
图8 我国POCT行业市场规模及增速
2.2 体外诊断试剂行业主要研发企业
全球体外诊断行业市场占比前五位的企业分别为Roche、Abbott、Siemens、Johnson & Johnson和Beckman,其市场份额合计超过50%,地位稳定,难以撼动。近年来,这些国际巨头在北美、欧洲等成熟市场的成长速度放缓,在新兴的不发达区域如亚洲、拉美洲地区增速较快,其中金砖四国成为竞相争夺的目标。
就竞争格局而言,企业分为3个层次:兼具设备、试剂生产能力的企业,如Roche、Abbott、Beckman、Siemens、迈瑞、科华等;只生产试剂的企业,如九强、迈克等;只生产仪器的企业,如Hitachi、Toshiba等。
2.2.1 国际型企业
近年来,全球体外诊断试剂市场以超过5%的速度增长,涌现了一批著名的国际型企业,以Roche、Abbott及Siemens等为代表(表3),这些国际型企业在该领域的年销售收入均逾10亿美元,主要集中在北美、欧洲等经济发达地区。
Roche成立于1896年,拥有两大核心业务,制药和诊断。诊断业务部在1968年成立,此后Roche开始了在整个诊断行业包括生化、免疫、分子、POCT的布局,成为全球体外诊断行业的领导者,形成与制药业务在健康产业链上的完美协同。
Abbott是全球体外诊断领域巨头之一,诊断产品线主要有传统核心实验室诊断(生化、免疫、血液学、实验室信息化及全自动免疫生化分析系统/诊断试剂)、分子诊断(试剂)和POCT(收购美艾利尔)。
2.2.2 中国企业
据CFDA统计,我国约有1.7万个体外诊断试剂注册产品,涉及约1200家生产企业,集中在生化诊断试剂、免疫诊断试剂领域。我国体外诊断试剂领域生产企业普遍规模不大,仅约20家企业的营业额过亿,市场占比约为30%[3]。与国际试剂仪器集成发展形式不同,我国企业侧重于试剂的生产与海外产品的代理。
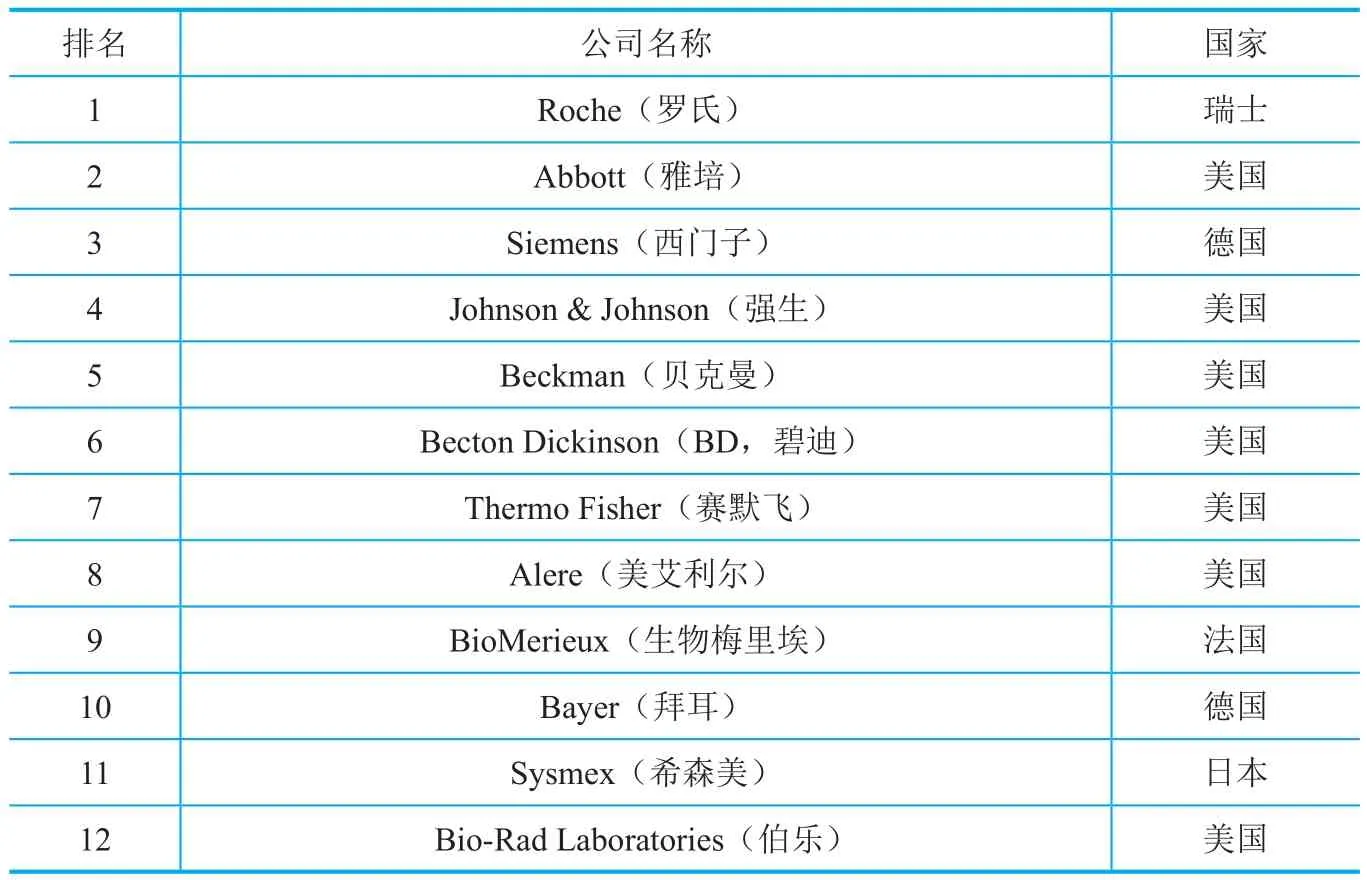
表3 全球体外诊断试剂公司市场占比排行
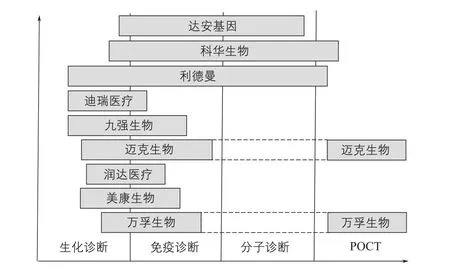
图9 我国部分上市公司主营的诊断业务领域
目前,我国有48家主营体外诊断的上市公司。①新三板:璟泓科技、厦门鲎试剂生物、迈迪生物、之江生物、科方生物、伊普诺康、新产业、伊仕生物、康美生物及虹博基因等。②中小板:达安基因、科华生物。③沪A:润达医疗。④创业板:利德曼、乐普医疗、九强生物、凯普生物及透景生命等。⑤港股:中生北控。
如图9所示,我国生化诊断试剂行业采用免疫比浊法的代表企业有九强生物、利德曼、迈克生物及美康生物。免疫诊断试剂行业的生产企业中,科华生物利用酶联免疫技术,安图生物和迈克生物采用化学发光技术。分子诊断试剂行业代表企业有达安基因、深圳普瑞康、厦门艾德、上海之江等,其中达安基因采用PCR及基因测序技术,千山药机采用基因芯片技术,华大基因在基因测序领域走在国内前列,上海之江聚焦qPCR诊断试剂与POCT领域,越来越多民族企业自主研发的核酸类体外诊断产品获得国内上市批准。POCT行业中万孚生物采用胶体金技术,璟泓科技以POCT床旁快速检测产品为主。
2.2.3 企业并购
我国现有上千家体外诊断试剂生产企业,上万家相关渠道商,且多集中在技术门槛较低的生化诊断试剂、免疫诊断试剂领域,企业多而散,规模偏小,市场集中度不高。随着国际型企业着力开拓中国市场,及我国逐步提高行业准入门槛与产品质量,兼并收购在所难免。
2015年,迪安诊断持股博圣生物,开拓遗传检测市场;九强生物联合迈瑞生物拓宽生化体外诊断试剂市场;红杉资本投资产前诊断公司Natera;汤臣倍健投资上海凡迪,布局基因检测等。2016年,迈克生物并购美因健康科技,拓展基因测序服务;三诺生物并购PTS,深化POCT检测业务;西陇科学收购美国Fulgent公司15%股权,进军基因检测领域,还并购了福建新大陆生物技术股份有限公司,以形成完整的体外诊断试剂产业链等。
3 体外诊断试剂行业的发展前景
新医改背景下,我国医保覆盖率和报销比例不断提升,而体外诊断可以影响约70%的医疗决策。随着医保控费压力增大,医院收入来源将从药品逐渐向医疗服务转移,而且国外医药和诊断营收比为1∶0.8,我国仅为1∶0.19,我国体外诊断行业成长空间是医药的4倍,将成为医疗服务主要收入来源之一。随着体外诊断产业的发展,更具融合性的大诊断产业正在不断形成。
同时,二胎政策每年新增的数百万新生儿将为无创产前筛查(NIPT)领域带来7亿元市场,再加上目前每年约1500万新生儿带来的35亿元的空间,NIPT带来的市场空间就达40亿元以上,且NIPT未来渗透率的不断提升将带来更大的市场空间。
3.1 行业监管加强,技术决定未来
从行业监管政策上看,我国关于体外诊断行业的法律法规和行业政策将逐步向国际惯例趋同。2007年以来CFDA出台的关于体外诊断试剂的系列管理办法,均充分体现了欧美发达国家关于体外诊断行业政策的普遍原则。2014年,国家监管部门开始加强对体外诊断行业的监管,出台了一系列有关政策法规,强化监督全链条各环节,以质取胜的细分市场优势企业将受益,国产品牌的市场份额将逐渐增加。
诊断新技术、互联网信息化与电子技术的应用,从技术层面上推动了市场的成长。就技术层面而言,未来体外诊断试剂行业发展着重于试剂品质的提高以及新检测技术开发。在试剂品质的提高方面,溯源能力对于以开放系统为主的生化诊断领域尤为重要。在新检测技术开发方面,胶乳增强免疫比浊和胶体金增强免疫技术得以应用。同时,一些新的技术,如治疗药物检测(TDM)、酶法和均相免疫分析等技术,开始使用生化诊断的方法。
3.2 产业整合加速,向分子诊断、即时诊断倾斜
分级诊疗的落实有助于引导患者分流,基层医院重要性凸显,且存在提升诊疗水平意愿,未来几年内存在较大的补差距需求,进而促使体外诊断试剂下基层,带动基层市场保持快速增长趋势,相比较而言基层市场对产品价格较为敏感,或将会是国内企业的发展机遇。
同时,政策背景变动造成行业经营环境变化,统一招标、挂网采购使得产品价格下行压力长期存在,两票制或将重新分配行业利益链。为了应对市场发展,行业整合势在必行:在体外诊断试剂行业产业链的上游原料方面,控制试剂成本和提高产品质量;在中游制造方面,采取试剂仪器集成发展之路,加强试剂丰富性;在下游应用方面,强化拓展渠道,注重各级医院。
生化诊断试剂和免疫诊断试剂占整个体外诊断试剂市场的比重高,是目前诊断试剂的主流。分子诊断和POCT所占市场份额相对较小,但是其关注度高,增长快,是细分行业的新兴领域。尤其是简单、快速及小型化便于普及的快速POCT诊断,可在家中进行,是发展的重要方向。具体如下所述。
① 国内市场中发展成熟的生化诊断试剂,已基本实现国产替代,整顿力度正加强,市场集中度在提升。未来市场份额呈下降趋势,但其在特定项目上具有优势,不会被替代消失,精品试剂和封闭式发展成为未来大趋势。
② 免疫诊断试剂保持主流地位,国外主流市场以化学发光为主,国内医院中化学发光和酶联免疫并存。高端市场为海外巨头所占据,国产品牌技术升级中,实现了部分进口替代。全自动化学发光免疫诊断产品增长快速,直接化学发光是免疫技术未来发展趋势。根据CFDA注册情况统计分析,化学发光现有注册证企业超过50家,竞争业态较乐观。
③ 分子诊断作为精准医疗的技术基础,是诊断技术的前沿技术,市场前景广阔[4]。其与海外同行差距相对较小,且受益于精准医疗发展趋势的推动,未来相当一段时间内仍将会保持较高增速。前沿领域如荧光定量PCR、微滴式数字PCR、DNA测序、液体活检等不仅增长很快,而且未来的市场空间也很大。
④ POCT由于诊断时间短、检测便捷等优势,成为近年来体外诊断行业的重要应用和增长最快的领域。POCT细分领域众多,避开同质化竞争是关键;心脏标志类、传染类、血糖类(尤其是糖尿病)及妊娠类市场对即时检测形成巨大需求;肿瘤类POCT技术壁垒较高,市场空间有待打开;分级诊疗助力POCT,需与传统诊断形成优势互补;关注POCT的小型化、网络化管理。
[1] 李耀华,张世庆. 体外诊断试剂行业发展回顾与展望[J]. 检验医学与临床,2017,14(2):299-301.
[2] 全国卫生产业企业管理协会医学检验产业分会,中国医疗器械行业协会体外诊断分会. 2015年中国体外诊断行业年度报告[J].中华临床实验室管理电子杂志,2016,4(1):30-36.
[3] 张超. 体外诊断行业发展大有可为[J]. 首都食品与医药,2017,24(7):12-13.
[4] ZIEGLER A,KOCH A,KROCKENBERGER K,et al. Personalized medicine using DNA biomarkers:a review[J]. Human Genetics,2012,131(10):1627-1638.
The development situation of research and market in vitro diagnostic reagents
YUAN Yinchi1,ZHAO Xiaoqin2,CHEN Daming1,ZHANG Chunfang3
1. Shanghai Information Center for Life Sciences, CAS, Shanghai 200031, China
2. Shanghai Library/Institute of Scientif c and Technical Information of Shanghai, Shanghai 200031, China
3. BOC Consumer Finance, Shanghai 200002, China
The development of basic disciplines, such as genomics and molecular biology, has promoted the development and application of in vitro diagnostics(IVD)reagent(s). IVD reagents are playing an increasingly important role in the diagnosis and treatment of diseases. The global IVD reagents market capacity is 68 billion USD approximately in 2016, expected to 7% to 8% of growth rate, of which China is the fastest growing market. The technology R & D and market development of IVD reagents are introduced.
in vitro diagnostics reagents; technology R & D; market development
10.3969/j.issn.1674-0319.2017.04.002
袁银池,硕士,助理馆员。主要从事生物技术、化学等领域的产业与技术情报研究。
E-mail:ycyuan@sibs.ac.cn
