果蔬功能成分与肠道菌群相互作用研究进展
2017-08-16王凤赵成英田桂芳郑金铠
王凤,赵成英,田桂芳,郑金铠
中国农业科学院农产品加工研究所,农业部农产品加工重点实验室,北京 100193
果蔬功能成分与肠道菌群相互作用研究进展
王凤,赵成英,田桂芳,郑金铠
中国农业科学院农产品加工研究所,农业部农产品加工重点实验室,北京 100193

郑金铠,研究员,博士生导师。2010~2013年美国麻省理工大学博士后、研究助理教授,2014年入选中国农业科学院“青年英才计划”A类学者。美国营养学会、美国食品技术协会等高级会员,中国农学会食物与营养专业委员会委员。长期从事果蔬精深加工、新型功能食品的开发创制及其营养健康分子机理研究,先后承担美国国立卫生研究院、美国癌症研究院、美国农业部、国家自然科学基金等国内外重大课题17项;发表学术论文56篇,其中SCI收录48篇,累计影响因子152;申请国家专利22项,其中已授权12项。E-mail:zhengjinkai@caas.cn
果蔬是日常膳食的重要组成部分,其富含多种具有显著营养健康功效的功能成分,在促进人体健康和预防疾病方面发挥着至关重要的作用。不断有研究证实,果蔬功能成分的多种营养健康功能是通过与肠道菌群的相互作用实现的。从果蔬功能成分对肠道菌群的结构、数量和后续对人体生理功能的影响,以及肠道菌群对果蔬功能成分体内代谢和营养健康作用的影响两大方面,阐述果蔬功能成分与肠道菌群的相互作用研究进展,初步探讨果蔬功能成分-肠道菌群-人体健康的关系,为揭示果蔬营养健康机制,进一步为合理膳食提供重要的参考。
果蔬;多酚;膳食纤维;肠道菌群;营养健康
果蔬是日常饮食的重要组成部分。《黄帝内经》记载“五谷为养、五果为助、五畜为益、五菜为充”,其中的“五果”和“五菜”分别指水果和蔬菜,它们能为人体提供营养、充实脏气,另外,果蔬也是“药食同源”食疗和药膳的主要食物组成部分,其与人体营养健康关系的研究成为关注的焦点。大量研究表明,果蔬中不仅富含水、蛋白质、碳水化合物、脂类、维生素、矿物质等人体必需的营养元素,还含有多酚、黄酮、糖苷、萜类、有机硫、脂肪酸、生物碱等多种功能成分(图1),具有显著的抗癌、抗炎、抗氧化、降血糖、降血压、降血脂等生理功能,在维持人体健康和疾病预防中发挥着举足轻重的作用。经过口腔、胃和小肠时,易被消化、吸收的功能成分被小肠上皮细胞吸收,通过肝门静脉进入肝脏,在I相和II相代谢酶的作用下发生代谢转化,一部分代谢产物通过血液循环,到达靶器官,发挥其营养健康功能,另一部分随着胆汁排泄,重新进入肠道;而不易被消化、吸收的功能成分,则直接进入大肠(图2)。
人体内存在数量巨大的共生微生物,其中90%以上存在于肠道内,称为肠道菌群,其中结肠中数量最多(1011~1012cfu/mL)。在分类上,肠道菌群基本可以归为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和疣微球菌门(Verrucomicrobia)5大门类。拟杆菌门主要包括拟杆菌属(Bacteroides)和普雷沃菌属(Prevotella);厚壁菌门主要包括梭状芽胞菌(Clostridium)、乳酸菌(Lactobacillus)、胃瘤球菌(Ruminococcus)、真杆菌(Eubacterium)、柔嫩菌(Faecalibacterium)及罗氏菌(Roseburia)等菌属;放线菌门中的主要菌属是双歧杆菌(Bif dobacterium),其中多个菌种是益生菌;变形菌门的主要成员是埃希氏菌属(Escherichia)和脱硫弧菌属(Desulfovibrio);而目前被发现的疣微球菌门只有阿克曼菌属(Akkermansia)。肠道菌群所编码的非冗余基因约是人类基因组的150倍,同时赋予肠道菌群强大的生理功能,成为人体不可或缺的微生态系统,在维持人体健康方面发挥着极其重要的作用,包括促进宿主免疫系统的发育、成熟[1];防止病原菌过度生长,维持肠道健康[2];影响宿主细胞的增殖和血管生成[3-4];调节肠道内分泌功能、神经信号传导、骨密度[4-6];为宿主提供能量来源(满足宿主5%~10%的能源需求)[7];合成人体自身无法合成的维生素[8]及神经递质[5];参与胆盐代谢[9]及清除外源性毒素[10]等。然而,肠道微生态平衡极易受到多种因素的调控,一旦被破坏,便会引起多种疾病的发生,从肠道到远端大脑,越来越多的疾病被证实与肠道菌群失衡有着密切关系(图3)。

图1 果蔬中的功能成分

图2 功能成分体内消化吸收示意图
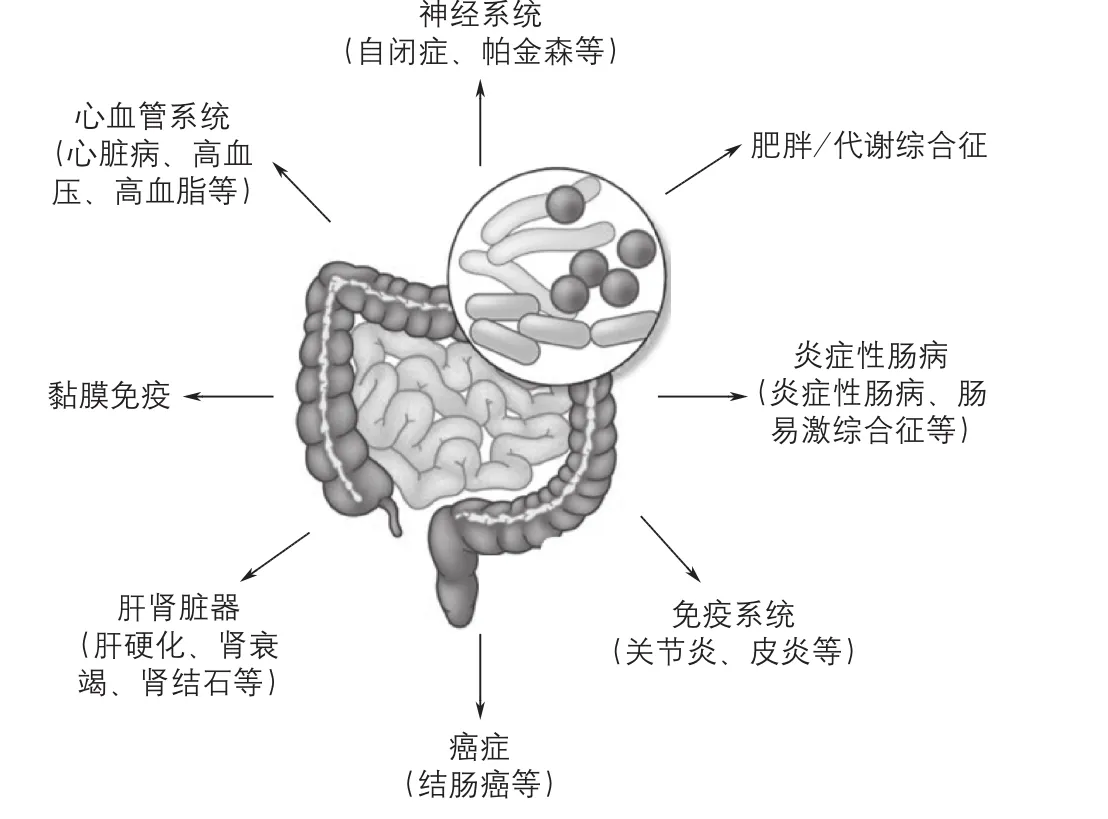
图3 肠道菌群与人体疾病
饮食、抗生素、疾病状态、运动、作息等外界因素均会影响结肠微生态平衡,已有研究表明,饮食是影响肠道菌群结构及其代谢的重要因素。乳糜泻患者肠道中葡萄球菌(Staphylococcus)、梭状芽胞杆菌和拟杆菌的数量显著增多,且双歧杆菌(Bif dobacteria)的数量也比健康的个体中少,而无麸质饮食可以显著降低该菌属的丰度,改善腹泻症状;母乳喂养可以显著增加肠道内益生菌双歧杆菌和乳酸菌的丰度,而普通饮食喂养,会增加大肠杆菌(E. coli)、脆弱拟杆菌(Bacteroides fragilis)及艰难梭状芽孢杆菌(Clostridium diff ile)等有害菌的丰度;高糖和高脂的“西方饮食”会引起肠道内无害梭状芽孢杆菌(Clostridium innocuum)、细长真杆菌(Eubacterium dolichum)及肠球菌(En-terococcus)等的数量增加,引起肠道微生态失衡,导致肥胖、高血压等慢性疾病的高发;长期素食,可以降低大肠杆菌、细长真杆菌(Enterobacteriaceae)、拟杆菌等有害菌的含量[11]。另一方面,饮食成分作用于肠道菌群的同时,肠道菌群也会参与饮食成分的代谢,进而影响其营养健康功能,如肉和蛋黄中的磷脂酰胆碱进入肠道后,消化产生的胆碱在肠道菌普拉梭菌(Faecalibacterium prausnitzii)和双歧杆菌产生的三甲胺酶的作用下生成三甲胺(TMA),进入肝脏后被氧化生成有毒物质氧化三甲胺(TMAO),增加心脏病发作和中风的风险[12];过量的未被人体消化的蛋白质进入大肠后在链球菌属(Streptococcus)、丙酸杆菌属(Propionibacterium)和葡萄球菌属的作用下分解为氨基酸,氨基酸在杆菌类细菌作用下产生的多胺类化合物会损伤大鼠的肠道组织,此外,氨基酸也会在其他微生物酶的作用下,产生硫化物、吲哚类和苯类化合物等产物,对肠道产生不利影响,诱发肠炎等相关疾病[13-14];厚壁菌门梭状芽孢杆菌属的真杆菌、罗氏菌、柔嫩菌及粪球菌(Coprococcus)等可以将食物中的碳水化合物发酵成短链脂肪酸(SCFAs),尤其是丁酸盐,是肠道黏膜的优选能量来源,在维持黏膜屏障,保护胃肠道中具有重要作用[15];肠道菌群可产生胆固醇氧化酶,能够促进胆固醇的代谢,减少肥胖以及相关的心脑血管症状[16]。大量研究结果表明,肠道菌群和膳食成分间的相互作用极大地影响着人体生理状态,阐明膳食成分-肠道菌群-人体生理间的关系及其相关机制具有重要意义,也是近年研究的热点。
果蔬作为饮食的重要组成部分,富含多种功能成分。越来越多的研究表明,果蔬中的多种功能成分的营养健康功能是通过与肠道菌群间的相互作用实现的。下面对果蔬功能成分(膳食多酚、膳食纤维、多不饱和脂肪酸等)与肠道菌群的相互作用研究进展进行全面综述,为揭示果蔬营养健康机制,进一步合理膳食提供重要参考。
1 膳食多酚与肠道菌群的相互作用
酚类化合物是指分子结构中有若干个酚羟基的植物成分的总称,常与糖和有机酸等结合。按照结构分为类黄酮和非类黄酮化合物两大类,前者包括花色苷和黄酮醇、黄烷酮等,后者包括咖啡酸、阿魏酸、绿原酸等小分子酚酸和单宁[17]。来自于食物的酚类化合物称为膳食多酚,广泛存在于果蔬植物中,是植物性食物中重要的功能成分,尤其是存在于葡萄、茶、咖啡中的多酚具有强烈的抗炎、抗增生、抗肿瘤等活性[18]。随着人们对肠道菌群研究的逐渐深入,不断有实验数据证明,果蔬中膳食多酚与肠道菌群间存在着密切的相互作用,受到广泛的关注。
1.1 膳食多酚对肠道菌群的影响
果蔬中多酚类物质能够通过抑制或者促进某些肠道微生物的生长来调整肠道菌群的数量和比例,优化肠道菌群结构,对人体健康产生积极作用。现有体内外实验结果表明,果蔬中的膳食多酚可选择性地抑制肠道致病菌,促进双歧杆菌等有益菌的生长,减少类杆菌、肠球菌和葡萄球菌等有害微生物的比例,使人体肠道菌群结构保持平衡[17]。例如,果蔬中橙皮素、柚皮苷、桔苷、香叶木素可对肠道细菌(大肠埃希氏菌和沙门氏菌)产生不同程度的抑制作用;单宁、红酒多酚、葡萄籽(渣)提取物能够刺激乳杆菌、双歧杆菌的增长,抑制梭状芽胞杆菌、肠杆菌、肠炎沙门氏菌、鼠伤寒沙门氏菌的生长[19-20];咖啡酸、芦丁、槲皮素可抑制大肠杆菌、金黄色葡萄球菌、鼠李糖乳杆菌等有害微生物的生长[21];花青素及其代谢产物能显著地促进双歧杆菌和乳酸链球菌的生长[22]。这些研究结果表明,不同果蔬以及果蔬中多酚结构、含量和种类都会对肠道微生物产生影响。
肠道微生物具有与宿主能量代谢、物质代谢及遗传信息转运等系列生理过程密切相关而种类繁多的酶系统,主要包括水解酶、氧化还原酶、裂解酶和转移酶。多酚则是位于小肠和结肠中一些消化酶(水解和结合酶)的基质成分[23-25],可影响肠道菌群某些酶的活性。研究发现,膳食多酚对肠道微生物酶系统的影响是通过改变肠道微生物的种类和数量,进而使微生物代谢酶的种类和数量发生相应改变;或通过与肠道中的金属离子螯合生成不溶性复合物的方式,如多酚与铁结合后可抑制某些需氧型微生物血红素的生成,使该种微生物及其酶系统受到影响[26];另外,由于多酚对金属离子的螯合作用使多种以金属离子作为辅酶的微生物酶系因缺乏辅基而无法合成[17]。由此说明,多酚不仅影响肠道微生物的数量,进而影响肠道菌群对底物残渣发酵作用,而且影响肠道菌群产生的酶系,进一步影响酶对代谢物质的转化和小肠对营养物的吸收。
另外,在一些多酚对肠道微生物抑制机理研究中发现,果蔬中的多酚物质可通过影响细菌对肠道细胞的附着力来调整肠道菌群,如原花青素B1和B2可显著增加乳酸杆菌对HT-29细胞的附着力;儿茶素能够增加干酪乳酸杆菌对结肠癌细胞的附着力[27]。同时也有研究表明,多酚物质对肠道菌群细胞膜的影响也是其抑菌的机理之一,如茶黄素和儿茶素的羟基结构可与细菌细胞膜结合,干扰细胞膜正常功能,从而达到抑制细菌的作用[17];果蔬多酚能够抑制某些革兰阳性细菌,这很可能是由于多酚或其代谢物能够与细菌细胞膜表面结合,触发过氧化氢释放,导致细胞壁破裂,达到溶菌作用[18]。在目前的机理研究中,仍有许多多酚物质对肠道菌群的作用机理尚未清晰,所以需要通过分子和基因等多层面的手段来实现对多酚影响肠道菌群机理的探究。
1.2 肠道菌群对果蔬中多酚体内代谢的影响
果蔬中多酚多与糖苷及有机酸等结合,以结合态形式存在。研究表明,口腔摄入的多酚仅有5%~10%可以被小肠吸收,而绝大部分则可抵抗胃和小肠的消化作用到达结肠进入大肠,在肠道菌群的作用下发生代谢。结合态的多酚在肠道微生物分泌的酶(α-鼠李糖苷酶、β-葡萄糖苷酶、β-葡萄糖醛酸酶)的作用下分解为游离多酚,进一步被特定微生物分解代谢[12]。果蔬中多酚对人体的生物活性作用很大程度上依赖于肠道微生物通过酯酶催化、葡萄糖酸酶催化、脱甲基化、去羟基化和脱羧等得到的代谢产物实现[28]。
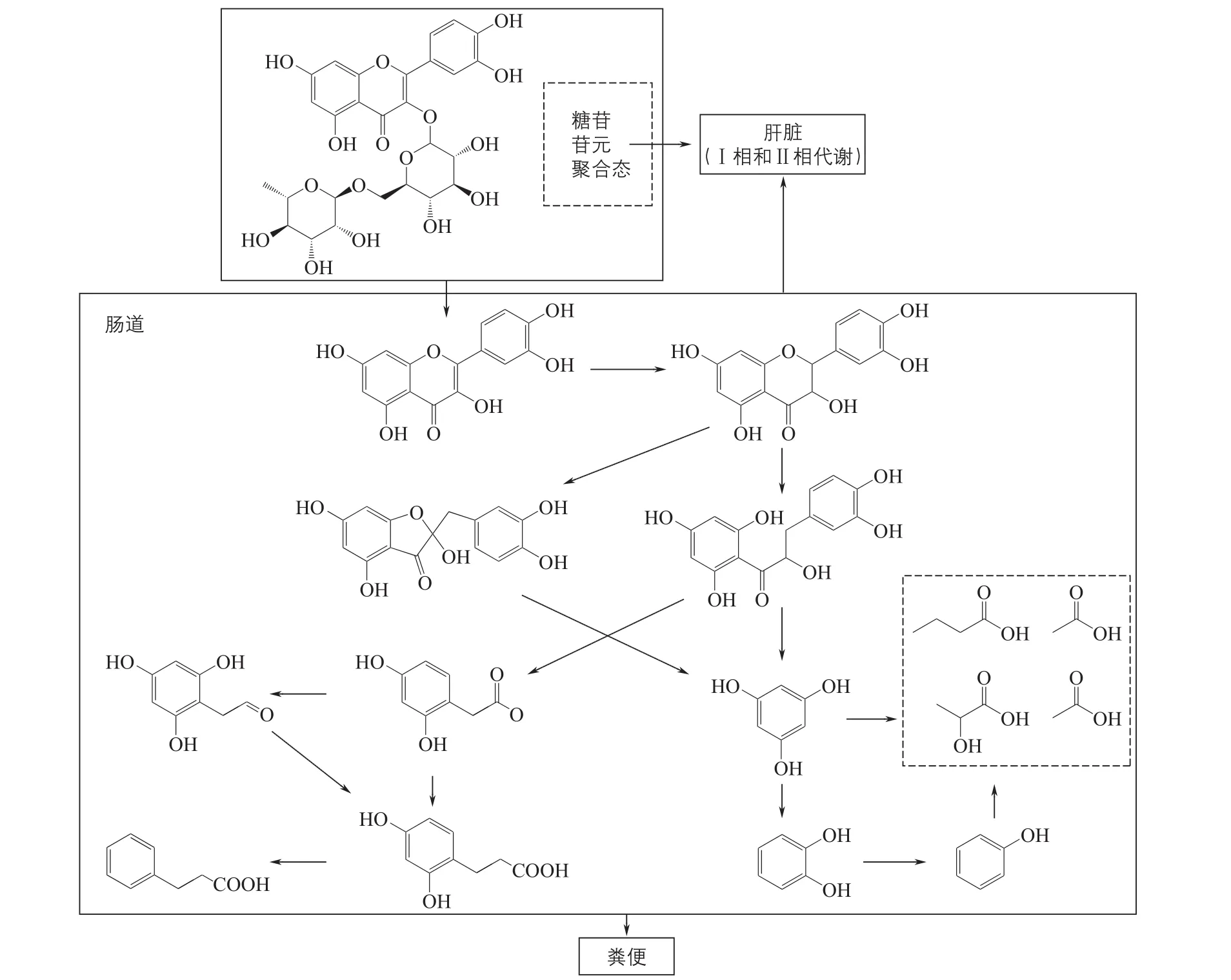
图4 膳食多酚基于肠道菌群的代谢途径
在微生物分解多酚过程中,黄酮类多酚首先发生C环裂变,然后是还原氢化、去羟基化、脱甲基化、脱羧化及异构化等反应,如黄酮醇糖甙和芦丁苷相应的糖苷配基需要肠道微生物先释放特定的酶裂解C环、脱甲基作用和脱羟基反应转换这些化合物(图4)[29]。有研究发现,多数花青素因未能被小肠上皮细胞吸收而到达结肠,在肠道菌群及其酶的作用下分解为原儿茶素、p-香豆素和香草酸等,通过代谢产物原儿茶素发挥抗炎、抗高血糖、抗肿瘤转移、保护神经等作用[17]。另外,拟杆菌、梭状芽胞杆菌可将多酚类分解产生肠内酯、肠二醇和尿胆素A等雌激素配体,可减轻更年期症状;同时,从人体分离的大肠杆菌、乳双歧杆菌(Bif dobacterium lacti)和加氏乳杆菌(Lactobacillus gasseri)能够分解绿原酸释放咖啡酸,从而产生抗金黄色葡萄球菌的功能[30-31]。以上研究结果表明,肠道微生物在果蔬中多酚物质的分解代谢和吸收方面发挥了很大的作用,尤其是其代谢物质的功能性质对人体肠道炎症及相关疾病的防治作用意义重大。
由于不同个体中肠道菌群的多样性,多酚在人体的代谢物和对人体的最终影响均会存在个体差异,在很多情况下,仅在特定菌群作用下产生的代谢产物能够被人体所吸收,进而发挥营养健康功能,若缺乏该菌群,即使补充该多酚物质,也无法发挥其功效[29]。因此,肠道菌群的多样性也是保证功能成分营养健康功能发挥的关键,同时也表明,揭示功能成分与肠道菌群间的相互作用,对果蔬营养、人体健康,乃至精准营养学的重要意义。
2 膳食纤维与肠道菌群的相互作用
膳食纤维是聚合度不小于3的非淀粉多糖的聚合物,主要来自于动植物的细胞壁,包括纤维素、半纤维素、木质素、壳聚糖、甲壳质、果胶、β-葡聚糖、菊糖和低聚糖等,通常分为非水溶性膳食纤维和水溶性膳食纤维两大类[32]。纤维素、半纤维素和木质素是常见的存在于植物细胞壁中非水溶性纤维;而果胶、树胶、β-葡聚糖和低聚糖等则是存在于动植物细胞或分泌物中的水溶性纤维。研究表明,由于人体自身缺乏相关酶,无法实现对膳食纤维的消化、吸收和利用,而肠道菌群则可产生相关酶,利用该物质进行发酵,将其分解,产生的代谢产物反过来则可调整菌群结构,维持肠道菌群微生态平衡,同时也为肠道黏膜提供能量来源。
2.1 膳食纤维对肠道菌群的影响
果蔬中大量的水溶性膳食纤维对于人体肠道菌群中益生菌的生长繁殖具有积极作用,对于调节菌群结构,保持菌群生态平衡,促进人体健康意义巨大。水溶性膳食纤维在柑橘、胡萝卜、芹菜、豆类、亚麻和燕麦糠等食物中含量丰富。其中菊粉,又称菊糖,是以块茎类植物菊苣为原料加工而成的功能性多聚果糖,也是最易溶解的水溶性膳食纤维。它存在于小麦、洋葱、香蕉中,可选择性地增加肠道中双歧杆菌和相关微生物的丰度;类似地,有研究表明健康成人志愿者连续口服菊粉约2周后,检测其肠道菌群发现,双歧杆菌数目显著增加[33]。也有研究表明,存在于洋葱、大蒜、芦笋、香蕉等果蔬中的低聚果糖、低聚木糖和低聚半乳糖等低聚糖,可以促进肠道内双歧杆菌和乳酸杆菌增殖及SCFAs含量的增加,抑制肠杆菌、沙门氏菌(Salmonella)等肠道有害菌的生长;作为婴幼儿奶粉中的益生元,可增加青春双歧杆菌、链状双歧杆菌(B. catenulatum)和普拉氏梭杆菌(Feacalibacterium prausnitzii)的数量[34-35],减少拟杆菌和肠杆菌的丰度[18]。在实际应用中,双歧杆菌低聚果糖合生元可以改善便秘人群肠道菌群失调状况,对便秘以及便秘可能诱发的心肌梗死、脑溢血等疾病具有一定防治作用[36]。
一些非水溶性纤维来自食物中的小麦糠、玉米糠、芹菜、果皮和根茎蔬菜,与可溶性膳食纤维一样,它可作为肠道菌群生长的能源物质,对于菌群的繁殖和组成影响重大,同时,有助于肠内大肠杆菌合成多种维生素,进而可影响人体的某些肠道及相关疾病,尤其可以降低患肠癌的风险。
研究发现,定植人源菌群的小鼠如果饮食中缺乏膳食纤维,其肠道菌群中微生物的多样性会显著下降,极易引发相关疾病,如果连续四代都是如此,即使恢复富含膳食纤维饮食也无法恢复菌群的原本状态[37]。所以,肠道菌群的正常结构需要随时维护,膳食纤维的缺乏可引起某个菌种的消失,而且这种消失是不可逆的,将极大危害人体健康,需要引起人们的注意。
2.2 肠道菌群对膳食纤维体内代谢的影响
由于人体自身缺乏相关酶,因此膳食纤维不能被人体消化和吸收,但是当膳食纤维进入结肠后,在肠道菌群分泌的水解酶、结合酶和氧化还原酶的作用下,被降解为多种SCFAs,被肠道菌群自身繁殖利用或被肠道细胞吸收利用。肠道厌氧菌(主要包括双歧杆菌、乳杆菌、拟杆菌)通过不同的代谢途径发酵这些膳食纤维产生的主要产物是SCFAs,包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、异己酸和己酸,其中主要的是乙酸(60%)、丙酸(16%)和丁酸(17%)(图5)。乙酸可作为胆固醇合成的最主要底物,经肝脏代谢可作为结肠上皮细胞的的能源物质,并促进细胞生长和分化;丙酸不仅可以作为能源物质,在体外实验中发现它还可以抑制胆固醇的合成,调节碳水化合物和脂肪在肝中的代谢;丁酸是人类结肠、盲肠上皮细胞最重要的能源物质,同时还能调节宿主的免疫应答和氧化应激反应,增强结肠黏膜的防御屏障,改善细胞膜通透性,进而可预防溃疡性结肠炎的发生[38-39]。例如,在体内和体外试验中都证实,菊粉来源的果聚糖能够促进肠道菌群增加丁酸盐的产生[40-41],进而可预防溃疡性结肠炎的发生[42]。由此可见,肠道菌群对膳食纤维代谢的重要影响,是实现营养物质对人体健康作用的重要途径。此外,肠道菌群影响膳食纤维代谢过程中,存在良性循环,肠道菌群-膳食纤维-肠道菌群模式,肠道微生物分解代谢膳食纤维,细菌大量繁殖,SCFAs的含量显著增加,肠腔内pH值下降,抑制致病肠杆菌生长[43],如此循环可以维持肠道的健康。
随着膳食纤维的重要性逐渐为人们所重视,各国对于膳食纤维均设定了推荐摄入量,英国建议摄入量约人均30g/d、美国FDA推荐摄入量约人均(成人)35g/d、澳大利亚推荐摄入约人均25g/d,我国建议摄入量约人均30 g/d(成长)。充足摄入膳食纤维可明显减少冠心病、癌症及炎症的发病率和死亡率。果蔬中膳食纤维占膳食纤维总量的很大一部分,随着营养保健医学的发展,人们发现大部分膳食纤维通过影响肠道菌群对人体起到多种健康保护作用,因此充分了解膳食纤维与肠道菌群的关系对人体的健康具有重大意义。
3 其他功能成分与肠道菌群的相互作用

图5 膳食纤维基于肠道菌群的代谢途径
除膳食多酚和膳食纤维外,果蔬中的蛋白质、脂质、维生素、矿物质等均会与肠道菌群发生相互作用。动物蛋白在肠道微生物的作用下分解为氨基酸,氨基酸再经肠道厌氧菌的作用可合成吲哚和多胺化合物,可引起炎症性肠道疾病,此类情况多发生在动物蛋白中[44-45];相反地,一些植物蛋白则可以增加乳酸杆菌和双歧杆菌的数量,同时肠道菌群也可分解蛋白,将约三分之一蛋白分解物转化为SCFAs,促进营养物质的消化代谢[45]。
脂类,包括ω-3、ω-6多不饱和脂肪酸,卵磷脂等,主要存在于猕猴桃、香菇、花生和核桃等,这些植物油脂不仅可以为人类提供热量和脂肪酸,而且具有特殊的生理作用,体外试验发现,多不饱和脂肪酸能够抑制益生菌鼠李糖乳杆菌的生长[46],而在另外的试验中,多不饱和脂肪酸加入到含有双歧杆菌的培养基中可以产生共轭亚油酸和共轭亚麻酸等营养元素[47],目前这类营养元素在欧美的健康食品界几乎已经成了预防现代文明病的“万灵丹”,从抗癌到预防心血管疾病、糖尿病,到体重控制上,是现代人不可或缺的健康食品[48]。
维生素广泛存在于十字花科蔬菜如大白菜、卷心菜,或草莓和柑橘类等水果中。维持健康人体所需的维生素大多由食物供给,只有极少部分可由体内肠道菌群合成,如维生素B1、维生素B2、维生素K、生物素和叶酸等,其中维生素K主要由大肠杆菌属的拟杆菌属、真细菌属和丙酸菌属(Propionibacterium)合成;双歧杆菌属和乳酸杆菌属可合成叶酸合成酶[49];枯草芽孢杆菌、大肠杆菌和沙门氏菌则可合成维生素B2[50];其他B族维生素,如维生素B1、B6和B12等也可在某种或多种菌株内合成[51]。
果蔬中矿物元素可以与肠道菌群相互影响。有研究发现,铁元素可通过铁调节蛋白2影响肠杆菌属、乳杆菌属,同时肠道菌群发酵产生的有机酸则可促进铁元素的吸收[52];果蔬中含有大量矿物元素,矿物元素对于肠道菌群的黏附作用有影响,如嗜酸乳杆菌黏附于肠道黏膜需要二价钙离子参与,而钙离子和镁离子的吸收则需要肠道微生物发酵产生的有机酸的帮助[53]。
其他活性成分也可以与肠道菌群发生相互作用。萜类化合物是精油的主要成分,有研究发现肉桂精油使小鼠结肠中的拟杆菌数量增加,但其多样性未发生显著变化,而Ⅳ簇梭菌的数量和多样性减少,改变了梭菌的组成[54];草本植物中的精油提取物有益于猪肠道微生物的生长[55]。
4 展 望
果蔬中的功能成分与肠道菌群的生态平衡密切相关,尤其是膳食多酚、膳食纤维、蛋白质、脂类以及其他功能物质对于肠道菌群的健康生长具有重要意义;同时,肠道菌群对这些成分的消化、吸收、代谢以及营养健康功能发挥了同样巨大作用。针对果蔬功能物质与肠道菌群的相互关系的研究已经取得了诸多成果,但仍存在诸多问题。如大多数研究仍然停留在体外试验或者动物肠道菌群,基于人体肠道菌群研究相对较少,缺乏临床数据;目前人们对于肠道菌群结构与组成仍然不清晰,且对于肠道菌群好坏的评价不明确;膳食成分对肠道菌群影响的量效关系缺乏系统研究,尤其是与日常摄入量的关系。此外对于膳食成分、肠道菌群以及人体健康功能间的相互作用研究,虽然已经构建了简单的关联,但其因果关系及相关的作用机制仍然不明,这将是该研究领域在将来的研究重点和难点之一。随着基因测序技术的发展,这些不明确的问题将逐渐为人们所知。
[1] HAKANSSON A,MOLIN G. Gut microbiota and inflammation[J]. Nutrients,2011,3(6):637-682.
[2] KHANNA S,TOSH P K. A clinician's primer on the role of the microbiome in human health and disease[J]. Mayo Clinic Proceedings,2014,89(1):107-114.
[3] STEPHEN A M,CUMMINGS J H. The microbial contribution to human faecal mass[J]. Journal of Medical Microbiology,1980,13(1):45-56.
[4] SOMMER F,BACKHED F. The gut microbiota-masters of host development and physiology[J]. Nature Reviews Microbiology,2013,11(4):227-238.
[5] HAYASHI H,TAKAHASHI R,NISHI T,et al. Molecular analysis of jejunal, ileal, caecal and recto-sigmoidal human colonic microbiota using 16S rRNA gene libraries and terminal restriction fragment length polymorphism[J]. Journal of Medical Microbiology,2005,54(11):1093-1101.
[6] WANG M,AHME S,JEPPSSON B,et al. Comparison of bacterial diversity along the human intestinal tract by direct cloning and sequencing of 16S rRNA genes[J]. FEMS Microbiology Ecology,2005,54(2):219-231.
[7] SAARELA M,LAHTEENMAKI L,CRITTENDEN R,et al. Gut bacteria and health foods-the European perspective[J]. International Journal of Food Microbiology,2002,78(1):99-117.
[8] DEL RIO D,RODRIGUEZ-MATEOS A,SPENCER J P E,et al. Dietary(poly)phenolics in human health:structures, bioavailability,and evidence of protective effects against chronic diseases[J]. Antioxidants & Redox Signaling,2013,18(14):1818-1892.
[9] SHEN S,WONG C H. Bugging inflammation:role of the gut microbiota[J]. Clinical & Translational Immunology,2016,5(4):e72.
[10] MARTINEZ I,KIM J,DUFFY P R,et al. Resistant starches types 2 and 4 have differential effects on the composition of the fecal microbiota in human subjects[J]. PloS One,2010,5:e15046.
[11] DUDA-CHODAK A,TAKO T,SATORA P,et al. Interaction of dietary compounds,especially polyphenols,with the intestinal microbiota:a review[J]. European Journal of Nutrition,2015,54(3):325-341.
[12] CRACIUN S,BALSKUS E P. Microbial conversion of choline totrimethylamine requires a glycyl radical enzyme[J]. Proceedings of the National Academy of Sciences the United States of America,2012,109(52):21307-21312.
[13] KADOTA H,ISHIDA Y. Production of volatile sulfur compounds by microorganisms[J]. Annual Reviews in Microbiology,1972,26(1):127-138.
[14] IGARASHI K,KASHIWAGI K. Modulation of cellular function by polyamines[J]. The International Journal of Biochemistry & Cell Biology,2010,42(1):39-51.
[15] DEN BESTEN G,VAN EUNEN K,GROEN A K,et al. The role of short-chain fatty acids in the interplay between diet,gut microbiota,and host energy metabolism[J]. Journal of Lipid Research,2013,54(9):2325-2340.
[16] WANG Z,KLIPFELL E,BENNETT B J,et al. Gut f ora metabolism of phosphatidylcholine promotes cardiovascular disease[J]. Nature,2011,472(7341):57-63.
[17] 杨华,叶发银,赵国华. 膳食多酚与肠道微生物相互作用研究进展[J]. 食品科学,2015,36(3):223-226.
[18] O’KEEFE S J D. Diet,microorganisms and their metabolites,and colon cancer[J]. Nature Reviews Gastroenterology & Hepatology,2016,13(12):691-706.
[19] SMITH A H,ZOETENDAL E,MACKIE R I. Bacterial mechanisms to overcome inhibitory effects of dietary tannins[J]. Microbial Ecology,2005,50(2):197-205.
[20] DOLARA P,LUCERI C,CRESCI A,et al. Red wine polyphenols inf uence carcinogenesis,intestinal microf ora,oxidative damage and gene expression prof les of colonic mucosa in F344 rats[J]. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,2005,591(1):237-246.
[21] LEE H C,JENNER A M,Low C S,et al. Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota[J]. Research in Microbiology,2006,157(9):876-884.
[22] HIDALGO M,ORUNA-CONCHA M J,KOLIDA S,et al. Metabolism of anthocyanins by human gut microflora and their influence on gut bacterial growth[J]. Journal of Agricultural and Food Chemistry,2012,60(15):3882-3890.
[23] YEH C T,YEN G C. Effects of phenolic acids on human phenolsulfotransferase in relation to their antioxidant activity[J]. Journal of Agricultural and Food Chemistry,2003,51(15):1474-1479.
[24] RECHNER A R,KUHNLE G,BREMNER P,et al. The metabolic fate of dietary polyphenols in humans[J]. Free Radical Biology and Medicine,2002,33(2):220-235.
[25] RECHNER A R,SPENCER J P E,KUHNLE G,et al. Novel biomarkers of the metabolism of caffeic acid derivatives in vivo[J]. Free Radical Biology and Medicine,2001,30(11):1213-1222.
[26] RASMUSSEN S E,FREDERIKSEN H,STRUNTZE K K,et al. Dietary proanthocyanidins:occurrence,dietary intake,bioavailability,and protection against cardiovascular disease[J]. Molecular Nutrition & Food Research,2005,49(2):159-174.
[27] BUSTOS I,GARCIA-CAYUELA T,HERNANDEZ-LEDESMA B,et al. Effect of f avan-3-ols on the adhesion of potential probiotic Lactobacilli to intestinal cells[J]. Journal of Agricultural and Food Chemistry,2012,60(36):9082-9088.
[28] POSSEMIERS S,BOLCA S,VERSTRAETE W,et al. The intestinal microbiome:a separate organ inside the body with the metabolic potential to inf uence the bioactivity of botanicals[J]. Fitoterapia,2011,82(1):53-66.
[29] DUDA-CHODAK,TARKO T,SATORA P,et al. Interaction of dietary compounds,especially polyphenols,with the intestinal microbiota:a review[J]. European Journal of Nutrition,2015,54(3):325-341.
[30] CLAVEL T,HENDERSON G,BLAUT M,et al. Intestinal bacterial communities that produce active estrogen-like compounds enterodiol and enterolactone in humans[J]. Applied and Environmental Microbiology,2005,71(10):6077-6085.
[31] LANDETE J M. Plant and mammalian lignans:a review of source,intake,metabolism,intestinal bacteria and health[J]. Food Research International,2012,46(1):410-424.
[32] 李建文,杨月欣. 膳食纤维定义及分析方法研究进展[J]. 食品科学,2007,28(2):350-355.
[33] KOLEVA P T,VALCHEVA R S,SUN X,et al. Inulin and fructooligo-saccharides have divergent effects on colitis and commensal microbiota in HLA-B27 transgenic rats[J]. British Journal of Nutrition,2012,108(9):1633-1643.
[34] DAVIS L M G,MARTINEZ I,WALTER J,et al. A dose dependent impact of prebiotic galactooligosaccharides on the intestinal microbiota of healthy adults[J]. International Journal of Food Microbiology,2010,144(2):285-292.
[35] DAVIS L M G,MARTINE I,WALTER J,et al. Barcoded pyrosequencing reveals that consumption of galactooliosccharides results in a highly specif c bif dogenic response in humans[J]. PloS One,2011,6(9):e25200.
[36] CHEN Y L,LIAO F H,LIN S H,et al. A prebiotic formula improves the gastrointestinal bacterial f ora in toddlers[J]. Gastroenterololgy Research and Practice,2016,2016(1):1-6.
[37] RAMIREZ-FARIAS C,SLEZAK K,FULLER Z,et al. Effect of inulin on the human gut microbiota:stimulation of Bif dobacterium adolescentis and Faecalibacterium prausnitzii[J]. British Journal of Nutrition,2009,101(4):541-550.
[38] FLINT H J. The impact of nutrition on the human microbiome[J]. Nutrition Reviews,2012,70(1):10-13.
[39] FLINT H J,SCOTT K P,DUNCAN S H,et al. Microbial degradation of complex carbohydrates in the gut[J]. Gut Microbes,2012,3(4):289-306.
[40] DUNCAN S H,LOUIS P,FLINT H J. Lactate-utilizing bacteria,isolated from human feces,that produce butyrate as a majorfermentation product[J]. Applied and Environmental Microbiology,2004,70(10):5810-5817.
[41] BELENGUER A,DUNCAN S H,CALDER A G,et al. Two routes of metabolic cross-feeding between Bif dobacterium adolescentis and butyrate-producing anaerobes from the human gut[J]. Applied and Environmental Microbiology,2006,72(5):3593-3599.
[42] 钟海平,郑红斌. 丁酸在溃疡性结肠炎中的作用概述[J]. 中医临床研究,2011,3(9):113-115.
[43] GREEN C J. Fibre in enteral nutrition[J]. Clinical Nutrition,2001,20(1):23-39.
[44] TIIHONEN K,OUWEHAND A C,RAUTONEN N. Effect of overweight on gastrointestinal microbiology and immunology:correlation with blood biomarkers[J]. British Journal of Nutrition,2010,103(7):1070-1078.
[45] 石塔拉,高蔚娜,郭长江. 膳食成分与肠道菌群相互作用[J]. 营养学报,2016,38(6):530-536.
[46] KANKAANPAA P,YANG B,KALLIO H,et al. Effects of polyunsaturated fatty acids in growth medium on lipid composition and on physicochemical surface properties of Lactobacilli[J]. Applied and Environmental Microbiology,2004,70(1):129-136.
[47] GORISSEN L,DE VUYST L,RAES K,et al. Conjugated linoleic and linolenic acid production kinetics by Bif dobacteria differ among strains[J]. International Journal of Food Microbiology,2012,155(3):234-240.
[48] 王璇琳,檀英霞,郁成雨,等. 自制酸奶乳脂中c9,t11-共轭亚油酸对小鼠免疫调节作用的影响[J]. 食品科学,2010,31(5):288-292.
[49] LAINO J E,LEBLANC J G,SAVOY DE GIORI G. Production of natural folates by lactic acid bacteria starter cultures isolated from artisanal Agrentinean yogurts[J]. Canadian Journal of Microbiology,2012,58(5):581-588.
[50] MAGNUSDOTTIR S,RAVCHEEV D,DE CRECY-LAGARD V,et al. Systematic genome assessment of B-vitamin biosynthesis suggests cooperation among gut microbes[J]. Frontiers in Genetics,2015,6(148):148.
[51] PLOUX O,SOULARUE P,MARQUET A,et al. Investigation of the f rst step of biotin biosynthesis in Bacillus sphaericus:purif cation and characterization of the pimeloyl-CoA synthase,and uptake of pimelat[J]. Biochemical Journal,1992,287(3):685-690.
[52] BUHNIK-ROSENBLAU K,MOSHE-BELIZOWSKI S,DANINPOLEG Y,et al. Genetic modification of iron metabolism in mice affects the gut microbiota[J]. Biometals,2012,25(5):883-892.
[53] 张董燕,季海峰,徐炜玲. 益生菌对动物肠道微生物生态学影响的研究进展[J]. 中国畜牧兽医,2007,34(3):15-18.
[54] 彭喜春,张志超,刘柳,等. 肉桂精油对大鼠肠道梭菌属Ⅳ簇菌群和拟杆菌群的影响[J]. 中草药,2013,44(4):437-442.
[55] COSTA L B,LUCIANO F B,MIYADA V S,et al. Herbal extracts and organic acids as natural feed additives in pig diets[J]. South African Journal of Animal Science,2013,43(2):181-193.
Research progress of interactions between functional components of fruits/vegetables and gut microbiota
WANG Feng,ZHAO Chengying,TIAN Guifang,ZHENG Jinkai
Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Key Laboratory of Agro-products Processing, Ministry of Agriculture, Beijing 100193, China
Fruits and vegetables, rich in various components with potent nutritional and healthy functions, are important in daily diet. They play a crucial role in health maintaining and disease prevention. Increasing researches demonstrate that many of the human body benef t functions of functional components in fruits and vegetables are associated with interactions with gut microbiota. Herein, the research progress of interactions between functional components of fruits and vegetables and gut microbiota is comprehensively discussed from two aspects. One is the effects of the components on composition and amount of gut microbiota, and the consequent effects on human body. The other is the inf uence of gut microbiota on the in vivo metabolism and human body benef t functions of the components in fruits and vegetables. The relationship between functional components of fruits and vegetables, gut microbiota and human healthy functions is also discussed. These would provide important references for revealing the mechanism of nutrition and health of fruits and vegetables, as well as for human reasonable diet.
fruits and vegetables; polyphenols; dietary f ber; gut microbiota; nutrition and health
10.3969/j.issn.1674-0319.2017.04.008
王凤,博士研究生。研究方向:果蔬黄酮的营养健康机制。
E-mail:411517552@qq.com
赵成英,博士后。主要研究方向:果蔬功能成分与肠道菌群的相互作用机制。E-mail:zcyzhaocy@sina.com
田桂芳,助理研究员。研究方向:农产品加工利用。E-mail:tiangui fang @caas.cn
国家自然科学基金青年项目(31401581)
