泄浊排毒方对慢性肾脏病大鼠模型蛋白结合型尿毒症毒素清除的影响*
2017-08-16戴铭卉
戴铭卉 孔 薇
(江苏省南京市中医院,江苏 南京 210001)
·研究报告·
泄浊排毒方对慢性肾脏病大鼠模型蛋白结合型尿毒症毒素清除的影响*
戴铭卉 孔 薇
(江苏省南京市中医院,江苏 南京 210001)
目的观察泄浊排毒方对慢性肾脏病模型大鼠代谢毒素尤其是蛋白结合型毒素的影响及优势。方法将32只SD大鼠随机分为4组:空白组、模型组、腹膜透析组、泄浊排毒方组,各组按相应药物剂量灌胃,腹透;造模第8周末检测各组血清尿素、肌酐、尿酸、胱抑素C含量,运用高效液相色谱-荧光检测法检测血清硫酸吲哚酚含量。结果与空白对照组相比,模型组血清尿素、肌酐含量明显升高(P<0.05);与模型组相比,泄浊排毒方组尿素、肌酐、尿酸、胱抑素C含量明显降低(P<0.05);与腹透组相比,泄浊排毒方组尿素、胱抑素C、尿酸含量明显降低(P<0.05);与模型组相比,泄浊排毒方组硫酸吲哚酚含量明显降低 (P<0.05);与腹透组相比,泄浊排毒方硫酸吲哚酚含量明显降低(P<0.05)。结论泄浊排毒方可清除尿毒症毒素,延缓肾损害进展,其原因可能与蛋白结合型代谢毒素的清除有关。
泄浊法 慢性肾脏病 尿毒症毒素
慢性肾脏病是多种因素引起的肾脏功能障碍和(或)结构改变所导致的一系列临床综合征。近年来成为严重损害人类健康的慢性杀手[1]。慢性肾脏病患者的肾功能不断减退,具有毒性的代谢产物因无法排出而潴留在机体内,导致各种病理改变。这些代谢废物通称为尿毒症毒素,主要分为4类:小分子毒素、中分子毒素、与蛋白结合的小分子化合物、蛋白质等。肾替代是慢性肾脏病的常用治疗手段,如血液透析,腹透透析等,成本均较高,且对于蛋白结合型毒素清除率较低,易影响患者生活质量。传统中医典籍中并无慢性肾脏病病名的记载,临床症状散见于“水肿”“癃闭”“关格”等病证中。慢性肾脏病最重要病机是浊毒内蕴,也是影响预后的主要因素。因此笔者根据《黄帝内经》中“开鬼门,洁净府,去菀陈莝”的理论为治则,予泄浊排毒方治疗慢性肾脏病,清除硫酸吲哚酚等蛋白结合型尿毒症毒素取得良好疗效。本研究通过观测泄浊排毒方对各类型尿毒症毒素的影响差异,探索中医药治疗慢性肾脏病的作用靶点,为临床治疗提供新思路。
1 材料与方法
1.1 实验动物
清洁级雄性SD大鼠32只,体质量(180±30)g,由南京中医药大学动物实验中心提供,动物许可证号:SCXK(浙)2014-0001。
1.2 药物与试剂
泄浊排毒方(组成:生大黄、生牡蛎、蒲公英、生槐米、六月雪、附子,为江阴天江药业有限公司生产的中药颗粒剂);2.5%腹膜透析液(广州百特医疗用品有限公司);硫酸吲哚酚标准品(美国Sigma公司);腺嘌呤(美国AMRESCO公司);甲醇 (山东瑞星化工有限公司);乙腈(德国Merck公司);三氟乙酸(济南瑞福化工有限公司);
1.3 主要仪器
Waters515型高效液相色谱仪,配717型自动进样器、2475型荧光检测器 (美国Waters公司)、BDSHy-Persil C18色谱柱 (大连依利特)、METTLER TOLEDO AL-204电子分析天平(梅特勒仪器上海有限公司)
1.4 分组与造模
按照随机数字表随机分为空白组、模型组、泄浊排毒方组、腹透组。每组8只,于温度、湿度恒定的动物房中适应性饲养1周。从实验第1天开始,除了空白对照组,其余各组大鼠每日上午灌服腺嘌呤,剂量200mg/(kg·d),至第4周结束。第4周末,每组随机抽取2只大鼠,目内眦取血,检测肌酐、尿素水平,提示造模成功[2]。从第5周开始除了空白组,其余各组大鼠隔日上午灌服腺嘌呤,剂量200mg/(kg·d),至第7周结束。第8周开始各组均停止腺嘌呤灌服。整个实验过程所有大鼠进水及饮食均不受限制。
1.5 给药方法
实验开始后第1天根据分组分别给予相应药物干预,根据药理学实验动物给药方法,均以成人剂量(70 kg/d)的6.3倍药量,即泄浊排毒方颗粒剂(生大黄2.31 g/d,附子0.56 g/d,生槐花2.1 g/d,六月雪0.35 g/d,蒲公英1.4 g/d,生牡蛎0.175 g/d)。以上中药颗粒溶于80mL蒸馏水中制成混悬液,予泄浊排毒方组大鼠灌胃10mL/d,连续8周。腹透组大鼠右下腹注入2.5%腹膜透析液,20mL/d,连续8周[3]。模型组大鼠自实验开始的第1天,予蒸馏水10 mL/d灌胃,每天1次,连续8周。空白组大鼠自实验开始的第1天,予蒸馏水10mL灌胃,每天2次,至第4周末。自第5周开始,隔日上午予蒸馏水10mL灌胃,每天下午予蒸馏水10mL灌胃,至第7周末。第8周予每天下午蒸馏水10mL灌胃。
1.6 标本采集与检测
第8周末采集标本,提前禁食、禁水12 h。0.3mL/ 100 g 10%水合氯醛腹腔注射麻醉,随后予腹主动脉采血,保存于无肝素采血管中,静置20min,3000 r/min离心10min后送检;采血结束后摘取肾脏,矢状面剖开,4%中性甲醛固定24 h,制作病理切片,HE染色备用。
1.6.1 生化检测 大鼠尿素、肌酐、尿酸、胱抑素C委托南京中医药大学第三附属医院检验科检测。
1.6.2 硫酸吲哚酚检测 采用高效液相色谱-荧光分析法。1)标准品储存液的制备。甲醇溶解并定容硫酸吲哚酚钾盐对照品23.71 mg,配得硫酸吲哚酚浓度为800μg/mL的贮备液,用乙腈稀释成最终质量浓度分别为80,40,20,10,5,0.5,0.1μg/mL的贮备液备用。2)色谱条件。流动相为磷酸二氢钠缓冲液(0.1%三氟乙酸,pH2.5)-乙腈(92∶8);流速1.0mL/min;柱温30℃;样品温度6℃;检测波长:λex=280 nm,λem=390 nm。3)样品处理方法:3000 r/min离心10 min分离血清,-20℃保存。小心吸取血清100μL于干净试管中,加入300μL 0.2%三氟乙酸-乙腈(10∶90)沉淀蛋白,漩涡混匀30 s后离心(12000 r/min,8 min,4℃),吸取上层清液200μL,微孔滤膜滤过后进行分析。
1.6.3 肾小管间质纤维化指数(TIFI) TIFI根据纤维化程度分为4级(0~3级)。具体评分方法如下(20倍目镜下)。1)0级,表示无明显小管间质病变;2)1级,表示病变程度小于25%;3)2级,即灶状损伤,病变程度25%~75%;4)3级,即多灶状损伤,代表病变程度大于75%。分值由低到高,提示肾小管间质纤维化由轻到重。以上分析均由未知分组的南京中医药大学第三附属医院病理科完成。TIFI=[(1×X1+2×X2+3×X3)/10](X表示病变肾小管间质视野数)
1.7 统计学处理
2 结 果
2.1 各组大鼠一般情况
空白组大鼠动作敏捷,无脱毛,体质量增长正常,尿量少,色淡黄,大便成形偏硬,饮水饮食正常,实验过程中死亡1只。模型组大鼠渐出现精神萎靡,反应迟钝,活动迟缓,皮毛无光泽,毛量偏少,食欲差,饮水量多,尿量多,大便稀,体质量增长缓慢。实验过程中死亡2只。腹透组整体状况与模型组相比有改善,实验过程死亡2只。泄浊排毒方组在毛色、精神状态、活动性、体质量方面较模型组明显改善。实验过程死亡2只。
2.2 各组大鼠生化指标
见表1。与空白组相比,模型组血清尿素、肌酐含量明显升高(P<0.05);与模型组相比,腹透组尿素、肌酐、胱抑素C含量明显降低(P<0.05);与模型组相比,泄浊排毒方组尿素、肌酐、尿酸、胱抑素C含量明显降低(P<0.05);与腹透组相比,泄浊排毒方尿素、胱抑素C、尿酸含量明显降低(P<0.05)。
表1 泄浊排毒方对慢性肾脏病大鼠尿素、肌酐、尿酸及胱抑素C的影响(±s)
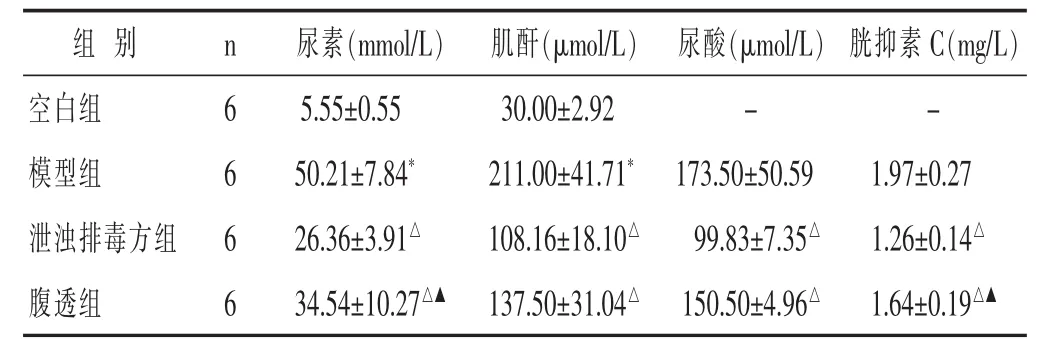
表1 泄浊排毒方对慢性肾脏病大鼠尿素、肌酐、尿酸及胱抑素C的影响(±s)
与空白组比较,*P<0.05;与模型组比较,△P<0.05:与泄浊排毒方组比较,▲P<0.05。下同。
组 别 n 尿素(mmol/L) 肌酐(μmol/L) 尿酸(μmol/L)胱抑素C(mg/L)空白组 6模型组 6泄浊排毒方组 6 5.55±0.55 30.00±2.92 - -50.21±7.84*211.00±41.71*173.50±50.59 1.97±0.27 26.36±3.91△108.16±18.10△99.83±7.35△1.26±0.14△腹透组 634.54±10.27△▲137.50±31.04△150.50±4.96△1.64±0.19△▲
2.3 各组大鼠硫酸吲哚酚测定结果比较 见表2。与模型组相比,泄浊排毒方组硫酸吲哚酚含量明显降低(P<0.05);与腹透组相比,泄浊排毒方硫酸吲哚酚含量明显降低(P<0.05)。
表2 各组大鼠硫酸吲哚酚测定结果比较(±s)

表2 各组大鼠硫酸吲哚酚测定结果比较(±s)
组别 n IS模型组 6泄浊排毒方组 6 44.15±16.41 18.14±4.90△腹透组 637.28±10.03▲
2.4 各组大鼠肾脏病理指标
2.4.1 肉眼观察 空白组大鼠肾脏蚕豆大小,暗红色,质韧光滑。其余组大鼠肾脏明显肥大,色白,粗糙不平。
2.4.2 光镜观察 见图1。光镜下空白组大鼠未见硬化肾小球;其余各组大鼠肾脏产生腺嘌呤异物肉芽肿,大量炎症细胞浸润,肾间质。纤维化,肾小管囊性扩张,毛细血管数量减少,大量管腔闭塞,系膜增生明显,以上变化符合腺嘌呤模型大鼠肾脏病理变化[4]。模型组大鼠肾脏病理改变最明显。
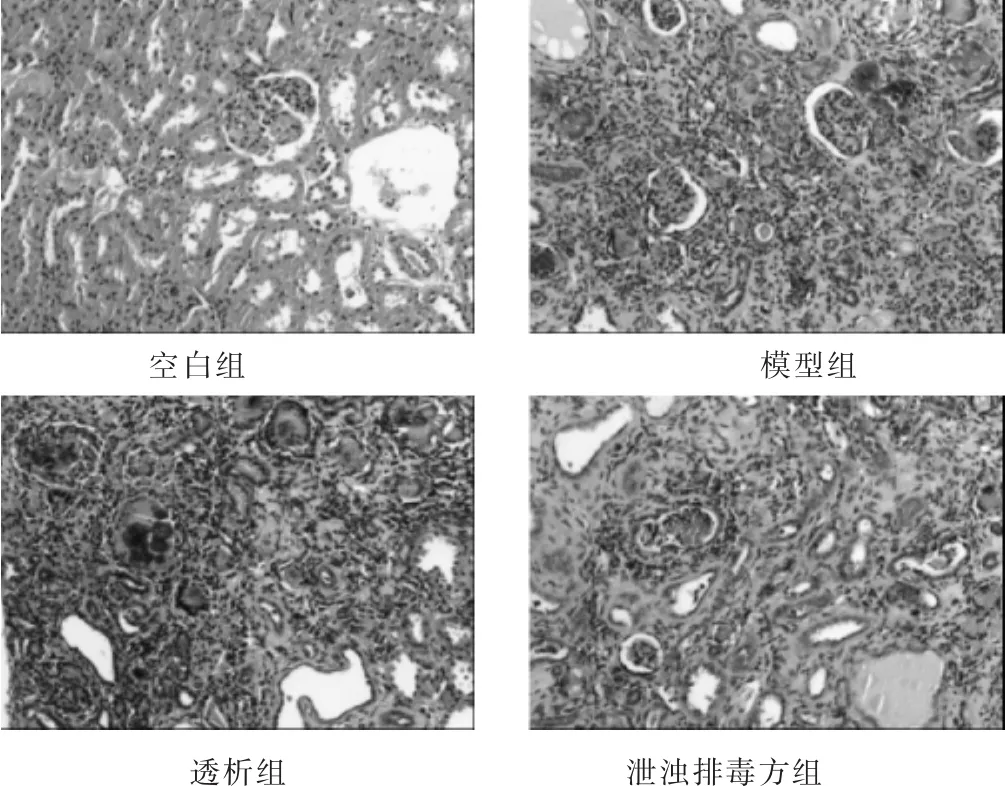
图1 各组大鼠肾脏组织(HE染色,200倍)
2.4.3 各组大鼠TIFI比较 见表3。泄浊排毒方组和腹透组TIFI均较模型组低(均P<0.05)。
表3 各组大鼠TIFI比较(±s)

表3 各组大鼠TIFI比较(±s)
组别 n TIFI模型组 6泄浊排毒方组 6 25.33±1.21 12.00±0.89△腹透组 618.00±0.63△
3 讨 论
临床近半数的慢性肾脏病患者首诊于消化科,原因是此类患者通常会出现腹痛腹胀,食欲不振,大便稀溏等症状。根据辨证,属于湿浊、浊毒范畴。因此,及时予以药物泄浊排毒,清除肠道毒素蓄积是治疗慢性肾脏病的关键。
本方紧扣“浊毒”病机以大黄为君药,共襄清热泄浊利湿之举。大黄是清热泻下的要药,现代药理研究发现,大黄可降低血氨及肝脏荷尔蒙生成;机体氮质的再利用率也可因大黄增强谷氨酰胺合成酶的活性而提高;大黄可以抑制炎症浸润,抑制促纤维化因子,延缓肾组织纤维化,下调残肾代谢率[5-7]。同时,牡蛎有收敛固涩的功效;附子能促进血尿素氮的排泄,改善电解质紊乱;槐花清热凉血;蒲公英、六月雪清热解毒利湿;诸药合用,附子燥热得制,大黄无泻下过度之虞。实验显示,泄浊排毒方组较模型组,硫酸吲哚酚含量有明显差异,提示泄浊排毒方可降低大鼠血清中硫酸吲哚酚含量。表明泄浊排毒方对此类蛋白结合型尿毒症毒素的清除具有一定优势。体现了标本并治的原则,达到延缓肾损害进展的目的。
当前尿毒症毒素研究的难点与热点是蛋白结合型毒素,这类毒素因为可与白蛋白紧密结合而使得常用的血液透析等治疗方法难以将其清除,随着疾病的发展不断于机体内累积,造成一系列的临床症状及多系统受累。硫酸吲哚酚属于吲哚类蛋白结合型毒素的代表之一。机体摄入的食物中含有色氨酸,这类氨基酸是硫酸吲哚酚的来源。肠道与肝脏是机体合成硫酸吲哚酚最主要的两个脏器。吲哚酚是色氨酸侧链被大肠埃希菌在结肠中氧化后的产物。结肠把大量此类氧化产物重新吸收,进入肝脏,硫酸盐酯化吲哚酚后生成硫酸吲哚酚。健康人群血清硫酸吲哚酚浓度通常不大于1.9μmol/L。肾脏是硫酸吲哚酚最主要的排泄器官。模型组大鼠肾脏病理示严重肾脏间质纤维化。根据近期研究结论,慢性肾脏病的进展速度,肾脏功能的损伤程度,均与肾间质纤维化正相关。肾小管上皮细胞中得细胞因子基因表达上调,促进转化生长因子,单核细胞趋化和激活因子诱导肾小管上皮细胞产生转化,细胞外基质沉积增多。硫酸吲哚酚正是通过活化肾脏局部多种炎症细胞浸润,从而达到加速间质纤维化的肾毒性作用[8]。此外,硫酸吲哚酚亦能遏制促红细胞生成素的生成,加重肾性贫血。慢性肾脏病患者致死的首要并发症是心血管意外。多数蛋白结合型尿毒症毒素同时具有心血管毒性,其中便包括硫酸吲哚酚[9]。其诱使全身氧化应激反应是机体动脉硬化的中心环节[10]。严重影响慢性肾脏病患者的远期预后。泄浊类中药因具有导泻、吸附[11]、活血、排毒等功效而被经常用于慢性肾脏病的中医临床治疗中。大黄作为其中应用最为广泛的一味中药,除具上述作用外,更因其富含多糖等数种益肾成分[12],成为治疗慢性肾脏病的要药及研究热点。
然而,中医药改善肾脏功能的机制长久以来缺乏系统深入的研究,多从治疗经验以及药物性味推导而来。实验结果显示泄浊排毒方在降低慢性肾脏病大鼠血清肌酐水平方面与腹膜透析无明显差异,但对于降低硫酸吲哚酚的作用却优于腹膜透析,提示对于蛋白结合类毒素的有效清除可能是泄浊排毒方延缓肾损害的原因。可能与以下机制相关:1)大黄可改善消化道微循环,增加局部血流灌注,提高血浆渗透压,降低毛细血管通透性,降低肠道缺血性损伤的发生率。2)抗自由基,防止多脏器功能衰竭。3)大剂量大黄作用于胃肠黏膜引起强烈的人工炎症,导致肠膜黏上皮细胞大量增生,绒毛融合,大量炎细胞浸润,肠腔内黏液的分泌功能增强,在胃肠黏膜表面形成保护膜促进肠黏膜杯状细胞的增生[13]。4)大黄能够抑制大肠杆菌等肠道条件致病菌和肠球菌等有害菌,显著降低体内内毒素水平。大黄作为清热泻下的代表药物,可刺激肠蠕动,增强胃肠道运动功能[14]。
实验以腹膜透析作为对照组。腹膜透析是终末期肾脏病患者肾替代治疗常用治疗手段,具有易于操作,对血流动力学影响较小的优势,对蛋白结合类毒素具有一定的清除效果,毒素代谢的方式是可能原因[15]。
泄浊排毒方可以降低慢性肾脏病大鼠尿毒症毒素水平,尤其在硫酸吲哚酚的清除方面具有一定优势,也为中药清除蛋白结合型毒素提供了新的思路。
[1] 赖玮婧,刘芳,付平.慢性肾脏病评估及管理临床实践指南解读——从K/DOQI到KDIGO[J].中国实用内科杂志,2013,33(6):448-450.
[2] Zaerie M,De Vriese AS,Hekking LH,et al.Immuno-Patholoical changes in a uraemic ratmodel for peritoneal dialys IS[J].Ne PhrolDial Trans Plant,2005,20(7):1350-1361.
[3] 郭小云,夏天.VEGF在腹膜透析模型大鼠中的表达及意义[J].河北北方学院学报:医学版,2010,27(4):9-11.
[4] 郑平东,朱燕俐,丁名城,等.用腺嘌呤制作慢性肾功能衰竭动物模型[J].中华肾脏病杂志,1989,5(6):342-344.
[5] 苏健,殷立平,张鑫,等.大黄酸对慢性移植肾肾病大鼠肾组织抗纤维化因子表达的影响[J].中国临床药理学与治疗学,2011,16(10):1114-1120.
[6] 张丽萍,尚春娥.尿毒清颗粒治疗慢性肾衰竭疗效观察[J].中国中医急症,2006,15(3):250-257.
[7] 何东元,王笑云,王宁宁,等.大黄酸抑制肾成纤维细胞激活的试验研究[J].中华肾脏病杂志,2006,22(2):95-108.
[8] Sun CY,Chang SC,Wu MS.Uremic toxins induce kidneyfibrosis by activating intrarenal rennin-angiotensin-aldosteronesystem associated ePithelial-to-mesenchymal transition[J].Plo Sone,2012,7(3):e34026
[9] Jourde-Chiche N,Dou L,CeriniC.Protein-bound toxins-update2009[J].Seminars in Dialysis,2009,22(4):334.
[10]Shimizu H,Hirose Y,Goto S,etal.Indoxyl sulfate en-hances angiotensinⅡsignaling through uPregulation of epidermalgrowth factor receptor expression in vascular smoothmusclecells[J].Life sciences,2012,91(5-6):172.
[11]彭涛,胡昭.中药灌肠在慢性肾衰竭中的治疗作用[J].江西医药,2005,40(3):130-131.
[12]林茵绿,杜顺福,蔡元坤.大黄对重症急性胰腺炎大鼠肠道屏障功能保护的实验研究[J].河北中医,2002,24(11):875-878.
[13]王娴.中药灌肠治疗慢性肾功能衰竭的研究进展[J].护理研究,2008,22(3):587-589.
[14]国家中医药管理局中华本草编委会.中华本草[M].上海:上海科学技术出版社,2009:38-40.
[15]Pham NM,Recht NS,Hostetter TH,etal.Removal of theprotein-bound solutes indican and P-cresol sulfate by Peritonealdialysis[J].Clinical Journalof the American Society of NePhrology,2008,3(1):85.
Effects of Xiezhuo Paidu Decoction on Protein Bound Urem ia Toxin in Ratsw ith Chronic K idney Disease
DAIMinghui,KONGWei.Nanjing Hospital of Traditional Chinese Medicine,Jiangsu Province,Jiangsu,Nanjing 210001,China.
Objective:To study the regulatory effects and advantages of Xiezhuo Paidu Decoction on protein bound uremia toxin in ratswith chronic kidney disease.M ethods:32 SD ratswere divided in to the blank group,themodel group,peritoneal dialysis group and Xiezhuo Paidu Decoction group.Each group
gavage and peritoneal dialysis according to the corresponding dose.After 56 days’treatment,serum urea,creatinine,uric acid,Cystatin C were measured,and the content of indoxyl sulfate in serum was determined by HPLC-MS.Results:Compared with the blank control group,the serum urea and creatinine levels in themodel group increased significantly(P<0.05).Compared with the model group,the contents of urea,creatinine,uric acid and cystatin C decreased significantly in Xiezhuo Paidu Decoction group(P<0.05).Compared with the peritoneal dialysis group,the contents ofurea,cystatin C and uric acid decreased significantly in Xiezhuo Paidu Decoction group(P<0.05).Compared with themodel group and the peritoneal dialysis group,the contentof indoxyl-sulfate decreased obviously in Xiezhuo Paidu Decoction group(P<0.05).Conclusions:Xiezhuo Paidu Decoction can clear uremic toxins and delay the progression of renal damage,whichmay be related to the elimination ofprotein boundmetabolic toxins.
Xiezhuo Method;Chronic kidney disease;Uremia toxin
R285.5
A
1004-745X(2017)07-1160-04
10.3969/j.issn.1004-745X.2017.07.009
2017-04-19)
江苏省南京市科技发展计划项目(201503032)
△通信作者(电子邮箱:kw-9009@163.com)
