加味大承气汤对急性胰腺炎模型大鼠血清炎症因子及细胞凋亡的影响*
2017-08-16郇义超赵
郇义超赵 佳
(1.辽宁省沈阳市骨科医院,辽宁 沈阳 110044;2.辽宁电力中心医院,辽宁 沈阳 110006)
·研究报告·
加味大承气汤对急性胰腺炎模型大鼠血清炎症因子及细胞凋亡的影响*
郇义超1赵 佳2
(1.辽宁省沈阳市骨科医院,辽宁 沈阳 110044;2.辽宁电力中心医院,辽宁 沈阳 110006)
目的观察加味大承气汤对急性胰腺炎模型大鼠血清炎症因子及细胞凋亡的影响。方法50只SD大鼠随机分为5组,每组10只,分别为空白对照组、模型对照组、加味大承气汤低、中、高剂量组,经胰胆管逆行注射牛磺胆酸钠建立急性胰腺炎大鼠模型。空白对照组和模型对照组给予蒸馏水灌胃,加味大承气汤低中高剂量组给予相应剂量中药煎煮液灌胃。灌胃24 h后观察胰腺组织病理学变化,比较大鼠小肠黏膜厚度、绒毛高度和上皮损伤指数,血清炎症因子白介素-1β(IL-1β)、白介素6(IL-6)和肿瘤坏死因子α(TNF-α)水平,大鼠腹水量、血清淀粉酶和脂肪酶含量,苷酸结合寡聚化结构域样模式识别受体(NLRP3)和凋亡相关斑点样蛋白(ASC)表达和胰腺细胞凋亡指数。结果与空白对照组比较,模型组大鼠胰腺组织充血、水肿、坏死及出血,中性粒细胞浸润,腺泡结构不完整,与模型组比较,加味大承气汤组大鼠损伤胰腺组织均减轻。加味大承气汤组小肠黏膜厚度和绒毛高度显著升高,上皮损伤指数显著降低,且有明显的量效关系,差异均有统计学意义(P<0.05);加味大承气汤组血清IL-1β、IL-6和TNF-α水平显著降低,有明显的量效关系,差异均有统计学意义(P<0.05);加味大承气汤组大鼠腹水量、血清淀粉酶和脂肪酶含量均降低,有明显的量效关系,差异均有统计学意义(P<0.05);加味大承气汤组大鼠NLRP3和ASC表达均显著降低,而胰腺细胞凋亡指数升高,差异均有统计学意义(P<0.05)。结论加味大承气汤可减轻急性胰腺炎模型大鼠胰腺组织损伤,保护肠道屏障功能,减少血清炎症因子,改善微循环,促进胰腺腺泡细胞凋亡。
加味大承气汤 急性胰腺炎 炎症因子 肠道屏障 细胞凋亡
急性胰腺炎是一种病情急、死亡率高的急腹症,伴有其他器官坏死、脓肿或假性囊肿等并发症,是临床常见危急重症,严重影响患者生活质量甚至威胁生命[1-2]。肠道是急性胰腺炎发生应激反应的中心器官,胰腺炎发病与全身炎症反应综合征密切相关,缺氧性病理生理改变可导致炎症因子升高,胰腺微环境障碍,加剧细胞凋亡[3-4]。加味大承气汤可减轻急性胰腺炎患者的腹痛程度、缩短肠道恢复时间,对急性重症胰腺炎有较好治疗作用,但其作用机制尚不明确[5-6]。因此,本研究以胰胆管逆行注射牛磺胆酸钠法建立急性胰腺炎大鼠模型,旨在探讨加味大承气汤对急性胰腺炎模型大鼠血清炎症因子及细胞凋亡的影响,为临床治疗提供参考。
1 材料与方法
1.1 实验动物 50只健康清洁级SD大鼠由北京维通利华实验动物技术有限公司提供 [许可证号:SCXK(京)2011-0011],雌雄各半,体质量(250±20)g。自然光线,以标准饲料和无菌蒸馏水喂养。
1.2 药物与试剂 加味大承气汤:生大黄6 g,芒硝9 g,厚朴15 g,枳实15 g,丹参10 g,川芎10 g,赤芍10 g,甘草10 g。药材均由本院中药房提供,加水煎煮,浓缩为质量浓度1 g/mL,4℃冰箱保存备用。戊巴比妥(国药集团化学试剂有限公司),牛磺胆酸钠(美国Sigma公司),白介素-1β(IL-1β)、白介素6(IL-6)和肿瘤坏死因子α(TNF-α)试剂盒(上海生工技术有限公司),血清淀粉酶和脂肪酶 (兰州硕达生物技术有限公司),血清淀粉酶试剂盒和脂肪酸试剂盒 (武汉博士德公司),苷酸结合寡聚化结构域样模式识别受体(NLRP3)和凋亡相关斑点样蛋白(ASC)抗体(美国Santa Cruz公司),凋亡试剂盒 (北京中杉金桥生物技术有限公司)。
1.3 主要仪器 13R离心机[力康集团力新仪器(上海)有限公司],Biotek aQuant型酶标仪(上海坤肯生物化工有限公司),OLYMPUSAU5400全自动生化分析仪(日本奥林巴斯有限公司),NI500显微镜 (日本尼康公司)。
1.4 造模与给药 50只SD大鼠,随机取10只为空白对照组,剩余40只SD大鼠3%戊巴比妥麻醉后,开腹行胃造瘘术,经胃造口置入内径1.0 mm硅胶管于空肠上段2.0 cm处,关腹。向胰周被膜内匀速注射3.5%牛磺胆酸钠1mL,整个胰腺均匀隆起。术后20min限制饮水,笼中自由活动。成模大鼠再随机分为模型对照组、加味大承气汤低、中、高剂量组,每组10只。术后2 h,空白对照组和模型对照组给予蒸馏水灌胃,加味大承气汤低、中、高剂量组分别给予0.50、1.00、2.00 mL/kg的加味大承气汤灌胃。
1.5 标本采集与检测 灌胃给药24 h后,处死各组大鼠,切取胰腺标本,甲醛固定,24 h后,经酒精脱水和二甲苯透明后,石蜡包埋,连续切片,切片间距5mm,HE染色,树胶封片后,光学显微镜观察视网膜结构。取幽门10 cm处小肠,甲醛固定后进行光镜检查,测定小肠绒毛高度、黏膜厚度和上皮损伤指数。取血液2mL,自然凝固后,3000 r/min离心10 min,分离血清,采用ELISA法检测血清IL-1β、IL-6和TNF-α水平,试剂盒购于上海生工技术有限公司,严格按说明书操作。棉球吸附大鼠腹水,计算腹水量。血清淀粉酶试剂盒和脂肪酶试剂盒检测血清淀粉酶和脂肪酶含量,严格按照说明书操作。采用免疫荧光法检测大鼠NLRP3和ASC表达,严格按照试剂盒说明书操作。取8个切片,每切取 8个阳性细胞数最多的高倍视野,每个视野计数100个细胞和凋亡细胞,凋亡指数=阳性细胞数/ 800×100%。
1.6 统计学处理 应用SPSS19.0统计软件。计量资料以(±s)表示,采用t检验比较组内和组间差异,计数资料以n(%)表示,应用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠胰腺组织病理学变化 见图1。空白对照组胰腺组织结构清晰,偶见少量炎细胞浸润;模型对照组大鼠胰腺组织充血、水肿、坏死及出血,中性粒细胞浸润,腺泡结构不完整;加味大承气汤低剂量组胰腺组织充血、水肿、坏死及出血减轻,炎细胞浸润减少,腺泡结构不完整;加味大承气汤中剂量组胰腺组织充血、水肿、坏死及出血明显减轻,可见炎细胞浸润和不完整腺泡结构;加味大承气汤高剂量组胰腺组织充血、水肿、坏死及出血显著改善,偶见炎细胞浸润,腺泡结构相对完整。
2.2 各组小肠黏膜厚度、绒毛高度和上皮损伤指数比较 见表1。与空白对照组比较,模型对照组大鼠小肠黏膜厚度、绒毛高度显著降低,上皮损伤指数显著升高;与模型对照组比较,加味大承气汤组大鼠加味大承气汤组小肠黏膜厚度和绒毛高度显著升高,上皮损伤指数显著降低,且有明显的量效关系,差异均有统计学意义(P<0.05)。

图1 各组大鼠胰腺组织病理学变化(HE染色,400倍)
表1 各组大鼠小肠黏膜厚度、绒毛高度和上皮损伤指数比较(±s)
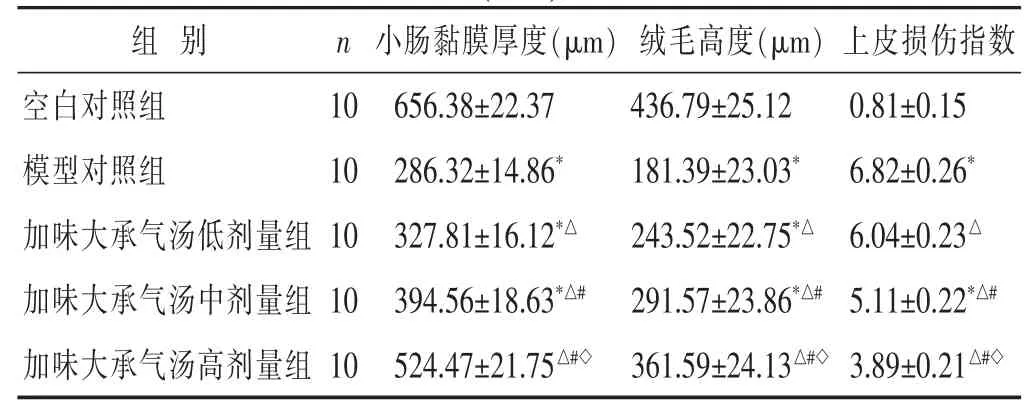
表1 各组大鼠小肠黏膜厚度、绒毛高度和上皮损伤指数比较(±s)
与空白对照组比较,*P<0.05;与模型对照组比较,△P<0.05;与加味大承气汤低剂量组比较,#P<0.05;与加味大承气汤中剂量组比较,◇P<0.05。下同。
组别 n 上皮损伤指数空白对照组 10 0.81±0.15模型对照组 10 6.82±0.26*加味大承气汤低剂量组10 6.04±0.23△小肠黏膜厚度(μm)绒毛高度(μm)656.38±22.37 436.79±25.12 286.32±14.86*181.39±23.03*327.81±16.12*△243.52±22.75*△加味大承气汤中剂量组10 5.11±0.22*△#394.56±18.63*△#291.57±23.86*△#加味大承气汤高剂量组 10 524.47±21.75△#◇361.59±24.13△#◇3.89±0.21△#◇
2.3 各组大鼠血清炎症因子水平比较 见表2。与空白对照组比较,模型对照组大鼠血清IL-1β、IL-6和TNF-α水平显著升高;与模型对照组比较,加味大承气汤组大鼠血清IL-1β、IL-6和TNF-α水平显著降低,有明显的量效关系,差异均有统计学意义(P<0.05)。
表2 各组大鼠血清炎症因子水平比较(pg/mL,±s)

表2 各组大鼠血清炎症因子水平比较(pg/mL,±s)
组别 n TNF-α空白对照组 10 65.38±13.07模型对照组 10 273.35±18.81*加味大承气汤低剂量组 10 215.26±16.56*△IL-1β IL-6 46.12±6.24 143.27±12.33 175.14±15.37*376.15±23.17*135.62±12.45*△311.78±21.34*△加味大承气汤中剂量组 10 143.66±15.60*△#98.74±9.67*△#251.07±17.47*△#加味大承气汤高剂量组 10 62.71±8.21△#◇201.35±15.65△#◇101.44±14.61△#◇
2.4 各组大鼠腹水量、血清淀粉酶和脂肪酶含量比较见表3。与空白对照组比较,模型对照组大鼠腹水量、血清淀粉酶和脂肪酶含量均显著升高;与模型对照组比较,加味大承气汤组大鼠腹水量、血清淀粉酶和脂肪酶含量均降低,有明显的量效关系,差异均有统计学意义(P<0.05)。
表3 各组大鼠腹水量、血清淀粉酶和脂肪酶含量比较(±s)

表3 各组大鼠腹水量、血清淀粉酶和脂肪酶含量比较(±s)
组别 n 脂肪酶(U/mL)空白对照组 10 6.11±0.54模型对照组 10 12.32±0.53*加味大承气汤低剂量组 10 11.05±0.57*△腹水量(mL) 淀粉酶(U/mL)0.84±0.51 2.42±0.12 2.41±0.62*6.86±0.34*2.01±0.59*△5.79±0.31*△加味大承气汤中剂量组 10 9.68±0.61*△#1.64±0.57*△#4.71±0.26*△#加味大承气汤高剂量组 10 1.21±0.55△#◇3.42±0.24△#◇7.98±0.57△#◇
2.5 各组大鼠NLRP3、ASC表达和胰腺细胞凋亡指数比较 见表4。与空白对照组比较,模型对照组大鼠NLRP3和ASC表达和胰腺细胞凋亡指数显著升高;与模型对照组比较,加味大承气汤组大鼠NLRP3和ASC表达均显著降低,而胰腺细胞凋亡指数升高,剂量密切相关,差异均有统计学意义(P<0.05)。
表4 各组大鼠NLRP3、ASC表达和胰腺细胞凋亡指数比较(%,±s)
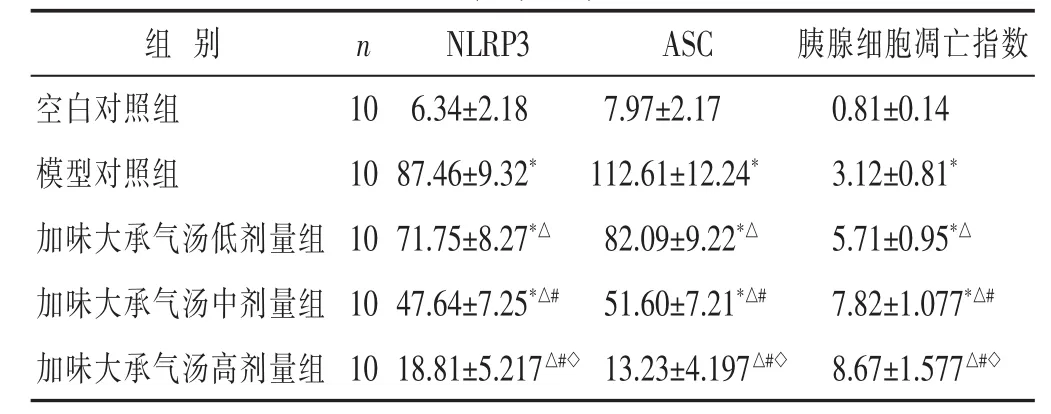
表4 各组大鼠NLRP3、ASC表达和胰腺细胞凋亡指数比较(%,±s)
组别 n 胰腺细胞凋亡指数空白对照组 10 0.81±0.14模型对照组 10 3.12±0.81*加味大承气汤低剂量组 10 5.71±0.95*△NLRP3 ASC 6.34±2.18 7.97±2.17 87.46±9.32*112.61±12.24*71.75±8.27*△82.09±9.22*△加味大承气汤中剂量组 10 7.82±1.077*△#47.64±7.25*△#51.60±7.21*△#加味大承气汤高剂量组 10 18.81±5.217△#◇13.23±4.197△#◇8.67±1.577△#◇
3 讨 论
急性胰腺炎是外科急症之一,可不同程度累及胰腺周围组织和全身相关脏器系统,胰腺腺泡及组织广泛坏死,出血自溶,并发症多,常并发全身炎症反应综合征和多器官功能障碍综合征[7-8]。急性胰腺炎发病机制与微循环紊乱、炎症反应、胰腺细胞缺氧、代谢障碍等密切相关,改善胰腺血流灌注,减轻炎症反应是治疗的目的[9]。急性胰腺炎属中医学“腹痛”“膈痛”“胃脘痛”等范畴,以气滞血瘀、毒瘀互结为病理特点,免疫细胞过度激活-炎性因子过度释放是其发病的关键环节[10-11]。中医治疗急性胰腺炎具有优势,具有通里攻下、清热解毒、活血化瘀功效的加味大承气汤,对急性重症胰腺炎有较好治疗作用,但其作用机制尚不明确。
本研究发现,加味大承气汤组大鼠损伤胰腺组织均减轻,加味大承气汤组小肠黏膜厚度和绒毛高度显著升高,上皮损伤指数显著降低,且有明显的量效关系,差异均有统计学意义。说明加味大承气汤可减轻急性胰腺炎模型大鼠胰腺组织损伤,保护肠道屏障功能。加味大承气汤中生大黄、芒硝共奏泄热通腑,厚朴、枳实行下气通滞除满,消癌除胀,川芎、丹参、赤芍活血祛瘀、清热凉血散瘀,防止实热进入血分,阻止血热互结有关[12]。加味大承气汤组血清IL-1β、IL-6和TNF-α水平显著降低,有明显的量效关系,差异均有统计学意义。说明加味大承气汤可减轻急性胰腺炎模型大鼠血清炎症因子。大黄蒽醌清热解毒、抗菌消炎等作用,保护胃肠黏膜机械屏障、增加肠蠕动,减少肠道内细菌及内毒素的易位;芒硝增强大黄泻下导滞之效,抑菌,利于肠道的恢复,且能减少细菌移位,减轻炎症级联反应有关[13-14]。加味大承气汤组大鼠腹水量、血清淀粉酶和脂肪酶含量均降低,有明显的量效关系。说明加味大承气汤可改善急性胰腺炎模型大鼠微循环。厚朴调整胃肠道运动功能,松弛血管平滑肌;枳实调节胃肠平滑肌活动,缓解小肠痉挛,抗变态反应;丹参改善血液流变性,抑制血管内凝血、激活纤溶、促进纤维蛋白降解,改善微循环等作用密切相关,加味大承气汤改善胰腺毛细血管灌注,减轻胰腺水肿或缺血,有改善急性胰腺炎大鼠胰腺微循环的作用[15-16]。加味大承气汤组大鼠NLRP3和ASC表达均显著降低,而胰腺细胞凋亡指数升高,差异均有统计学意义。说明加味大承气汤可促进急性胰腺炎模型大鼠胰腺腺泡细胞凋亡。NLRP3为固有免疫的重要组成部分,主要存在于细胞内,ASC是NLRP3与Caspase-1的桥梁,参与Caspase-1的活化,将IL-1β的前体裂解为IL-1β,与IL-1受体结合引起炎症反应,大黄蒽醌抑制急性胰腺炎模型大鼠早期过激的免疫反应发挥作用,减轻多器官功能损伤,川芎嗪解除血管痉挛,降低血管阻力,增加血流量,改善氧供,减少血循疲滞状态;赤芍抑制血小板聚集作用,抗炎止痛作用有关[17-18]。
综上所述,加味大承气汤可减轻急性胰腺炎模型大鼠胰腺组织损伤,保护肠道屏障功能,减少血清炎症因子,改善微循环,促进胰腺腺泡细胞凋亡。
[1] 许利剑,汪宝林.急性胰腺炎全身炎症反应综合征与急性胰腺炎预后关系的分析[J].南京医科大学学报:自然科学版,2002,22(4):346-347.
[2] 中华医学会消化病学分会胰腺疾病学组,中华胰腺病杂志编辑委员会,中华消化杂志编辑委员会,等.中国急性胰腺炎诊治指南(2013年,上海)[J].中华消化杂志,2013,33(4):217-222.
[3] 钱进,钱孝先,田尧,等.急性胰腺炎严重程度与急性肾功能损害及肾周间隙受累的关系[J].广东医学,2016,37(19):2939-2942.
[4] 吴娟,张强,邓明明,等.高脂血症性急性胰腺炎大鼠胰腺组织NCX1、LC3Ⅱ、Beclin-1、Caspase-3及Caspase-9蛋白表达观察[J].山东医药,2016,56(39):27-29.
[5] 蔡玲.大承气汤对改善重症急性胰腺炎患者胃肠功能障碍临床观察[J].中国中医急症,2014,23(1):155-156.
[6] 黄定鹏,陈健,赵亚刚,等.加味大承气汤联合西药对急性胰腺炎患者疗效、微炎性反应状态、血清淀粉酶及血清钙影响[J].世界中医药,2016,11(11):2259-2262.
[7] 刘建,李非.急性胰腺炎患者的诊治及预后[J].中华肝胆外科杂志,2016,22(10):714-718.
[8] 金伟,钟娟,李情洁,等.中药治疗急性胰腺炎并发急性胃肠损伤的系统评价[J].世界科学技术-中医药现代化,2016,18(4):699-708.
[9] 李满.急性胰腺炎胰腺组织修复机制的研究进展[J].中国普通外科杂志,2016,25(3):430-434.
[10]张玉,邵建国,卞兆连,等.中医药通过影响JAK-STAT信号通路治疗急性胰腺炎的机制[J].南通大学学报:医学版,2016,36(2):144-147.
[11]王晓瑜,张国华,苏振政,等.大承气汤对急性胰腺炎患者SOD水平影响的研究[J].中国中西医结合消化杂志,2014,22(5):275-276.
[12]沈银峰,金文银,廖恒祥,等.大承气汤对重症急性胰腺炎大鼠肠道免疫屏障的保护作用[J].湖北中医药大学学报,2015,17(1):9-12.
[13]陈立,范玲,谭小勇,等.大黄游离蒽醌对重症急性胰腺炎大鼠肠道免疫功能的影响及其作用机制[J].山东医药,2016,56(24):13-16.
[14]杨宝晶,尤胜义,张志远,等.大黄素治疗重症急性胰腺炎肺损伤机制研究[J].中国全科医学,2016,19(24):2943-2947.
[15]党琳,张晓芹,刘芳,等.柴芩承气汤对重症急性胰腺炎并肝损伤大鼠肝组织氧化应激的影响[J].新乡医学院学报,2015,32(12):1059-1063.
[16]苏振政,张国华,王晓瑜,等.大承气汤治疗急性胰腺炎肠屏障功能障碍[J].长春中医药大学学报,2014,30(6):1104-1105.
[17]刘瑞霞,齐文杰.大黄素治疗重症急性胰腺炎的作用与机制研究进展[J].临床和实验医学杂志,2016,15(2):193-195.
[18]史玉,郭永泽,王建华,等.川芎嗪对重症急性胰腺炎大鼠的治疗作用及其机制[J].山东医药,2016,56(1):33-34.
E ffect of Modified Dachengqi Decoction on Serum Inflammatory Factors and Cell Apoptosis in Rats w ith Acute Pancreatitis
XUN Yichao,ZHAO Jia.Shenyang Orthopedic Hospital,Liaoning,Shenyang 110044,China.
Objective:To study the effect of Modified Dachengqi Decoction on serum inflammatory factors and cell apoptosis in rats with acute pancreatitis.M ethods:50 SD rats were random ly divided into 5 groups,10 in each,namely the blank control group,themodel control group,low dose group of Modified Dachengqi Decoction,middle dose group of Modified Dachengqi Decoction and high dose group of Modified Dachengqi Decoction,respectively.Ratmodel of acute pancreatitiswas established by retrograde injection of sodium taurocholate into the pancreatic duct.The blank control group and model control group were given distilled water to the stomach;the Modified Dachengqi Decoction groups were given traditional Chinese medicine decoction lavage.After 24 h,the pathology of pancreatic tissue was observed;intestinalmucosal thickness of rats,the villus height and epithelial damage index were compared;the levels of IL-1β,IL-6 and TNF-α,the abdominal water,expression of NLRP3,ASC and pancreatic cell apoptosis index were also compared.Results:Compared with the blank control group,congestion,there was edema and necrosis and hemorrhage,neutrophil infiltration,and gland bubble structure was not complete in pancreatic tissue in the model group.Compared with the model group,the injury of pancreatic tissue were relieved in Modified Dachengqi Decoction groups.The small intestinalmucosa thickness and villus heightwere significantly increased,and the epithelial injury index decreased significantly in Modified Dachengqi Decoction groups,and there was a significant dose effect;the differences were statistically significant(P<0.05). The levels of IL-1β,IL-6 and TNF-αwere significantly reduced in Modified Dachengqi Decoction groups,and there was a significant dose effect;the differences were statistical significant(P<0.05).The amount of ascites,serum amylase and lipase decreased in Modified Dachengqi Decoction groups,and there was a significant doseeffect;the differenceswere statistical significant(P<0.05).The expression of NLRP3 and ASC were significantly lower in Modified Dachengqi Decoction groups,and the apoptosis index of pancreas increased;the differences were statistical significant(P<0.05).Conclusion:The Modified Dachengqi Decoction can alleviate pancreatic tissue injury in the rats with acute pancreatitis,protect the intestinal barrier function,reduce serum inflammation factors,improvemicrocirculation,and promote apoptosis of pancreatic acinar cells.
Modified Dachengqi Decoction;Acute pancreatitis;Inflammation factors;Intestinal barrier;Cell apoptosis
R285.5
A
1004-745X(2017)07-1152-04
10.3969/j.issn.1004-745X.2017.07.007
2017-04-19)
辽宁省科技发展计划重点项目(2015225008-9)
