葎草幼苗对盐胁迫响应的性别差异
2017-08-11王碧霞黎云祥
王碧霞,黎云祥
(西华师范大学环境科学与工程学院,四川 南充 637009)
葎草幼苗对盐胁迫响应的性别差异
王碧霞,黎云祥
(西华师范大学环境科学与工程学院,四川 南充 637009)
采用盆栽试验研究了葎草(Humulusscandens)幼苗对盐胁迫响应的生理生化性别差异,测定了不同盐(NaCl)浓度(0、100、200、300 mmol·L-1)下雌雄植株的单叶面积、气体交换参数、叶水势、叶绿素荧光、叶绿素含量、过氧化氢酶(CAT)和丙二醛(MDA)含量等指标的变化。结果表明,NaCl胁迫后葎草雌雄幼苗的叶干重、净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)、叶水势(ψw)和CAT均呈逐渐降低的趋势,而气孔限制值(Ls)和MDA逐渐上升,其单叶面积则先升后降。随着NaCl胁迫的递增,雌株的最小荧光(Fo)呈先升后降的变化,最大荧光(Fm)、可变荧光(Fv)、PSⅡ潜在活性(Fv/Fo)和非光化学淬灭系数(qN)则逐渐递增,光化学淬灭系数(qP)和叶绿素含量却逐渐递减;从总体上看,雄株的表现光合电子传递速率(ETR)、Fm和Fv、最大光化学效率(Fv/Fm)和Fv/Fo也呈上升趋势,qN和qP却呈下降趋势,而叶绿素含量却先升后降。因此,NaCl胁迫影响了葎草雌雄幼苗的单叶面积、叶绿素含量、叶绿素荧光、气体交换、CAT和MDA含量等生理生化特征,但雌雄幼苗对NaCl胁迫的响应存在差异。与雄株相比,雌株对NaCl胁迫更耐受。
葎草;雌雄异株;盐胁迫;性别差异;气体交换;叶绿素含量;叶绿素荧光
土壤盐渍化是制约农业生产和影响生态环境的重要因素,盐分过高会严重影响植物生长[1]。盐分可直接对植物产生伤害[2],也可通过抑制酶[3]、光合色素[4-5]、类囊体膜蛋白及膜脂[6-7]等光合作用器官的组分而间接影响其生长发育。为此,针对植物对盐胁迫的响应机制,国内外众多学者已做了大量研究[4-6],大多数文献表明植物对盐胁迫的反应是由生理[7-9]、生化[10-11]、细胞[11-12]等多种因素共同调节和控制的,涉及到形态和代谢等多方面的变化。已有研究表明,盐胁迫对植物的危害主要来自Na+和Cl-离子引起的渗透胁迫,并产生离子胁迫[8,10],且高浓度NaCl引起植物氧化胁迫也是非生物胁迫中的重要因素[5],进而造成叶绿素含量下降,光系统PSⅡ反应能力减弱,光合效率降低[4],最终导致植株生长停滞,生物量降低,严重时植株死亡。如栽培大豆(Glycinemax)和杂交大豆的光合速率随着盐胁迫浓度的升高而下降,二者的光化学淬灭系数(qP)、表观光合电子传递速率(ETR)和Rubisco羧化活性显著下降,但PSⅡ最大光化学效率(Fv/Fm)却仅在高浓度盐胁迫下出现降低[6]。苦楝(Meliaazedarach)叶片的叶绿素含量也随着盐浓度的增大而下降,H2O2大量积累,MDA含量升高,SOD活性则受到抑制,Ca2+、Mg2+、K+含量下降不显著,但可溶性蛋白却在盐胁迫前期增加,后期下降[8]。
然而从已有的文献来看,针对盐胁迫展开的相关研究主要集中在雌雄同株植物中,而较少涉及雌雄异株植物。相关学者对24万种被子植物做了调查,雌雄异株植物有959个属,共计14 620种,是陆地生态系统的重要组成部分[13]。因人类干扰和全球环境的恶化,环境胁迫下雌雄异株植物在生长状况[14]、空间分布[15]、遗传特性[16];生理特征及适应性[17-18]等方面已出现性别差异。如盐渍地区的窄叶火棘(Phillyreaangustifolia)雄株叶片的脯氨酸含量高于非盐渍地区[19];干旱胁迫下青杨(Populuscathayana)雌株在生长、光合参数、用水效率和抗氧化酶活性方面受到的负面影响大于雄株[16],而盐胁迫下银杏(Ginkgobiloba)雌株的光合速率和抗氧化酶活性却高于雄株[20]。因此,雌雄异株植物在不同性别间不同胁迫条件下存在不同的形态结构、生存策略以及适应性特征,鉴于此,本研究选用常见的雌雄异株植物葎草(Humulusscandens)作为对象,研究不同盐浓度下葎草雌雄幼苗的膜脂过氧化、抗氧化酶活性、叶绿素含量、叶绿素荧光、单叶面积、气体交换参数以及叶水势等指标的性别差异,旨在探明葎草雌雄幼苗对不同浓度盐胁迫的响应机制及抗逆能力,为进一步探究该类植物对环境的适应机制提供理论依据。
1 材料与方法
1.1 试验材料
于2014年10月中下旬采集南充市本地野生葎草果期成熟且饱满的种子,封存于纸袋子中干燥保存备用。南充市地处30°35′-31°51′ N,105°02′-106°28′ E,整个区域属亚热带湿润型季风气候,年均温15.9~17.8 ℃。待2015年2月23日播种,生长45 d后,选择48株长势基本一致的幼苗,移栽到体积为10 L的塑料盆内自然生长,毎盆装入河沙1.5 kg,匀质土壤7.5 kg,毎盆1株,缓苗20 d。试验采用双因素的完全随机设计:2性别(雌、雄)×4盐处理[0(CK)、100、200、300 mmol·L-1],雌雄幼苗在各处理下分别5株重复,共40株,对照组(5株)浇施等量清水,按相应浓度将NaCl配成1 000 mL的溶液,于4月25日缓慢、均匀、一次性浇灌于土壤中,为防止溶液渗漏,土壤置于塑料袋内,对照组和处理组塑料盆内均套有塑料袋。
1.2 测量指标及测定方法
1.2.1 形态指标 于2015年5月25日用LI-3000C便携式面积仪(LI-COR公司,美国)对各雌雄幼苗的单叶面积进行测量。5月30日采集各处理下的雌雄幼苗叶片,置于70 ℃烘箱内48 h烘干至恒重后[21],测定各植株叶的干重。
1.2.2 气体交换参数和叶绿素荧光参数指标 于2015年5月26日08:30-11:30采用便携式光合测定仪LI-6400(Li-Cor公司,美国)进行气体交换特征的测定,其方法参照王碧霞等[17],各处理下雌雄各3株取植株上部第5或6片全展向阳叶片,每片重复3次。测定指标分别为蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)、净光合速率(Pn),采用Berry和Downton[22]的方法计算气孔限制值[Ls= (Ca-Ci)/Ca],瞬时水分利用效率(WUEi)为Pn与Tr之比,叶水势(ψw,MPa)用露点水势仪(WP4C,Decagon,美国)同期活体原位测定。
叶绿素荧光动力学参数可作为快速、无损伤测定叶片光合功能的探针。采用便携式调制叶绿素荧光仪(Junior-Pam,Heinz Walz,Effeltrich,德国)于2015年5月26日20:00-24:00测定自然条件下葎草雌雄植株的叶绿素荧光参数[14]。选取健康且长势一致的雌雄幼苗,每株植物从顶端数第4~6片充分展开的叶片中部进行活体测定,每叶片重复3次,光化光强度设为190 μmol·(m2·s)-1,每隔20 s照射饱和脉冲光[6 000 μmol·(m2·s)-1,0.6 s]。由仪器自动测得的指标包括:光化学淬灭系数(qP)、非光化学淬灭系数(qN)、最大光化学效率(Fv/Fm)、表观光合电子传递速率(ETR)、最小荧光(Fo)、最大荧光(Fm),同时计算出PSⅡ潜在活性(Fv/Fo)、可变荧光(Fv=Fm-Fo)。
1.2.3 生理指标 随机选择各种处理下的幼苗各3株,于2015年5月29日选取各植株上部第5或6片完全展开向阳叶片,用于测定叶绿体色素含量、过氧化氢酶(CAT)及丙二醛含量(MDA)。
采用丙酮提取法测定叶绿素含量[23],在波长663、646和470 nm下分别测定吸光值,叶绿素a (Chla)(Chla=12.21A663-2.81A646)、叶绿素b(Chl b)(Chlb=20.13A646-5.03A663)、类胡萝卜素(Chl x)[Chlx=(1 000A470-3.27Chla-104Chlb)/229]和叶绿素a/b(Chl a/b=Chla/Chlb)的含量,按照Lichtenthaler[24]的公式计算。
酶液提取:分别取0.3 g叶片于预冷的研钵中,加入6 mL预冷的提取缓冲液[磷酸缓冲液pH 7.8,1 mmol·L-1乙二胺四乙酸(EDTA)和1%聚乙烯吡咯烷酮(PVP)]研磨成匀浆,于4 ℃下离心30 min(5 963 r·min-1),取上清液(酶液)用于试验。CAT活性采用紫外分光光度计法测量[25],采用硫代巴比妥酸(TBA)比色法测定MDA含量[26]。
1.3 数据分析
数据分析采用SPSS 17.0统计软件,采用单因素方差分析方法(One-Way ANOVA) 进行平均值间的比较;采用Duncan多重比较检验(Duncan’s Multiple Range Test)进行不同处理间的差异分析;采用双因素方差分析性别与处理间的交互作用。显著性水平设定为a=0.05。
2 结果与分析
2.1 NaCl胁迫对葎草雌雄幼苗的叶干重和单叶面积的影响
葎草雌雄植株的叶干重和单叶面积受到了NaCl胁迫的显著影响(图1),雄株叶干重的下降比雌株更显著,单叶面积均呈先升后降的趋势,盐胁迫极显著影响了雌雄单叶面积(P<0.001)。其中,CK处理时,雌株叶干重显著低于雄株(P<0.05),雌雄株单叶面积差异不显著(P>0.05);100 mmol·L-1盐处理时,雄株叶干重显著低于CK,雌雄株单叶面积均显著增大;200 mmol·L-1盐处理时,雌株叶干重和单叶面积与CK相近,雄株单叶面积较CK仍然显著上升,但叶干重却较CK显著降低;300 mmol·L-1盐处理时,二者的单叶面积均显著降低,雄株叶干重下降幅度较大。此外,性别与盐处理以及它们的交互作用显著(P<0.05)和极显著(P<0.001)影响了叶干重,而性别与性别×盐交互作用对单叶面积则没有影响。
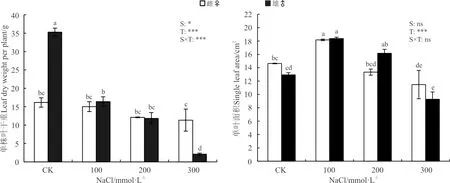
图1 NaCl胁迫下葎草雌雄幼苗的叶干重和单叶面积Fig. 1 Leaf dry weight and single leaf area of male and female Humulus scandens under NaCl stress
注:S代表性别;T代表盐胁迫处理;S×T代表性别与处理交互效应;不同小写字母表示不同处理间差异显著(P<0.05);*,P<0.05;**,P<0.01;***,P<0.001;ns,无显著差异。下图同。
Note: S, Sex effect; T, NaCl stress effect; S×T, Sex×NaCl stress interaction effect. Different lowercase letters indicate significant differences between different treatments at the 0.05 level. *,P<0.05; **,P<0.01; ***,P<0.001; ns, no significant; similarly for the following figures.
2.2 NaCl胁迫对葎草雌雄幼苗的气体交换参数和叶水势的影响
随着NaCl胁迫的递增,葎草雌雄幼苗的ψw呈先升后降,Pn、Gs、Ci和Tr则逐渐降低(表1),而Ls却相反,WUEi的变化无规律。雌株的Pn、Gs和Tr在CK处理时显著高于雄株(P<0.05),而Ls和ψw显著低于雄株,二者的Ci和WUEi差异不显著(P>0.05)。与CK相比,在100 mmol·L-1处理时,雌株和雄株的Pn、Gs和Tr均显著降低,雌株ψw显著升高,Ci、WUEi和Ls均无显著差异;在200 mmol·L-1时,二者的Pn、Gs和Tr继续降低,Ci和WUEi差异仍不显著,Ls和ψw雌株无差异,雄株显著降低;随着盐浓度增至300 mmol·L-1时,雌、雄植株的Pn、Gs、Ci、Tr和ψw降至最低,WUEi和Ls却升至最高。此外,Pn和WUEi没有受到性别与盐处理的交互影响,而性别与盐处理交互作用显著或极显著影响Gs、Ci、Tr、ψw和Ls。
2.3 NaCl胁迫对葎草雌雄幼苗的叶绿素含量的影响
CK处理下,Chl a、Chl b、Chl a+b和Chl x存在性别差异,但NaCl胁迫后叶绿素含量性别差异不显著;且随着NaCl胁迫的加剧,叶绿素含量逐渐降低(表2)。100 mmol·L-1盐处理下雄株的叶绿素含量升高,200 mmol·L-1盐处理下雌株和雄株的响应存在差异,300 mmol·L-1盐处理下二者均降低,其中雌雄株Chl a/b较CK显著减少(P<0.05)。雌株的Chl a、Chl b、Chl a+b和Chl x在CK条件下,分别比雄株高33.85%、32.14%、34.78%和28.44%;与CK相比,100 mmol·L-1处理时,雌株的Chl b和Chl x显著减少,Chl a、Chl a+b和Chl a/b无显著差异(P>0.05),雄株的Chl a、Chl b、Chl a+b和Chl x增加了27.69%、21.43%、27.17%和30.25%;200 mmol·L-1处理时,雌株的Chl a、Chl b、Chl a+b和Chl x显著降低,雄株减幅较小;300 mmol·L-1时,雌株的叶绿素含量均减至最低,雄株也有下降,但差异不显著。此外,性别与处理的交互作用显著影响Chl a、Chl b和Chl x,但Chl a+b和Chl a/b受到影响不显著。
2.4 NaCl胁迫对葎草雌雄幼苗的叶绿素荧光参数的影响
2.4.1 NaCl胁迫下葎草雌雄幼苗ETR、Fo、Fm、Fv的变化 NaCl胁迫对葎草雌雄幼苗的ETR、Fo和Fv的影响极显著(P<0.001)(表3),对Fm也具有显著的影响(P<0.05)。盐胁迫下雌株的ETR、Fm和Fv逐渐递增,雄株的ETR、Fm和Fv总体上也呈上升趋势,而二者Fo的变化却不规律。在CK处理时,雌株的ETR比雄株高(P<0.05),Fv相反(P<0.05),Fo和Fm无显著差异(P>0.05)。与CK相比,100 mmol·L-1时,雌雄株的变化趋势相似,ETR、Fm和Fv显著下降,Fo显著增加;200 mmol·L-1时,雌株的ETR和Fm仍较低,Fv、Fo与CK无显著差异(P>0.05),雄株的ETR较CK显著降低,Fo变化较小,但Fm和Fv较CK显著增高;300 mmol·L-1时,雌株和雄株的Fm、Fv分别较CK增加了21.45%和15.22%、31.30%和14.59%,雄株的Fo也显著增加,雌株没有显著变化,但二者的ETR较CK差异不显著。另外,在性别与盐处理交互效应下对ETR没有显著影响,对Fv影响显著,对Fo和Fm影响极显著。

表1 NaCl胁迫下葎草雌雄幼苗的气体交换参数和叶水势Table 1 Gas exchange characteristics and leaf water potential of male and female Humulus scandens under NaCl stress
注:同列不同小写字母表示不同处理间差异显著(P<0.05)。*,P<0.05;**,P<0.01;***,P<0.001; ns, 无显著差异。下表同。
Note: Different lowercase letters within the same column show significant differences between different treatments at the 0.05 level. *,P<0.05;**,P<0.01;***,P<0.001; ns, no significant; similarly for the following tables.
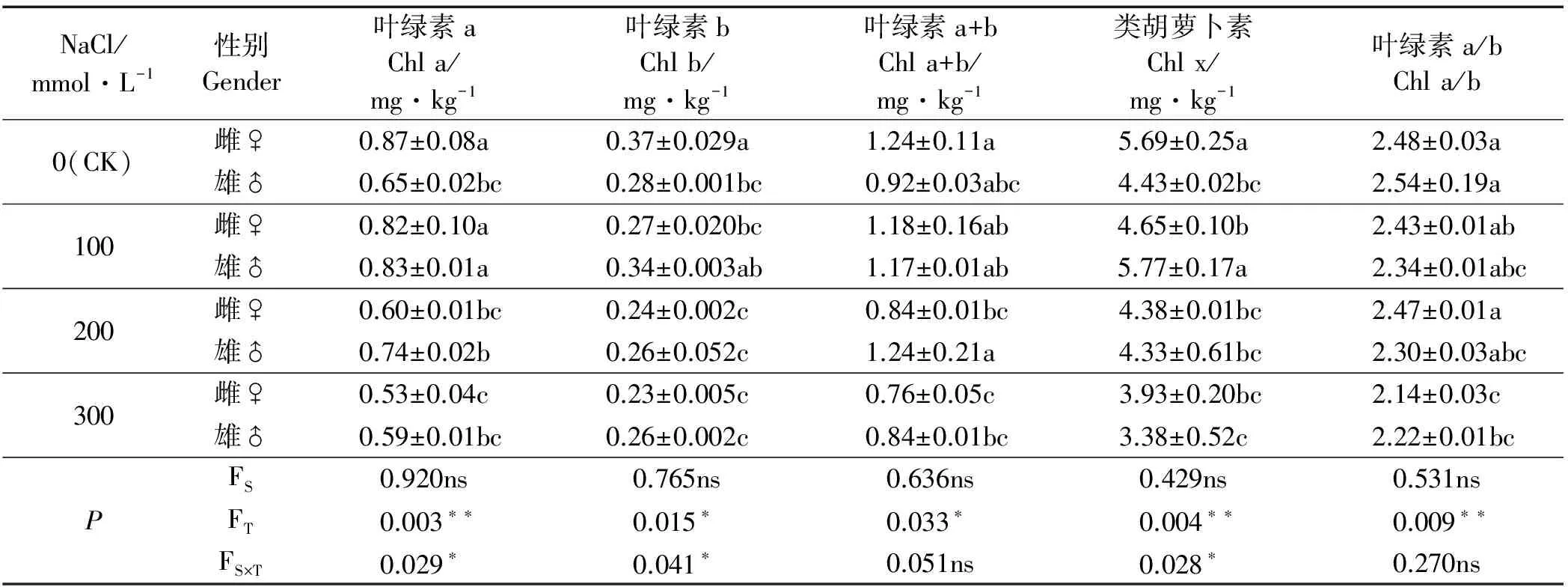
表2 NaCl胁迫下葎草雌雄幼苗的叶绿素含量Table 2 Chlorophyll pigments content of male and female Humulus scandens under NaCl stress
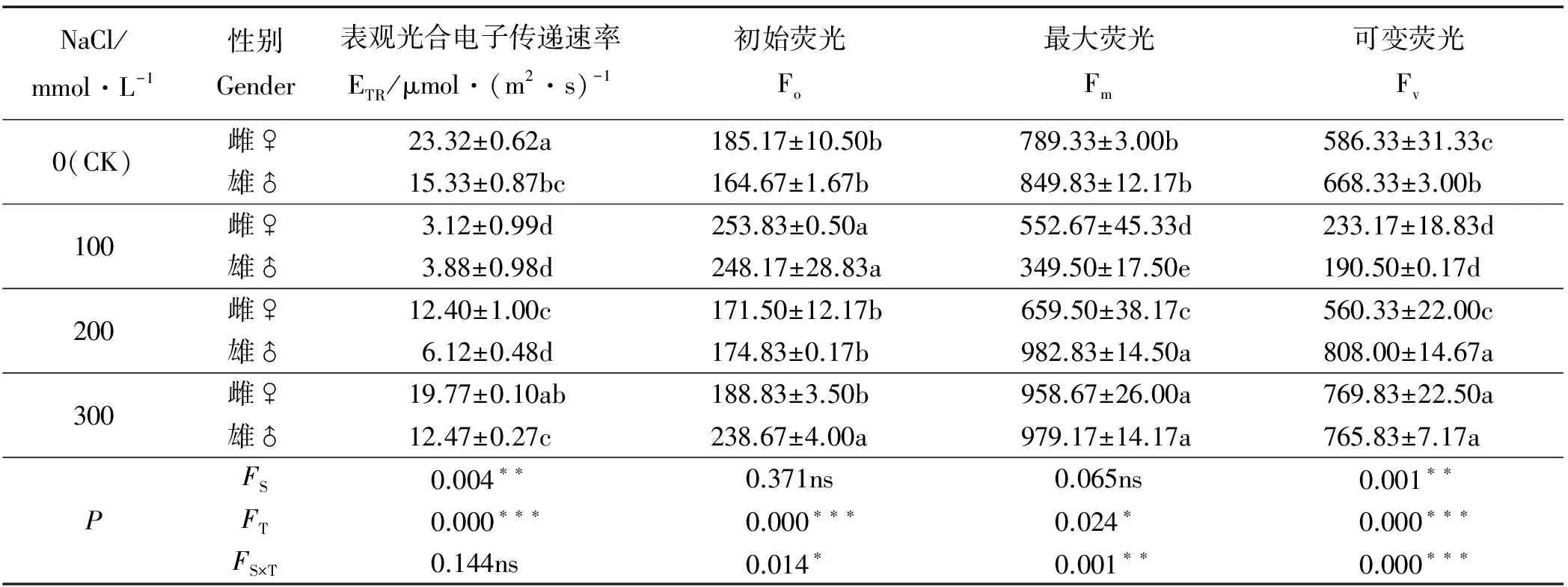
表3 NaCl胁迫下葎草雌雄幼苗的叶绿素含量叶绿素荧光参数Table 3 Chlorophyll fluorescence parameters of male and female Humulus scandens under NaCl stress
2.4.2 NaCl胁迫下葎草雌雄幼苗Fv/Fm、Fv/Fo、qP、qN的变化 在不同浓度的NaCl处理对葎草雌雄幼苗的Fv/Fo和qN影响极显著(P<0.001)和显著(P<0.01),Fv/Fm和qP无显著影响;性别对Fv/Fo和Fv/Fm影响显著,对qP和qN影响不显著。雌株Fv/Fm在3个盐浓度处理下较CK 无显著差异(P>0.05),Fv/Fo和qN呈随着盐浓度的升高呈逐渐增加的趋势,qP则逐渐下降。在100 mmol·L-1处理时,雄株的Fv/Fm和Fv/Fo较CK显著下降,200和300 mmol·L-1处理时上升,qN却相反,qP较CK显著下降,但盐处理间差异不显著。与雄株相比,雌株在CK处理时,qP显著降低,Fv/Fm、Fv/Fo和qN没有显著差异。雌株除Fv/Fo在100 mmol·L-1盐处理时较CK显著降低之外,该指标的其它盐浓度处理以及Fv/Fm、qP和qN在不同盐浓度处理间差异基本不显著。与CK相比,雄株的Fv/Fm仅在100 mmol·L-1时显著下降,其它盐浓度处理下与CK无显著差异,Fv/Fo在各盐处理间差异显著,在200 mmol·L-1时达到最大值,qN在100 mmol·L-1时达到最高。另外,在性别与盐处理的交互作用对Fv/Fm和Fv/Fo影响极显著差异,对qN也影响显著,对qP无显著影响。
2.5 NaCl胁迫下对葎草雌雄幼苗CAT和MDA含量的影响
NaCl胁迫对葎草雌雄幼苗的CAT和MDA影响极显著(P<0.001)和显著(P<0.01)(图3)。性别对CAT的影响极显著(P<0.001),随着盐胁迫的加重雌株的CAT总体呈降低趋势,雄株先降后升,雌雄MDA均逐渐上升。在CK处理时,雄株的CAT显著高于雌株,二者的MDA没有差异(P>0.05)。与CK相比,NaCl胁迫100 mmol·L-1时,雌株的CAT和MDA较CK显著增高(P<0.05),雄株的CAT显著降低,而MDA则显著升高;200 mmol·L-1处理时,雌雄株的CAT均降低,MDA则均上升;300 mmol·L-1处理时,雌雄株的CAT较CK和100 mmol·L-1处理仍下降,MDA较CK和其它盐胁迫处理仍上升。NaCl胁迫后雄株的CAT下降幅度比雌株大,MDA含量的上升幅度比雌株小。另外,性别与盐处理之间的交互作用极显著和显著影响CAT和MDA。
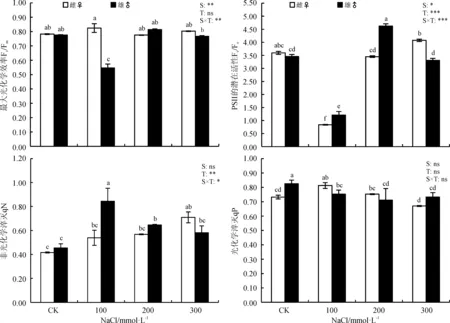
图2 NaCl胁迫下葎草雌雄幼苗的光系统Ⅱ反应中心特征Fig. 2 PSⅡof male and female Humulus scandens under NaCl stress
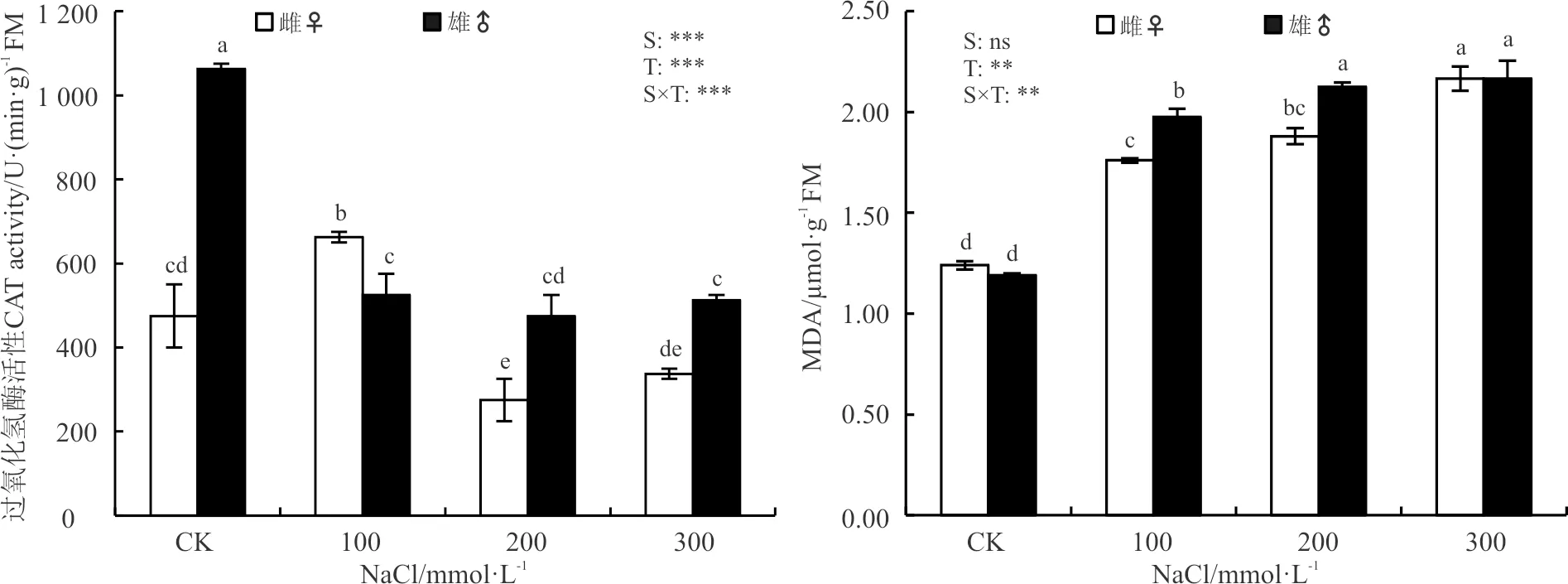
图3 NaCl胁迫下葎草雌雄幼苗的CAT和MDA含量Fig. 3 CAT activity and MDA content of male and female Humulus scandens under NaCl stress
3 讨论与结论
相关研究表明,在各种胁迫条件下雌雄异株植物的生长、干物质积累、光合和代谢等生理生化指标方面性别显著差异。如干旱胁迫有利于梣叶槭(Acernegundo)雄株的生长,其平均叶面积明显增大[27]。在水分条件较好时,沙棘(Hippophaerhamnoides)雌雄之间没有差异,但在水分亏缺时雄株的株高、干物质积累、Pn和Tr比雌株高,叶面积比雌株低[28],而在干旱条件下葎草雄株比雌株的总叶面积、茎分枝数、根长度和生物量低[29]。本研究中,在正常生长条件下葎草雄株的单叶面积、Pn、Gs和Tr比雌株低,叶干重、Ls和ψw比雌株高,当盐胁迫浓度增加到300 mmol·L-1时,雄株的单叶面积和叶干重均比雌株低(图1)。这与雌雄异株植物在有利环境下性别比例偏雌性的结论相一致[27,30],也与胁迫环境对葎草雄株的影响大于雌株的结论相吻合[17,29],同时这还可能是胁迫条件下葎草雄株为种群繁衍而采取了缩短营养生长期并缩小植株体型的生存策略[29]。由于Ci和Gs的变化反映了叶肉细胞内外CO2浓度的变化状况,也是反映气孔开张程度的重要指标。本研究发现,在100和200 mmol·L-1胁迫时雌雄株的Ci和Ls与CK比基本无显著差异,Pn均显著下降,但随着NaCl胁迫浓度增至300 mmol·L-1时,雌雄株的Ci均下降,Ls均显著升高,Pn达到最小值。Farquhar和Sharkey[31]认为,Ci降低,Ls增大,Pn降低的主要原因是Gs同步下降所引起,反之则是非气孔限制。这表明在中低浓度(100和200 mmol·L-1)胁迫下,雌雄植株Pn降低可能与叶肉导度、PSⅡ活性、光合电子传递以及光合色素的平衡失调等非气孔因素相关[6],而在300 mmol·L-1胁迫时,二者Pn的降低其主要因素则是由于Gs的大幅度降低所引起。该结论与低浓度盐胁迫通常为气孔限制,而高浓度盐胁迫为非气孔限制的结论不一致[6]。究其原因可能是低浓度盐胁迫下光能力下降导致了Ci不变,对气孔产生了反馈抑制[32],而高浓度盐胁迫下Gs的相应变化则是为了达到水分利用的最优策略,雌雄植株均能通过维持较低的Tr和ψw以及较高的WUEi来减少水分散失,能更高效地利用水分以增强其耐受性[33]。这还同时反映了在不同浓度的NaCl胁迫下葎草雌雄幼苗的气体交换参数具有性别差异,其原因也可能与盐胁迫浓度的大小、胁迫时间的长短以及植物种类有关[2]。
另一方面,通过对葎草雌雄幼苗光合色素的测定发现,NaCl胁迫后雌株的叶绿体色素的合成受到显著抑制,其叶绿素含量显著降低,而雄株的Chl a、Chl b、Chl a+b和Chl x在低浓度(100 mmol·L-1)时升高,中高浓度(200和300 mmol·L-1)时变化较小(表2)。这与铝胁迫下青杨(Populuscathayana)雌雄幼苗的研究结果相一致[33]。因此,推测雌株较低的叶绿素含量是导致净光合速率降低的原因之一,NaCl可能引起了雌株Na+离子流入胞质,导致的ψw下降从而引起渗透胁迫,并最终导致呼吸电子传递的失活和光合的降低[34],而NaCl胁迫后雄株净光合速率下降的原因则可能与叶绿素荧光参数有关。进而,通过对叶绿素荧光参数的测量得以证实,在100 mmol·L-1胁迫时仅雄株Fv/Fm降低,在300 mmol·L-1胁迫时雌株的Fv/Fo和qN较其它盐浓度及CK增加,qP下降,而雄株随着盐胁迫的加剧,qP降低,Fv/Fo呈先降后升再降,qN却相反(图2)。由于Fv/Fm在非胁迫条件下不受物种和生长条件的影响,胁迫条件下显著降低[32],这表明NaCl胁迫对雄株的Fv/Fm具有一定的影响,而对雌株的Fv/Fm则没有直接影响,其原因与雌雄异株植物性别间对逆境胁迫的敏感性和耐受性差异有关[14]。同时,qP反映了原初电子QA的还原状态,qP愈大,PSⅡ电子传递的活性愈大;qN则反映了PSⅡ天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的光能部分[35]。在300 mmol·L-1胁迫时,雄株的Fo和qN高于CK,qP低于CK,这反映出雄株在NaCl胁迫下PSⅡ反应中心过剩的激发能使QA的还原程度逐渐增加,电子传递活性降低,为缓解过量光能的吸收,热耗散增加,Fo升高,光合机构受到部分损伤,因而导致其光合效率降低[32],这一结果与青杨扦插苗的研究结果相一致[36]。因此,葎草雄株对NaCl胁迫的敏感性更高,而雌株对NaCl胁迫的适应性更强。此外,MDA含量的高低也是衡量植物适应环境的一个重要指标,其含量是植物在逆境条件下膜脂过氧化作用形成的产物[6]。NaCl胁迫下雄株MDA含量上升的幅度比雌株高,反映了其细胞膜受伤害的程度比雌株更高,与葎草雌雄幼苗在铬胁迫下的研究结果相吻合[16]。这也进一步说明了葎草雌株比雄株更耐受NaCl胁迫,但其耐盐阈值还有待进一步研究。
综上所述,NaCl胁迫影响了葎草雌雄幼苗的单叶面积、叶绿素含量、叶绿素荧光、气体交换以及CAT和MDA含量等生理生化特征,但雌雄幼苗对NaCl胁迫的响应存在显著的性别差异。与雄株相比,雌株对NaCl胁迫的耐性更强。
References:
[1] Liang Y,Zhu H,Bauelos G,Yan B,Zhou Q,Yu X,Cheng X.Constructed wetlands for saline wastewater treatment:A review.Ecological Engineering,2016,98:275-285.
[2] Azizi S,Tabari M,Striker G G.Growth,physiology,and leaf ion concentration responses to long-term flooding with fresh or saline water ofPopuluseuphratica.South African Journal of Botany,2017,108:229-236.
[3] Geilfus C M,Niehaus K,Gödde V,Hasler M,Zörb C,Gorzolka K,Jezek M,Senbayram M,Müller J L,Mühling K H.Fast responses of metabolites inViciafabaL. to moderate NaCl stress.Plant Physiology and Biochemistry,2015,92:19-29.
[4] Nunkaew T,Kantachote D,Kanzaki H,Nitoda T,Ritchie R J.Effects of 5-aminolevulinic acid (ALA)-containing supernatants from selectedRhodopseudomonaspalustrisstrains on rice growth under NaCl stress,with mediating effects on chlorophyll,photosynthetic electron transport and antioxidative enzymes.Electronic Journal of Biotechnology,2014,17(1):19-26.
[5] Gong B,Wen D,Vanden Langenberg K,Wei M,Yang F,Shi Q,Wang X.Comparative effects of NaCl and NaHCO3stress on photosynthetic parameters,nutrient metabolism,and the antioxidant system in tomato leaves.Scientia Horticulturae,2013,157:1-12.
[6] 陆开形.盐胁迫对大豆光合作用和抗氧化系统的影响及其调控机制.杭州:浙江大学博士学位论文,2008. Lu K X.Effects and regulation mechanism of salt stress on photosynthesis and antioxidant system in soybean.PhD Thesis.Hangzhou:Zhejiang University,2008.(in Chinese)
[7] 赵生龙,曾凡江,张波,刘波,高欢欢,罗瀚林.盐分胁迫对骆驼刺幼苗叶片性状的影响.草业科学,2016,33(9):1770-1778. Zhao S L,Zeng F J,Zhang B,Liu B,Gao H H,Luo H L.Effects of salt stress on leaf traits ofAlhagisparsifolia.Pratacultural Science,2016,33(9):1770-1778.(in Chinese)
[8] 潘多锋,申忠宝,王建丽,高超,李道明,张瑞博,邸桂俐,刘慧来.碱性盐胁迫对偃麦草苗期生长的影响.草业科学,2016,33(11):2276-2282. Pan D F,Shen Z B,Wang J L,Gao C,Li D M,Zhang R B,Di G L,Liu H L.Effects of saline-alkaloid stress on the seedling growth and physiological characteristics ofElystrigiarepens.Pratacultural Science,2016,33(11):2276-2282.(in Chinese)
[9] 孙清洋,李志勇,李鸿雁,李俊.不同盐浓度下9份老芒麦种质材料的萌发及生理特性.草业科学,2016,33(11):2266-2275. Sun Q Y,Li Z Y,Li H Y,Li J.Seed germination and physiological characteristics of nineElymussibiricusaccessions under different salt stress.Pratacultural Science,2016,33(11):2266-2275.(in Chinese)
[10] Gorai M,Aloui W,Yang X,Neffati M.Toward understanding the ecological role of mucilage in seed germination of a desert shrubHenophytondeserti:Interactive effects of temperature,salinity and osmotic stress.Plant and Soil,2014,374(1):727-738.
[11] 王家源.苦楝种苗耐盐胁迫的生理响应机制研究.南京:南京林业大学博士学位论文,2013. Wang J Y.Studies on salt-tolerant mechanism of seeds and seedlings inMeliaazedarachL. PhD Thesis.Nanjing:Nanjing Forestry University,2013.(in Chinese)
[12] Gadallah M A.Effects of proline and glycinebetaine onViciafabaresponses to salt stress.Biologia Plantarum,1999,42(2):249-257.
[13] Renner S S,Ricklefs R E.Dioecy and its correlates in the flowering plants.American Journal of Botany,1995:596-606.
[14] 何梅,孟明,施大伟,王涛,李圆,谢寅峰.雌雄异株植物对干旱胁迫响应的性别差异.植物资源与环境学报,2015,24(1):99-106. He M,Meng M,Shi D W,Wang T,Li Y,Xie Y F.On gender difference of dioecious plant in response to drought stress.Journal of Plant Resources and Environment,2015,24(1):99-106.(in Chinese)
[15] 陈娟,李春阳.环境胁迫下雌雄异株植物的性别响应差异及竞争关系.应用与环境生物学报,2014,20(4):743-750. Chen J,Li C Y.Sex-specific responses to environmental stresses and sexual competition of dioecious plants.China Journal Applied Environment Biology,2014,20(4):743-750.(in Chinese)
[16] Xu X,Yang F,Xiao X,Zhang S,Korpelainen H,Li C Y.Sex-specific responses ofPopuluscathayanato drought and elevated temperatures.Plant,Cell & Environment,2008,31(6):850-860.
[17] 王碧霞,肖娟,冯旭,甘丽芬,唐娅.铬胁迫对葎草雌雄植株光合生理特性的不同影响.草业学报,2016,25(7):131-139. Wang B X,Xiao J,Feng X,Gan L F,Tang Y.Effects of Chromium stress on physiological and ecophysiological characteristics of male and female plants ofHumulusscandens.Acta Prataculturae Sinica,2016,25(7):131-139.(in Chinese)
[18] 胥晓,杨帆,尹春英,李春阳.雌雄异株植物对环境胁迫响应的性别差异研究进展.应用生态学报,2007,18(11):2626-2631. Xu X,Yang F,Yin C Y,Li C Y.Research advances in sex-specific responses of dioecious plants to environmental stresses.Chinese Journal of Applied Ecology,2007,18(11):2626-2631.(in Chinese)
[19] Megdiche W,Hessini K,Gharbi F,Jaleel C A,Ksouri R,Abdelly C.Photosynthesis and photosystem 2 efficiency of two salt-adapted halophytic seashoreCakilemaritimaecotypes.Photosynthetica,2008,46(3):410-419.
[20] 蒋雪梅,胡进耀,戚文华,陈光登,胥晓.银杏幼苗雌雄株对盐胁迫响应的差别.云南植物研究,2009,31(5):447-453. Jiang X M,Hu J Y,Qi W H,Chen G D,Xu X.Different physiological responses of male and femaleGinkgobiloba(Ginkgoaceae) seedlings to salt stress.Acta Botanica Yunnanica,2009,31(5):447-453.(in Chinese)
[21] 张国新,刘雅辉,李强,王秀萍,鲁雪林,薛志忠.梯度滨海盐土对费菜生长指标及 Na+,K+分布的影响.中国农学通报,2015,31(10):163-166. Zhang G X,Liu Y H,Li Q,Wang X P,Lu X L,Xue Z Z.Effect of gradient coastal saline soil on growth index and Na+,K+distribution ofSedumaizoon.Chinese Agricultural Science Bulletin,2015,31(10):163-166.(in Chinese)
[22] Berry J A,Downton W J S.Environmental regulation of photosynthesis.Photosynthesis,1982,2:263-343.
[23] Arnon D I.Copper enzymes in isolated chlorplastes.Polyphenoloxidase inBetavulgaris.Plant Physiology,1949,24:1-15.
[24] Lichtenthaler H K.Chlorophyll and carotenoids:Pigments of photosynthetic biomembranes.Methods in Enzymology,1987,148:350-382.
[25] Chance M,Maehly A C.Assay of catalases and peroxidases.Methods Enzymol,1955,2:764-817.
[26] 李合生,孙群,赵世杰,章文华.植物生理生化实验原理和技术.北京:高等教育出版社,2000,165-167. Li H S,Sun Q,Zhao S J,Zhang W H.Principles and Techniques of Plant Physiological and Biochemical Experiment.Beijing:Higher Education Press,2000:165-167.(in Chinese)
[27] Dawson T E,Ehleringer J R.Gender-specific physiology,carbon isotope discrimination,and habitat distribution in boxelder,Acernegundo.Ecology,1993:798-815.
[28] Li C,Ren J,Luo J,Lu R S.Sex-specific physiological and growth responses to water stress inHippophaerhamnoidesL. populations.Acta Physiologiae Plantarum,2004,26(2):123-129.
[29] 刘金平,段婧.营养生长期雌雄葎草表观性状对水分胁迫响应的性别差异.草业学报,2013,22(2):243-249. Liu J P,Duan J.Humulusscandensgender differences in response to water stress in the vegetative growth stage.Acta Prataculturae Sinica,2013,22(2):243-249.(in Chinese)
[30] 尹春英,李春阳.雌雄异株植物与性别比例有关的性别差异研究现状与展望.应用与环境生物学报,2007,13(3):419-425. Yin C Y,Li C Y.Gender differences of dioecious plants related sex ratio:Recent advances and future prospects.Journal of Applied and Environmental Biology,2007,13(3):419-425.(in Chinese)
[31] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis.Annual Review of Plant Physiology,1982,33(1):317-345.
[32] 许大全,张玉忠,张荣铣.植物光合作用的光抑制.植物生理学通讯,1992,28(4):237-243. Xu D Q,Zhang Y Z,Zhang R X.Photoinhibition of photo synthesis in plants.Plant Physiology Communications,1992,28(4):237-243.(in Chinese)
[33] 李俊钰,胥晓,杨鹏,王碧霞,王志峰,李霄峰.铝胁迫对青杨雌雄幼苗生理生态特征的影响.应用生态学报,2012,23(1):45-50. Li J Y,Xu X,Yang P,Wang B X,Wang Z F,Li X F.Effects of aluminum stress on ecophysiological characteristics of male and femalePopuluscathayanaseedlings.Chinese Journal of Applied Ecology,2012,23(1):45-50.(in Chinese)
[34] Allakhverdiev S I,Sakamoto A,Nishiyama Y,Murata N.Inactivation of photosystems Ⅰ and Ⅱ in response to osmotic stress in Synechococcus.Contribution of water channels.Plant Physiology,2000,122(4):1201-1208.
[35] 张守仁.叶绿素荧光动力学参数的意义及讨论.植物学通报,1999,16(4):444-448. Zhang S R.A discussion on chlorophyll fluorescence kinetics parameters and their significance.Chinese Bulletin of Botany,1999,16(4):444-448.(in Chinese)
[36] 贺俊东,胥晓,郇慧慧,杨帅,秦芳.青杨雌雄扦插苗光合作用日变化与叶绿素荧光参数特征.植物研究,2014,34(2):219-225. He J D,Xu X,Huan H H,Yang S,Qin F.Characteristics of chlorophyll fluorescent parameters and daily dynamics of photosynthesis in female and malePopuluscathayanacutting seedlings.Bulletin of Botanical Research,2014,34(2):219-225.(in Chinese)
(责任编辑 张瑾)
Gender differences ofHumulusscandensseedlings in response to NaCl stress
Wang Bi-xia, Li Yun-xiang
(1.College of Environmental Science and Engineering, China West Normal University, Nanchong 637009, China)
In this study, we examined sex-specific differences in leaf area, gas exchange parameters, leaf water potential and chlorophyll fluorescence of male and female seedlings ofHumulusscandensunder NaCl stress (0, 100, 200 and 300 mmol·L-1NaCl). Under the effects of NaCl, the net photosynthetic rate (Pn), stomatal conductance (Gs), intercellular CO2concentration (Ci), transpiration rate (Tr), leaf water potential (ψw), catalase (CAT), limiting value of stomata(Ls) and malondialdehyde (MDA) of male and female seedlings increased gradually. The leaf area of single leaves increased first and then decreased. The maximum fluorescence (Fm), the variable fluorescence (Fv), the potential activity of PSⅡ (Fv/Fo) and the non-photochemical quenching coefficient (qN) of the females gradually increased with the increase of NaCl stress. The photochemical quenching coefficient (qP) and chlorophyll content decreased by degrees. Overall, the ETR, Fv, Fv/Fmand Fv/Foof the males showed an increasing trend, but qN and qP decreased, while chlorophyll content increased first and then decreased. Therefore, the physiological and biochemical characteristics such as single leaf area, chlorophyll content, chlorophyll fluorescence, gas exchange, and CAT and MDA contents in male and female seedlings ofH.scandenswere affected by NaCl stress. There were significant gender differences in the response of male and female seedlings to NaCl stress. Compared to the males, the females had greater resistance against NaCl stress.
Humulusscandens; dioecism; NaCl stress; gender difference; gas exchange; chlorophyll content; chlorophyll fluorescence
Wang Bi-xia E-mail:696wbx@163.com
2017-02-23 接受日期:2017-04-06
四川省教育厅项目(12ZB142)
王碧霞(1977-),女,四川营山人,讲师,硕士,主要从事环境生态方面的研究。E-mail:696wbx@163.com
10.11829/j.issn.1001-0629.2017-0082
S543+.903.4;Q945.78
A
1001-0629(2017)07-1487-09
王碧霞,黎云祥.葎草幼苗对盐胁迫响应的性别差异.草业科学,2017,34(7):1487-1495.
Wang B X,Li Y X.Gender differences ofHumulusscandensseedlings in response to NaCl stress.Pratacultural Science,2017,34(7):1487-1495.
