外源NO对盐胁迫下沙打旺种子萌发和幼苗生长的影响
2017-08-11王建武王建军王富刚
陈 花,王建武,王建军,王富刚
(1.榆林学院生命科学学院,陕西 榆林 719000; 2.榆林学院能源工程学院,陕西 榆林 719000)
外源NO对盐胁迫下沙打旺种子萌发和幼苗生长的影响
陈 花1,王建武1,王建军2,王富刚1
(1.榆林学院生命科学学院,陕西 榆林 719000; 2.榆林学院能源工程学院,陕西 榆林 719000)
本研究以沙打旺(Astragalusadsurgens)种子为材料,硝普钠(sodium nitroprusside,SNP)为外源NO供体,测定不同浓度(30、60、90、120、150、200、300 μmol·L-1)SNP处理盐胁迫(0.3%)下沙打旺的种子萌发和幼苗生长,以此探讨NaCl胁迫下外源NO在沙打旺种子萌发和幼苗生长过程中的生理调节功能。结果表明,沙打旺种子和幼苗经SNP处理后,除300 μmol·L-1SNP处理对盐胁迫下沙打旺种子萌发和幼苗生长起到一定的抑制作用外,其余SNP处理组均能不同程度地减缓盐胁迫造成的损伤;60 μmol·L-1SNP能显著降低盐胁迫对沙打旺种子造成的伤害(P<0.05),该处理下沙打旺种子的发芽势、发芽率、发芽指数、活力指数、胚根长较单盐对照分别提高了54.5%、22.6%、58.2%、112.0%、43.7%,并且接近或略高于空白对照;120 μmol·L-1SNP明显减轻了盐对沙打旺幼苗的胁迫(P<0.05),沙打旺幼苗叶片叶绿素含量、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)的活性分别较单盐对照提高了208.91%、117.565%、40.24%和89.95%,丙二醛含量降低了32.55%。综上所述,适宜浓度的外源NO能够提高盐胁迫下沙打旺种子的萌发,促进幼苗叶绿素的合成,降低丙二醛含量,减少膜脂过氧化产物,保护叶绿体膜的完整性,提高SOD、CAT和POD活性,抑制过氧化物和自由基的积累,加快幼苗生长,从而缓解盐胁迫对沙打旺幼苗的伤害。
硝普钠;沙打旺;萌发特性;幼苗生长;抗氧化酶;叶绿素含量;丙二醛
土壤盐渍化已成为全世界极其重要的农业与环境问题[1]。在中国盐渍化土壤所占比例极高[2]。高浓度的盐会对植物造成高渗透胁迫,导致植物代谢缓慢,进而影响植物的产量。盐害已成为阻碍牧草生长的重要逆境因子之一,利用和培育抗盐牧草被认为是缓解土壤盐渍化的一条重要途径[3]。沙打旺(Astragalusadsurgens)属豆科多年生草本植物。种植沙打旺不仅可以改良土壤,还可以减少风沙危害、保护果林、防止水土流失。因此,沙打旺成为了中国北方地区尤其是地处毛乌素沙漠的陕北榆林地区肥力土壤、水土保持及快速绿化荒山的先锋草种[4],但陕北地处干旱和半干旱地区,灌溉及降水的缺乏加剧了土壤的盐渍化程度,因此盐胁迫已成为影响其生长发育的主要限制因子之一。NO作为一种重要的信号分子,广泛参与植物多种代谢反应,诸如种子萌发、植株生长发育以及高等植物对逆境胁迫的反应。研究表明,适宜浓度的外源NO对植物抗性有明显的提高作用。近年来,硝普钠(SNP)作为外源NO供体在提高种子萌发和幼苗生理特性方面的研究不在少数,对玉米(Zeamays)[5]、小麦(Triticumaestivum)[6]、燕麦(Avenasativa)[7-8]、辣椒(Capsicumannuum)[9]、黄瓜(Cucumissativus)[10]、桔梗(Platycodongrandiflorus)[11]、板蓝根(Isatistinctoria)[12]、紫花苜蓿(Medicagosativa)[13]、沙葱(Alliummongolicum)[14]、早熟禾(Poaannua)[15]、蒺藜苜蓿(M.truncatula)[16]等物种都有涉及。樊怀福等[17]研究了盐胁迫下外源NO对黄瓜生长的影响,发现外源NO可以显著缓解盐胁迫对黄瓜生长造成的不利影响;孙立荣等[18]研究了外源NO对盐胁迫下黑麦草(Loliumperenne)幼苗生长的影响,发现盐胁迫对黑麦草幼苗生长所造成的抑制作用经外施不同浓度的SNP后得到了缓减,这种缓减程度与外施SNP浓度和NaCl胁迫程度有关;潘龙和谷文英[19]研究SNP浸种对紫花苜蓿种子萌发及幼苗生长的影响,发现SNP可以缓解盐胁迫对种子萌发和酶活性的影响。但是,外源NO对盐胁迫下沙打旺种子萌发和幼苗生长发育方面的影响还未见报道。为此,本研究通过外源NO供体SNP处理盐胁迫下的沙打旺种子和幼苗,探讨外源NO对盐胁迫下沙打旺种子萌发和幼苗生理代谢的影响,以期为外源NO提高植物耐盐性提供理论依据和指导生产实践。
1 材料与方法
1.1 供试材料
供试材料沙打旺种子来自陕西省榆林市农业科学院,于2014年10月上旬采收自榆林市榆阳区古塔乡杭庄村(109°15′ E, 37°36′ N,海拔 1 100 m),千粒重为1.7 g。NO供源为硝普纳[Na2Fe(CN)5NO·2H2O],北京化工厂生产。
1.2 试验方法
1.2.1 种子萌发试验及其测定方法 选取籽粒饱满、大小均一的沙打旺种子,用1%的次氯酸钠消毒5 min,蒸馏水冲洗至无味后浸种24 h,将浸种催芽后的种子播于垫有双层滤纸的培养皿(直径为9 cm)中,每皿播50粒种子。处理1:设置不添加NaCl(空白对照,CK1)和添加浓度为0.1%、0.2%、0.3%、0.4%和0.5%的NaCl溶液,共6个盐胁迫处理,每皿添加4 mL NaCl溶液使滤纸饱和,每个处理3次重复。处理2:分别用蒸馏水(单盐对照,CK2)、30、60、90、120、150、200、300 μmol·L-1SNP溶液浸种48 h后,根据处理1试验筛选到的沙打旺种子各项发芽指标均受到抑制的NaCl胁迫临界阈值为0.3%,对上述处理组均用0.3% NaCl处理,放入GZ-025型全自动光照培养箱中萌发,温度设定为(20±2) ℃,光照12 h,黑暗12 h,光照强度15 000 lx。
培养7 d后,以胚根突破种皮2 mm为标准,逐日统计种子萌发,并按照如下公式计算发芽率(GP)[20]、发芽势(GE)[21]、发芽指数(GI)[22]和活力指数(VI)[23]:
GP=n/N,
式中:n为第7天时的种子发芽数,N为供试种子总数;
GE=n4/N,
式中:n4为第4天的种子发芽数,N为供试种子总数;
GI=∑(Gt/Dt),
式中:Gt为第t天的种子发芽数,Dt为对应Gt的发芽天数;
VI=幼苗长度×发芽率。
萌发试验结束后,从每个处理的3个重复中选取长势相近的15株幼苗,用精度为0.1 mm 的游标卡尺分别测定胚根长,对于生长歪曲的幼苗,可以先用细绳测量其胚根长,再用游标卡尺间接测量,最终求取15株幼苗胚根长度的平均数,即为每个处理的平均胚根长。
1.2.2 幼苗处理试验及其测定方法 种子发芽待两片子叶展开时,移至装有干净沙土的花盆中,出苗后用Hoagland营养液定期浇灌。待株高达10 cm时,每天用SNP溶液进行叶面喷施60 mL,SNP溶液设0、30、60、90、120、150、200和300 μmol·L-18个浓度处理,每个处理3次重复,同时每隔3 d各处理组浇灌0.3% NaCl溶液 50 mL,空白对照为CK1,单盐对照为CK2。
于开始处理后第10天,在每个处理组采集足够数量的沙打旺幼苗上叶片,去除叶片表面污物和叶脉,用液氮速冻后保存在-80 ℃冰箱中,进行各指标的测定。叶绿素含量测定采用丙酮乙醇混合液法[24],丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法[24],超氧化物歧化酶(SOD)活性测定采用NBT光化还原法[25],过氧化物酶(POD)活性测定采用愈创木酚法测定;过氧化氢酶(CAT)活性测定采用紫外分光光度法[26]。
1.3 统计分析
采用Microsoft Excel 2010进行数据统计和制图,结果均用平均值±标准误表示,对不同SNP浓度下的种子萌发指标和幼苗生长等生理指标用SPSS19.0软件进行单因素方差分析,用SSR法检验差异显著性(α=0.05)。
2 结果与分析
2.1 外源NO对盐胁迫下沙打旺种子萌发的影响
经不同浓度NaCl处理,沙打旺种子的发芽率、发芽势、发芽指数、活力指数和胚根长均呈下降趋势,且随NaCl浓度不断增加,下降幅度越明显(表1)。与空白对照CK1相比, 0.1%NaCl处理下,发芽势、发芽率、发芽指数、活力指数和胚根长分别下降了4.7%、2.7%、12.8%、6.1%和15.8%,其中,发芽率和胚根长达到了显著水平(P<0.05);0.3% NaCl处理下,发芽势、发芽率、发芽指数、活力指数和胚根长分别下降了34.5%、16.9%、38.5%、54.2%和29.5%,差异均显著(P<0.05);当NaCl浓度达到0.5%时,各项指标降低百分率除发芽率达到44.7%外,其余均超过60%,可见一定浓度的NaCl处理抑制了种子的萌发,低浓度抑制作用小,高浓度抑制作用大。另外,在相同浓度的NaCl处理下,发芽势与发芽率相比,发芽势受到的抑制更为严重。
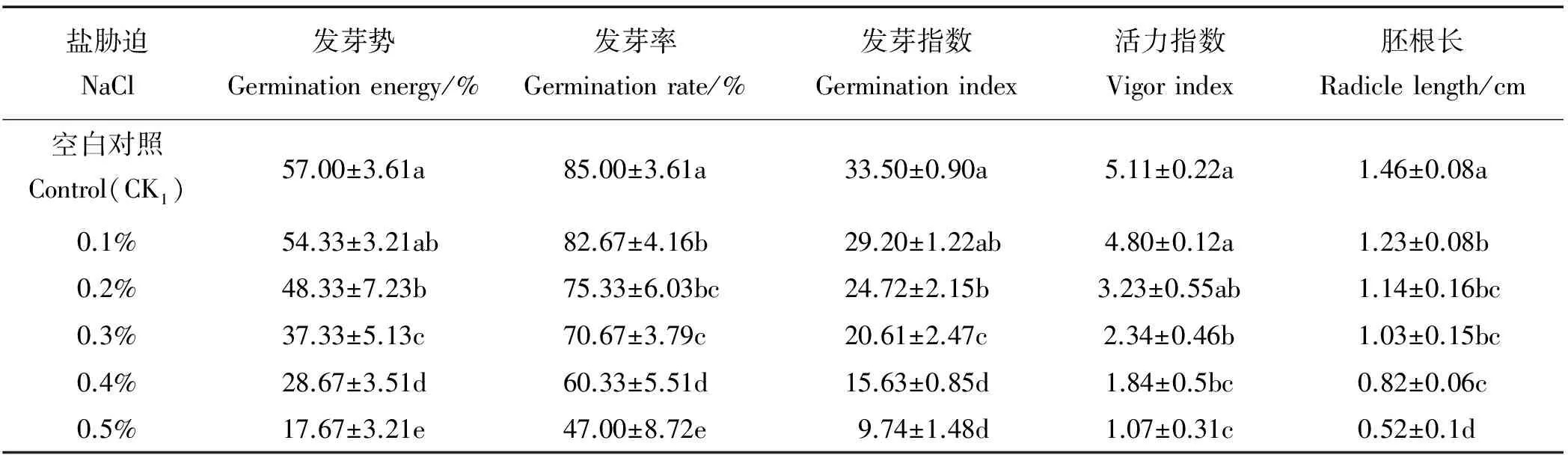
表1 NaCl对沙打旺种子萌发的影响Table 1 Effects of NaCl on seed germination of Astragalus adsurgens
注:同列不同小写字母表示处理间差异显著(P<0.05)。下表同。
Note: Different lowercase letters indicate significant difference among the treatments at the 0.05 level. similarly for the following tables.
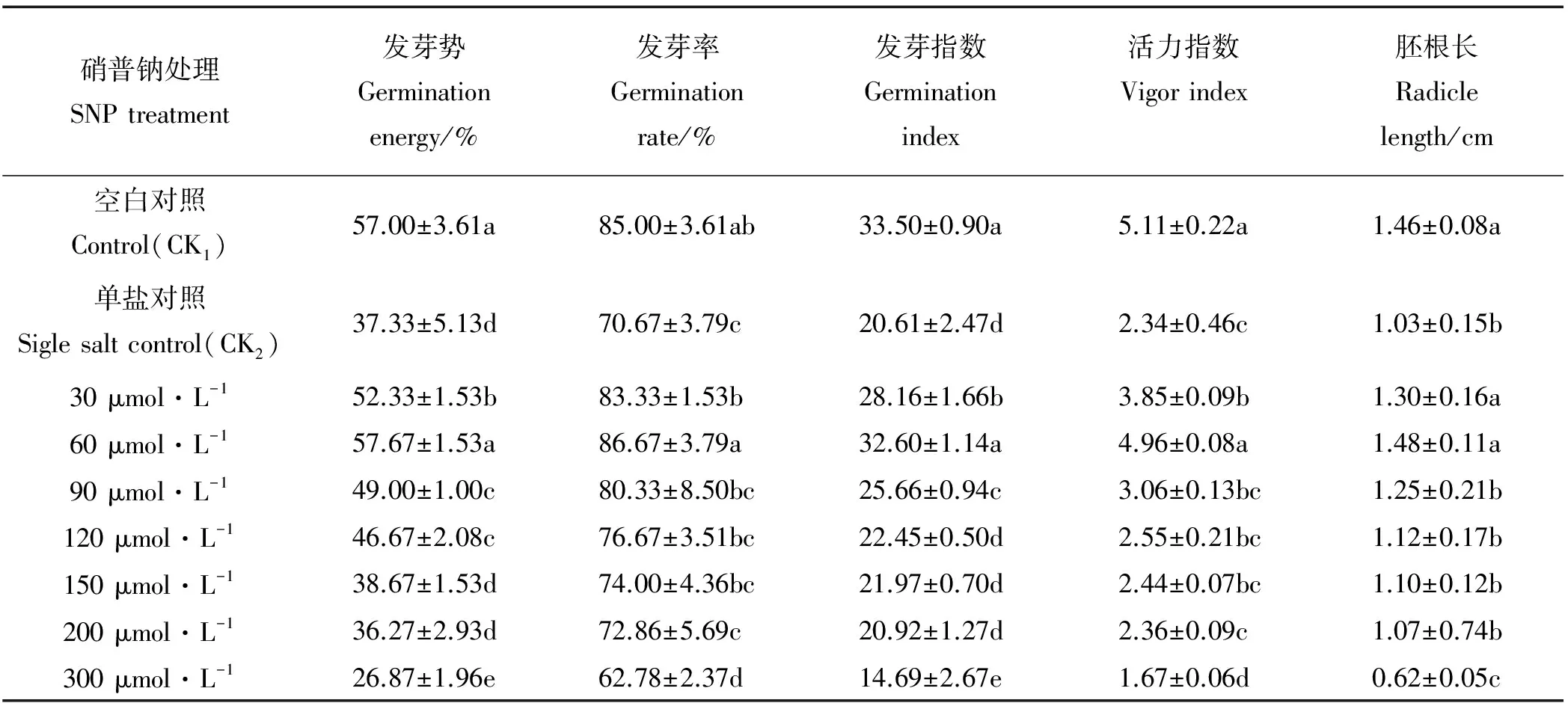
表2 外源NO对0.3%盐胁迫下沙打旺种子萌发的影响Table 2 Effects of exogenous nitric oxide on seed germination of Astragalus adsurgens under 0.3% NaCl stress
0.3% NaCl处理下,种子萌发的各项指标均受到了抑制,在此基础上施加不同浓度的SNP,可以不同程度地缓解盐对种子萌发的迫害,且随SNP浓度的增大,种子的抗盐性呈先上升后下降趋势(表2)。与单盐对照CK2相比,SNP浓度为60 μmol·L-1时,种子抗盐性最强,发芽势、发芽率、发芽指数、活力指数、胚根长分别提高了54.49%、22.64%、58.18%、112.53%和43.69%,并接近或略高于空白对照CK1;大于60 μmol·L-1时,各项萌发指标的增长百分率下降,种子抗盐性的提高幅度逐渐降低;当达到300 μmol·L-1时,种子受到的盐迫害程度最大,发芽势、发芽率、发芽指数、活力指数、胚根长分别降低了28.02%、11.17%、28.72%、28.63%、39.81%,均达到了显著水平(P<0.05)。因此,在0.3%的NaCl处理下,60 μmol·L-1的SNP为促进沙打旺种子萌发的最适盐胁迫缓解浓度。
2.2 外源NO对盐胁迫下沙打旺幼苗叶绿素含量的影响
叶绿素是光合色素,直接反映光合作用强度,其含量的多少反映了盐胁迫下植物光合作用所受的损害程度[27]。
经SNP处理后的盐胁迫下的沙打旺幼苗叶绿素含量均高于单盐对照(CK2),低于空白对照(CK1)(图1)。与空白对照相比,单盐胁迫处理10 d后,沙打旺幼苗叶绿素含量显著下降了67.43%(P<0.05)。这表明0.3% NaCl 处理显著抑制了沙打旺幼苗叶绿素的合成。经SNP处理后,随SNP浓度的增加,叶绿素含量呈先上升后下降的趋势。与单盐对照相比,SNP浓度为120 μmol·L-1时叶绿素显著提高了208.91%(P<0.05);超过150 μmol·L-1时,叶绿素含量呈下降趋势;达到300 μmol·L-1时,叶绿素含量高于单盐对照44.24%,但差异不显著(P>0.05)。说明SNP对盐胁迫下沙打旺幼苗叶绿素含量下降有一定的缓解作用,并且在适宜的范围下缓解作用较为明显。
2.3 外源NO对盐胁迫下沙打旺幼苗丙二醛含量的影响
丙二醛(MDA)是膜脂过氧化产物,其含量的多少表示膜损伤程度的大小[27]。丙二醛含量的变化与叶绿素含量变化相反(图2)。经SNP处理后的盐胁迫下的沙打旺幼苗丙二醛含量均低于单盐对照(CK2)高于空白对照(CK1)。与空白对照相比,单盐胁迫处理10d后,沙打旺幼苗MDA的含量显著上升了62.54% (P<0.05)。与单盐对照相比,90和120 μmol·L-1SNP处理下的MDA含量最低,分别下降了30.95%、32.55%,均达到了显著水平(P<0.05);当SNP浓度高于120 μmol·L-1时,MDA含量随SNP浓度升高而升高;当达到300 μmol·L-1时,MDA含量仅上升了6.33%,差异不显著(P>0.05)。由此说明,只有适宜浓度的SNP溶液可降低盐胁迫对沙打旺幼苗造成的氧化损伤。
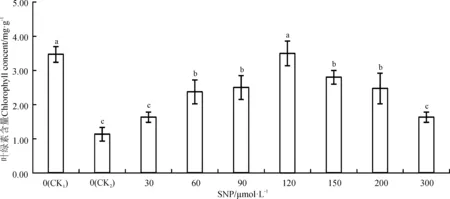
图1 外源NO对0.3%盐胁迫下沙打旺幼苗叶片叶绿素的影响Fig. 1 Effects of exogenous nitric oxide (NO) on the content of chlorophyll in leaves of Astragalus adsurgens seedlings under 0.3% NaCl stress
注:CK1,空白对照;CK2,单盐对照。不同小写字母表示不同处理间差异显著(P<0.05)。下图同。
Note: CK1, control; CK2, 0.3 NaCl without SNP; Different lowercase letters indicate significant difference among treatments (P<0.05). similary for the following figures.
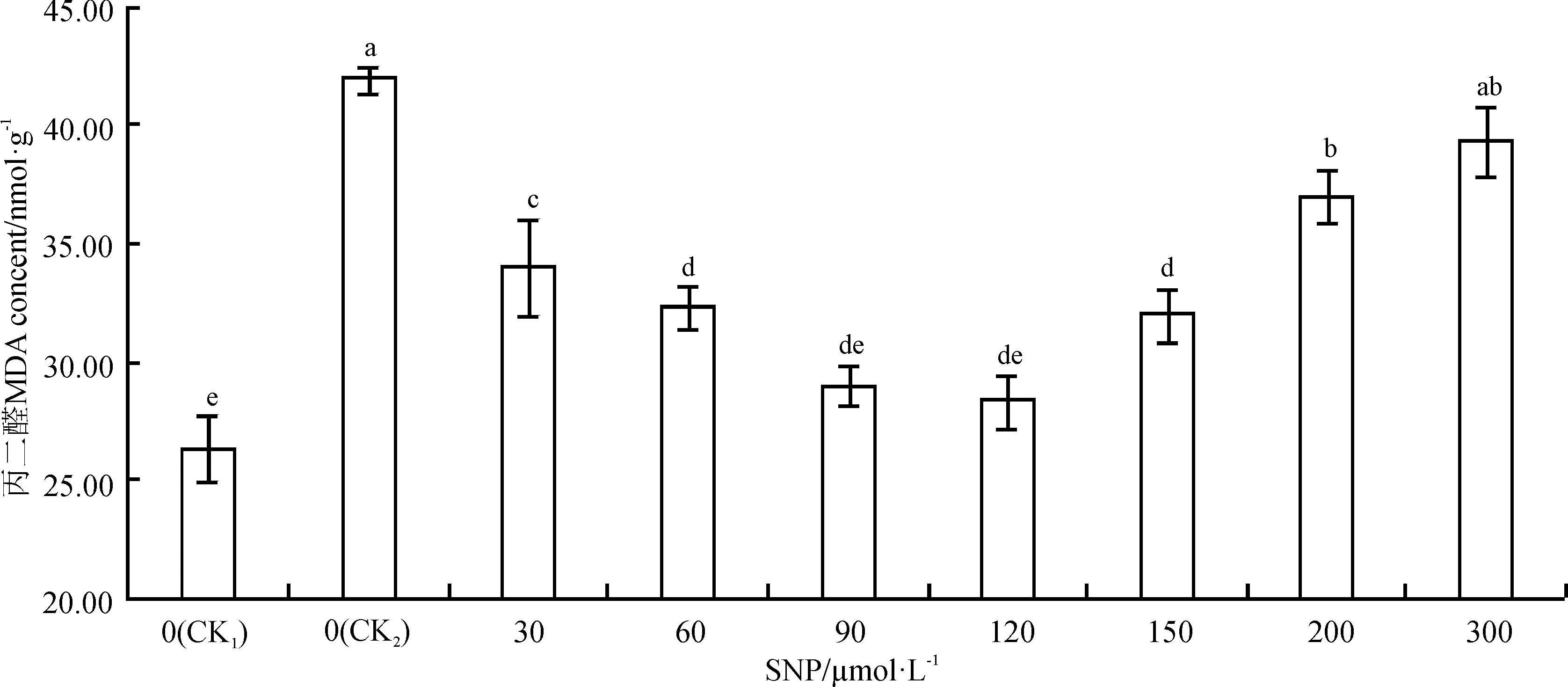
图2 外源NO对0.3%盐胁迫下沙打旺幼苗叶片MDA含量的影响Fig. 2 Effects of exogenous NO on the content of malondialdehyde (MDA) in leaves of Astragalus adsurgens seedlings under 0.3% NaCl stress
2.4 外源NO对盐胁迫下沙打旺幼苗超氧化物歧化酶活性的影响
逆境打破了植物体内活性氧代谢系统的平衡,SOD可通过歧化反应清除O2-,形成-OH和H2O2[27]。
与空白对照(CK1)相比,单盐胁迫(CK2)处理10 d后,沙打旺幼苗SOD活性显著下降了50.52%(P<0.05)(图3)。随SNP浓度增加,SOD活性呈先上升后下降趋势,除300 μmol·L-1SNP处理组低于单盐对照组外,其余处理组均高于单盐对照组、低于空白对照组。SNP浓度在120、150 μmol·L-1时,SOD活性与单盐对照相比,增长幅度较大,分别为117.56%、98.04%,均达到显著水平(P<0.05);高于150 μmol·L-1时,SOD活性呈下降趋势; 300 μmol·L-1时,SOD活性较单盐对照组下降了5.72%,差异不显著(P>0.05)。说明适宜浓度的SNP处理有利于提高盐胁迫下沙打旺幼苗SOD活性,当浓度较高时,可抑制SOD活性。
2.5 外源NO对盐胁迫下沙打旺幼苗叶片过氧化氢酶活性的影响
逆境胁迫造成了植物体内积累了大量的活性氧成分,过氧化氢酶(CAT)是主要清除H2O2的酶类[27]。各处理组间CAT活性变化较为平缓(图4)。沙打旺幼苗经单盐胁迫处理10 d后,较空白对照(CK1)显著下降了24.16%(P<0.05)。随SNP浓度的升高,CAT活性与单盐对照(CK2)相比均有不同程度的升高,在30~120 μmol·L-1SNP处理下,CAT活性分别提高了12.74%、25.63%、28.95%、40.24%,差异均显著(P<0.05),其中120 μmol·L-1SNP处理组提高幅度最大;SNP浓度高于120 μmol·L-1时,CAT活性呈下降趋势,但仍高于单盐对照。说明SNP对盐胁迫下沙打旺幼苗CAT活性有提升作用,并且120 μmol·L-1是其最适浓度值。
2.6 外源NO对盐胁迫下沙打旺幼苗叶片过氧化物酶活性的影响
逆境下,植物体内活性氧代谢系统失衡,过氧化物酶(POD)是植物体内清除-OH的主要酶类[27]。单盐胁迫处理10 d后,沙打旺幼苗POD活性较空白对照(CK1)显著下降了37.82%(P<0.05)(图5)。随SNP浓度的增加,POD的活性呈先增后减趋势。其中,120 μmol·L-1SNP处理组POD活性最大,较单盐对照显著上升了89.95%;SNP浓度高于120μmol·L-1时,POD活性开始下降,但均高于单盐对照;达到300 μmol·L-1时,与单盐对照相比,只提高了4.92%,差异不显著(P>0.05)。说明SNP浓度在一定条件下对盐胁迫下沙打旺幼苗的POD酶活性具有提高作用,浓度过高可能会在一定程度上抑制POD酶活性。

图3 外源NO对0.3%盐胁迫下沙打旺幼苗叶片SOD活性的影响Fig. 3 Effect of exogenous NO on the activity of superoxide dismutase (SOD) in leaves of Astragalus adsurgens seedlings under 0.3% NaCl stress
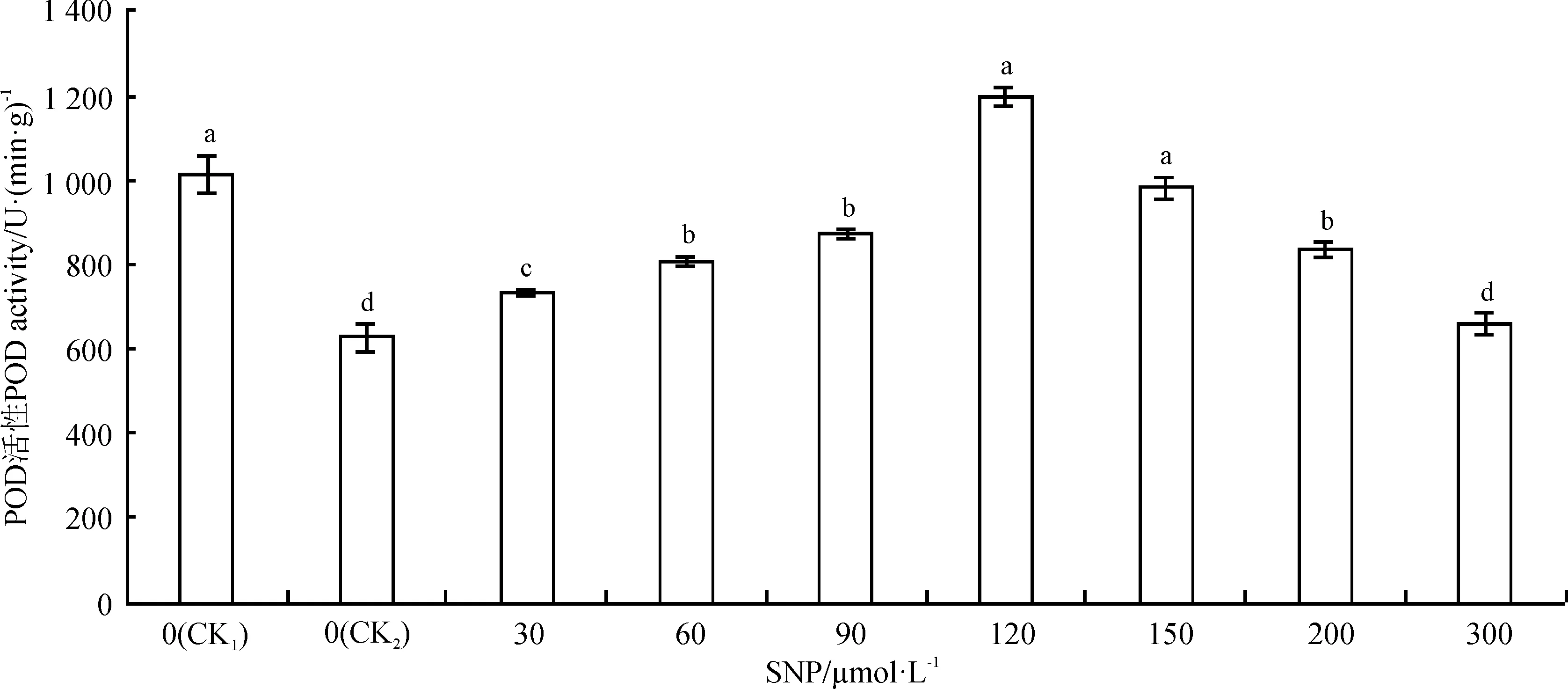
图5 外源NO对盐胁迫下沙打旺幼苗叶片POD活性的影响Fig. 5 Effect of exogenous NO on the activity of peroxidase (POD) in leaves of Astragalus adsurgens seedlings under NaCl stress
3 讨论
3.1 外源NO对盐胁迫下沙打旺种子萌发的影响
盐分对种子萌发产生影响主要是通过离子效应和渗透效应两条途径,离子效应的主要影响机理是离子毒害作用,Na+等离子渗入细胞后使原生质凝集和叶绿素被破坏,蛋白质水解加强,最终导致氨基酸转化成了丁二胺、戊二胺等,引起细胞中毒死亡;渗透效应的主要影响机理是高盐环境导致植物细胞大量失水造成生理干旱[28-29]。本研究表明,0.3%NaCl胁迫对沙打旺种子萌发起了一定的抑制作用,当NaCl浓度增加到0.5%时严重地抑制了种子的萌发。
现今,NO在植物学方面的研究已经取得了很大的进展并且达成了较为广泛的共识,不仅可以提高植物的耐盐性,在植物的抗寒和抗旱方面也有一定的作用,但主要集中在抗盐性方面。SNP是一种常用的外源NO供体。雍山玉[9]认为,0.1~0.7 mmol·L-1的SNP处理可提高盐胁迫下的辣椒种子萌发,其中SNP浓度为0.1、0.3 mmol·L-1时促进效果相对较好。王春林等[10]研究表明,适宜浓度的SNP可以明显提高盐胁迫下白皮黄瓜种子的萌发,其中以0.10 mmol·L-1的SNP对盐害的缓解效果较好。本研究表明,30~200 μmol·L-1SNP处理能缓解盐胁迫对沙打旺种子萌发的影响,而300 μmol·L-1高浓度SNP预处理后种子的各项萌发指标反而低于单盐对照。说明适宜浓度SNP可以缓解盐胁迫对沙打旺种子萌发的影响,提高盐胁迫下种子的抗盐性,其中以60 μmol·L-1的SNP对盐害的缓解效果最好,浓度过高对种子萌发起到抑制作用。
3.2 外源NO对盐胁迫下沙旺幼苗叶片叶绿素含量的影响
叶绿素被称为天然色素,通过吸收光能,促进植物的光合作用。本研究中,0.3%盐胁迫下显著地抑制了沙打旺幼苗叶绿素的合成,幼苗经SNP(60~200 μmol·L-1)处理后,均可显著提高叶绿素含量,其中120 μmol·L-1SNP作用效果最明显,30和300 μmol·L-1SNP作用下的叶绿素含量差异不显著,但均高于单盐对照组,这与SNP对紫花苜蓿[19]、黄瓜[17]和辣椒[9]幼苗叶绿素含量的影响一致。说明外源NO提高了盐胁迫下幼苗的叶绿素含量,强化了幼苗的光合作用,从而提供了幼苗生长所需要的营养物质,促进了幼苗的抗盐性。
3.3 外源NO对盐胁迫下沙打旺幼苗叶片丙二醛含量的影响
MDA是脂质过氧化的最终分解产物之一,其含量反映了细胞膜脂质过氧化程度及植物遭受迫害的强度[27]。本研究中,单盐处理沙打旺幼苗,其叶片MDA的含量显著升高,说明盐产生的过氧化物对膜脂的伤害较大,进而会影响植物细胞膜的通透性,通透性的改变对离子的选择运输和运输速度等产生影响,同时还造成膜内有机质的外渗,从而影响了细胞的代谢活动[30]。经SNP处理盐胁迫下的沙打旺幼苗,与单盐对照相比,MDA含量显著下降,在120 μmol·L-1SNP时达到最低值,大于此浓度时MDA含量呈现上升趋势。表明SNP处理盐胁迫下的沙打旺幼苗有效降低了叶片中MDA的含量,能缓减盐胁迫造成的氧化损伤,从而中断对细胞膜造成的伤害,这与孙立荣等[18]对黑麦苗、程丽萍等[31]对小麦的研究结果一致。而高浓度处理组300 μmol·L-1SNP作用下缓解效果不明显,因此认为外源NO提高沙打旺抗盐性能的生理效应与浓度密切相关。
3.4 外源NO对盐胁迫下沙打旺幼苗叶片保护酶活性的影响
盐胁迫下,植物体内活性氧代谢失去平衡,体内积累较多的活性氧,使SOD、CAT、POD等活性氧清除剂的结构受到损害,含量降低,导致植物清除活性氧的能力下降[27,32]。本研究中,单盐胁迫下沙打旺幼苗保护酶活性显著降低,SNP处理可提高盐胁迫下植物保护酶的活性。程丽萍等[31]研究SNP对盐胁迫下小麦幼苗叶片MDA、叶绿素及氧化酶的影响中,证实了SNP浓度为60 μmol·L-1时对小麦氧化酶的提高作用最显著,本研究也表明SNP对盐胁迫下的沙打旺幼苗叶片保护酶(SOD、CAT和POD)活性有提高作用。但二者的浓度是不相同的,在SNP浓度为120 μmol·L-1时对盐胁迫下沙打旺幼苗叶片保护酶活性提高幅度较大,说明SNP处理盐胁迫下不同植物其最适浓度是不相同的;同时本研究中SNP对SOD和POD活性影响较大,对CAT活性影响较小。这与对辣椒[9]、小麦[6]、黑麦草[18]的研究结果一致。以上研究说明SNP通过诱导抗氧化酶活性,消除体内活性氧成分,降低MDA含量,进而减轻了膜脂过氧化作用,保护蛋白质及膜脂完整性,缓解盐胁迫下造成的膜损伤,从提高了沙打旺幼苗的抗盐性。Mata和Lamattina[33]的研究表明,可能由于NO作为气体信号分子,通过诱导CAT等含血红素铁的酶类活性和抑制含非血红素铁的顺乌头酸酶类活性,参与了植物抗性生理反应,但此类信号转导途径是怎样的,还需进一步研究。
4 结论
盐胁迫下的沙打旺种子萌发期施用外源NO能够促进其萌发,提高耐盐性;幼苗期施用外源NO能够提高幼苗叶绿素含量,降低MDA含量,减少膜脂过氧化产物,保护叶绿体膜的完整性,促进了沙打旺幼苗叶绿素的合成,提高SOD、CAT和POD活性,抑制过氧化物和自由基的积累,加快幼苗生长,从而缓解盐胁迫对沙打旺幼苗的伤害。
References:
[1] 赵生龙,曾凡江,张波,刘波,高欢欢.罗瀚林.盐分胁迫对骆驼刺幼苗叶片性状的影响.草业科学,2016,33(9):1770-1778. Zhao S L,Zeng F J,Zhang B,Liu B,Gao H H,Luo H L.Effects of salt stress on germination characteristics ofAgropyronmongolicumand salt tolerance evaluation.Pratacultural Science,2016,33(9):1770-1778.(in Chinese)
[2] 张洋,李素艳,孙向阳,张涛,龚小强,张乐,潘淑意,徐平平.不同改良剂对滨海盐渍土的改良效果.灌溉排水学报,2016,35(5):68-73. Zhang Y,Li S Y,Sun X Y,Zhang T,Gong X Q,Zhang L,Pan S Y,Xu P P.Improvement effects of different amendments on the coastal saline-alkali soil.Journal of Irrigation and Draimage,2016,35(5):68-73.(in Chinese)
[3] 武祎,田雨,张红香,杨健,吴志红.盐、碱胁迫与温度对黄花苜蓿种子发芽的影响.草业科学,2015,32(11):1847-1853. Wu Y,Tian Y,Zhang H X,Yang J,Wu Z H.Effects of salinity,alkalinity,temperature and their interactions on seed germination ofMedicagofalcata.Pratacultural Science,2015,32(11):1847-1853.(in Chinese)
[4] 王宝曾,韩晓光.水杨酸对沙打旺幼苗耐盐性的影响.湖北农业科学,2015(18):4525-4528. Wang B Z,Han X G.Effects of salicylic acid on salt tolerance ofAstragalusadsurgensPall seedlings.Hubei Agricultural Sciences,2015(18):4525-4528.(in Chinese)
[5] 唐静.一氧化氮促进盐胁迫下玉米种子萌发和幼苗生长机制的研究.青岛:青岛农业大学硕士学位论文,2008:13. Tang J.Study on the mechanism of nitric oxide promoted maize seed germination and seedling growth under salt stress.Master Thesis.Qindao:Qingdao Agricultural University,2008:13.(in Chinese)
[6] 杨青,宋杰,史功伟,王宝山.NaCl胁迫下外源NO供体硝普纳(SNP)对小麦种子萌发的影响.植物生理学通讯,2008,44(5):857-858. Yang Q,Song J,Shi G W,Wang B S.Effect of NO donor SNP on seed germination of wheat under NaCl stress.Plant Physiology Communications.2008,44(5):857-858.(in Chinese)
[7] 芦翔,石卫东,王宜伦,汪强,谭金芳,韩燕来.外源NO对NaCl胁迫下燕麦幼苗抗氧化酶活性和生长的影响.草业科学,2011,28(12):2150-2156. Lu X,Shi W D,Wang Y L,Wang Q,Tan J F,Han Y L.Effects of exogenous nitric oxide on activity of antioxidative enzyme and growth of oat seedlings under saltstress.Pratacultural Science,2011,28(12):2150-2156.(in Chinese)
[8] 李海萍,周青平,颜红波.硝普钠对燕麦幼苗苗期盐胁迫缓解作用的生理机制.草业科学,2014,31(9):1739-1745. Li H P,Zhou Q P,Yan H B.Effects of sodium nitroprusside on physiological characteristics of oat seedling under salt stress.Pratacultural Science,2014,31(9):1739-1745.(in Chinese)
[9] 雍玉山.外源一氧化氮(NO)对盐胁迫下辣椒种子萌发和幼苗生理特性的影响.兰州:甘肃农业大学硕士学位论文,2007:25-53. Yong Y S.Effects of exogenous nitric oxide on seed germination and seedling physiological characteristics of pepper under salt stress.Master Thesis.Lanzhou:Gansu Agricultural University,2007:25-53.(in Chinese)
[10] 王春林,刘建新,尚菲.外源一氧化氮对盐胁迫下白皮黄瓜种子萌发的影响.北方园艺,2014,8:26-29. Wang C L,Liu J X,Shang F.Effect of nitric oxide on seed germination of the white cucumber under salt stress.Northern Horticulture,2014,8:26-29.(in Chinese)
[11] 杜丹丹.外源ALA、SNP、和Spd对盐胁迫下桔梗种子萌发特性及幼苗生理特性的影响.重庆:西南大学硕士学位论文,2012:25-40. Du D D.Effect of exogenous ALA,SNP and Spd on seed germination and physiological characteristics ofPlatycodongrandiflorumunder NaCL stress.Master Thesis.Chongqing:Southwest University,2012:25-40.(in Chinese)
[12] 毛亚斌,魏小红.外源 NO 对干旱胁迫下板蓝根叶片氧化损伤的保护作用.草业科学,2010,27(6):97-101. Mao Y B,Wei X H.Effects of exogenous nitric oxide on lipid peroxidation antioxidase fluorescence ofIsatisindigoticaleaves under drought stress.Pratacultural Science,2010,27(6):97-101.(in Chinese)
[13] 徐严,魏小红,李兵兵,曹丽,康志敏.外源NO对NaCl胁迫下紫花苜蓿种子萌发及幼苗氧化损伤的影响.草业学报,2013,22(5):145-153. Xu Y,Wei X H,Li B B,Cao L,Kang Z M.Effects of exogenous nitric oxide on seed germination and seedling oxidative-damage inMedicagosativaunder NaCl stess.Acta Pratacultural Sinica,2013,22(5):145-153.(in Chinese)
[14] 王萍,路莹,刘杰才,陈贵华.外源NO浸种对NaCl胁迫下沙葱种子萌发的影响.内蒙古农业大学学报,2013,34(3):15-18. Wang P,Lu Y,Liu J C,Chen G H.Effect of seed soaking with exogenous NO on seed germination ofAlliummongolicumRegel under NaCl stress.Journal of Inner Mongolia Agricultural University,2013,34(3):15-18.(in Chinese)
[15] 周丽,金宁,张德罡,贠旭疆.盐胁迫下硝普纳浸种对草地早熟禾种子萌发的影响.草原与草坪,2015,35(5):55-57. Zhou L,Jin N,Zhang D G,Yun X J.Effect of seed soaking with sodium nitroprusside on seed germination of Kentucky bluegrass.Grassland and Turf,2015,35(5):55-57.(in Chinese)
[16] 刘文瑜,杨宏伟,魏小红,刘博,王高强,吴伟涛.外源NO调控盐胁迫下蒺藜苜蓿种子萌发生理特性及抗氧化酶的研究.草业学报,2015,24(2):85-95. Liu W Y,Yang H W,Wei X H,Liu B,Wang G Q,Wu W T.Effects of exogenous nitric oxide on seed germination,physiological characteristics and activ,eoxygen metabolism ofMedicagotruncatulaunder NaCl stress.Acta Pratacultural Sinica,2015,24(2):85-95.(in Chinese)
[17] 樊怀福,郭世荣,焦彦生,张润花,李娟.外源一氧化氮对NaCl胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响.生态学报,2007,27(2):546-553. Fan H F,Guo S R,Jiao Y S,Zhang R H,Li J.The effects of exogenous nitric oxide on grow th,active oxygen metabolism and photosynthetic characteristics inCucumissativusseedlings under NaCl stress.Acta Ecologica Sinica,2007,27(2):546-553.(in Chinese)
[18] 孙立荣,郝福顺,吕建洲,吕鹏飞,赵世领.外源一氧化氮对盐胁迫下黑麦草生长及生理特性的影响.生态学报,2008,20(11):5714-5722. Sun L R,Hao F S,Lyu J Z,Lyu P F,Zhao S L.Effects of exogenous nitric oxide on growth and physiological characteristics of ryegrass seedlings under salt stress.Acta Ecologica Sinica,2008,20(11):5714-5722.(in Chinese)
[19] 潘龙,谷文英,销普纳浸种对紫花苜蓿种子萌发及幼苗生长的影响,草业科学,2013,30(1):58-62. Pan L,Gu W Y.Effects of soaking seeds in SNP on seed germination and seedling growth of alfalfa.Pratacultural Science,2013,30(1):58-62.(in Chinese)
[20] 薛延丰,石志琦,严少华,郑建初,常志.利用生理生化参数评价水葫芦沼液浸种可行性初步研究.草业学报,2010,19(5):51-56. Xue Y F.Shi Z Q,Yan S H,Zheng J C,Chang Z.A preliminary study of assessing the feasibility of using physiological and biochemical parameters to assess water hyacinth biogas slurry for soaking seeds to improve germination characteristics.Acta Prataculturae Sinica,2010,19(5):51-56.(in Chinese)
[21] 高承芳,翁伯琦,王义祥,徐国忠.铝、镁离子胁迫下决明对百喜草的化感作用.草业学报,2009,18(5):40-45. Gao C F,Wen B Q,Wang Y X,Xu G Z.Allelopathy ofChamaecristaspp. onPaspalumnotatumunder aluminum and magnesium stresses.Acta Prataculturae Sinica,2009,18(5):40-45.(in Chinese)
[22] 李兵兵,魏小红,徐严.麻花秦艽种子休眠机理及其破除方法.生态学报,2013,33(15):4631-4638. Li B B,Wei X H,Xu Y.The causes ofGentianastramineaMaxim seeds dormancy and the methods for its breaking.Acta Ecologica Sinica,2013,33(15):4631-4638.(in Chinese)
[23] 姜义宝,郑秋红,王成章,郭玉霞,李德锋.超干贮藏对菊苣种子活力与抗氧化性的影响.草业学报,2009,18(5):93-97. Jiang Y B,Zheng Q H,Wang C Z,Guo Y X,Li D F.Effects of ultradrying storage on vigor and antioxidase activity ofCichoriunintybusseeds.Acta Prataculturae Sinica,2009,18(5):93-97.(in Chinese)
[24] 苍晶,赵会杰.植物生理学实验教程.北京:高等教育出版社,2008:65. Cang J,Zhao H J.Plant Physiology Experimental Course.Beijing:Higher Edication,2008:65.(in Chinese)
[25] 张蜀秋.植物生理学实验技术教程.北京:科学出版社,2011:191-196. Zhang S Q.Tutorial of Plant Physiological Experiment and Technology.Beijing:Science Press,2011:191-196.(in Chinese)
[26] Aebi H,Catalase in vitro.Methods in Enzymology,1984,105:121-126.
[27] 芦翔.NaCl胁迫下外源NO对燕麦幼苗生长及相关指标的影响.郑州:河南农业大学硕士学位论文,2009:14-37. Lu X.Study on the effect of seedling growth and correlation physiology target with exogenous nitric oxide under the salt stress.Master Thesis.Zhengzhou:Henan Agricultural University,2009:14-37.(in Chinese)
[28] 张红香.种子发芽生态研究.长春:东北师范大学博士学位论文,2008. Zhang H X.Research on seed germination ecology.PhD Thesis.Changchun:Northeast Normal University,2008.(in Chinese)
[29] 徐猛.盐胁迫下不同温度型小麦的渗透和离子胁迫效应及NO信号研究.杨凌:西北农林科技大学硕士学位论文,2010. Xu M.Study of osmotic and ion effects of winter wheats with different genotypes & nitric oxide signalin salt stress conditions.Master Thesis.Yangling:Northwest A & F University,2010.(in Chinese)
[30] 潘多锋,申忠宝,王建丽,高超,李道明,张瑞博,邸桂俐,刘慧来.碱性盐胁迫对偃麦草苗期生长的影响.草业科学,2016,33(11):2276-2282. Pan D F,Shen Z B,Wang J L,Gao C,Li D M,Zhang R B,Di G L,Liu H L.Effects of saline-alkaloid stress on the seedling growth and physiological characteristics ofElytrigiarepens.Pratacultural Science,2016,33(11):2276-2282.(in Chinese)
[31] 程丽萍,刘晋秀,胡青平.外源NO对盐胁迫下小麦幼苗叶片丙二醛、叶绿素及氧化酶的影响.麦类作物学报,2013,33(6):1222-1225. Cheng L P,Liu J X,Hu Q P.Effects of exogenous nitric oxide on the contents of MDA and chlorophyll and the activities of oxidases in leaves of wheat seedlings under salt.Journal of Triticeae Crops,2013,33(6):1222-1225.(in Chinese)
[32] 李善家,韩多红,王恩军,武燕.外源甜菜碱对盐胁迫下黑果枸杞种子萌发和幼苗保护酶活性的影响.草业科学,2016,33(4):674-680. Li S J,Han D H,Wang E J,Wu Y.Effects of exogenous betaine on seed germination and antioxidase activities ofLyciumrutheniumseedlings under NaCl stress.Pratacultural Science,2016,33(4):674-680.(in Chinese)
[33] Mata C G,Lamattina L.Nitric oxide induces stomatal closure and enhances the adaptive plant responses against drought stress.Plant Physiology,2001,126(3):1196-1204.
(责任编辑 苟燕妮)
Effect of nitric oxide on seed germination and seedling growth ofAstragalusadsurgensunder NaCl stress
Chen Hua1, Wang Jian-wu1, Wang Jian-jun2, Wang Fu-gang1
(1.Department of Life Sciences of Yulin College, Yulin 719000, China;2.Department of Energy Engineering of Yulin College, Yulin 719000, China)
The aim of this study was to clarify the physiological regulatory function of exogenous nitric oxide (NO) duringAstragalusadsurgensseed germination and seedling growth.A.adsurgenswas treated with different concentrations of sodium nitroprusside SNP solution as an NO donor under 0.3% NaCl stress and physiological indexes of seed germination and seedling growth were tested. The results showed that under the NaCl stress condition, SNP promoted seed germination and relieved damage at the seedling stage, at concentrations up to 200 μmoL·L-1. However, at the higher concentration of 300 μmoL·L-1, SNP inhibited seed germination and seedling growth. Damage toA.adsurgensseeds caused by 0.3% NaCl stress was significantly alleviated in the presence of 60 μmol·L-1SNP. With SNP treatment under NaCl stress, the seed germination percentage, germination potential, germination index, vigour index, and radicle length were 22.6%, 54.5%, 58.20%, 112.00%, and 43.70%, respectively, as compared with controls subjected to NaCl stress without SNP treatment. These values were close to or slightly higher than those of untreated controls (without NaCl stress or SNP). Treatment with 120 μmol·L-1SNP significantly reduced the damage to theA.adsurgensseedlings under 0.3% NaCl stress. The chlorophyll content, superoxide dismutase, catalase, and peroxidase activities ofA.adsurgensseedling leaves increased by 208.91%, 117.57%, 40.24%, and 89.95%, respectively, while the concentration of malondialdehyde decreased by 32.55%. In conclusion, our experiments demonstrated that an appropriate concentration of exogenous NO could improve seed germination, promote the synthesis of chlorophyll by seedlings, reduce the malondialdehyde content, relieve lipid peroxidation and protect the integrity of the chloroplast membrane, increase superoxide dismutase, catalase, and peroxidase activities, inhibit the accumulation of free radicals and peroxides, and accelerate the growth of seedlings. These physiological processes lowered the harm toA.adsurgensseedlings under salt stress conditions.
sodium nitroprusside;Astragalusadsurgens; germination characteristics seedling growth; antioxidant enzymes; chlorophyll content; malondialdehyde
Wang Jian-wu E-mail:wjw19830801@163.com
2016-10-17 接受日期:2017-03-04
陕西省教育厅科学研究计划项目(14JK1857);榆林学院校内科研项目(13YK41)
陈花(1979-),女,山西神池人,讲师,硕士,主要从事植物抗性生理研究。E-mail:510697622@qq.com
王建武(1983-),男,山东滕州人,副教授,博士,主要从事植物抗逆研究。E-mail:wjw19830801@163.com
10.11829/j.issn.1001-0629.2016-0523
S543+.903.4;Q945.78
A
1001-0629(2017)07-1459-10
陈花,王建武,王建军,王富刚.外源NO对盐胁迫下沙打旺种子萌发和幼苗生长的影响.草业科学,2017,34(7):1459-1468.
Chen H,Wang J W,Wang J J,Wang F G.Effect of nitric oxide on seed germination and seedling growth ofAstragalusadsurgensunder NaCl stress.Pratacultural Science,2017,34(7):1459-1468.
