西藏多地区土壤可培养细菌的分离鉴定及多样性分析
2017-08-11戚珊珊周礼红胡久平
戚珊珊, 周礼红,3, 胡久平, 刘 敏, 赵 辉*, 熊 燕
(1. 西藏月王生物技术有限公司,西藏 拉萨 850000;2.青藏高原微生物国家地方联合工程研究中心,西藏 拉萨 850000;3.贵州大学,生命科学院,贵州 贵阳 550000)
西藏多地区土壤可培养细菌的分离鉴定及多样性分析
戚珊珊1,2, 周礼红1,2,3, 胡久平1,2, 刘 敏1,2, 赵 辉1,2*, 熊 燕1,2
(1. 西藏月王生物技术有限公司,西藏 拉萨 850000;2.青藏高原微生物国家地方联合工程研究中心,西藏 拉萨 850000;3.贵州大学,生命科学院,贵州 贵阳 550000)
【目的】了解西藏多地区土壤可培养细菌的多样性。【方法】采用梯度稀释涂布分离法分离土壤细菌,根据形态特征、生理生化试验去除冗余,对细菌进行16S rDNA序列系统发育分析,鉴定其种属,研究其亲缘关系及多样性。【结果】经形态特征、生理生化试验以及16S rDNA序列测定,38株细菌菌株归属于四个类群,厚壁菌门(Firmicutes)、放线菌门(Actinobacteria),拟杆菌门(Bacteroidetes),变形菌门(Proteobacteria),12个科,13个属,包含链霉菌属(Streptomyces)11株,芽孢杆菌属(Bacillus)10株,节杆菌属(Arthrobacter)3株、类香味菌属(Myroides)3株、葡萄球菌属(Staphylococcus)1株、新鞘氨醇菌属(Novosphingobium)1株、红球菌属(Rhodococcus)2株、诺卡氏菌属(Nocardia)1株、拟无枝菌酸菌属(Amycolatopsis)2株、氨基杆菌属(Aminobacter)1株、原小单孢菌属(Promicromonospora)1株、威廉姆斯氏菌属(Williamsia)1株,分支杆菌属(Mycobacterium)1株。【结论】西藏地区土壤中细菌多样性丰富,优势菌为链霉菌属和芽孢杆菌属。根据多样性指数分析,同一地区,3000~4000 m海拔的土壤细菌多样性低于4000~5000 m海拔地区,3000~4000 m海拔地区土壤细菌分布较均匀。林芝地区土壤细菌多样性丰富,山南地区土壤细菌多样性最少。
土壤细菌;16S rDNA;多样性;分离鉴定
【研究意义】青藏高原海拔高,生态环境复杂多样,气候恶劣,具有极地特点。由于地理的特殊性,青藏高原土壤细菌具有特殊性,是全球微生物多样性的重要部分。青藏高原土壤细菌长期生活在极端环境中,适应了极端气候,在进化过程中可能会形成独特的代谢途径,新的调控机制及与之相关的新型基因,产生新的生物活性物质。因此,有较大可能成为新型药物及发酵工程菌种的重要来源之一。【前人研究进展】我国学者对西藏地区生态环境中的细菌多样性的研究主要集中在北部冰川、盐碱湖及高原湖泊沉积物等[1-3]。土壤可培养细菌的研究较少[4-6],罗建峰[7]等分析了西藏高原土壤可培养细菌群落结构,发现不同采样点土壤可培养细菌群落结构多样性和分布上的差异。唐雅利[8]分离西藏地区环境中的细菌,尚未发现的细菌菌株占分离细菌总数的15.7 %。【本研究切入点】本试验采用传统的可培养方法对西藏各地区的土壤细菌进行分离和鉴定,分析西藏各地区土壤细菌多样性系数。【拟解决的关键问题】了解西藏各地区土壤可培养细菌的的优势种群及多样性,为更好的开发和利用西藏地区土壤细菌资源奠定一定基础。
1 材料与方法
1.1 材料
1.1.1 供试土样的采集与处理 供试土样采集地点为林芝、拉萨、那曲、日喀则、山南。采集时间2013年7月。采样信息参见表1。采用五点取样法,在50 cm×50 cm的正方形取样地上,用无菌小铲挖取5~10 cm深处土壤,每处的采样量一致,将每处的土样均匀混合后装入灭菌的采样袋中密封,放置于冰盒,带回实验室后置于4 ℃冰箱中保存。
1.1.2 主要试剂和仪器 微生物生理生化微量管购自杭州天和微生物试剂有限公司。细菌基因组DNA提取试剂盒购自索莱宝公司,E×TaqDNA Polymerase等扩增所用试剂购自大连宝生物技术有限公司。引物合成由上海生工生物工程技术服务公司完成。PCR仪为Bio-Rad公司生产的Thermal Cycler S1000,凝胶成像分析仪为Bio-Rad公司生产的Gel DocTMXR+。
1.2 土壤细菌的分离培养
土壤细菌分离采用梯度稀释涂布平板分离法,称取1 g土样,加入9 mL无菌水摇匀,制成10-1浓度土壤悬液,吸取1 mL的10-1浓度土壤悬液加入9 mL无菌水,此为10-2浓度土壤悬液,依此方法制成10-2~10-6浓度土壤悬液,静置5 min。取0.2 mL浓度为10-4~10-6的上层清液均匀的涂布于牛肉膏蛋白胨琼脂平板上,每个浓度3个平行。置于35 ℃恒温培养2~5 d。挑取形态特征各异的菌落,四区划线直至出现单菌落,4 ℃下短期保藏于牛肉膏蛋白胨琼脂斜面。
1.3 形态学鉴定
疑似细菌菌落的菌株划线于牛肉膏蛋白胨琼脂培养基平板上,35 ℃培养24~48 h,观察描述并记录单菌落的形态特征,包括菌落大小、形状、颜色、质地、有无隆起、边缘形状、透明度、产色素情况等。采用革兰氏染色法染色,在100倍光学显微镜下观察细菌的显微结构特征,记录细胞大小,形状、排列方式等。参考《伯杰氏细菌鉴定手册》等鉴定手册进行形态学鉴定和生理生化试验[9-11]。

表1 土壤样品采样信息
疑似放线菌菌落的菌株划线于高氏1号培养基平板上,28 ℃培养5~7 d,期间对单个菌落的形态进行观察描述,记录其形态特征。包括菌落的大小、形状、颜色、质地、隆起、边缘形状、气生菌丝和基内菌丝的颜色、有无产色素等。在光学显微镜下观察放线菌的显微结构特征,记录气生菌丝的有无,基内菌有无断裂,分生孢子形状、大小、排列等。
1.4 16S rDNA基因序列PCR扩增与测序
吸取1mL供试菌株菌悬液加入到1.5 mL离心管中,离心收集菌体。用细菌基因组DNA提取试剂盒提取基因组DNA。细菌16S rDNA基因序列的扩增采用通用引物,27f:5′-AGAGTTTGATCCTGGCTCAG-3′;1492r:5′-GGTTACCTTGTTACGACTT-3′[12]。
PCR反应体系为:2×TaqPCR MasterMix 25 μl;27f (10 μM) 1.0 μl;1492r(10 μM) 1.0 μl;DNA模板(50 ng/mL) 10.0 μl;ddH2O加至50 μl。PCR反应条件为:94 ℃预变性5 min;94 ℃变性1 min、55 ℃退火1 min、72 ℃延伸2 min,共30个循环;最后72 ℃延伸7 min,4 ℃保存。扩增产物在1 %琼脂糖凝胶上80 V电泳30 min,凝胶成像系统下观察,拍照。扩增产物置于-20 ℃冰箱保存。
1.5 基于16S rDNA基因序列的系统发育分析
将菌株的16S rDNA基因序列在GenBank数据库中进行有效种的序列相似性搜索,获取相似度较高的相关模式菌株的16S rDNA基因序列。用ClustalX 2.0对菌株的16S rDNA基因序列及其近似序列进行多序列比对后,MEGA6.0软件进行聚类分析并构建系统发育树。Kimura双参数模型计算进化距离,邻接法(Neighbor-joining)获得分支系统树,设定自展值(Bootstrap value)1000评估系统发育树的拓扑结构稳定性。
1.6 细菌多样性指数
运用辛普森(Simpson)多样性指数(D)、香农-纳威(Shannon-Wiener)指数(H)、香农-纳威(Shannon-Wiener)均匀度指数(E)计算多样性[12]。计算公式如下。
辛普森(Simpson)多样性指数:
香农-纳威(Shannon-Wiener)指数:
香农-纳威(Shannon-Wiener)均匀度指数:
式中,S为菌种数。Pi为第i种的多度比例。即群落中物种i的个体占总个体的比例[10]。Ni是第i种的菌株数,N是所有菌株数总和。
2 结果与分析
2.1 分离结果
从形态上看,细菌菌落有白色、黄色、粉色,质地包括蜡状、液滴状、皮革状。细胞多数为杆状,少数为球状、分支状。放线菌菌落多数为白色,表面干燥,呈粉状,细胞多分支,无隔,产生可溶性色素,具典型的链霉属特征。生理生化试验结果显示西藏土壤细菌多数呈革兰氏染色阳性,接触酶阳性,明胶液化阳性,能在10 %NaCl生长,多数能利用葡萄糖,果糖,蔗糖。
2.2 16S rDNA序列的PCR扩增及分析
通过16S rDNA序列在NCBI上比对,38株供试菌株分布于细菌的13个属(表2)。链霉菌属(Streptomyces)出现频率最高,有11株,其次为芽孢杆菌属(Bacillus),有10株,16S rDNA序列与标准菌株的同源性多数在99 %以上。此外还有节杆菌属(Arthrobacter)、类香味菌属(Myroides)、葡萄球菌属(Staphylococcus)、新鞘氨醇菌属(Novosphingobium)、红球菌属(Rhodococcus)、诺卡氏菌属(Nocardia)、拟无枝菌酸菌属(Amycolatopsis)、氨基杆菌属(Aminobacter)、原小单孢菌属(Promicromonospora)、威廉姆斯氏菌属(Williamsia)和分支杆菌属(Mycobacterium)。
2.3 系统发育分析
由图1可知,系统发育树分为四个大分支。第一个分支是放线菌门(Actinobacteria)为高G+C含量,革兰氏阳性菌,包括链霉菌属、节杆菌属、红球菌属、原小单孢菌属、分支杆菌属、诺卡氏菌属、威廉姆斯氏菌属和拟无枝菌酸菌属,共8个属。第二个分支为厚壁菌门(Firmicutes),属于高G+C含量[13-15],革兰氏阳性菌,有芽孢杆菌属、葡萄球菌属,共2个属。第三个分支拟杆菌门(Bacteroidetes)仅有类香味菌属[16-18],第四个分支是变形菌门(Proteobacteria),包括新鞘氨醇菌属和氨基杆菌属,共2个属。从进化树上看,有25株可以归入种一级的分类单元,占65.8 %。
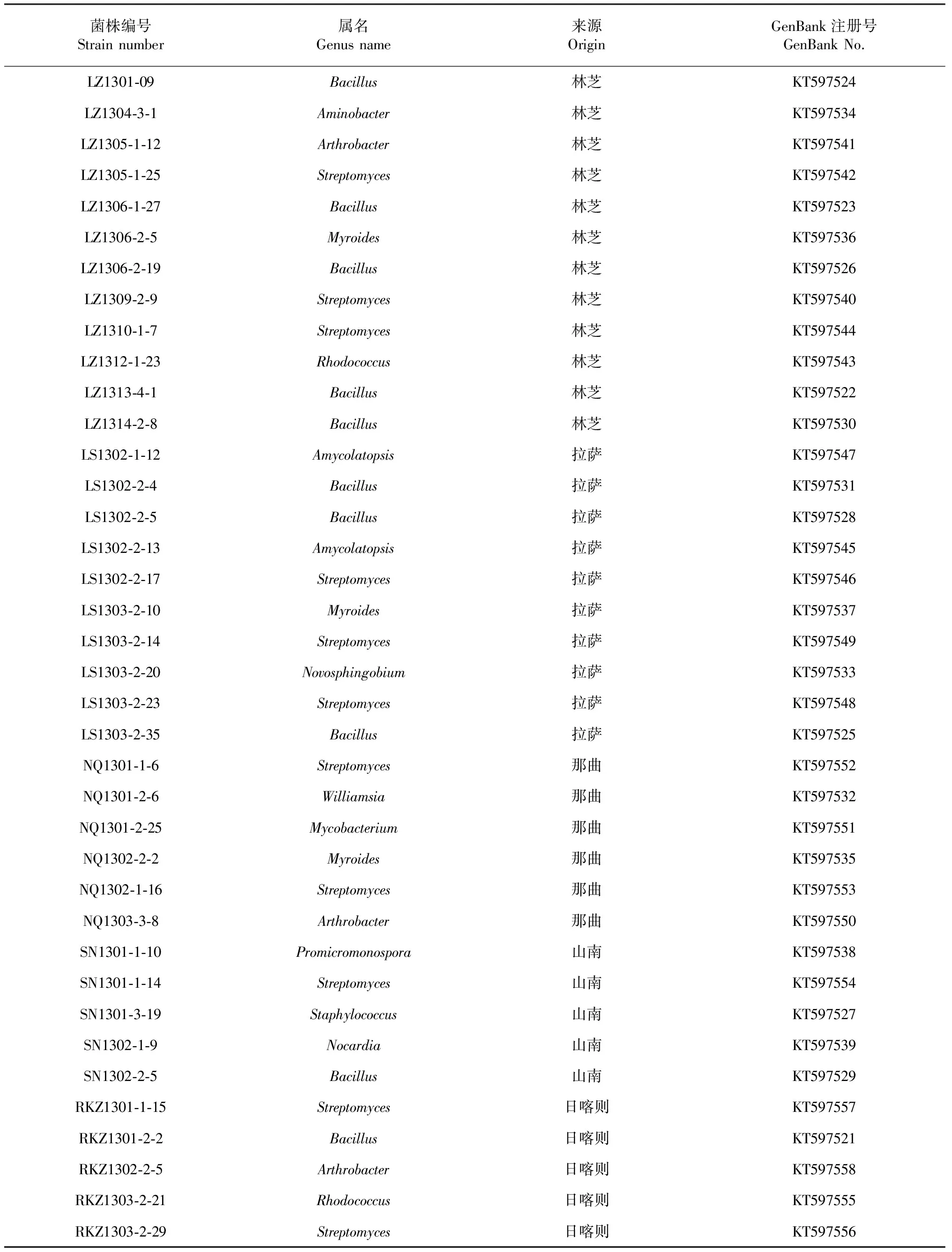
表2 测序供试菌株
2.4 细菌多样性指数
根据公式计算细菌多样性指数,评价西藏土壤可培养细菌多样性。辛普森多样性指数(Simpson)D为0.7901,香农-纳威(Shannon-Wiener)指数H为2.2327,香农-纳威均匀度指数E为0.4047。由此可知,西藏土壤细菌具有较丰富的多样性。
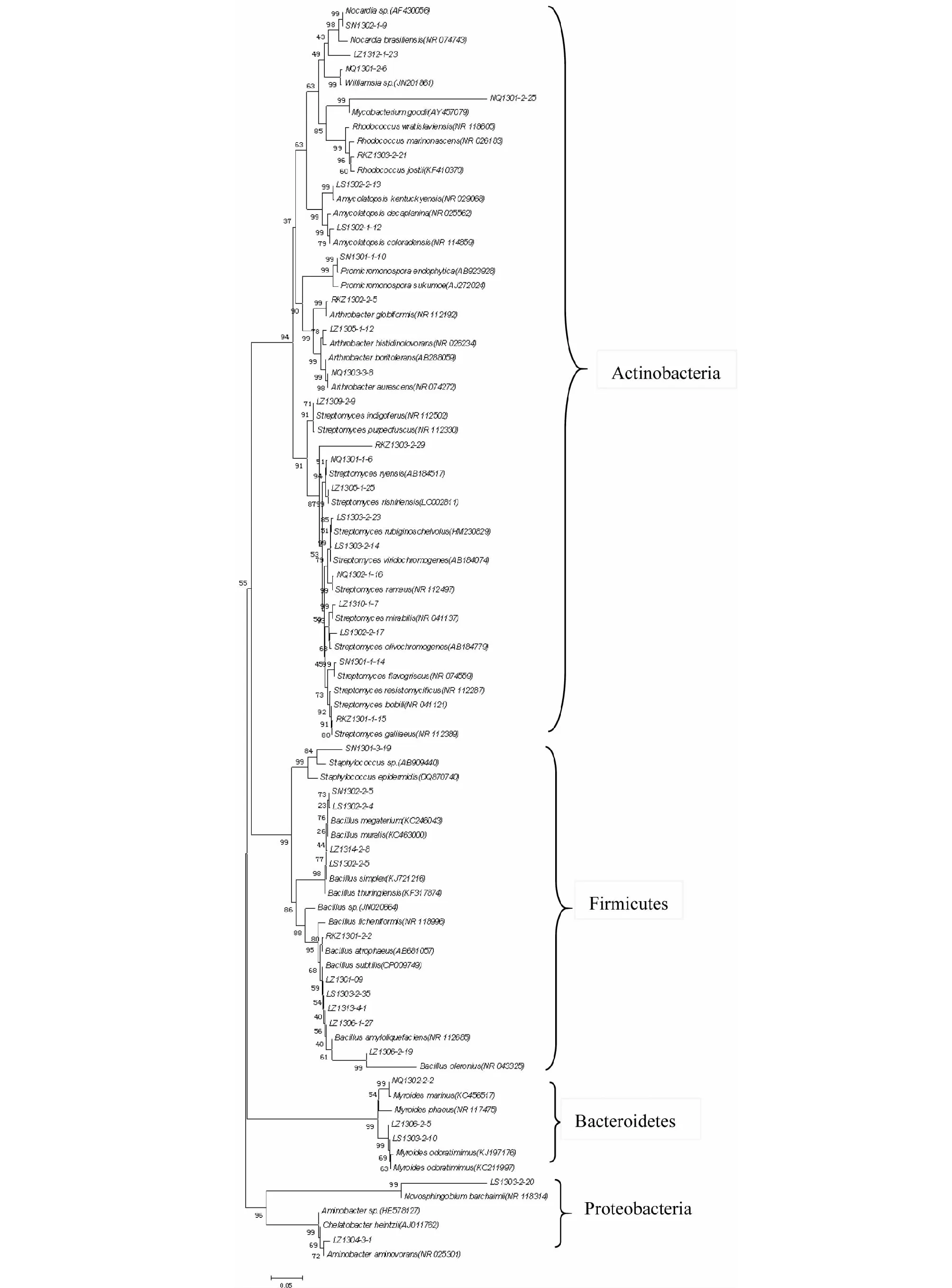
图1 基于16S rDNA基因序列构建的西藏部分地区土壤细菌的系统发育树Fig.1 Neighbor-joining phylogenetic tree based on 16S rDNA sequence Bootstrap value expressed as a percentage of 1000 replication were given at the branching point
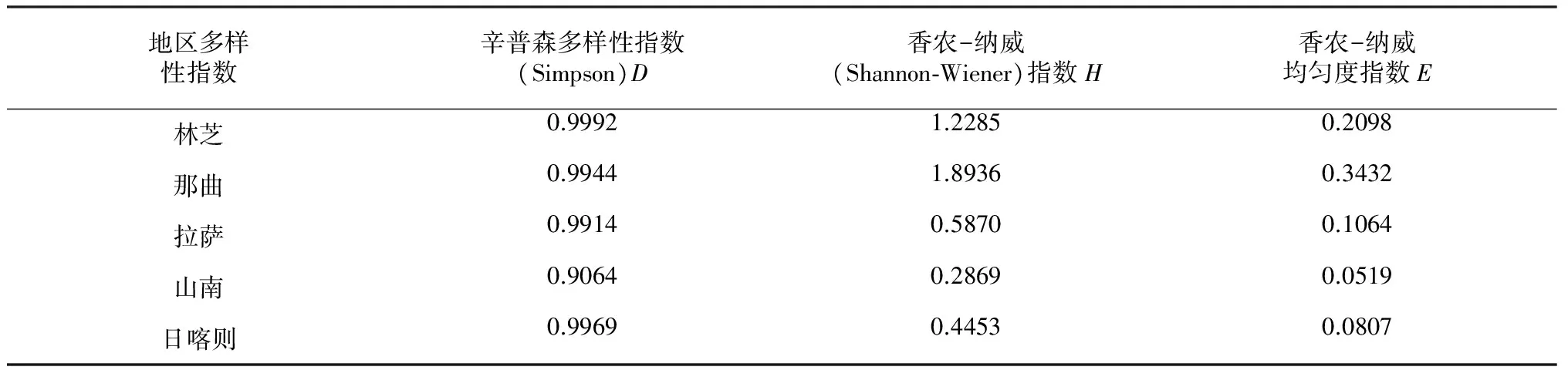
地区多样性指数辛普森多样性指数(Simpson)D香农-纳威(Shannon⁃Wiener)指数H香农-纳威均匀度指数E林芝0.99921.22850.2098那曲0.99441.89360.3432拉萨0.99140.58700.1064山南0.90640.28690.0519日喀则0.99690.44530.0807
在3000~4000 m海拔上,土壤细菌辛普森多样性指数D为0.6331,香农-纳威指数为2.4319,香农-纳威均匀度指E为0.8662;在4000~5000 m海拔上,土壤细菌辛普森多样性指数D为0.8406,香农-纳威指数为3.0778,香农-纳威均匀度指数为0.5063。
辛普森多样性指数(Simpson)D的排序(表3)为:林芝>日喀则>那曲>拉萨>山南。香农-纳威(Shannon-Wiener)指数H的排序为:那曲>林芝>拉萨>日喀则>山南。香农-纳威均匀度指数E的排序为:那曲>林芝>拉萨>日喀则>山南。
3 讨 论
本研究分离获得菌株的形态多样。在菌种分离期间,多数细菌的菌落在普通营养琼脂平板上生长很小,直径小于2 mm,可能是由于西藏地区土壤中营养比较贫瘠,细菌在短期内没有适应,难以长出。通过多次纯化与传代,部分细菌的生长趋于稳定,但有一些菌株在多次转接传代后不再生长,说明这部分细菌可能对营养或培养条件存在特殊要求,很可能存在特殊的代谢方式。
38株供试菌株分布于细菌4个门,12个科,13个属。其中,链霉菌属(Streptomyces)11株,芽孢杆菌属(Bacillus)10株,节杆菌属(Arthrobacter)3株、类香味菌属(Myroides)3株、葡萄球菌属(Staphylococcus)1株、新鞘氨醇菌属(Novosphingobium)1株、红球菌属(Rhodococcus)2株、诺卡氏菌属(Nocardia)1株、拟无枝菌酸菌属(Amycolatopsis)2株、氨基杆菌属(Aminobacter)1株、原小单孢菌属(Promicromonospora)1株、威廉姆斯氏菌属(Williamsia)1株,分支杆菌属(Mycobacterium)1株。可见,链霉菌属和芽孢杆菌属是西藏地区土壤细菌的优势菌,与郭慧娟的结果一致[19]。此外,本研究分离获得了较多的稀有放线菌,如诺卡氏菌、拟无枝菌酸菌、原小单孢菌等,稀有放线菌是新型抗生素的重要来源之一,具有重要的科研价值。
同一个地区,3000~4000 m海拔梯度上的土壤细菌多样性低于4000~5000 m海拔梯度上地区的土壤细菌多样性,3000~4000 m海拔地区的物种均匀度较高。与孙怀博的研究结果一致[20]。林芝地区气候环境条件相对温和,因此土壤细菌多样性丰富,山南地区土壤细菌多样性最少。
4 结 论
西藏地区土壤细菌多样性较丰富,且代谢方式存在特殊性,西藏地区菌种资源具有很大的开发潜力。特殊的生态环境和气候决定了西藏地区蕴含着大量特殊的微生物资源,目前对西藏地区可培养细菌的研究较少。了解西藏地区土壤细菌种类,可以为合理开发和利用打好基础。西藏地区作为微生物资源的宝库,蕴含了巨大的价值,随着经济的发展,西藏的生态环境处在不断变化中,大量微生物物种正在快速消失,研究西藏地区微生物资源对可持续发展具有重要意义。
[1]李 明, 郭 嘉, 石正国, 等. 春季青藏高原东北部湖泊细菌种类组成[J]. 应用与环境生物学报, 2013, 19(5): 750-758.
[2]时 玉, 孙怀博, 刘勇勤, 等. 青藏高原淡水湖普莫雍错和盐水湖阿翁错湖底沉积物中细菌群落的垂直分布[J].微生物学通报, 2014, 41(11): 2379-2387.
[3]李定瑶. 青藏高原多年冻土区可培养微生物多样性及生长特性研究[D]. 兰州: 兰州大学硕士学位论文, 2014.
[4]卢晓飞. 西藏米拉山高寒草甸土土壤微生物多样性研究[D]. 北京: 中国农业科学院博士学位论文, 2009.
[5]孙 莹,苏进进,李潮流,等.可可西里碱性土壤样品细菌的分离和生物学特性[J].微生物学通报,2011,38(10):1473-1481.
[6]张现辉, 孔凡晶. 西藏扎布耶盐湖细菌多样性的免培养技术分析[J]. 微生物学报, 2010, 50(3):334-341.
[7]罗建峰, 曲 东. 西藏高原土壤中可培养细菌群落结构分析[J]. 水土保持学报, 2013, 27(2): 261-266.
[8]唐雅丽. 新疆与西藏地区细菌多样性分析及四个潜在新种的多相分类学研究[D]. 武汉: 武汉大学博士学位论文, 2009.
[9]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M].北京:科学出版社, 2001: 370-387.
[10]阮继生, 黄 英. 放线菌快速鉴定与系统分类[M]. 北京: 科学出版社, 2011.
[11]中国科学院微生物研究所放线菌分类组. 链霉菌鉴定手册[M]. 北京: 科学出版社, 1975.
[12]金 岚, 王振堂, 朱秀丽, 等. 环境生态学[M]. 北京: 高等教育出版社, 2001: 108-109.
[13]L.K.Nakamura, Michael S.Roberts, Frederick M.Cohan. Relationship ofBacillussubtilisclades associated with strain 168 and W23: a proposal forBacilliussubtilissubsp.subtilissubsp.nov.andBacillussubtilissubsp.Spizizeniisubsp.nov[J]. International Journal of Systematic Bacteriology, 1999, 49: 1211-1215.
[14]R.Pukall. P.Schumann, D.Clermont et al.BacillusaeoliusDSM 15084T(=CIP 107628T) is a strain ofBacilluslicheniformis[J]. International Journal of Systematic and Evolutionary Microbiology.2008, 58: 1268-1270.
[15]L.K.NAKAMURA. Taxonomic Relationship of Black-PigmentedBacillussubtilisStrain and a Proposal forBacillusatrophaeussp.nov.[J]. Ineternational Journal of Systematic Bacteriology, 1989, 39(3): 295-300.
[16]JayoungPaek, JeongHwain Shin, Yeseul Shin, et al.Myriodesinjenensissp.nov., a new member isolated from human urine[J]. Antonie van Leeuwenhoek, 2015, 107: 201-207.
[17]Xi-Ying Zhang, Yan-Jiao Zhang, Xiu-Lan Chen, et al.Myriodesprofundisp.nov., isolated from deep-sea sediment of the southern Okinawa Trouth[J]. FEMS Microbiol Lett, 2008, 287: 108-112.
[18]M.VANCANNEYT, P. SEGERS, U.TORCK, et al. Reclassification ofFlacvobacteriumodoratum(Stutzer 1929) Strain to a New Genus,Myroides, asMyroidesodoratuscomb.nov. andMyroidesodoratimimussp.nov[J]. International Journal of Systematic Bacteriology, 1996, 46(4): 926-932.
[19]郭慧娟. 培养与非培养方法对青藏高原土壤细菌多样性的研究[D]. 保定: 河北农业大学硕士毕业论文, 2011.
[20]孙怀博. 青藏高原阿里地区土壤细菌群落多样性及其分布的研究[D]. 南京: 南京农业大学硕士毕业论文, 2013.
(责任编辑 李 洁)
Isolation, Identification and Diversity of Soil Bacteriain Multiple Regions from Tibetan Plateau
QI Shan-shan1,2,ZHOU Li-hong1,2,3,HU Jiu-ping1,2,LIU Min1,2,ZHAO Hui1,2*,XIONG Yan1,2
(1. Tibet Yuewang Biotechnology Co., Ltd.,Tibetan Lhasa 850000, China;2. National United Engineering Research Center for Tibetan Plateau Microbiology, Tibetan Lhasa 850000, China;3.Institute of Fungi Resource, College of Life Science, Guizhou University, Guizhou Guiyang 550025, China)
【Objective】 The study aims to understand the culturable bacterial diversity isolated from the soil in multiple regions of Tibet plateau.【Method】Soil samples from Tibet plateau, were used to isolate by dilution plate coating method. Strains were identified by morphology and 16S rDNA sequence analyses. 【Result】Results show that 38 strains belong to 4 phylogenetic groups (Firmicutes, Actinobacteria, Bacteroidetes), 12 families and 13 genus ,includingStreptomyces11 strains,Bacillus10 strains ,Arthrobacter3 strains,Myroides3 strains ,Staphylococcus1 strain ,Novosphingobium1 strain ,Rhodococcus2 strains ,Nocardia1 strain,Amycolatopsis2 strains,Aminobacter1 strain,Promicromonospora1 strian,Williamsia1 strian,Mycobacterium1 strain. 【Conclusion】Soil bacteria is abundant in Tibet plateau,StreptomycesandBacilluswere most common groups. Soil bacteria diversity is more abundant in higher altitudes.Linzhi soil bacterial diversity was abundant and the uniformity of soil bacteria was low in Shannan area.
Soil bacteria;16s rDNA;Diversity
1001-4829(2017)7-1629-07
10.16213/j.cnki.scjas.2017.7.028
2016-10-12
国家科技型中小企业技术创新基金(12c2621540 6517)
戚珊珊(1984-),女,硕士研究生,研究方向为植物微生物资源开发与利用,E-mail:xiaowanzi61@hotmail.com,*为通讯作者。
S154.38+1
A
