琥珀酸呋罗曲坦薄膜衣片的制备及体外溶出行为考察
2017-08-11刘晓霞王明刚陈阳生孙桂玉臧云龙青岛正大海尔制药有限公司山东青岛266101
刘晓霞,王明刚,陈阳生,孙桂玉,臧云龙(青岛正大海尔制药有限公司,山东青岛 266101)
琥珀酸呋罗曲坦薄膜衣片的制备及体外溶出行为考察
刘晓霞*,王明刚,陈阳生,孙桂玉,臧云龙(青岛正大海尔制药有限公司,山东青岛 266101)
目的:制备琥珀酸呋罗曲坦薄膜衣片,并考察其体外溶出行为。方法:以一水乳糖、微晶纤维素、二氧化硅、羧甲淀粉钠和硬脂酸镁为辅料制备琥珀酸呋罗曲坦素片,以欧巴代预混包衣液喷雾包衣制备琥珀酸呋罗曲坦薄膜衣片。采用单因素试验,以水分、休止角、硬度、脆碎度、崩解时限和溶出度为指标筛选素片处方,以溶出度为指标筛选包衣材料用量。比较自制片剂与进口片剂在水、0.1mol/LHCl和pH为5.5、6.8的磷酸盐缓冲液中的体外溶出曲线。结果:素片最优处方为琥珀酸呋罗曲坦3.91mg、一水乳糖99.18mg、微晶纤维素33.06mg、硬脂酸镁1.40mg、羧甲淀粉钠1.05mg、二氧化硅1.40mg;最优包衣增质量在2.0%~4.0%范围内。在4种介质中,自制片剂与进口片剂溶出行为均相似。结论:成功制得琥珀酸呋罗曲坦薄膜衣片,其体外溶出行为与进口制剂相似。
琥珀酸呋罗曲坦;薄膜衣片;单因素试验;喷雾包衣;体外溶出行为
偏头痛是一种常见的慢性、反复发作性疾病,在世界范围内广泛流行,严重影响患者的生活质量。自1991年2月第一个曲坦类治疗偏头痛药舒马曲坦上市以来,有多种曲坦类药物被美国FDA批准上市,其中,琥珀酸呋罗曲坦薄膜衣片(商品名:Frova)由德国Berlin-Chem ie AG公司开发研制,于2001年11月8日在美国批准上市,用于有或无先兆的急性偏头痛的治疗[1]。呋罗曲坦是一种新型的5-羟色胺(5-HT)受体激动药,和5-HT1B/1D受体以及5-HT7受体有很高的亲和力,进入人体后只需2~3 h就能达到最大血药浓度,半衰期长达26 h,明显长于其他曲坦类药物,而且很少与其他药物发生相互作用,不良反应少,耐受性好,且可能对持续时间较长的偏头痛有特殊疗效[2],临床应用前景良好。国外上市片剂为琥珀酸呋罗曲坦薄膜包衣片,规格为每片2.5mg(以呋罗曲坦计),上市药品说明书中显示所用辅料为一水乳糖[D-(+)-Lactosemonohydrate]、微晶纤维素、二氧化硅、羧甲淀粉钠、硬脂酸镁,但未公开辅料用量及比例。因此,本文在已知资料的基础上,以溶出度为指标,对琥珀酸呋罗曲坦薄膜包衣片的辅料用料及比例进行研究,从而确定适宜的制备工艺,以满足国内患者临床用药的需求。
1 材料
1.1 仪器
UV-1750/UV-1700型紫外-可见分光光度计(日本岛津公司);DP/30型单冲压片机(北京国药龙立科技有限公司);LabcotingⅢ型高效包衣机(深圳信宜特科技有限公司);DPT-140型铝塑包装机(浙江澳尔特机械有限公司);CJY-300B型片剂脆碎度测定仪、78X-2型片剂四用测定仪、ZDJ-1S型卡氏微量水分测定仪(杭州科博仪器有限公司);RC806型溶出试验仪(天津市天大天发科技有限公司)。
1.2 药品与试剂
琥珀酸呋罗曲坦薄膜衣片(德国Berlin-Chemie AG公司,批号:23054,规格:每片含呋罗曲坦2.5mg);琥珀酸呋罗曲坦原料药(批号:20120420,纯度:99.6%)、琥珀酸呋罗曲坦对照品(批号:20120422,纯度:95.13%)均由南京华威医药科技集团有限公司提供;一水乳糖、微晶纤维素、二氧化硅、羧甲淀粉钠、硬脂酸镁(山东聊城阿华制药有限公司,药用级);欧巴代(上海卡乐康包衣技术有限公司);纯化水(杭州娃哈哈集团有限公司)。
2 方法与结果
2.1 质量评价指标的测定方法
2.1.1 水分 取样品,按2015年版《中国药典》(四部)通则0931“第一法”[3]测定水分。
2.1.2 休止角 取样品,按固定圆锥底法测定休止角,锥底直径(2R)为5.24 cm,测定样品堆集的高度(h),计算休止角(α),α=arctg(h/R)。
2.1.3 硬度 取样品,使用片剂四用测定仪测定其硬度。
2.1.4 脆碎度 取样品若干,总质量约为6.5 g,按2015年版《中国药典》(四部)通则0923“片剂脆碎度检查法”进行检查[3],用吹风机吹去脱落的粉末,精密称质量,置圆筒中,转动100次,取出,同法除去粉末,精密称质量,计算减失质量。
2.1.5 崩解时限 取样品,按2015年版《中国药典》(四部)通则0921“崩解时限检查法”测定其崩解时限[3]。
2.1.6 检测波长 取琥珀酸呋罗曲坦对照品加水制成2.5μg/m L的溶液,过滤,取滤液作为对照品溶液。按2015年版《中国药典》(四部)通则0401“紫外分光光度法”[3],于200~400 nm波长范围内进行紫外扫描。结果表明,琥珀酸呋罗曲坦在245 nm波长附近有最大吸收,故选择245 nm作为检测波长。紫外吸收光谱图见图1。
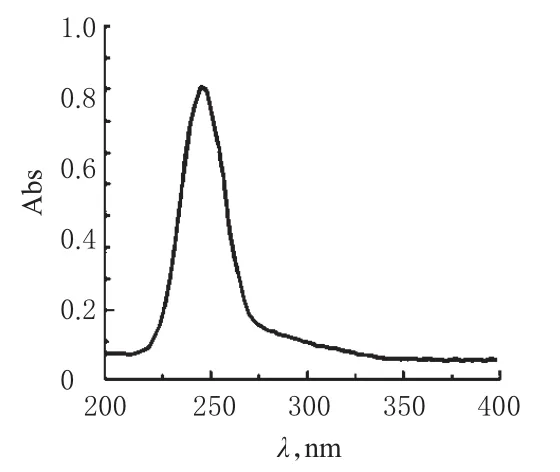
图1 琥珀酸呋罗曲坦的紫外吸收光谱图Fig 1 UV absorption spectrum of frovatriptan succinate
2.1.7 溶出度 取样品,按2015年版《中国药典》(四部)通则0931“溶出度测定法”[3],以pH 5.5的磷酸盐缓冲液(PBS)900m L为溶出介质,转速为50 r/m in,依法操作。分别于5、10、15、20、30min时取样10m L,经0.22μm微孔滤膜过滤,取续滤液作为供试品溶液,取样同时补加等量等温度的溶出介质。取供试品溶液在245 nm波长下测定吸光度,计算累积溶出度,绘制溶出曲线。
2.2 琥珀酸呋罗曲坦素片的制备
称取处方量的琥珀酸呋罗曲坦原料药,过筛备用;将主药与处方量的微晶纤维素、二氧化硅、羧甲淀粉钠分别等量递增混匀,将混合物与处方量的一水乳糖混合均匀,加入处方量的硬脂酸镁,混合2min,调整片质量,压片,即得。
2.3 主药粒径的选择
将琥珀酸呋罗曲坦原料药分别过80目筛和400目筛后,按“2.2”项下方法制备成琥珀酸呋罗曲坦素片,按“2.1.7”项下方法测定累积溶出度并绘制溶出曲线。结果显示,将原料药过80目筛和400目筛后制备的样品溶出行为相似,从工艺易操作的角度考虑,选择将原料药过80目筛即可。不同粒径原料药所制琥珀酸呋罗曲坦素片的溶出曲线见图2。
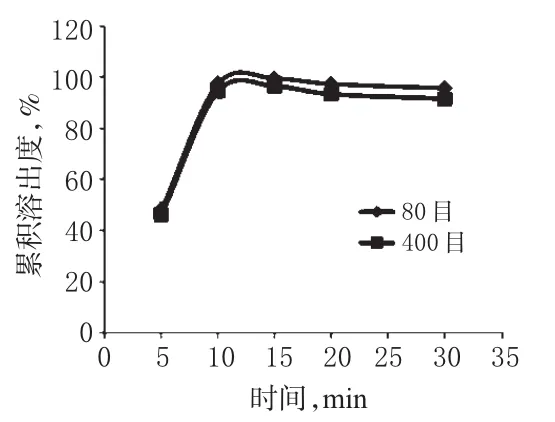
图2 不同粒径原料药所制琥珀酸呋罗曲坦素片的溶出曲线Fig 2 Dissolution curvesof frovatriptan succinate tabletsby different particle sizeof crude drug
2.4 素片处方单因素考察
2.4.1 填充剂 一水乳糖和微晶纤维素为常用的填充剂,其主要作用是保证片剂的可压性和成型性。采用一水乳糖压出的片子表面光滑、美观,可以提高药物的溶出度;而微晶纤维素同样也具有良好的可压性,压出的片剂紧密却具有良好的崩解性,与一水乳糖配合使用能加快药物在体内溶出。二者搭配在速释制剂中应用广泛,其具体比例可根据主药的性质进行调整。根据进口片剂处方的辅料组成和片质量,本研究设计了处方1~4,考察了不同比例(1∶1、2∶1、3∶1、4∶1)填充剂(一水乳糖-微晶纤维素)对琥珀酸呋罗曲坦素片质量的影响,处方设计用量见表1。
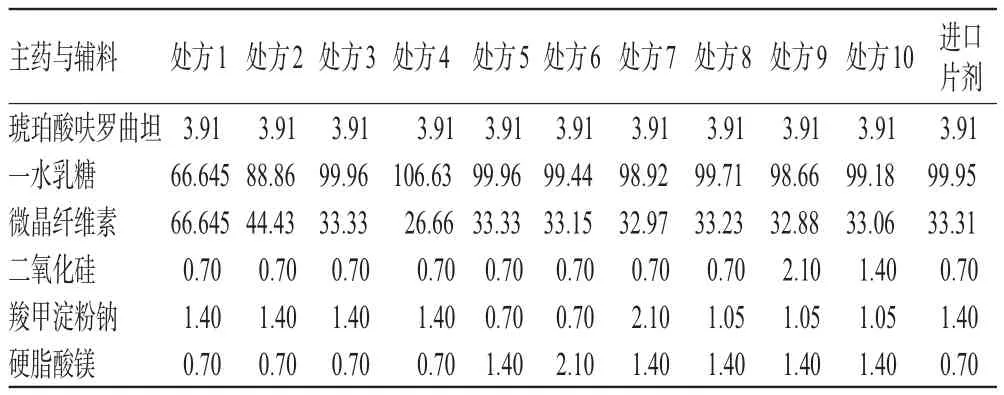
表1 琥珀酸呋罗曲坦素片的10个处方设计(mg/片)Tab 1 Design of the 10 formulations of Frovatriptan succinate tablet(mg/piece)
2.4.2 润滑剂 硬脂酸镁作为润滑剂,常规用量为0.3%~1.5%,硬脂酸镁用量和混合时间会影响粉末的流动性和压片过程的润滑效果,且硬脂酸镁对制剂的崩解和溶出均有影响。根据进口片剂处方的辅料组成和片质量,本研究设计了处方5和处方6,考察了不同用量(1.0%、1.5%)硬脂酸镁对琥珀酸呋罗曲坦素片质量的影响,处方设计用量见表1。
2.4.3 崩解剂 羧甲淀粉钠为崩解剂,具有较强的吸水性和膨胀性,常规用量为0.5%~6%,在此范围内崩解效果较好,如果量再大反而会降低崩解效果。因为羧甲淀粉钠的崩解机制是遇水快速膨胀从而达到崩解效果,量太大后遇水膨胀速度过快,使制剂表面迅速形成凝胶层,反而抑制了水的渗透、降低了崩解速度。根据进口片剂处方的辅料组成和片质量,本研究设计了处方7和处方8,考察了不同用量(1.5%、0.75%)羧甲淀粉钠对琥珀酸呋罗曲坦素片质量的影响,处方设计用量见表1。
2.4.4 助流剂 二氧化硅为助流剂,常规用量为0.15%~3%[4],可增加粉体的流动性、减少片重差异。根据国外上市片剂处方的辅料组成和片质量,本研究设计了处方9和处方10,考察了不同用量(1.5%、1.0%)二氧化硅对琥珀酸呋罗曲坦素片质量的影响,处方设计用量见表1。
2.4.5 质量评价 按表1所列处方和“2.2”项下方法制备琥珀酸呋罗曲坦素片,按“2.1”项下方法对其进行质量评价。结果表明,水分、休止角、硬度、脆碎度和崩解时限和进口片剂比较均无明显差异。指标考察结果见表2,溶出曲线见图3。

表2 不同处方设计的琥珀酸呋罗曲坦素片的指标考察结果Tab 2 Investigation results of Frovatriptan succinate tablet indexes designed by different formulations
由图3A可知,一水乳糖-微晶纤维素比例对琥珀酸呋罗曲坦素的溶出行为有很大的影响,当一水乳糖-微晶纤维素片比例为4∶1时,15m in的累积溶出度达85%以上,然后基本保持不变,无法完全溶出。根据结果,选择处方3,即一水乳糖与微晶纤维素的比例为3∶1,其溶出曲线与进口片剂溶出曲线更相似。由图3B可知,当硬脂酸镁用量为1.5%时素片的溶出度比用量为1.0%时低;当硬脂酸镁的用量为1.0%时,素片溶出曲线与进口片剂较为相似。因此将硬脂酸镁的用量定为1.0%。由图3C可知,随着羧甲淀粉钠处方量的增大,素片溶出速率也随之升高,因此将羧甲淀粉钠处方量设为0.75%,以使素片溶出曲线更接近进口片剂。由图3D可知,二氧化硅的用量对素片的质量评价项目,尤其是溶出曲线无显著的影响,故从经济角度考虑,将二氧化硅的用量定为1.0%。

图3 不同处方的琥珀酸呋罗曲坦素片的体外溶出曲线Fig 3 Dissolution curves in vitro of Frovatriptan succinate tablet designed by different formulations
综上所述,根据各辅料考察结果,最终确定琥珀酸呋罗曲坦素片的处方为琥珀酸呋罗曲坦3.91mg、一水乳糖99.18mg、微晶纤维素33.06mg、硬脂酸镁1.40mg、羧甲淀粉钠1.05mg、二氧化硅1.40mg。
2.5 包衣工艺的单因素考察
称取处方量的纯化水,边搅拌边加入欧巴代预混包衣粉,制成均匀的包衣液;将素片片芯置于包衣锅中,调节适合的包衣参数,进行喷雾包衣。分别取包衣增质量为2.0%、3.0%、4.0%的琥珀酸呋罗曲坦薄膜衣片进行崩解时限和溶出度考察。结果显示,包衣增质量为2.0%、3.0%、4.0%时,所制琥珀酸呋罗曲坦薄膜衣片的崩解时限分别为3.5、4、4.5m in,溶出曲线无明显差别,详见图4。结果表明,当包衣增质量在2.0%~4.0%范围时,对该药薄膜衣片的溶出行为无明显影响,因此将包衣增质量设定在2.0%~4.0%范围内。
2.6 自制片剂与进口片剂在不同介质中的溶出曲线比较
取自制琥珀酸呋罗曲坦薄膜衣片,分别以900m L水、pH 5.5 PBS、pH 6.8 PBS和0.1mol/L HCl为溶出介质,按“2.1.7”项下方法测定样品的溶出度,绘制溶出曲线,并与进口琥珀酸呋罗曲坦薄膜衣片(进口片剂)的溶出曲线进行比较。自制片剂与进口片剂在4种介质中的体外溶出曲线见图5。
由图5显示,在水、pH 5.5 PBS和pH 6.8 PBS 3种溶出介质中,自制片剂和进口片剂的溶出曲线相似,在15m in之后的溶出度均大于85%,可以认为自制片剂与进口片剂的溶出行为相似。在0.1mol/LHCl溶出介质中,进口片剂15min的溶出度较自制片剂小,20min时二者的溶出度几乎一致,均大于85%。按溶出行为相似因子(f2)法进行判断[5],只要f2大于50即可认定为溶出行为相似。经计算,自制片剂与进口片剂溶出行为的f2为55,由此判断二者在0.1mol/LHCl中的溶出行为相似。

图4 不同包衣增质量的琥珀酸呋罗曲坦薄膜衣片的体外溶出曲线(n=6)Fig 4 in vitro dissolution curvesof Frovatriptan succinate firm-coated tablet w ith different coating weighted quality(n=6)
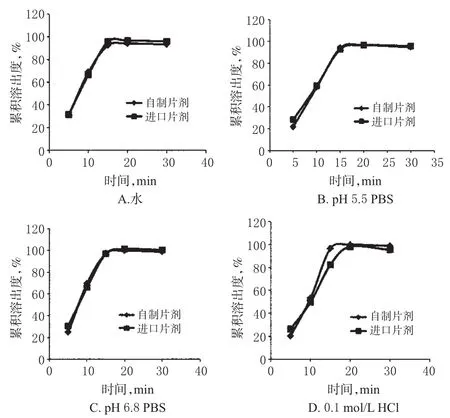
图5 自制片剂与进口片剂在4种介质中的体外溶出曲线(n=6)Fig 5 in vitro dissolution curves of self-made tablets and im ported tablets in 4mediums(n=6)
2.7 制备工艺的确定
称取3.91 g琥珀酸呋罗曲坦原料药,过筛备用;将主药与33.06 g微晶纤维素、1.40 g二氧化硅、1.05 g羧甲淀粉钠分别等量递加混匀;将混合物与99.18 g一水乳糖混合均匀,加入1.40 g硬脂酸镁,混合2m in,调整片质量,压片,得1 000片素片片芯备用。称取425 g水于配制容器中,开动搅拌器,称取75 g欧巴代预混包衣粉,缓缓加入到以上配制容器中,得到均匀的混悬包衣液,备用;将片芯置于包衣锅中,调节适当的包衣锅转速,控制物料温度,调节喷枪的雾化效果,进行薄膜包衣,待片芯增质量达到2.0%~4.0%范围内,即可。
3 讨论
薄膜包衣是在药物片芯表层外包一层比较稳定的高分子聚合物衣膜,其辅料的增质量仅为片芯的2%~4%。与糖衣片相比,薄膜衣片生产时间短、操作自动化、不易产尘、不污染环境,更易符合《药品生产质量管理规范》(GMP)要求,且具有不易产生裂片、花斑、霉点,易于崩解,溶出度和生物利用度高等优点[6]。欧巴代是一种较好的薄膜包衣材料,是以羟丙基甲基纤维素为主体成分,同时配以适当的增塑剂和着色剂组成[7]。
溶出度对难溶性药物制剂的生物利用度研究和生物等效性评价是重要的指标,是新药和仿制药的科学评价手段[8]。f2相似因子法是美国FDA推出的采用溶出曲线评价药品内在质量,推测仿制制剂与原研制剂是否有生物等效性的方法,该法可判断不同处方对药物释放的影响程度,为新药申报注册的生物等效性试验作前瞻性预测[5]。
本研究成功制得了琥珀酸呋罗曲坦薄膜衣片,且其体外溶出行为与进口制剂相似,初步确定受试产品生产工艺及配方的合理性,为琥珀酸呋罗曲坦薄膜衣片的研发和生产提供了有力的科学依据。
[1]郭郁,雷静,封宇飞.新一代5-HT1B/1D受体激动剂夫罗曲坦[J].中国新药杂志,2004,13(9):853-855.
[2]马爱梅,赵永波.偏头痛的新药治疗[J].临床神经病学杂志,2005,18(2):159-160.
[3]国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:通则0401、通则0921、通则0931.
[4]古一雯.微粉硅胶在制剂工艺中的应用[J].安徽医药,2008,12(10):981-982.
[5]谢沐风.溶出曲线相似性的评价方法[J].中国医药工业杂志,2009,40(4):308-311.
[6]王钰琦,李瑞明,李世良,等.阿莫西林克拉维酸钾薄膜衣片的制备工艺研究[J].中国药物经济学,2013,doi: 10.3969/j.issn.1673-5846.
[7]陈娥功,赵峡,黎华,等.甘糖酯薄膜衣片的制备及稳定性试验[J].中国海洋药物,2003,22(6):38-40.
[8]程怡,裘建设,胡瑞标,等.f2因子法评价头孢克洛干混悬剂溶出曲线的相似性[J].中国新药杂志,2012,21(20): 2437-2440.
(编辑:邹丽娟)
Preparation and in vitro Dissolution Behavior Investigation of Frovatriptan Succinate Film-coated Tablet
LIU Xiaoxia,WANG M inggang,CHEN Yangsheng,SUN Guiyu,ZANG Yunlong(Qingdao Chiatai Haier Pharmaceutical Co.,Ltd.,Shandong Qingdao 266101,China)
OBJECTIVE:To prepare Frovatriptan succinate film-coated tablet,and investigate its in vitro dissolution behavior. METHODS:Using lactosemonohydrate,m icrocrystalline cellulose,dioxide,silica,sodium carboxymethyl starch and magnesium stearate as accessories,Frovatriptan succinate tabletwas prepared.Using opadry prem ix spray-coating liquid,Frovatriptan succinate film-coated tablet was prepared.Single factor test was used,using moisture,angle of repose,rigidity,friability,disintegration time and dissolution rate as indexes,to screen the formulation;using dissolution degree as index,coating material dosage was screened.The dissolution curves in vitro of self-made tablets and imported tablets in water,0.1 mol/L HCL,pH of 5.5,6.8 phosphate buffer solutions were compared.RESULTS:The optimal formulation of Frovatriptan succinate uncoated tablet was as follow as frovatriptan succinate 3.91 mg,lactose monohydrate 99.18 mg,m icrocrystalline cellulose 33.06 mg,magnesium stearate 1.40 mg,sodium carboxymethyl starch 1.05 mg,silica 1.40 mg;optimal coating weighed quality was 2.0%-4.0%.In the 4 mediums,the dissolution behavior of self-made tablets and imported tablets were sim ilar.CONCLUSIONS:Frovatriptan succinate film-coated tablet is prepared successfully,and its in vitro dissolution behavior is sim ilar to the imported preparations.
Frovatriptan succinate;Film-coated tablet;Single factor test;Spray coating;in vitro dissolution behavior
R943;R927
A
1001-0408(2017)19-2696-04
2016-10-18
2016-12-08)
*工程师。研究方向:药物化学、制药工程。电话:0532-88939212。E-mail:liuxx.zdhr@haier.com
DOI 10.6039/j.issn.1001-0408.2017.19.29
