莪术-三棱药对合煎液对大鼠子宫肌瘤的防治作用及机制研究Δ
2017-08-11李文静李雪岩蔡德富齐齐哈尔医学院药学院黑龙江齐齐哈尔6000沈阳药科大学药学院沈阳006
李文静,李雪岩,崔 涛,蔡德富,樊 丽,张 昊,刘 雷,洪 博#(.齐齐哈尔医学院药学院,黑龙江齐齐哈尔6000;2.沈阳药科大学药学院,沈阳006)
·实验研究·
莪术-三棱药对合煎液对大鼠子宫肌瘤的防治作用及机制研究Δ
李文静1,2*,李雪岩1,崔 涛1,蔡德富1,樊 丽1,张 昊1,刘 雷1,洪 博1#(1.齐齐哈尔医学院药学院,黑龙江齐齐哈尔161000;2.沈阳药科大学药学院,沈阳110016)
目的:研究莪术-三棱药对合煎液对大鼠子宫肌瘤的防治作用及机制。方法:将大鼠随机分为正常组、模型组、阳性组(米非司酮,2.25mg/kg)和药对合煎液组(莪术-三棱药对合煎液,6.0 g/kg),每组10只。除正常组外,其余各组大鼠分别于每周一、三、五im苯甲酸雌二醇注射液(0.5mg/kg),持续12周;从第13周开始,造模组大鼠增加im黄体酮注射液(5mg/kg),并每天ig给药1次,至实验第16周。给药结束后,测定大鼠子宫系数,苏木精-伊红染色观察大鼠子宫病理变化并测定平滑肌厚度,免疫组化染色法测定大鼠子宫组织中转化生长因子β3(TGF-β3)和基质金属蛋白酶11(MMP-11)蛋白表达。结果:与正常组比较,模型组大鼠子宫系数升高、子宫发生明显病理变化、子宫平滑肌厚度增加、子宫组织中TGF-β3和MMP-11蛋白表达增强(P<0.05或P<0.01);与模型组比较,阳性组和药对合煎液组大鼠上述变化均显著改善(P<0.05或P<0.01)。结论:莪术-三棱药对合煎液对大鼠子宫肌瘤有一定的防治作用,其机制可能与下调子宫组织中TGF-β3、MMP-11蛋白表达有关。
莪术;三棱;药对;子宫肌瘤;转化生长因子β3;基质金属蛋白酶11;大鼠
药对是中药复方的核心,是以安全有效为特点的最小联合用药单元,有的发挥协同作用,有的发挥相制作用。药对配伍符合中医理论的“七情和合”,是中医遣方用药特色的体现[1]。子宫肌瘤是女性生殖器最常见的一种良性肿瘤,主要是由子宫平滑肌细胞增生而成,其中有少量纤维结缔组织作为一种支持组织而存在[2-3]。虽然子宫肌瘤是良性肿瘤,但大部分子宫肌瘤临床上常伴有子宫出血、腹部包块及压迫等症状,尤其极易导致孕期妇女不孕或流产,严重影响了女性生活及工作质量[4-5]。关于子宫肌瘤的病因及发病机制,有报道称与激素、免疫等因素有关[6-7],但目前尚无定论。据报道,转化生长因子β3(Transform ing grow th factorβ3,TGF-β3)在子宫肌瘤的发生中起着重要的作用[8];基质金属蛋白酶11(Matrix metalloproteinase 11,MMP-11)在促进肿瘤细胞增殖凋亡、降解结缔组织成分等方面起着核心的作用[9-10]。
莪术与三棱为破血化瘀的代表药物,二药伍用首见于《经验良方》中三棱丸[11]。莪术-三棱药对在临床常用于治疗气血凝滞所致的血滞经闭腹痛、癥瘦积聚、痞块等。目前,对于子宫肌瘤的中医药治疗均采用活血化瘀、消癥散结的药物,如桂技茯苓丸(胶囊)、宫瘤清胶囊、三棱丸、宫瘤消胶囊、三棱祁甲合剂、软坚散结颗粒等,上述方中均含有莪术-三棱药对。所以,本研究以三棱丸为基础,选择莪术-三棱药对为研究对象,探讨该药对治疗子宫肌瘤的作用及机制。
1 材料
1.1 仪器
Nikon-ECLIPSECi显微镜(包括CCD成像系统)购自日本Nikon公司;LD4-2A常温离心机(北京医用离心机厂);pH计、Sartorius BS 223 S电子天平(德国赛多利斯科学仪器有限公司)。
1.2 药品与试剂
米非司酮片(湖北葛店人福药业有限责任公司,批号:140407,规格:25mg/片);苯甲酸雌二醇注射液、黄体酮注射液(宁波市三生药业有限公司,批号:110042511、110041439,规格:2mg/m L、50mg/m L);所有抗体以及辣根过氧化物(DAB)酶底物显色试剂盒(批号: AR1022)均购自武汉博士德生物技术有限公司;甲醛(分析纯,辽宁泉瑞试剂有限公司)。
1.3 药材与合煎液
莪术(产地:安徽毫州,批号:20150329)、三棱(产地:安徽毫州,批号:20151104)药材均购自毫州市国峰药业销售有限公司,经齐齐哈尔医学院中药研究室郭丽娜教授鉴定分别为姜科植物蓬莪术(Curcuma phaeocaulis)的干燥根茎和黑三棱科植物黑三棱或细叶黑三棱(Sparganium stoloniferum)的块茎。莪术-三棱药对合煎液由本实验室提取(批号:160922,规格:含生药1.25 g/m L)。
1.4 动物
Wistar大鼠40只,♀,体质量190~210 g,由北京维通利华实验动物技术有限公司提供,实验动物许可证编号:SCXK(京)2007-0001。动物均喂以标准灭菌鼠饲料,自由饮水。动物房设定室温为20~22℃、湿度为40%~70%。
2 方法
2.1 分组、造模及给药
将40只大鼠随机分成正常组、模型组、阳性组和药对合煎液组,共4组,每组10只。各组大鼠分别于代谢笼中适应性饲养1周后,除正常组外,其余各组大鼠分别于每周一、三、五im苯甲酸雌二醇注射液(0.5mg/kg)复制子宫肌瘤模型,正常组大鼠im等体积的生理盐水,连续12周;第13周开始,造模组大鼠每周im苯甲酸雌二醇注射液后再增加im用苯甲酸雌二醇稀释的黄体酮注射液(5mg/kg),正常组大鼠同时im等体积的生理盐水;并于第13周开始给药,阳性组小鼠ig米非司酮2.25mg/kg (根据人临床用量换算而得),药对合煎液组小鼠ig莪术-三棱合煎液6.0 g/kg(根据人临床用量为每天莪术与三棱药材各10 g的剂量换算而得),正常组和模型组小鼠ig生理盐水溶液2m L,每天1次,第16周后结束造模及给药[12-13]。
2.2 子宫形态观察及子宫系数测定
给药结束后称定各组大鼠体质量,处死取出子宫,观察每组大鼠的子宫形态改变。将子宫称质量后计算子宫系数[子宫质量(g)/体质量(g)],并以10%甲醛溶液固定。
2.3 HE染色后子宫病理变化观察及平滑肌厚度测定
取每只大鼠子宫分角上0.5 cm处的一段子宫组织,用石蜡包埋于模具中,将石蜡包埋的组织块切成适宜的厚度(5μm),进行HE染色后拍照,每个标本取3张照片(×20,2张;×40,1张)。参照文献[14-15]中病理分级标准进行分级:0级,子宫平滑肌细胞排列均匀规则;Ⅰ级,平滑肌层少许增厚或不增厚,肌纤维排列紊乱;Ⅱ级,平滑肌层明显增厚,大面积平滑肌出现穿插现象;Ⅲ级,平滑肌细胞排列紊乱,穿插现象明显,肌层成漩涡状。并选用200倍光镜下拍摄的照片对子宫平滑肌厚度进行测定,每张照片计数3次,每个样本3张照片,共计测量9次,以平均值作为该样本的平滑肌厚度。
2.4 免疫组化染色后子宫中TGF-β3、MMP-11蛋白表达检测
子宫切片常规脱蜡至水,室温加入过氧化酶阻断液10m in,柠檬酸钠缓冲液抗原修复,5%牛血清白蛋白封闭液封闭后,滴加一抗(1∶100),4℃孵育过夜。0.01 mol/L磷酸盐缓冲液(PBS)洗涤3次,每次3min;滴加生物素标记的二抗1滴,37℃孵育20m in,PBS液洗涤3次,每次3m in;滴加链霉亲和素-生物素复合物(SABC)溶液,37℃孵育20m in,PBS洗涤4次,每次5m in;DAB显色,染色,封片。每只大鼠取1张免疫组化切片,置于显微镜下放大20倍,随机选取5个视野拍片。应用Image-Pro-plus软件,计算TGF-β3和MMP-11的积分光密度(IOD)值,取这5个视野的平均IOD值作为该切片TGF-β3和MMP-11的蛋白表达量。
2.5 统计学方法
采用SPSS Statistics22软件进行统计分析。计量资料以±s表示,采用单因素方差分析和t检验进行组间比较;等级资料采用秩和检验。P<0.05表示差异有统计学意义。
3 结果
3.1 大鼠子宫形态观察与子宫系数测定结果
造模后大鼠子宫明显增生,给药后大鼠子宫增生不同程度减轻,并以药对合煎液组效果最明显,详见图1。与正常组比较,其余各组大鼠子宫系数均显著升高(P<0.01);与模型组比较,阳性组和药对合煎液组大鼠子宫系数均显著降低(P<0.01),结果详见表1。

图1 各组大鼠子宫形态图Fig 1 Theuterusmorphology of rats in each group
表1 各组大鼠子宫系数测定结果(±s,n=10)Tab 1 Determ ination resu lts of the uterine coefficient of rats in each group(±s,n=10)

表1 各组大鼠子宫系数测定结果(±s,n=10)Tab 1 Determ ination resu lts of the uterine coefficient of rats in each group(±s,n=10)
注:与正常组比较,**P<0.01,与模型组比较,##P<0.01Note:vs.normalgroup,**P<0.01;vs.modelgroup,##P<0.01
组别正常组模型组阳性组药对合煎液组子宫系数,g/g 0.001 9±0.000 2 0.004 3±0.000 5**0.003 1±0.000 4**##0.003 2±0.000 7**##
3.2 大鼠子宫病理观察结果
正常组大鼠子宫平滑肌层较薄,平滑肌细胞细长、排列整齐;模型组大鼠子宫平滑肌呈不同程度的增生,平滑肌细胞排列紊乱,肌纤维排列疏松,肌纤维或较长或粗短,肌纤维束之间有或多或少的结缔组织纤维,纵行肌层和环行肌层均明显增厚,发生明显病理改变(P<0.01);阳性组和药对合煎液组大鼠子宫的纵、环行肌层的厚度较模型组薄,病理程度明显减轻(P<0.01)。病理观察图片见图2、分级结果见表2。
3.3 大鼠子宫平滑肌层厚度测定结果
与正常组[(189.9±21.1)μm]比较,模型组大鼠子宫平滑肌厚度[(218.9±44.6)μm]显著增加(P<0.05);与模型组比较,阳性组和药对合煎液组大鼠子宫平滑肌层厚度[分别为(182.7±24.4)、(181.8±28.6)μm]均显著减少(P<0.05)。
3.4 大鼠子宫组织中TGF-β3、MMP-11蛋白表达测定结果TGF-β3和MMP-11在各组大鼠子宫平滑肌细胞的

图2 各组大鼠子宫HE染色图(×20)Fig 2 HE staining chartsof rats’uterus in each group (×20)

表2 各组大鼠子宫病理分级结果Tab 2 Resu lts of uterine pathology grading of rats in each group
胞浆中均有不同程度的表达,表现为黄色或棕黄色的阳性细胞。与正常组比较,其余各组大鼠子宫中TGF-β3、MMP-11蛋白表达均增强(P<0.01);与模型组比较,阳性组和药对合煎液组大鼠子宫中TGF-β3、MMP-11蛋白表达均减弱(P<0.01)。免疫组化图见图3、蛋白表达测定结果见表3。
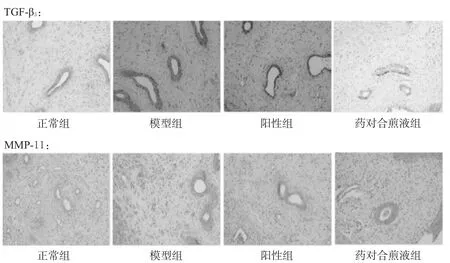
图3 各组大鼠子宫组织中TGF-β3、MMP-11蛋白表达的免疫组化染色图(×20)Fig 3 Immunohistochem ical staining charts of TGF-β3,MMP-11 protein expressions of rats’uterus tissue in each group(×20)
4 讨论
据文献[12-13]报道,采用雌、孕激素联合使用的方
表3 各组大鼠子宫组织中TGF-β3、MMP-11蛋白表达测定结果(±s,n=10)Tab 3 Determ ination resultsof TGF-β3,MMP-11 protein expressions of rats’uterus tissue in each group(±s,n=10)

表3 各组大鼠子宫组织中TGF-β3、MMP-11蛋白表达测定结果(±s,n=10)Tab 3 Determ ination resultsof TGF-β3,MMP-11 protein expressions of rats’uterus tissue in each group(±s,n=10)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01Note:vs.normalgroup,**P<0.01;vs.modelgroup,##P<0.01
MMP-11,×1043.696±0.49 14.200±0.83**7.582±1.27**##7.900±1.53**##组别正常组模型组阳性组药对合煎液组IOD值TGF-β3,×1042.929±0.43 13.260±1.42**6.653±1.08**##7.323±1.26**##
法进行造模可使动物模型更加稳定,建立的子宫肌瘤模型与人子宫肌瘤也更加相似,且发病原因也更吻合,因此在本研究中采用雌激素和孕激素联合法制备大鼠子宫肌瘤动物模型。造模后大鼠子宫形态发生了明显的改变,正常组大鼠子宫呈Y型,质地均匀,色泽均一呈粉色,富有弹性;而模型组大鼠子宫体积较正常组明显增大,呈暗红色,水肿现象明显,出现结节、囊肿,个别大鼠子宫角可见肿块,子宫系数也比正常组显著升高(P<0.05),提示造模成功。
莪术-三棱药对配伍在临床上被应用于治疗子宫肌瘤,本研究为了进一步探讨莪术-三棱药对治疗子宫肌瘤的药理作用及机制,采用莪术-三棱药对的合煎液ig给药。结果显示,莪术-三棱药对合煎液ig给药4周后,在雌、孕激素作用下过度增生的子宫受到抑制,病理变化得到显著改善(P<0.05)。
子宫HE染色结果显示,模型组大鼠子宫明显增厚,平滑肌纤维排列明显紊乱,肌细胞纵横交错;而莪术-三棱药对合煎液可不同程度地减轻大鼠子宫内膜和肌层的增厚程度。免疫组化结果显示,造模组大鼠子宫肌瘤组织和正常组大鼠的子宫肌壁组织中均有TGF-β3、MMP-11蛋白的表达,且子宫肌瘤组织中TGF-β3、MMP-11蛋白的表达明显高于正常组织(P<0.05),提示TGF-β3、MMP-11蛋白与子宫肌瘤的发生发展具有一定的相关性。莪术-三棱药对合煎液可减弱子宫肌瘤大鼠子宫组织中TGF-β3、MMP-11蛋白的表达。
综上所述,本研究证实了莪术-三棱药对合煎液对大鼠子宫肌瘤具有一定的防治作用,可降低模型大鼠子宫系数、减少模型大鼠子宫肌层过度增生,此作用可能与其下调模型大鼠子宫中TGF-β3、MMP-11蛋白的表达有关。本研究为子宫肌瘤发病及治疗机制的研究提供了一定的实验依据,也为子宫肌瘤的诊断和治疗提供了一个新的靶点,但其更多的作用机制有待进一步研究。
[1]王嘉俊,李双蕾,李梦瑶.中药药对的现代认识与研究[J].中医杂志,2016,57(8):701-704.
[2]苏萍,廖铃,周文,等.重庆市三级甲等医院子宫肌瘤治疗现状的调查分析[J].中国药房,2012,23(40):3764-3767.
[3]陈嘉,赵绪韬,顾丰华,等.鳖甲煎丸对子宫肌瘤模型大鼠血清激素水平及子宫组织病理改变的影响[J].世界临床药物,2015,36(4):1-4.
[4]Nnoaham KE,Hummelshoj L,Webster P,etal.Impactof endometriosis on quality of life and work productivity:a multicenter study across ten countries[J].Fertil Steril,2011,96(2):366-371.
[5]Husby GK,Haugen RS,Moen MH.Diagnostic delay in women w ith pain and endometriosis[J].Acta ObstetGynecol Scand,2003,82(7):649-658.
[6]王亚松,李冬华,邹小丽,等.理冲汤对子宫肌瘤模型大鼠血清激素水平及组织病理改变的影响[J].现代中西医结合杂志,2012,21(5):475-479.
[7]奚剑敏,丁正香.子宫肌瘤大鼠模型的病理改变及病因分析[J].现代生物医学进展,2010,10(3):466-469.
[8]张春华,温泽清,朱勇.子宫肌瘤中TGF-β3和Bcl-2的表达及其意义[J].中华肿瘤防治杂志,2009,16(19):1494-1497.
[9]Guelaguetza V,Patricia P,Karla V,et al.Overexpression of cathepsin F,matrix metalloproteinases 11 and 12 in cervical cancer[J].BMCCancer,2005,5(4):68-75.
[10]Ravakhan K,Gover A,Mukunda BN.Humoral hypercalcemia associated w ith a uterine fibroid[J].Ann Intern Med,1999,130(8):702-712.
[11]余成浩,孙涛,冯业琼,等.三棱-莪术关联子宫肌瘤的研究进展[J].时珍国医国药,2012,23(6):1493-1495.
[12]陈海冈,朱兰,崔全才,等.雌激素制备大鼠子宫肌瘤动物模型[J].中国医学科学院学报,2011,33(4):408-411.
[13]荆慧娟,刘振华,许建阳.子宫肌瘤动物模型的研究进展[J].实验动物与比较医学,2010,30(3):225-257.
[14]奚剑敏,丁正香.子宫肌瘤大鼠模型的病理改变及病因分析[J].现代生物医学进展,2010,10(3):466-469.
[15]胡颖,罗俊,黄能慧.妇科再造丸对雌孕激素负荷大鼠子宫病理形态学的影响[J].中国实验方剂学杂志,2011,17 (23):140-144.
Study on the Preventive and Therapeutic Effect and Its M echanism of M edicine Pair Decoction Liquid of Curcuma phaeocaulis-Sparganium stoloniferum on Uterine M yoma in Rats
LIWenjing1,2,LIXueyan1,CUITao1,CAIDefu1,FAN Li1,ZHANG Hao1,LIU Lei1,HONG Bo1(1.School of Pharmacy,Qiqihar Medical University,Heilongjiang Qiqihar 161000,China;2.School of Pharmacy,Shenyang Pharmaceutical University,Shenyang 110016,China)
OBJECTIVE:To study the preventive and therapeutic effect and itsmechanism ofmedicine pair decoction liquid of Curcuma phaeocaulis-Sparganium stoloniferum on rats w ith uterine myoma.METHODS:Rats were random ly divided into normal group,model group,positive group(mifepristone,2.25mg/kg)and medicine pair decoction liquid group(C.phaeocaulis-S.stoloniferum decoction liquid,6.0 g/kg),10 in each group.Except for the normal group,rats in other groupswere injected Estradiol benzoate injection(0.5 mg/kg)intramuscularly every Monday,Wednesday and Friday,for 12 weeks.From the 13th week,rats in modeling group were added Progesterone injection(5 mg/kg)intramuscularly as well as relevantmedicines intragastrically,once a day,until the 16th week.A fter adm inistration,uterine coefficient of rats was detected.HE staining was used to observe the pathological changes of uterus and determine the thickness of smooth muscle;immunohistochemical staining was adopted to detect the transform ing grow th factorβ3(TGF-β3),matrix metalloproteinase 11(MMP-11)protein expressions in uterus tissue of rats.RESULTS:Compared w ith normal group,uterine coefficient was increased in model group,pathological changes were obvious in uterus,thickness of smooth muscle was increased,TGF-β3and MMP-11 protein expressionswere enhanced(P<0.05 or P<0.01). Compared w ith model group,above-mentioned changes were improved significantly in positive group and medicine pair decoction liquid groups(P<0.05 or P<0.01).CONCLUSIONS:Medicine pair decoction liquid of C.phaeocaulis-S.stoloniferum shows certain preventive and therapeutic effect on ratsw ith uterinemyoma.Themechanism may be associated w ith downregulating the TGF-β3,MMP-11 protein expressions in uterus tissue.
Curcuma phaeocaulis;Sparganium stoloniferum;Medicine pair;Uterinemyoma;Transforming grow th factorβ3; Matrix metalloproteinase 11;Rats
R965
A
1001-0408(2017)19-2609-04
2017-01-10
2017-04-11)
(编辑:林 静)
国家自然科学基金资助项目(No.81403173)
*讲师,博士。研究方向:中药质量标准。电话:0452-2663159。E-mail:lw j022325@163.com
#通信作者:讲师,博士。研究方向:中药配伍机制。电话: 0452-2663159。E-mail:bohong200630174@163.com
DOI 10.6039/j.issn.1001-0408.2017.19.05
