响应面法优化微生物萃取转化制备L-苯基乙酰基甲醇的工艺
2017-08-11薛迎迎连云港中医药高等职业技术学校中医药系江苏连云港222007
薛迎迎(连云港中医药高等职业技术学校中医药系,江苏连云港 222007)
响应面法优化微生物萃取转化制备L-苯基乙酰基甲醇的工艺
薛迎迎*(连云港中医药高等职业技术学校中医药系,江苏连云港 222007)
目的:优化微生物萃取转化制备L-苯基乙酰基甲醇(L-PAC)的条件。方法:以啤酒酵母萃取制备L-PAC。采用高效液相色谱法测定L-PAC浓度。以L-PAC浓度为响应值,通过Box-Behnken响应面法对苯甲醛、曲拉通(Triton)X-100和葡萄糖用量这3个主要因素进行考察,同时进行验证试验。结果:苯甲醛和Triton X-100之间的交互作用最为显著,最优因素组合为苯甲醛1.1%、Triton X-100 0.14 g/m L、葡萄糖0.028 g/m L;验证试验中L-PAC的平均浓度为28.04mmol/L(RSD=1.35%,n=3),与预测值28.01 mmol/L的相对误差为0.11%。结论:利用响应面法对微生物萃取转化制备L-PAC的条件进行了优化,得到了各因素的最优组合,可为大批量转化制备L-PAC提供有利参考。
响应面法;微生物萃取转化;L-苯基乙酰基甲醇
麻黄是我国重要的中药资源之一,用于治疗风寒感冒、胸闷喘咳、风水浮肿、支气管哮喘等病症[1]。麻黄的主要有效成分是麻黄碱和伪麻黄碱。麻黄碱具有兴奋中枢神经、收缩毛细血管、增强心肌收缩力等功能。近年来,因滥采滥挖导致野生麻黄资源匿乏,使得麻黄碱产量不足,因此开发化学、生物等途径合成麻黄碱及伪麻黄碱的关键中间体L-苯基乙酰基甲醇(L-phenylacetylcarbinol,L-PAC)具有重要意义。
啤酒酵母在非离子表面活性剂曲拉通X-100(Triton X-100)溶液中具有较好的生物相容性[2],可用于在胶束溶液中经微生物萃取转化制备L-PAC。本文采用Box-Behnken响应面法,分析底物苯甲醛、表面活性剂Triton X-100和辅底物葡萄糖用量3个主要因素对L-PAC生成浓度的影响,以获取最优的转化条件,为大批量转化生产L-PAC提供有利参考。
1 材料
1.1 仪器
HZQ-Q全温振荡器(哈尔滨东联电子技术开发有限公司);Waters600高效液相色谱仪(HPLC),包括Waters 600泵、Waters 486紫外检测器和Waters PC 800工作站(美国Waters公司)。
1.2 菌种与试剂
啤酒酵母(Saccharomyces cerevisiae)购于中国科学院微生物研究所;Triton X-100、L-PAC标准品(美国Sigma公司,批号:BFBD20152V、K37218-719,纯度:>98%);葡萄糖、苯甲醛(国药集团化学试剂有限公司,批号: 20160108、151201,均为分析纯);乙腈为色谱纯,其余试剂均为分析纯。
2 方法与结果
2.1 湿酵母细胞的培养
每100m L去离子水中加入葡萄糖3 g、蛋白胨2 g、酵母膏1 g,混匀后用移液管吸取50m L分别装入250 m L三角瓶中,纱布密封,置于30℃、200 r/m in振荡器中培养24 h。培养结束后,将培养液经2 500 r/min离心(离心半径:10 cm)5min,收集湿酵母细胞作为后续微生物萃取转化的催化剂。
2.2 微生物萃取转化
每100m L去离子水中加入蛋白胨2 g、酵母膏1 g、七水硫酸镁(MgSO4·7H2O)0.1 g、二水氯化钙(CaCl2· 2H2O)0.005 g、乙醛0.6m L、湿酵母细胞8 g和苯甲醛、Triton X-100、葡萄糖(苯甲醛、Triton X-100和葡萄糖的用量参考“2.4”项下),用磷酸氢二钠和柠檬酸调节溶液pH至4.8,混匀后用移液管取10m L分别装入50m L三角瓶中,纱布密封,置于30℃、200 r/m in振荡器中微生物萃取转化8 h。转化结束后,将转化液经4 000 r/m in离心(离心半径:10 cm)5min,取上清液,进样测定。
2.3 L-PAC浓度测定
2.3.1 L-PAC标准溶液的制备 称取L-PAC标准品1 g,溶解于200m L无水乙醇中,充分搅拌均匀,制得浓度为33mmol/L的L-PAC标准溶液,备用。
2.3.2 供试品溶液的制备 取“2.2”项下上清液0.5m L,无水乙醇稀释至1.5m L,即得[3]。
2.3.3 色谱条件与系统适用性 色谱柱:Hypersil C18(250 mm×4.6mm,5μm);流动相:乙腈-水(30∶70,V/ V);柱温:30℃;流速:1.0m L/min;检测波长:283 nm;进样量:20μL。在此色谱条件下,分别取空白溶液(不加湿酵母细胞,其余处理同“2.2”项下)、“2.3.1”“2.3.2”项下溶液进样测定。结果,L-PAC保留时间为9.3m in,分离度>1.5,色谱图见图1。
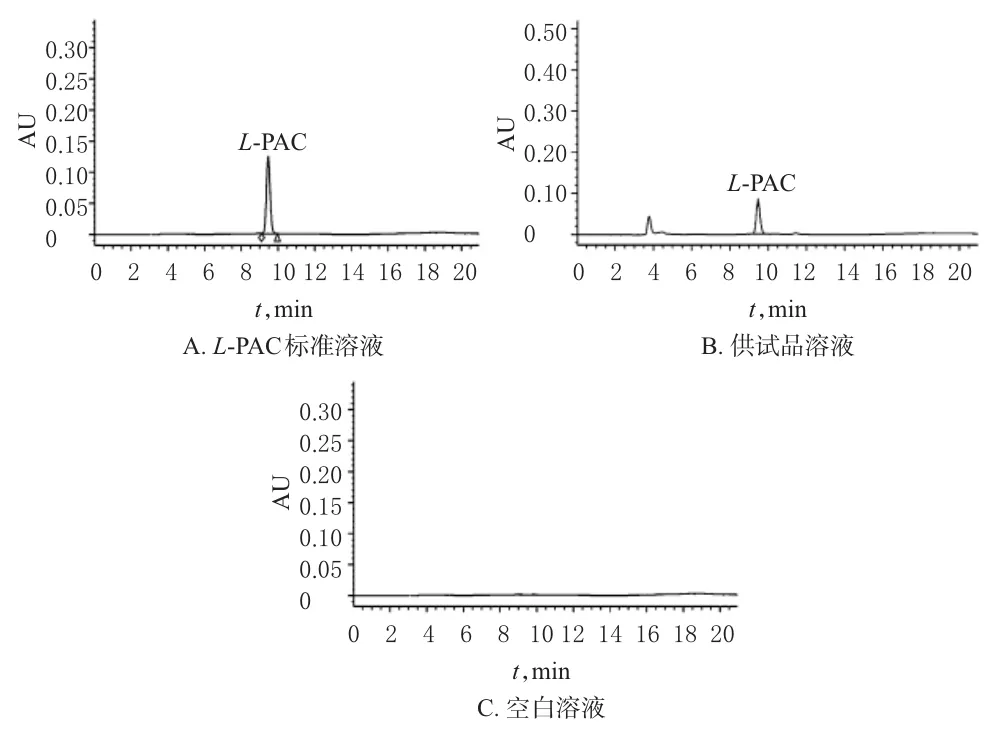
图1 高效液相色谱图Fig 1 HPLC chromatogram s
2.3.4 回归方程与线性范围 分别精密量取L-PAC标准溶液4、6、8、10、12、14、16μL,按“2.3.1”项下色谱条件进样测定,记录峰面积。以L-PAC浓度(mmol/L)为横坐标(x)、峰面积为纵坐标(y)进行线性回归,得回归方程为y=70 048x(r=0.999 6),表明L-PAC在1.298 6~30.793 3mmol/L范围内线性关系良好。
2.3.5 方法学考察 按照相关要求进行操作。结果,在重复性试验、稳定性试验和精密度试验中,L-PAC峰面积的RSD分别为1.2%(n=6)、0.11%(n=7)、0.09% (n=6),表明重复性、稳定性和精密度均良好;加样回收率为98.17%~101.62%(RSD=1.04,n=6),表明准确度较好。
2.4 Box-Behnken响应面法优化L-PAC转化生成条件
根据预试验结果,选择显著影响L-PAC浓度的3个因素,即底物苯甲醛(X1)、表面活性剂Triton X-100(X2)和辅底物葡萄糖(X3)用量为考察变量,产物L-PAC的浓度(Y)为响应值,采用Box-Behnken响应面法设计试验方案,其他操作条件同“2.2”项下,共设计15组试验。因素与水平见表1,Box-Behnken设计与结果见表2。

表1 因素与水平Tab 1 Factorsand levels
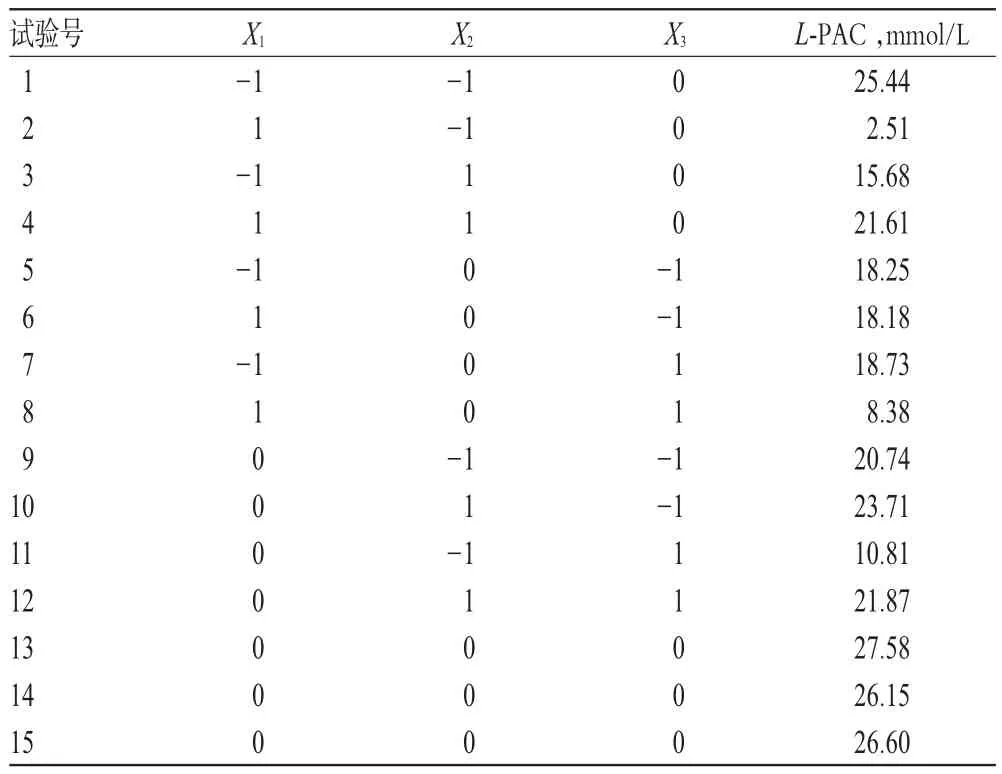
表2 Box-Behnken设计与结果Tab 2 Box-Behnken design and results
利用Design Expert7.0.1软件对表2中的数据进行二次多元回归拟合,得到Y对X1、X2、X3之间的二次多项回归方程为Y=26.78-3.43X1+2.92X2-2.64X3+7.21X1X2-2.57X1X3+2.02X2X3-6.94X12-3.54X22-3.96X32。对上述回归模型进行方差分析,结果见表3。
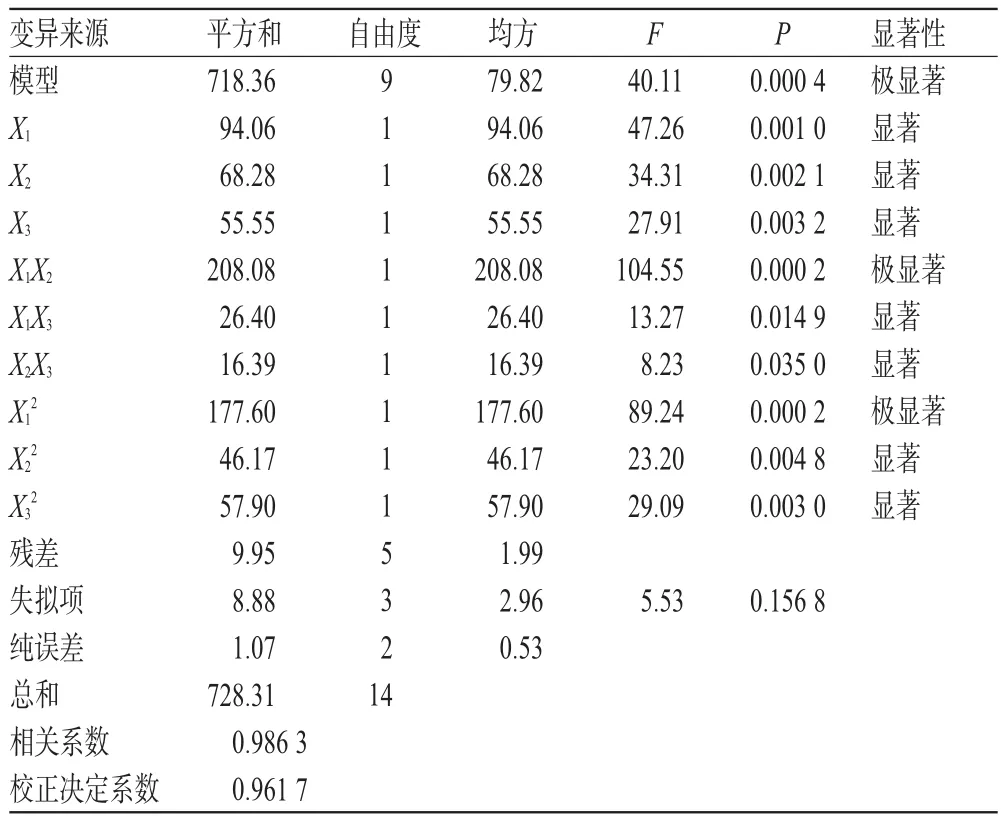
表3 方差分析结果Tab 3 Resultsof varianceanalysis
由表3可以看出,模型方程的P=0.000 4<0.01,说明模型方程极显著,该试验方法可靠。模型方程失拟项的P=0.156 8>0.05,为不显著,表明未知因素对试验结果干扰很小。试验值与模型方程预测值的校正决定系数为0.961 7,表明该模型能解释96.17%响应值随响应因素的变化,模型拟合程度较好。对方程中各项进行显著性分析,一次项、平方项和交互作用项的P均小于0.05,说明这3个因素以及因素之间的相互作用对响应值的影响都是显著的,其中Triton X-100和苯甲醛的相互作用非常显著(P=0.000 2)。因此,所得模型方程能够很好地预测产物L-PAC浓度随各响应因素的变化。
通过Design Expert7.0.1软件绘制出能够反映影响产物L-PAC浓度的3个因素交互作用的三维响应面图和二维等高线图,结果见图2。

图2 三维响应面图和的等高线图Fig 2 Corresponding surfaceand contourmap
由图2可知,若等高线图呈椭圆形则表明两个因素交互作用显著,若呈圆形则表明交互作用不显著[4-5]。3个椭圆形的等高线图表明X1、X2、X3这3个因素中任意2个因素的交互作用显著,尤其底物X1和表面活性剂X2的相互作用非常显著。
2.5 最佳条件的确定及验证试验
利用Design Expert7.0.1软件中的优化模块得到最优组合,即:苯甲醛用量为1.1%,Triton X-100用量为0.14 g/m L,葡萄糖用量为0.028 g/m L,相应L-PAC浓度的模型预测值为28.01mmol/L。在最优条件下进行微生物转化验证试验,操作同“2.2”项下,在转化8 h后,测得L-PAC浓度为28.04mmol/L(RSD=1.35%,n=3),与模型预测值28.01mmol/L的相对误差为0.11%,表明响应面设计得到的工艺条件是有效、可行的。
3 讨论
通过图2A、2B可以看出,苯甲醛单纯作用时,其用量较高对L-PAC的生成有强烈的抑制作用。
图2B、2C显示,随着辅底物葡萄糖用量逐渐升高,产物L-PAC浓度先增加后降低,这与文献[6]报道一致。这是因为酵母在葡萄糖用量高时的代谢以发酵代谢为主,主要产物是乙醇,导致细胞转化产物L-PAC的活性减弱。因此为了得到高浓度的L-PAC,葡萄糖用量必须适当。
如图2B所示,随着Triton X-100用量的增加,在低苯甲醛浓度时L-PAC浓度逐渐降低,在高苯甲醛浓度时L-PAC浓度逐渐增加。这是由于Triton X-100胶束对底物苯甲醛的萃取增溶作用所致。当苯甲醛用量少时,少量的苯甲醛被增溶到Triton X-100胶束中,降低了底物的利用度,导致产物L-PAC浓度降低。模型或毒性测定表明增溶到胶束中的底物利用度只有20%[7-9]。当苯甲醛用量多时,大量的毒性底物对微生物有强烈的抑制作用,导致L-PAC浓度很低。随着Triton X-100用量增加,苯甲醛可以被萃取增溶到胶束中,降低了对微生物的毒性作用,使产物L-PAC浓度升高。胶束对底物苯甲醛的增溶一方面可以降低底物对微生物细胞的抑制作用,有利于反应进行;另一方面却使底物的利用度降低,不利于转化反应。所以在胶束溶液中对于一定量的底物存在一个最优的表面活性剂浓度。响应面方法可以使表面活性剂和底物的相互作用很直观地表现出来,能够有效地优化胶束系统中的萃取微生物转化。
非水介质用于全细胞转化的前提就是具有良好的生物相容性,但是只有某些非离子表面活性剂对某些特定的微生物才具有生物相容性。非离子表面活性剂溶液的生物相容性是由表面活性剂的分子结构和微生物种类决定的[10]。Laouar L等[2]报道啤酒酵母在Triton X-100胶束溶液中保持了稳定的生物活性,从而使得在Triton X-100胶束溶液中萃取微生物转化制备L-PAC成为可能。
综上,本研究填补了国内外相关研究的空白,而且利用响应面法优化得到的模型方程是有效的,具有较好的预测性,这将对以后大批量转化制备L-PAC提供有利的参考。
[1]曹道平.保护鲁西北平原上重要的中药资源[J].山东中医杂志,1991,10(2):45.
[2]Laouar L,Lowe KC,Mulligan BJ,etal.Yeast responses to nonionic surfactants[J].Enzyme Microb Technol,1996,18 (6):433-438.
[3]Rosche B,Sandford V,Breuer M,etal.Biotransformation of benzaldehyde into(R)-phenylacetylcarbinol by filamentous fungior their extracts[J].ApplMicrobiol Biotechnol,2001,57(3):309-315.
[4]陈凯,李收,金凯,等.Box-Behnken响应面法优化吲哚美辛固体脂质纳米粒处方[J].中国药房,2016,27(22): 3118-3121.
[5]雷艳萍,石晓峰,刘东彦,等.响应面法优化雪松松针中总木脂素的提取工艺[J].中国药房,2016,27(7):939-942.
[6]薛迎迎,杨汝德,齐瀚实,等.胶束溶液中微生物萃取转化合成L-苯基乙酰基甲醇条件的研究[J].食品科技,2010,35(2):2-5.
[7]Guha S,Jaffe P,Peters CA.Bioavailability ofmixtures of PAHs partitioned into themicellar phaseof a nonionic surfactant[J].Environ SciTechnol,1998,32(15):2317-2324.
[8]Jang SA,Lee DS,Lee MW,etal.Toxicity of phenanthrene dissolved in nonionic surfactantsolutions to Pseudomonas putida P2[J].FEMSM icrobiol Lett,2007,267(2): 194-199.
[9]Lee HJ,LeeMW,Lee DS,etal.Estimation of direct-contact fraction for phenanthrene in surfactant solutions by toxicity measurement[J].J Biotechnol,2007,131(4): 448-457.
[10]薛迎迎.非离子表面活性剂胶束溶液萃取微生物转化的参数优化[D].广州:华南理工大学,2010.
(编辑:刘明伟)
Optim ization of Extractive M icrobial Transformation for Producing L-phenylacetylcarbinol by Response Surface M ethod
XUE Yingying(Dept.of TCM,Lianyungang Higher Vocational and Technical College of TCM,Jiangsu Lianyungang 222007,China)
OBJECTIVE:To optimize the conditions of extractive microbial transformation for producing L-phenylacetylcarbinol(L-PAC).METHODS:HPLC was used to determ ine the concentration of L-PAC,which was extracted by saccharmyces cerevisiae.Using L-PAC concentration as response value,Box-Behnken response surface design was adopted to investigate the 3main factors of benzaldehyde,Triton X-100 and glucose dose,and verification test was conducted.RESULTS:The interaction between benzaldehyde and Triton X-100 was themost significant.The optim ized combination was as follows as benzaldehyde of 1.1%,Triton X-100 of 0.14 g/m L,glucose of 0.028 g/m L.The average concentration in verification test of L-PAC was 28.04 mmol/L (RSD=1.35%,n=3),show ing 0.11%relative error w ith the predicted value of 28.01 mmol/L.CONCLUSIONS:Response surface method has optimized the conditions of extractive microbial transformation for producing L-PAC,obtained optimal combination of each factor,and provided favorable reference for volume-producing L-PAC.
Response surfacemethod;Extractivem icrobial transformation;L-phenylacetylcarbinol
R284.3
A
1001-0408(2017)19-2692-04
2016-12-02
2017-05-03)
*讲师,硕士。研究方向:生物制药。E-mail:314302095@qq. com
DOI 10.6039/j.issn.1001-0408.2017.19.28
