桉柠蒎肠溶软胶囊对脂多糖诱导小鼠急性肺损伤的改善作用
2017-08-11杨玉梅武汉科技大学天佑医院肾病科武汉430064武汉科技大学天佑医院呼吸内科武汉430064
李 璇,杨玉梅(1.武汉科技大学天佑医院肾病科,武汉 430064;2.武汉科技大学天佑医院呼吸内科,武汉430064)
桉柠蒎肠溶软胶囊对脂多糖诱导小鼠急性肺损伤的改善作用
李 璇1*,杨玉梅2#(1.武汉科技大学天佑医院肾病科,武汉 430064;2.武汉科技大学天佑医院呼吸内科,武汉430064)
目的:研究桉柠蒎肠溶软胶囊对脂多糖(LPS)诱导小鼠急性肺损伤(ALI)的改善作用。方法:将60只小鼠随机分为空白对照组、模型对照组和桉柠蒎肠溶软胶囊低、中、高剂量组(100、300、900mg/kg),每组12只。给药组小鼠ig相应药物,空白对照组和模型对照组小鼠ig等体积生理盐水(0.1m L/10 g)。给药2 h后,除空白对照组外,其余各组小鼠均采用LPS雾化吸入的方法诱导ALI模型。造模6 h后,处死小鼠取肺泡灌洗液(BALF)和肺组织,镜下观察肺组织形态学变化;血细胞计数板计算BALF中总细胞数和瑞氏-吉姆萨染色后计算BALF中中性粒细胞数;二喹啉甲酸法检测BALF上清液中总蛋白浓度;酶联免疫吸附法检测BALF上清液中肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)含量。结果:与空白对照组比较,模型对照组小鼠肺组织发生明显病理学损伤,肺水肿严重;BALF中总细胞数、中性粒细胞数和BALF上清液中总蛋白浓度以及TNF-α、IL-6含量均显著增加(P<0.01)。与模型对照组比较,桉柠蒎肠溶软胶囊高剂量组小鼠肺组织病理损伤明显改善,BALF中总细胞数、中性粒细胞数和BALF上清液中总蛋白浓度以及TNF-α、IL-6含量均显著减少(P<0.05);其余各组差异无统计学意义(P>0.05)。结论:高剂量桉柠蒎肠溶软胶囊能明显改善LPS诱导的小鼠ALI。
桉柠蒎肠溶软胶囊;急性肺损伤;脂多糖;小鼠;改善作用
急性肺损伤(Acute lung injury,ALI)是一种以炎症、肺通透性增加和肺功能下降为特征的综合征,其病因及发病机制复杂。研究表明,各种炎症因子和趋化因子介导的复杂网络调控在启动、放大和促进ALI的病理过程中发挥了重要作用[1]。流行病学资料表明,ALI的临床病死率高达30%~50%,然而到目前为止,临床上尚无安全、有效的治疗药物[1-2]。开发相应药物势在必行。
桉柠蒎肠溶软胶囊是由桃金娘科桉属和芸香科桔属及松科松属植物的提取物所组成,主要成分为桉油精、柠檬烯及α-蒎烯,临床上广泛用于急、慢性支气管炎、肺炎、支气管扩张、肺脓肿、慢性阻塞性肺部疾病等的治疗[3]。近期临床和基础研究结果显示,桉柠蒎肠溶软胶囊具有较强的抗炎活性[3-4],又考虑到该药本身对肺部炎症疾病具有较好的临床疗效,故在本研究中,笔者以雾化吸入脂多糖(LPS)的方法诱导小鼠发生ALI[5-6],观察桉柠蒎肠溶软胶囊对模型小鼠ALI的改善作用,为该药临床应用提供参考。
1 材料
1.1 仪器
550多功能酶标仪(美国Bio-Rad公司);NB-150U超声雾化器(日本欧姆龙公司);SZ61光学显微镜(日本Olympus公司);RC5B高速低温离心机(美国Sorvall公司);血细胞计数板(上海求精生化试剂仪器有限公司)。
1.2 药品与试剂
桉柠蒎肠溶软胶囊(北京九和药业有限公司,批号: 20161033,规格:300mg/粒);大肠埃希菌LPS(美国Sigma公司,批号:113M 4068V,规格:100mg/瓶);白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)酶联免疫吸附(ELISA)试剂盒(深圳市达科为生物技术有限公司,批号: DKW 12-2060-096、DKW 12-2720-096);二喹啉甲酸(BCA)蛋白定量试剂盒(江苏凯基生物技术股份有限公司,批号:E162-01)。
1.3 动物
健康Babl/c小鼠60只,♂,体质量18~20 g,购自广东省医学实验动物中心,合格证号:SCXK(粤)2013-0002。实验前禁食12 h,自由饮水。
2 方法
2.1 造模、分组与给药
将60只小鼠随机分为5组,每组12只,分别为空白对照组(生理盐水)、模型对照组(生理盐水)和桉柠蒎肠溶软胶囊低、中、高剂量组(100、300、900mg/kg,给药剂量根据预实验结果而定),ig给药,0.1m L/10 g。在给药2 h后,参考文献[6]中方法,将模型对照组和桉柠蒎肠溶软胶囊各剂量组小鼠置于20 cm×30 cm×40 cm的密闭箱中,雾化吸入LPS溶液(1mg/m L)30m in,诱导小鼠ALI;正常对照组小鼠雾化吸入生理盐水。小鼠在雾化完成6 h后处死。
2.2 肺组织病理学检测
每组随机抽取6只小鼠,取左上肺舌叶,用10%中性甲醛固定24 h,常规脱水、石蜡包埋、切片后,苏木精-伊红(HE)染色。在光学显微镜下观察小鼠肺泡间隔病变、炎症细胞浸润、血管瘀血状况等肺组织病理学变化。
2.3 肺泡灌洗及灌洗液中细胞计数
每组取剩余6只小鼠,暴露气管,用1.5m L磷酸盐缓冲液(PBS)进行肺泡灌洗,回收肺泡灌洗液(BALF)约1.35m L。取其中0.1m L,使用血细胞计数板进行总细胞计数。剩余BALF在低温环境下离心(1 000×g)3 m in,取上清液分装后置于4℃冰箱中保存(用于总蛋白定量和炎症细胞因子检测);再取细胞沉淀涂片,晾干后瑞氏-吉姆萨染色,在光学显微镜下观察200个细胞,对中性粒细胞分类计算,最终得出BALF中中性粒细胞的数量。
2.4 BALF上清液中总蛋白浓度及TNF-α、IL-6含量检测
从4℃冰箱中取出各组小鼠的BALF上清液,采用BCA法检测其中总蛋白浓度,采用ELISA法检测其中TNF-α、IL-6含量,具体操作按照相应试剂盒说明书进行。
2.5 统计学处理
3 结果
3.1 肺组织病理学变化观察结果
空白对照组小鼠肺组织结构完整,肺泡间隔适中、无水肿、炎症,肺泡腔清晰;模型对照组小鼠肺泡间隔增宽、肺泡壁破坏、肺间质水肿、部分肺泡融合,腔内可见渗出、水肿及出血,肺间质炎症细胞浸润;桉柠蒎肠溶软胶囊各剂量组小鼠肺组织上述病理变化均明显改善,肺泡壁破坏减少、出血及渗出情况减轻,结果详见图1。
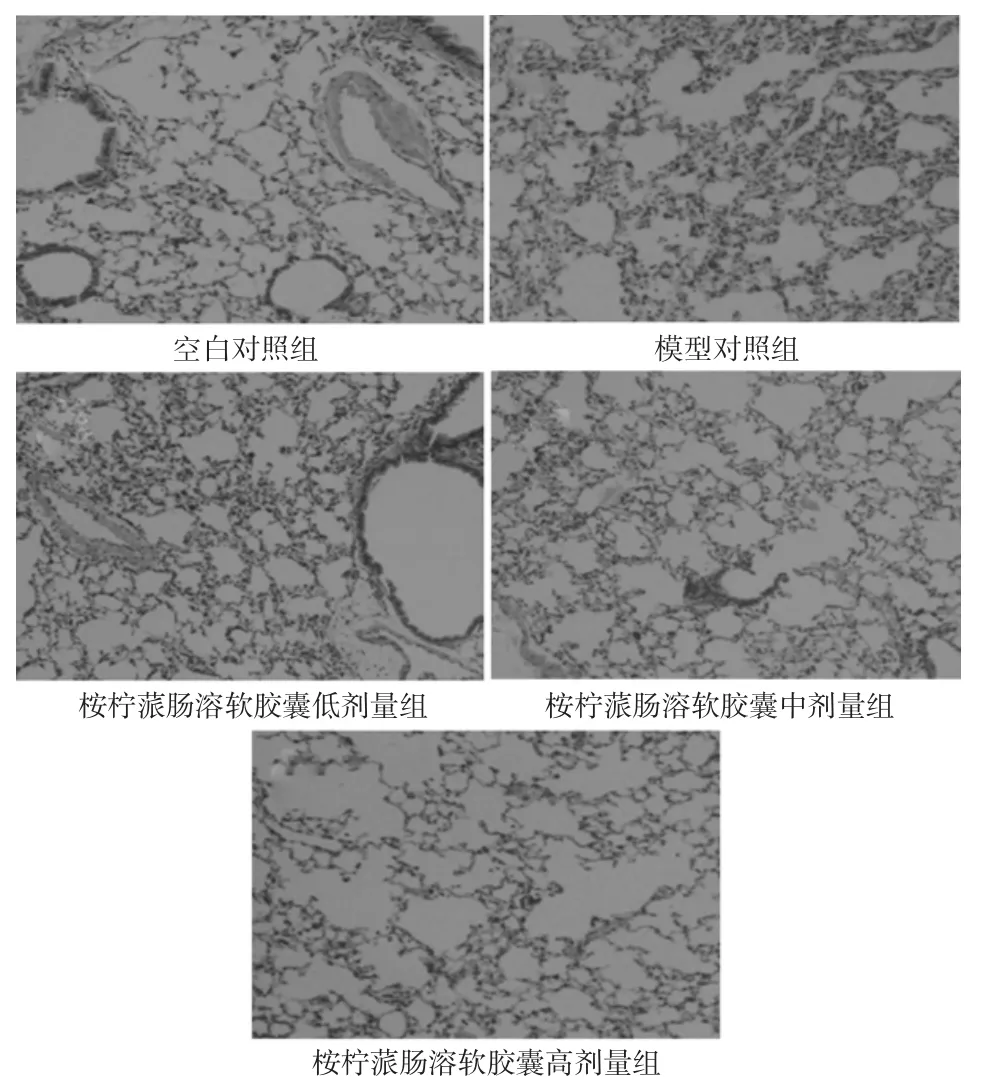
图1 各组小鼠肺组织病理学变化观察结果(HE,×100)Fig 1 Observation results of pathological changes of lung tissue ofm ice in each group(HE,×100)
3.2 BALF中总细胞数和中性粒细胞数的检测结果
与空白对照组比较,其余各组小鼠BALF中总细胞数和中性粒细胞数均显著增加(P<0.01);与模型对照组比较,桉柠蒎肠溶软胶囊高剂量组小鼠BALF中总细胞数和中性粒细胞数均显著减少(P<0.05),桉柠蒎肠溶软胶囊低、中剂量组差异无统计学意义(P>0.05),结果详见表1。
表1 各组小鼠BALF中总细胞数和中性粒细胞数的检测结果(±s,n=6)Tab 1 Determ ination results of number of total cells and neutrophils in BALF ofm ice in each group (±s,n=6)

表1 各组小鼠BALF中总细胞数和中性粒细胞数的检测结果(±s,n=6)Tab 1 Determ ination results of number of total cells and neutrophils in BALF ofm ice in each group (±s,n=6)
注:与空白对照组比较,**P<0.01;与模型对照组比较,#P<0.05Note:vs.blank control group,**P<0.01;vs.model control group,#P<0.05
中性粒细胞数,×106mL-10.008±0.006 0.809±0.244**0.829±0.207**0.668±0.381**0.338±0.239**#组别空白对照组模型对照组桉柠蒎肠溶软胶囊低剂量组桉柠蒎肠溶软胶囊中剂量组桉柠蒎肠溶软胶囊高剂量组总细胞数,×106mL-10.030±0.016 0.918±0.316**0.979±0.218**0.773±0.430**0.408±0.254**#
3.3 BALF上清液中总蛋白浓度的检测结果
与空白对照组比较,其余各组小鼠BALF上清液中总蛋白浓度均显著升高(P<0.01);与模型对照组比较,桉柠蒎肠溶软胶囊高剂量组小鼠BALF上清液中总蛋白浓度显著降低(P<0.05),桉柠蒎肠溶软胶囊低、中剂量组小鼠BALF上清液中总蛋白浓度差异无统计学意义(P>0.05),结果详见表2。
表2 各组小鼠BALF上清液中总蛋白浓度以及TNF-α、IL-6含量的检测结果(±s,n=6)Tab 2 Determ ination results of total protein concentration and TNF-α,IL-6 contents in BALF supernatantofm ice in each grou(p±s,n=6)

表2 各组小鼠BALF上清液中总蛋白浓度以及TNF-α、IL-6含量的检测结果(±s,n=6)Tab 2 Determ ination results of total protein concentration and TNF-α,IL-6 contents in BALF supernatantofm ice in each grou(p±s,n=6)
注:与空白对照组比较,**P<0.01;与模型对照组比较,#P<0.05Note:vs.blank control group,**P<0.01;vs.model control group,#P<0.05
组别空白对照组模型对照组桉柠蒎肠溶软胶囊低剂量组桉柠蒎肠溶软胶囊中剂量组桉柠蒎肠溶软胶囊高剂量组IL-6,ng/mL 0.016±0.005 0.972±0.187**0.874±0.213**0.739±0.309**0.385±0.124**#总蛋白,mg/mL 0.134±0.021 0.349±0.058**0.312±0.075**0.299±0.119**0.229±0.081**#TNF-α,ng/mL 0.025±0.012 5.155±1.256**4.751±1.672**4.464±1.393**2.469±0.909**#
3.4 BALF上清液中TNF-α、IL-6含量的检测结果
与空白对照组比较,其余各组小鼠BALF上清液中TNF-α、IL-6含量均显著增加(P<0.01);与模型对照组比较,桉柠蒎肠溶软胶囊高剂量组小鼠BALF上清液中TNF-α、IL-6含量均显著减少(P<0.05),桉柠蒎肠溶软胶囊低、中剂量组差异无统计学意义(P>0.05),结果详见表2。
4 讨论
过度及失控的炎症反应是ALI发病的关键因素,其中最主要表现为肺内中性粒细胞聚集激活,以及肺内炎症细胞因子的大量释放。在ALI发病时,中性粒细胞被激活后产生和释放远超机体清除能力的大量自由基,并释放弹性蛋白酶等损伤性酶,对肺泡上皮细胞、内皮细胞等造成氧化损伤[7]。同时,TNF-α、IL-6等炎症细胞因子介导的级联“瀑布”反应进一步扩大了炎症损伤。许多临床和基础研究均报道,肺部中性粒细胞的减少预示着肺损伤的良好预后[7-8],而TNF-α、IL-6等细胞因子的水平则可能作为评估急性肺损伤严重程度的重要指标[9]。在本研究中,笔者观察到高剂量桉柠蒎肠溶软胶囊可显著抑制LPS诱导的ALI模型小鼠肺部炎症细胞的浸润,以及炎症细胞因子TNF-α、IL-6的释放,提示抑制肺部炎性反应是桉柠蒎肠溶软胶囊发挥ALI改善作用的重要机制。
ALI的一个主要临床表现为顽固性的低氧血症,这是因为肺部过度炎症损伤引起了肺微血管内皮细胞壁通透性的增加,毛细血管向肺组织渗出大量的蛋白内容物淤积于肺泡中,破坏了气血屏障的换气功能[10]。在本研究中,LPS的雾化吸入引起小鼠BALF上清液中总蛋白浓度显著增高,提示小鼠造模成功,而高剂量桉柠蒎肠溶软胶囊可显著减少ALI模型小鼠BALF上清液中总蛋白浓度。同时,本研究病理结果显示,模型对照组小鼠肺泡间隔增宽,肺泡壁破坏,肺间质水肿,部分肺泡融合,腔内可见渗出、水肿及出血,肺间质炎症细胞浸润;而高剂量桉柠蒎肠溶软胶囊组小鼠肺组织中上述病理变化较模型对照组明显改善,肺泡壁破坏减少,出血及渗出减轻,这进一步验证了该药对模型小鼠ALI的改善作用。
由于目前临床上对于ALI尚无安全、有效、可靠的治疗药物[11],故本研究未设置阳性药物对照组。本研究结果显示,高剂量蒎肠溶软胶囊对ALI具有潜在的治疗作用,但相关的作用机制以及临床的实际疗效还有待进一步的研究。
[1]马晓春,王辰,方强,等.急性肺损伤/急性呼吸窘迫综合征诊断与治疗指南:2006[J].中国危重病急救医学,2006,16(12):1-6.
[2]Bein T,Grasso S,Moerer O,etal.The standard of care of patientsw ith ARDS:ventilatory settings and rescue therapies for refractory hypoxemia[J].Intensive Care Med,2016,42(5):699-711.
[3]詹瑾,耿维凤,鄢学芬.桉柠蒎的药理作用与临床评价[J].中国现代药物应用,2008,2(24):26-28.
[4]杭伟,张强,刘钢,等.桉柠蒎对慢性鼻-鼻窦炎治疗效果的分析[J].中国耳鼻咽喉头颈外科,2016,23(6):338-340.
[5]Chen H,BaiC,Wang X.The value of the lipopolysaccharide-induced acute lung injury model in respiratory medicine[J].ExpertRev Respir Med,2014,4(6):773-783.
[6]Matute-Bello G,Frevert CW,M artin TR.Reply to fisher and beers:animalmodels of acute lung injury[J].Am J Physiol Lung CellMol Physiol,2008,295(6):L1067.
[7]Grommes J,Soehnlein O.Contribution of neutrophils toacute lung injury[J].MolMed,2011,17(3/4):293-307.
[8]Bruns B,Hönle T,Kellermann P,et al.Divergent effects of neutrophilson fas-induced pulmonary inflammation,apoptosis,and lung damage[J].Shock,2017,47(2):225-235.
[9]Tunceroglu H,Shah A,Porhomayon J,et al.Biomarkers of lung injury in critical caremedicine:past,present,and future[J].Immunol Invest,2013,42(3):247-261.
[10]Sharp C,M illar AB,Medford AR.Advances in understanding of the pathogenesis of acute respiratory distress syndrome[J].Respiration,2015,89(5):420-434.
[11]朱贲贲,马晓鹂,吴科锋,等.3-甲基嘌呤对脂多糖诱导小鼠急性肺损伤的保护作用及其机制研究[J].中国药房,2016,27(4):464-468.
(编辑:林 静)
Im p rovem ent Effect of Eucalyp tol Enteric Soft Capsu le on Lipopolysaccharide-induced Acute Lung Injury in M ice
LIXuan1,YANG Yumei2(1.Dept.of Nephrology,Tianyou Hospital,Wuhan University of Science and Technology,Wuhan 430064,China;2.Dept.of Respiratory,Tianyou Hospital,Wuhan University of Science and Technology,Wuhan 430064,China)
OBJECTIVE:To investigate the improvement effect of Eucalyptol enteric soft capsule onm ice w ith lipopolysaccharide(LPS)-induced acute lung injury(ALI).METHODS:60 m ice were random ly divided into blank control group,model control group,Eucalyptol enteric soft capsule low-dose,medium-dose,high-dose groups(100,300,900mg/kg),12 in each group.M ice in administration groups were intragastrically given relevantmedicines,mice in blank control group and model control group were intragastrically given equal volume of normal saline(0.1m L/10 g).A fter 2 h of adm inistration,except for the blank control group,ALIwas induced in other groups by atomized LPS.After 6 h ofmodeling,themice were sacrificed,alveolar lavage fluid(BALF) and lung tissue were taken.Morphological changes of lung tissue were observed under m icroscope;number of total cells,neutrophils in BALF were calculated by blood cell count plate and staining by w right-giemsa respectively.Total protein concentration in BALF supernatant was detected by BCA method;TNF-α,IL-6 contents in BALF supernatant were determ ined by enzyme-linked immunosorbent assay.RESULTS:Compared w ith blank control group,lung tissue of m ice in model control group showed obvious pathological damage and severe pulmonary edema;number of total cells,neutrophils in BALF,total protein concentration and TNF-α,IL-6 contents in BALF supernatantwere significantly increased(P<0.01).Compared w ith model control group,pathological damage in lung tissue of mice was obviously improved in Eucalyptol enteric soft capsule high-dose group,number of total cells,neutrophils in BALF,total protein concentration and TNF-α,IL-6 contents in BALF supernatantwere significantly decreased (P<0.05);and there were no significant differences in other groups(P>0.05).CONCLUSIONS:High-dose Eucalyptol enteric soft capsule can obviously improve LPS-induced ALIofm ice.
Eucalyptol enteric soft capsule;Acute lung injury;Lipopolysaccharide;M ice;Improvement effect
R967
A
1001-0408(2017)19-2655-04
2016-11-15
2017-04-27)
*主管护师。研究方向:慢性阻塞性疾病、支气管哮喘。电话: 027-51228500。E-mail:1044500949@qq.com
#通信作者:副主任医师,副教授,硕士。研究方向:呼吸系统疾病。电话:027-51228500。E-mail:2873174957@qq.com
DOI 10.6039/j.issn.1001-0408.2017.19.18
