螺旋藻激酶对动脉粥样硬化模型大鼠血管内皮功能的影响Δ
2017-08-11何秋璟王慧杰黄媛恒黄泽裕江梦凤华媛媛农秀红张康玲广东医科大学基础医学院广东东莞53808广西医科大学基础医学院南宁53001
何秋璟,王慧杰,庞 辉#,杨 莹,黄媛恒,黄泽裕,江梦凤,华媛媛,农秀红,张康玲(1.广东医科大学基础医学院,广东东莞 53808;.广西医科大学基础医学院,南宁 53001)
螺旋藻激酶对动脉粥样硬化模型大鼠血管内皮功能的影响Δ
何秋璟1,2*,王慧杰2,庞 辉2#,杨 莹2,黄媛恒2,黄泽裕2,江梦凤2,华媛媛2,农秀红2,张康玲2(1.广东医科大学基础医学院,广东东莞 523808;2.广西医科大学基础医学院,南宁 530021)
目的:研究螺旋藻激酶(SPK)对动脉粥样硬化模型大鼠血管内皮功能的影响。方法:将60只大鼠随机分为正常对照组(蒸馏水)、模型组(蒸馏水)、阳性对照组(辛伐他汀,0.005 g/kg)和SPK低、中、高剂量组(80、160、320 U/kg)。除正常对照组外,其余各组大鼠均复制动脉粥样硬化模型;同时,各组大鼠ig相应药物,每天1次,连续给药12周。测定大鼠血清中总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、白细胞介素6(IL-6)和肿瘤坏死因子α(TNF-α)的含量;苏木精-伊红染色观察大鼠胸主动脉血管内膜的形态改变。结果:与正常对照组比较,模型组大鼠血清中TC、TG、LDL-C、IL-6和TNF-α含量增加(P<0.01),HDL-C含量降低(P<0.01);血管内皮细胞脱落,内膜增生、向管腔内突起,平滑肌细胞增殖且排列紊乱,中膜弹力纤维崩解断裂。与模型组比较,各给药组大鼠血清中TC、TG、LDL-C、IL-6和TNF-α含量下降(P<0.05或P<0.01),阳性对照组和SPK中、高剂量组大鼠血清中HDL-C含量增加(P<0.05);给药组大鼠血管内皮细胞形态较模型组明显改善,其中SPK中、高剂量组大鼠血管内皮细胞各层结构完整、内膜基本光滑,SPK中剂量组大鼠血管中膜平滑肌细胞排列稍紊乱,与正常对照组比较无明显变化。结论:SPK有明显的降脂和抗炎作用,可保护血管内皮功能;其作用机制可能与降低血清中TC、TG、LDL-C、IL-6、TNF-α含量和升高血清中HDL-C含量有关。
螺旋藻激酶;动脉粥样硬化;白细胞介素6;肿瘤坏死因子α;血管内皮;大鼠
螺旋藻(Spirulina)是一种原核生物,在水中生存,具有丰富的营养价值,富含蛋白质、氨基酸、维生素、多糖、γ-亚麻酸等。螺旋藻经过发酵酶化后可产生螺旋藻激酶(Spirulina kinase,SPK),SPK是一种丝氨酸蛋白酶,耐热、耐碱,具有直接降解纤维蛋白[1]、可延长大鼠血液凝固时间、溶解大鼠血栓的作用,同时对体外培养的过氧化损伤模型和肾上腺素损伤模型的人脐静脉内皮细胞(HUVEC)具有保护作用,可提高HUVEC细胞活性、降低其通透性[2]。SPK的作用机制是通过增加HUVEC分泌组织型纤溶酶原激活物t-PA的含量,减少纤溶酶原激活物抑制剂1的释放,使内皮细胞表面纤溶活性升高,增强抗血栓作用[2-5]。内皮细胞的功能除与血液的抗凝、溶栓作用有关外,还与血管的功能有密切联系。本研究通过复制大鼠动脉粥样硬化模型,观察不同剂量SPK对动脉粥样硬化模型大鼠血脂、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)含量以及动脉血管形态学的影响,探讨SPK保护内皮细胞、抗动脉粥样硬化的作用及作用机制,为将其开发为抗动脉粥样硬化药物提供理论依据。
1 材料
1.1 仪器
BA 400数码三目摄像光学显微镜(麦克奥迪实业集团有限公司);TGL-16A低温离心机(长沙平凡仪器仪表有限公司);7100全自动生化仪(日本日立公司)。
1.2 药品与试剂
辛伐他汀片(涿州东乐制药有限公司,批号:10C14-0907,规格:20mg/片);维生素D3胶囊(上海通用药业股份有限公司,批号:121203,规格:1m L∶7.5mg∶30万单位);大鼠IL-6、TNF-α酶联免疫吸附试验(ELISA)试剂盒(武汉华美生物工程有限公司,批号:L29015724、L29015724);螺旋藻发酵物粉剂(广西北海康福公司,批号:152871,用时提纯);其他试剂均为分析纯。
1.3 动物
SPF级SD大鼠60只,♂,体质量200~230 g,由广西医科大学实验动物中心提供,动物合格证号:桂动许字(2000)第001号。
2 方法
2.1 SPK的制备
取螺旋藻发酵物粉剂20 g,低温离心(4℃,离心半径:9 cm,3 000 r/m in,下同)10min后弃去沉淀,加入三蒸水,在层析冷柜中搅拌均匀,4℃下静置过夜后,离心10m in。收集上清液,硫酸铵分级盐析收集沉淀,透析,冻干,凝胶层析,冻干保存备用,得到SPK比活(活力单位数/毫克蛋白)为2 631U/mg[1]。
2.2 分组、造模与给药
将60只大鼠随机分为正常对照组(蒸馏水)、模型组(蒸馏水)、阳性对照组(辛伐他汀,0.005 g/kg,给药剂量为人体等效剂量)和SPK低、中、高剂量组(80、160、320 U/kg,给药剂量依据预实验确定,为有效剂量),每组10只。除正常对照组外的其余各组大鼠给予高脂饲料喂养(高脂饲料配方:3%胆固醇、0.2%丙基硫氧嘧啶、0.9%胆酸钠、10%猪油、5%白糖、80.9%基础饲料)[6],并于第1~3天ip维生素D3200 000 u/kg,于第15、36、57天ip维生素D3100 000 u/kg;正常对照组大鼠给予普通饲料喂养,并在上述对应时间ip 2m L注射用油[7]。造模开始时,正常对照组、模型组大鼠每天ig蒸馏水2m L,各给药组大鼠ig相应药物,每日1次,连续给药12周。
2.3 取材
各组大鼠于给药第12周后,ip 20%氨基甲酸乙酯麻醉,腹主动脉取血。血样在常温(25℃)静置30m in后,离心10min,取血清分装冷冻(-80℃)保存。取升主动脉根部起始段至腹主动脉分叉处的胸主动脉血管,生理盐水冲洗,10%中性甲醛固定,室温(25℃)放置,待检。
2.4 检测项目及方法
采用全自动生化仪测定大鼠血清中总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)含量。采用ELISA法测定大鼠血清中IL-6、TNF-α含量,严格按照试剂盒规定操作。将固定后的胸主动脉血管脱水、石蜡包埋、切片,苏木精-伊红(HE)染色,采用光学显微镜观察血管内膜形态。
2.5 统计学方法
采用SPSS 16.0统计软件对所得数据进行分析。计量资料以±s表示。组间比较采用单因素方差分析,若方差齐则使用LSD检验进行两两比较,若不齐则采用Games-Howell检验。P<0.05表示差异有统计学意义。
3 结果
3.1 各组大鼠血清中TC、TG、LDL-C、HDL-C含量测定结果
与正常对照组比较,模型组大鼠血清中TC、TG、LDL-C含量增加(P<0.01),HDL-C含量降低(P<0.01);与模型组比较,除SPK低剂量组大鼠血清中HDL-C含量变化不显著外,其余各给药组大鼠上述血清指标均显著改善(P<0.05或P<0.01),结果见表1。
表1 各组大鼠血清中TC、TG、LDL-C、HDL-C含量测定结果(±s,n=10,mmol/m L)Tab 1 Results of TC,TG,LDL-C,HDL-C contents in serum of rats in each group(±s,n=10,mmol/m L)
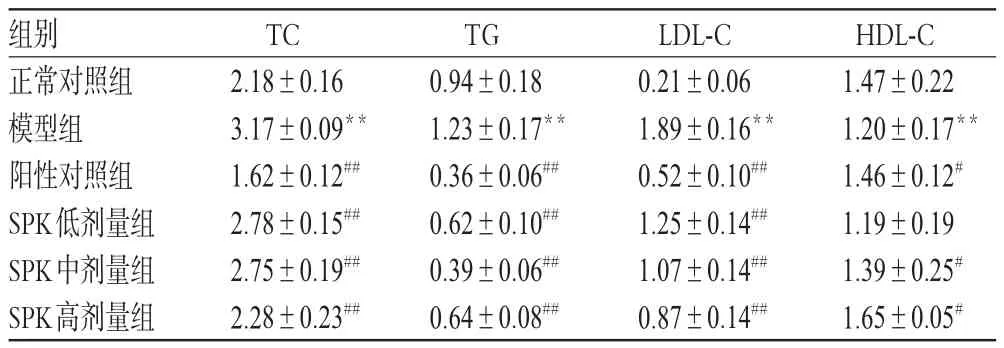
表1 各组大鼠血清中TC、TG、LDL-C、HDL-C含量测定结果(±s,n=10,mmol/m L)Tab 1 Results of TC,TG,LDL-C,HDL-C contents in serum of rats in each group(±s,n=10,mmol/m L)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal control group,**P<0.01;vs.model group,#P<0.05,##P<0.01
HDL-C 1.47±0.22 1.20±0.17**1.46±0.12#1.19±0.19 1.39±0.25#1.65±0.05#组别正常对照组模型组阳性对照组SPK低剂量组SPK中剂量组SPK高剂量组TC 2.18±0.16 3.17±0.09**1.62±0.12##2.78±0.15##2.75±0.19##2.28±0.23##TG 0.94±0.18 1.23±0.17**0.36±0.06##0.62±0.10##0.39±0.06##0.64±0.08##LDL-C 0.21±0.06 1.89±0.16**0.52±0.10##1.25±0.14##1.07±0.14##0.87±0.14##
3.2 各组大鼠血清中IL-6、TNF-α含量测定结果
与正常对照组比较,模型组大鼠血清中IL-6、TNF-α含量增加(P<0.01);与模型组比较,各给药组大鼠血清中IL-6、TNF-α含量均减少(P<0.05或P<0.01),结果见表2。
表2 各组大鼠血清中IL-6、TNF-α含量测定结果(x± s,n=10,pg/m L)Tab 2 Results of IL-6,TNF-αcontents in serum of rats in each grou(p±s,n=10,pg/m L)
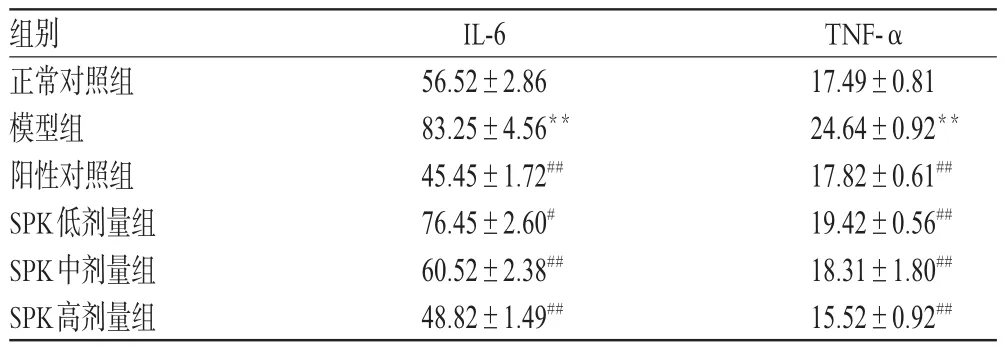
表2 各组大鼠血清中IL-6、TNF-α含量测定结果(x± s,n=10,pg/m L)Tab 2 Results of IL-6,TNF-αcontents in serum of rats in each grou(p±s,n=10,pg/m L)
注:与正常对照组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal control group,**P<0.01;vs.model group,#P<0.05,##P<0.01
TNF-α 17.49±0.81 24.64±0.92**17.82±0.61##19.42±0.56##18.31±1.80##15.52±0.92##组别正常对照组模型组阳性对照组SPK低剂量组SPK中剂量组SPK高剂量组IL-6 56.52±2.86 83.25±4.56**45.45±1.72##76.45±2.60#60.52±2.38##48.82±1.49##
3.3 各组大鼠胸主动脉血管内膜形态学观察结果
正常对照组大鼠血管各层结构完整,内膜光滑,中膜弹力纤维正常;与正常对照组比较,模型组大鼠血管内皮细胞脱落,内膜增生、向管腔内凸起,平滑肌细胞增殖且排列紊乱,中膜弹力纤维崩解断裂;SPK低剂量组大鼠尚见血管内膜脱落,内膜增生、向管腔内凸起;SPK中剂量组大鼠血管内膜光滑,中膜平滑肌细胞排列稍紊乱;阳性对照组和SPK高剂量组大鼠血管内膜各层结构完整,内膜光滑,中膜弹力纤维正常,结果见图1。

图1 各组大鼠胸主动脉内膜形态学观察结果(HE,×400)Fig 1 M orphological observations of thoracic aortic intmamorphology of rats in each group(HE,× 400)
4 讨论
本研究结果显示,与正常对照组比较,模型组大鼠血清中TC、LDL-C含量升高,血管壁出现硬化改变,表明动脉粥样硬化模型复制成功[6-7]。动脉粥样硬化的发病机制复杂、表现形式多样,血脂代谢异常是其重要病因之一。血脂代谢异常包括TC、LDL-C、TG含量的升高和HDL-C含量的降低。血清中TC和LDL-C含量的异常升高是发生动脉粥样硬化的危险信号。与LDL-C的作用相反,HDL-C是一种重要的抗氧化物质,具有将肝外组织的胆固醇转运到肝,减少超氧阴离子生成,从而保护内皮细胞的作用,起到抗动脉粥样硬化的作用。当LDL-C含量升高时,可向动脉内膜迁移,然后被内膜细胞产生的氧化自由基氧化修饰成氧化的LDL-C,导致脂质和脂肪酸的沉淀,引起巨噬细胞内胆固醇的聚集和泡沫细胞的形成,引发内皮细胞功能障碍,这是动脉粥样硬化形成的重要病理机制[8-10]。辛伐他汀能显著降低血清中TG、LDL-C含量,升高HDL-C含量,是目前临床应用效果最明确的改善血脂代谢紊乱、改善内皮功能、延缓动脉粥样硬化进程的药物[11-12],故本研究以其为阳性对照。结果,与模型组比较,阳性对照组和SPK各剂量组大鼠血清中TC、TG、LDL-C含量均下降,阳性对照组和SPK中、高剂量组大鼠血清中HDL-C含量显著上升,表明SPK也具有改善血脂代谢紊乱的作用,并由此抑制动脉粥样硬化的形成。
研究表明,动脉粥样硬化是血管受损后发生的一种炎症反应过程,炎症反应贯穿动脉粥样硬化发生和发展的整个阶段。IL-6是在多种刺激下产生的多功效细胞因子,可调节炎症反应过程。IL-6水平长期升高可促进动脉粥样硬化的发生[13]。TNF是一类具有多种生物学活性的细胞因子,共包括3种,其中TNF-α主要由单核-巨噬细胞产生。动脉粥样硬化发生时,血清中的TNF-α含量显著上升[14],其可通过诱导细胞坏死、促进新生血管和血栓形成而诱导动脉粥样硬化的发生,是病理变化过程中引发内膜增生与内皮功能紊乱的重要炎症因子之一[15]。本研究结果显示,与模型组比较,阳性对照组与SPK各剂量组大鼠血清中IL-6、TNF-α含量均下降,说明辛伐他汀和SPK均可有效降低动脉粥样硬化大鼠血清中IL-6、TNF-α的释放。
综上所述,SPK能保护血管内皮结构完整,减轻炎症反应,对动脉粥样硬化的发生有一定的预防作用,其作用机制可能与降低血清中TC、TG、LDL-C、IL-6和TNF-α含量,升高血清中HDL-C含量有关。
[1]肖云晓,陈高斯,庞辉,等.螺旋藻激酶分离提纯方法初探[J].时珍国药国药,2011,22(6):1399-1400.
[2]庞辉,蒋皓,李小花,等.螺旋藻蛋白激酶提取物的溶栓作用研究[J].时珍国医国药,2012,23(10):2521-2522.
[3]赵杰,肖云晓,庞辉,等.螺旋藻激酶对人脐静脉内皮细胞t-PA mRNA、PAI-1mRNA表达的影响[J].时珍国医国药,2012,23(6):1471-1473.
[4]陈萌,庞辉,王慧杰,等.螺旋藻激酶对人脐静脉内皮细胞抗氧化能力的影响[J].中国药理学通报,2016,32(2): 293-294.
[5] 陈萌,肖云晓,庞辉,等.螺旋藻激酶对内皮细胞分泌VWF的影响[J].国医论坛,2015,30(3):64-65.
[6]赵娟,李相君,孙波.维生素D3联合高脂饲料建立大鼠动脉粥样硬化模型[J].实用医学杂志,2009,25(21): 3569-3571.
[7]曹杰,王巧黎,赵宏,等.心脉通片对动脉粥样硬化模型大鼠的防治作用及其机制研究[J].中国药房,2016,27 (25):3499-3501.
[8]李薇,杜军保.动脉粥样硬化发病机制研究进展[J].实用儿科临床杂志,2009,24(1):58-60.
[9]李静,陈长勋,高阳,等.鱼腥草素抗炎与抗动脉硬化作用的探索[J].中成药,2010,32(1):26-30.
[10]刘俊田.动脉粥样硬化发病的炎症机制和研究进展[J].西安交通大学学报(医学版),2015,26(52):141-152.
[11]丁云,张晓萍,欣明花,等.阿托伐他汀钙联合辛伐他汀治疗混合型高血脂症的临床观察[J].中国药房,2015,26 (12):1627-1629.
[12]CavieresV,Valdes K,Moreno B,etal.Vaccularhypercontractility and endothelial dysfunction before development of atherosclerosis inmoderate dyslipidem ia:role for nitric oxide and interleukin-6[J].Am JCardiovacc Dis,2014,4 (3):114-122.
[13]Danesh J,Kaptoge S,Mann AG,etal.Long-term interleukin-6 levelsand subsequent risk of coronary heartdisease: two new prospecetive studies and a systematic review[J]. Annu Rev Immunol,2008,5(4):178-183.
[14]Hata H,Sakaguchi N,Yoshitomi H,et al.Distinct contribution of IL-6,TNF-α,IL-1 and IL-10 to T cellmediated spontaneous autoimmune arthritis in mice[J].J Clin Invest,2004,114(4):582-588.
[15]Xu H,Duan J,Wang W,et al.Reactive oxygen species mediate oxidized low-density lipoprotein-induced endothelin-1 gene expression via extracellular signal-regulated kinase in vascularendothelial cells[J].Hypertens,2008,26 (5):956-963.
Effects of Spiru lina K inase on Vascular Endothelial Function of M odel Ratsw ith Atherosclerosis
HE Qiujing1,2,WANG Huijie2,PANG Hui2,YANG Ying2,HUANG Yuanheng2,HUANG Zeyu2,JIANG Mengfeng2,HUA Yuanyuan2,NONG Xiuhong2,ZHANG Kangling2(1.Basic Medical College,Guangdong Medical University,Guangdong Dongguan 523808,China;2.Basic Medical College,Guangxi Medical University,Nanning 530021,China)
OBJECTIVE:To study the effects of spirulina kinase(SPK)on the vascular endothelial function ofmodel rats w ith atherosclerosis.METHODS:60 rats were random ly divided into normal control group(distilled water),model group(distilled water),positive control group(simvastatin,0.005 g/kg)and SPK low-dose,medium-dose,high-dose groups(80,160,320 U/kg). Except for normal control group,rats in other groupswere induced formodel of atherosclerosis.A ll groupswere intragastrically adm inistrated relevantmedicines at the same time,once a day for consecutive 12 weeks.Total cholesterol(TC),triglyceride(TG),low density lipoprotein cholesterol(LDL-C),high density lipoprotein cholesterol(HDL-C),interleukin-6(IL-6),tumor necrosis factor-α(TNF-α)contents in serum of rats weremeasured.And the changes of thoracic aortic endothelium morphology were observed by HE staining.RESULTS:Compared w ith normal control group,TC,TG,LDL-C,IL-6,TNF-αcontents in serum of rats in model group were increased(P<0.01),HDL-C content in serum was decreased(P<0.01);vascular endothelial cells fell off,intimal proliferation projected into the lumen,smooth muscle cell proliferated and disordered,medium film elastic fiber disintegrated and fractured.Compared w ith model group,TC,TG,LDL-C,IL-6,TNF-αcontents in serum of rats in adm inistration groups were decreased(P<0.05 or P<0.01),HDL-C content in positive control group and SPK medium-dose,high-dose groupswas increased(P<0.05).Vascular endothelial cellmorphology was improved significantly in administration groups,in which,vascular endothelial cells were structurally intact in SPK medium-dose,high-dose groups,inner membrane was basically smooth;medium smooth muscle cells arranged slightly disordered in SPK medium-dose group.Compared w ith normal control group,there were no obvious changes.CONCLUSIONS:SPK shows obvious lipid-lowering and anti-inflammatory effects,it can protect vascular endothelial function.Themechanism may be related to reducing TC,TG,LDL-C,HDL-C,IL-6,TNF-αcontents and increasing HDL-C content in serum.
Spirulina kinase;Atherosclerosis;Interleukin-6;Tumor necrosis factor-α;Vascular endothelium;Rats
R965.1
A
1001-0408(2017)19-2628-04
2017-01-24
2017-05-24)
(编辑:刘明伟)
广西自然科学基金资助项目(No.2013GXNSFAA019176,2014GXNSFBA118156)
*实验师,硕士。研究方向:海洋药物、心血管保护机制。电话: 0771-5358074。E-mail:765260567@qq.com
#通信作者:教授,硕士生导师。研究方向:海洋药物及心血管保护机制。电话:0771-5358074。E-mail:454720524@qq.com
DOI 10.6039/j.issn.1001-0408.2017.19.10
